서 론
재료 및 방법
1. 검체 운송 상자
2. 검체 운송 상자의 온도 유지 기능 평가
3. 검체 보관조건이 검사결과에 미치는 영향
결 과
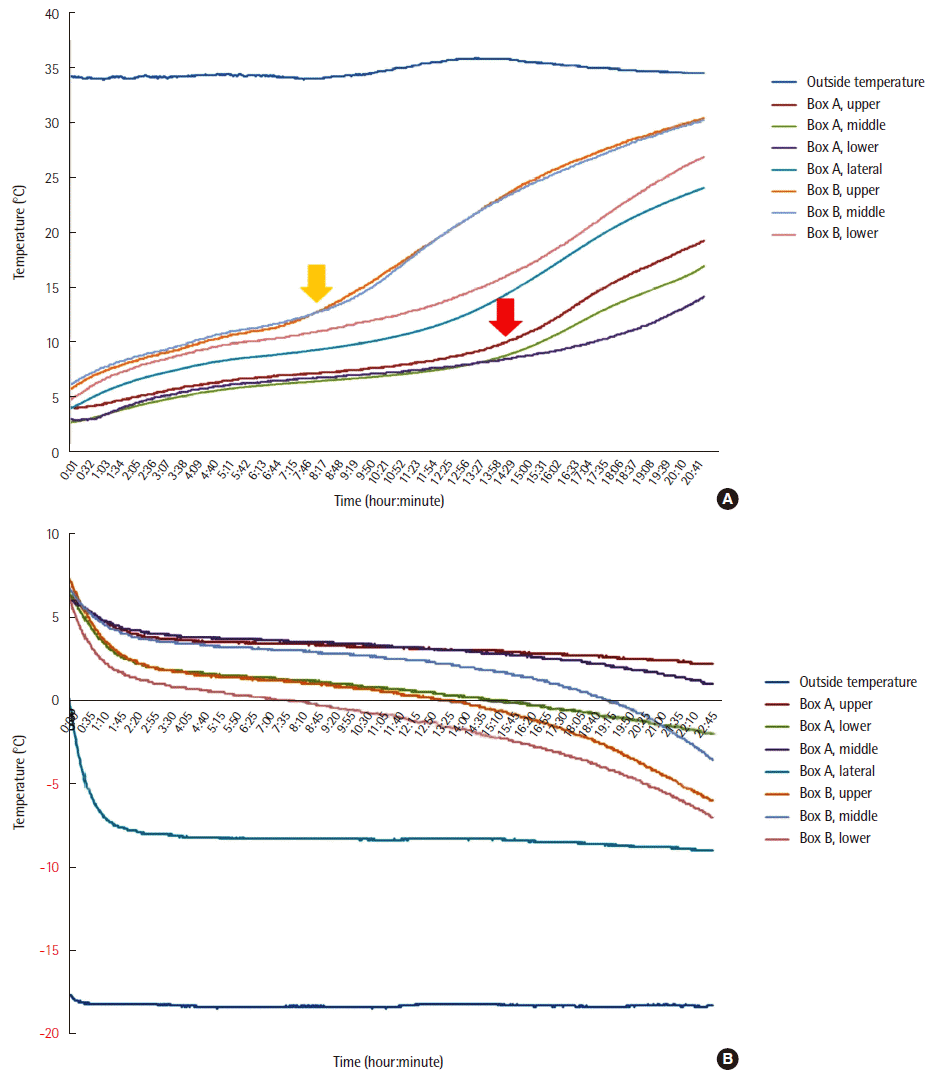
1. 검체 운송 상자의 온도 유지 기능 평가
Table 1
2. 검체 보관조건이 검사결과에 미치는 영향
Table 2
| Analyte (Total error %*) | Storage condition (N=20) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||
| Ambient (24 hours) | Refrigerated (24 hours) | Frozen (24 hours) | Vibrated (6 hours, ambient) | |||||||||
|
|
|
|
|
|||||||||
| P value | Max. error (%) | Ave. error (%) | P value | Max. error (%) | Ave. error (%) | P value | Max. error (%) | Ave. error (%) | P value | Max. error (%) | Ave. error (%) | |
| WBC (15.49) | 0.06 | 2.95 | 1.14 | < 0.05 | 3.40 | 1.41 | - | - | - | 0.41 | 2.35 | 1.01 |
| RBC (4.4) | 0.61 | 0.95 | 0.40 | 0.66 | 1.15 | 0.53 | - | - | - | 0.52 | 0.97 | 0.38 |
| Hemoglobin (4.19) | < 0.05 | 1.12 | 0.49 | < 0.05 | 1.29 | 0.65 | - | - | - | 0.12 | 0.87 | 0.31 |
| Hematocrit (3.97) | < 0.05 | 7.85 | 5.72 | < 0.05 | 2.84 | 0.94 | - | - | - | < 0.05 | 3.52 | 2.12 |
| Platelet (13.4) | < 0.05 | 6.13 | 2.54 | 0.08 | 7.76 | 2.28 | - | - | - | 0.59 | 3.52 | 1.29 |
| MCV (2.42) | < 0.05 | 7.52 | 5.77 | < 0.05 | 1.72 | 0.96 | - | - | - | < 0.05 | 3.22 | 2.04 |
| MCH (2.5) | < 0.05 | 1.35 | 0.64 | < 0.05 | 2.19 | 0.70 | - | - | - | 0.13 | 1.17 | 0.49 |
| MCHC (1.27) | < 0.05 | 6.78 | 4.95 | 0.06 | 1.49 | 0.63 | - | - | - | < 0.05 | 3.70 | 2.22 |
| Plasma hemoglobin† | 0.09 | 166.67 | 30.62 | < 0.05 | 233.33 | 40.98 | - | - | - | < 0.05 | 55.56 | 24.51 |
| PT (5.3) | < 0.05 | 30.83 | 5.61 | < 0.05 | 3.48 | 1.47 | 0.24 | 13.47 | 2.77 | < 0.05 | 5.79 | 4.36 |
| aPTT (4.5) | < 0.05 | 15.72 | 2.52 | < 0.05 | 19.47 | 6.09 | < 0.05 | 8.20 | 4.95 | < 0.05 | 8.67 | 3.50 |
| Fibrinogen (13.6) | < 0.05 | 14.54 | 9.06 | < 0.05 | 27.39 | 7.84 | < 0.05 | 14.74 | 6.10 | < 0.05 | 12.36 | 2.37 |
| LDH (11.4) | < 0.05 | 5.30 | 2.12 | < 0.05 | 5.61 | 2.70 | - | - | - | < 0.05 | 75.08 | 22.72 |
| AST (16.69) | 0.20 | 19.05 | 8.83 | 0.25 | 17.50 | 8.22 | - | - | - | 0.17 | 19.05 | 9.23 |
| ALT (27.48) | < 0.05 | 21.43 | 12.90 | < 0.05 | 12.00 | 5.76 | - | - | - | < 0.05 | 18.18 | 10.20 |
| K (5.61) | 0.45 | 6.77 | 3.02 | 0.48 | 7.52 | 2.95 | - | - | - | 0.21 | 6.77 | 3.19 |
| GGT (22.11) | 0.16 | 15.69 | 4.76 | 0.46 | 19.44 | 4.30 | - | - | - | - | - | - |
| CK (30.3) | 0.06 | 4.85 | 1.79 | 0.09 | 3.72 | 1.41 | - | - | - | - | - | - |
| Glucose (6.96) | < 0.05 | 7.81 | 2.94 | < 0.05 | 7.21 | 2.76 | - | - | - | - | - | - |
| Na (0.73) | < 0.05 | 1.89 | 1.10 | < 0.05 | 2.40 | 1.73 | - | - | - | - | - | - |
| Cl (1.5) | < 0.05 | 3.97 | 2.77 | < 0.05 | 3.97 | 2.44 | - | - | - | - | - | - |
| IGF-1 (24) | < 0.05 | 11.40 | 5.88 | 0.08 | 15.09 | 3.12 | - | - | - | 0.14 | 9.82 | 3.93 |
| FT4 (8.0) | < 0.05 | 6.30 | 2.62 | 0.51 | 3.99 | 2.51 | - | - | - | < 0.05 | 5.79 | 1.35 |
| NSE (10.0)† | < 0.05 | 27.48 | 10.14 | 0.21 | 18.14 | 6.06 | - | - | - | < 0.05 | 64.38 | 25.16 |
| E2 (26.86) | 0.31 | 32.08 | 7.09 | 0.33 | 21.61 | 5.36 | - | - | - | < 0.05 | 34.33 | 11.03 |
| TSH (23.7) | < 0.05 | 11.66 | 4.83 | < 0.05 | 8.42 | 4.04 | - | - | - | 0.05 | 6.01 | 2.51 |
*Westgard database, total error (https://www.westgard.com/biodatabase1.htm) [2]; †Royal College of Pathologists of Australasia (RCPA) Analytical Quality Requirements (2010) [4].
Abbreviations: WBC, white blood cell; RBC, red blood cell; MCV, mean corpuscular volume; MCH, mean corpuscular hemoglobin; MCHC, mean corpuscular hemoglobin concentration; PT, prothrombin time; aPTT, activated partial thromboplastin time; LDH lactate dehydrogenase; AST, aspartate aminotransferase; ALT, alanine aminotransferase; GGT, gamma-glutamyl transferase; CK, creatine kinase; IGF-1, insulin growth factor-1; FT4, free thyroxine; NSE, neuron specific enolase; E2, estradiol; TSH, thyroid stimulating hormone.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download