Abstract
Osteochondral lesions of the talus (OLT) can heal and remain asymptomatic, or they can progress to deep ankle pain on weight bearing and the formation of subchondral cysts. Treatment varies from nonoperative treatment to open and arthroscopic procedures. Operative procedures include marrow stimulation techniques (abrasion chondroplasty, multiple drilling, microfracture), osteochondral autografts or allografts, and autologous chondrocyte implantation. Among these treatments, arthroscopic marrow stimulation techniques have been the preferred initial surgical treatment for most OLT. Despite these treatments, many patients complain of persistent pain even after surgery, and many surgeons face the challenge of determining a second line of treatments. This requires a thorough re-evaluation of the patient’s symptoms as well as radiological measures. If the primary surgical treatment has failed, multiple operative treatments are available, and relatively more invasive methods can be administered. On the other hand, it is inappropriate to draw a firm conclusion in which methods are superior.
거골의 골연골병변은 그 병인에 대한 논란이 여전히 지속되고 있으나 성인에서 발생한 경우 내외측을 불문하고 대부분 외상에서 기인한 것으로 생각된다.1) 1959년 Berndt와 Harty2)는 거골 골연골병변과 내측과 외측 부위 손상의 기전을 밝히고 내측 손상은 내번 및 족저 굴곡에 의하여 생기며, 외측 손상은 내번 및 족배 굴곡에 의해 발생한다고 보고하였다. 즉 내번 또는 회전에 의한 발목관절 손상 시 거골의 관절 표면이 발목관절의 격자에서의 압박 또는 전단력에 의해 손상을 입게 된다. 거골의 내측은 주로 압박에 의한 골연골 함몰 골절 형태로 발생하고 외측은 전단력에 의한 wafer 모양의 얇은 연골 또는 골연골편 형태의 손상이 발생하는 것으로 생각된다(Table 1).2-9) 이렇게 발생 기전에 따라 내측과 외측의 골편 모양이 각기 다르게 형성되며 이러한 모양의 차이에 의해 골편의 안정성이 그 예후의 차이를 만든다는 것이다. 압박에 의해 발생한 내측 골편은 깊은 컵 모양의 골편을 형성하여 안정성이 높아 자연 치유의 가능성이 높아지고 얇은 외측 골연골편은 형태적인 불안정성에 의해 예후가 불량할 가능성이 높다고 알려져 있다. 병변의 정확한 위치 및 불안정성을 알기 위해서는 컴퓨터 단층촬영(computed tomography, CT)이나 자기공명영상(magnetic resonance imaging, MRI) 촬영이 필요하며 최근에는 병변의 활성도를 평가하기 위해 single photon emission computed tomography (SPECT)가 이용되기도 한다.
골연골병변의 치료는 다양한 인자에 의해 결정된다. 환자의 연령, 건강상태, 활동 정도 및 병변 크기와 위치, 동반된 퇴행성 변화 등이 고려되어야 한다. 발목관절의 염좌 및 골절 당시 함께 발생한 골연골 골절(osteochondral fracture) 또는 경연골 골절(transchondral fracture)은 발생 위치와 모양에 따라 수술적 치료 여부를 결정해야 할 것이다. 외측에 발생한 얇은 골절편은 전위되어 관절에 추가적인 손상을 야기할 위험이 높아 조기에 골편 제거와 긁어냄술(abrasion)등의 사전준비(bed preperation)를 하는 것이 바람직할 것이고 내측에 발생한 깊은 골편은 자연 치유를 기대하며 증상의 추이를 지켜볼 수 있을 것이다.5,8,9)
내측의 병변이 자연 치유되지 않고 증상을 유발하는 만성 골연골병변으로 고착화되면 수술적 치료를 고려할 수 있을 것이다. 하지만 이때에도 환자의 증상이 골연골병변에 의한 것인지 다른 원인에 의한 것인지 구분하는 것이 중요할 것이다. 연자는 catching pain, 즉 보행 시 발생하는 갑작스런 통증(acute pain)이 치료를 요하는 골연골병변의 특징적인 증상이라고 생각하며 만성적인 aching pain만 있는 경우 다른 병적인 요인을 더 찾아봐야 한다고 생각한다.
보행 시 발생하는 만성적인 aching pain의 경우 족관절의 퇴행성 변화 및 다른 병변에 의한 족관절내의 골내압력 상승과 활액막염에서 기인할 가능성이 많으며 이는 골연골병변과 구별될 수 있다.10) 골연골병변이 관절 내 압력을 상승시키는 경우 및 활액막염을 유발하는 경우는 드물며 catching pain은 보행 시 연골하골(subchondral bone)의 위치한 신경말단(nerve ending)의 노출 및 자극으로 갑작스런 통증이 발생할 가능성이 크다.11)
아직까지 보존적 치료 및 수술 기준에 대한 명확한 합의는 이루어져 있지 않다. 일반적으로 급성의 발목 염좌에서 X-ray 소견은 정상이나 MRI에서는 약 40%에서 골의 멍(bruise) 소견이 관찰되며 이를 거골 골연골병변으로 오인해서는 안 된다.12) 일반적인 보존적 치료의 적응증은 무증상 병변, 전위가 없는 급성 손상, 신체 기능이 저하된 고령의 환자, 아직 성장이 끝나지 않은 환자 등에서 고려해 볼 수 있다.13) 수술적 치료 방법으로는 관절경을 이용한 소파술, 연마, 변연 절제술 및 다발성 천공, 미세 절골술(microfracture) 등의 골수 자극 요법이 선호되며 연골 결손 부위를 초자연골 대신 섬유 연골로 복원시키는 방법들이다. 관절면의 초자연골을 복원시키기 위한 방법으로는 자가 골연골편 또는 동종 연골편 이식법(osteochondral transplantation, OAT)이나 자가 연골세포 이식법(autologous chondrocyte transplantation, ACI) 등이 있다. 여러 연구에서 관절경적 치료 방법은 약 65%∼90% 환자에서 좋은 임상적 결과를 보이고 있으나 병변의 크기가 크고(>15 mm), uncontained lesion, 발목 불안정성이 있는 경우 예후가 좋지 않다고 알려져 있다(Table 2).7,13-18)
수술 전에 어떠한 증상으로 얼마나 불편하였는지 다시 물어보고 수술 전 영상을 증상과 맞추어 보아야 한다. 적지 않은 환자가 증상을 유발하지 않는 우연히 발견된(자연 치유된) 병변에 대해 수술을 권유 받고 있다.
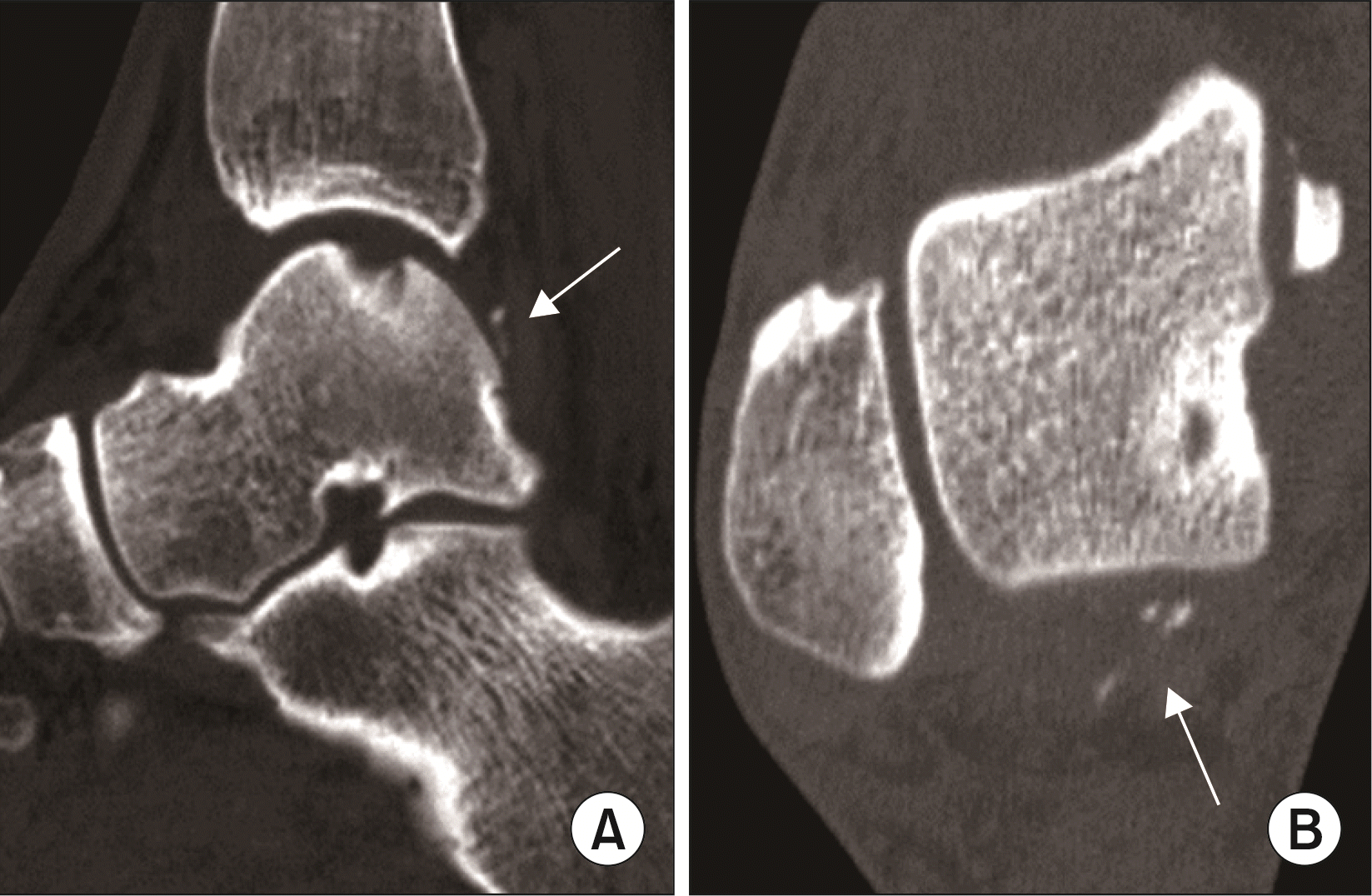
수술 후 6개월 정도는 치유 기간으로 회복의 가능성을 열어두고 경과를 지켜보는 것이 좋을 것으로 생각된다. 하지만 이후에도 계속 통증을 호소한다면 현재의 통증이 수술 전과 유사한지 혹은 다른지 확인하는 것이 중요할 것이다. 수술 후 6개월 이후에도 수술 전 통증과 유사한 catching pain이 지속되는 경우 병변의 치유가 실패하였거나 소파술 시 일부 골편이 남아 유리체(Fig. 1)로 증상을 유발할 가능성이 있으므로 MRI 및 진단적 관절경으로 확인하여 재수술 여부를 판단하는 것이 필요하다.16,19) 수술 시 연골의 불안정한 조각은 제거하고 건강한 연골 경계를 확보하며 지방 방울(fat droplet)이 보이는 적절한 깊이로 골수 자극이 되었는지 확인해야 한다(Fig. 2).14) 수술 전 증상과 다른 유형의 통증은 portal 주위의 신경 손상에 의한 증상 및 수술 후 관절강내 과도한 반흔 형성에 의한 충돌 증후군도 aching pain의 원인이 될 수 있다(Table 3).
신경통의 경우 환자에게는 설명과 함께 물리 치료 및 필요하다면 약물 치료를 병행한다. 회복 시기가 매우 지연될 수 있음을 주지시키는 것이 중요하다.
수술 후 관절의 부전 강직과 활동 시 aching pain을 호소한다면 온열 치료, 소염진통제 투여 및 관절강내 스테로이드 소량 투여 등의 치료를 시도해보는 것이 좋을 것이다. 증상의 호전이 없다면 환자와 상의 후 관절경으로 반흔조직의 변연 절제술을 시도해볼 수 있겠다. 수술 전 증상과 유사하거나 심해진 경우는 병변의 치유 실패로 생각되므로 MRI로 확인한 후 환자의 상의하여 재수술 여부를 결정한다.20) Yoon 등21)과 Choi 등16)의 연구에 의하면 관절경적 골수자극술(bone marrow stimulation, BMS)을 시행한 환자에서 각각 399명 중 11%, 120명 중 6.7%에서 증상의 지속으로 재수술이 필요하다고 발표하였다. 병변의 위치와 크기에 따라 관절경적 소파술 및 BMS를 다시 시행할 수도 있고 OAT 또는 scaffold와 골수천자 원심분리 침전물 등을 이용한 재생 촉진제를 추가로 투여할 수 있다.16,22-24)
O’Driscoll은 관절 연골병변의 손상 및 치료에 대해서 네 가지의 원칙을 가정하였는데 병변은 restored, replaced, relieved 또는 resected (4R’s)를 해야 한다는 것이다.25) 이에 거골 골연골병변의 1차 치료는 연골 및 관절하골의 자가치유능력을 자극하여 restoration을 하나 2차로는 replacement하는 방법이 많이 제시되었다. Robinson 등26)의 연구에서는 재관절경적 소파 및 BMS에 대해 좋지 않은 결과를 보고했으며 OAT 등을 대안으로 제시했다. 그러나 최근 연구에서는 small to medium size (<15 mm)의 2차 BMS로 70% 이상의 증상 호전을 보였다고 보고하였다.19) 또한 2018년 Lambers 등27)에서 발표한 메타 분석(meta-analysis)에 의하면 BMS를 재실시하였을 때 수술 후 성공률이 69%∼75% (Table 4)로 비록 1차 치료로서의 성공률인 82%보다는 낮지만 덜 침습적이고, 비용적인 측면을 생각하였을 때 환자와의 상담을 통해 충분히 시행될 수 있다고 생각된다. 그러나 큰 연골하 낭종 및 크기가 크거나 골관절염(osteoarthritis)이 동반되어 있을 경우 성공률이 떨어지게 된다는 보고가 있으므로 치료 시 반드시 이를 유념해야 한다.21) Kim 등28)은 고령의 환자나 연골하 낭종을 동반한 골연골병변에서 BMS와 더불어 관절 내로 중간엽 줄기세포(mesenchymal stem cell)를 주입하는 것이 임상적 결과에 좋은 영향을 주었다는 발표를 하였다. 또한 Murphy 등29)의 연구에 의하면 미세 절골술만 시행한 군에서 28.8% 재수술률을 보였으나 자가골수줄기세포술(bone marrow aspirate concentration)과 같이 시행한 군에서는 12.2%로 낮았다고 발표하였다. 이에 재수술 시에는 관절경적 BMS와 더불어 이런 재생 촉진제를 같이 투여하는 것도 좋은 대안이 될 수 있다.
여러 문헌에서 OAT는 실패한 1차 치료에서 제일 많이 제시되는 치료 방법이며 52%∼94%의 증상 완화 및 기능적 결과를 보이고 있다.26,27,30) 크기가 작은 연골병변에는 재소파술에 의한 섬유연골로의 대체가 충분할 수 있으나 사이즈가 큰 경우에는 생역학적 특성이 떨어져 지속성(durability)은 기대하기 어렵다. 이에 OAT를 통한 보다 구조적으로 안정적인 초자연골로의 복원이 당연히 더 바람직할 것으로 생각된다. Yoon 등21)에 의하면 실패한 1차 치료에서 재소파술과 OAT를 비교하였을 때 단기적 추시관찰 결과 비슷한 증상 호전을 보였으나 4년 이상의 추시관찰에서는 OAT가 더 좋은 기능적 결과를 보였으며 80%가 넘는 성공률을 보였다. 또한 자가 골연골(autograft) 이식술이 동종 골연골(allograft) 이식술보다 2차 치료에서 월등히 높은 성공률(90% vs. 55%)을 보였는데 수술 전 병변의 크기 차이에서 기인했을 수 있으나 가능하다면 자가골의 사용을 추천한다. 하지만 OAT는 건강한 슬관절에서 골연골편을 채취해야 하며 술식이 복잡하고 슬관절과 족근관절의 연골 두께의 차이가 난다는 점 등의 단점이 있다. BMS를 시행한 후 OAT를 재시행할 경우 Imhoff 등31)은 임상적 결과가 더 좋지 않을 수 있다고 하였는데 이는 연골하골의 열손상의 발생으로 OAT 이식편의 동화(integration)에 저해가 있을 수 있음을 명심 하여야 한다. 이에 OAT 시행 시 연골하골의 충분한 제거 및 이식편(cylinder)의 깊이가 충분 하여 골유착능 및 안정성 가지고 있어야 한다.24)
Giannini 등32)은 자가 연골세포 이식술(ACI & matrix-associated chondrocyte implantation [MACI])을 이용해 거골 병변에 초자연골이 형성되는 것을 관찰하였으며 작은 연골 표본으로 연골을 배양할 수 있는 장점을 가지고 있다고 하였다. 최근 메타 분석에 의하면 재수술에서 ACI와 MACI 각각 73% 및 59%의 통증 호전 및 기능 회복을 보였으나 두 번의 수술이 필요하고 술기가 복잡하며 비용이 많이 든다는 단점이 있어 OAT에 비해 뚜렷한 장점이 없어 보인다.27) 최근에는 scaffold와 골수천자 원심분리 침전물 등을 이용한 재생 촉진제(autologous matrix-induced chondrogenesis)를 추가로 투여하는 방법을 사용하기도 하며 성공률은 57%∼67%를 보였다.27) Scaffold는 자극된 골수로부터 세포 분화를 촉진하는 환경을 만들어주며 연골의 생성 과정을 보호하는 역할을 하게 된다. 이 방법은 관절경적인 수술이 가능하며 여러 번의 수술이 필요 없으므로 재수술에서 충분히 고려될 수 있다고 생각한다.33) 그러나 많은(58%) 환자에서 내측 상과 절골술 시행이 필요하며 이후 삽입된 내고정 기기로 관련된 증상이 있을 수 있다.27)
수술 후 6개월간은 치료기간으로 회복의 가능성을 열어두고 경과를 지켜보아야 한다. 이후에도 지속적인 통증을 호소한다면 현재의 통증이 수술 전과 유사한지 혹은 다른지를 확인하는 것이 중요하다. 만약 병변의 치유가 실패하여 발생하는 catching pain일 경우 환자와 상의하여 재수술 여부를 결정하게 되며 병변의 위치 및 크기에 따라 관절경적 소파술 및 BMS를 다시 시행할 수도 있고 OAT 또는 scaffold와 골수천자 원심분리 침전물 등을 이용한 재생 촉진제를 추가로 투여할 수 있다. 주로 처음 치료보다는 더 침습적인 방법이 사용되는 경우가 많으나 아직까지 어떠한 방법도 다른 방법보다 우월한 결과를 보이지 않으므로 환자와의 충분한 상담 및 개인화된 치료가 필요함을 명심하여야 한다.
REFERENCES
1. Ray RB, Coughlin EJ Jr. 1947; Osteochondritis dissecans of the talus. J Bone Joint Surg Am. 29:697–706. PMID: 20253044.
2. Berndt AL, Harty M. 1959; Transchondral fractures (osteochondritis dissecans) of the talus. J Bone Joint Surg Am. 41:988–1020. DOI: 10.2106/00004623-195941060-00002. PMID: 13849029.

3. Canale ST, Belding RH. 1980; Osteochondral lesions of the talus. J Bone Joint Surg Am. 62:97–102. DOI: 10.2106/00004623-198062010-00014. PMID: 7351423.

4. Chen DS, Wertheimer SJ. 1992; Centrally located osteochondral fracture of the talus. J Foot Surg. 31:134–40. PMID: 1644999.
5. Flick AB, Gould N. 1985; Osteochondritis dissecans of the talus (transchondral fractures of the talus): review of the literature and new surgical approach for medial dome lesions. Foot Ankle. 5:165–85. doi: 10.1177/107110078500500403. DOI: 10.1177/107110078500500403. PMID: 3830846.

6. Stone JW. 1996; Osteochondral lesions of the talar dome. J Am Acad Orthop Surg. 4:63–73. doi: 10.5435/00124635-199603000-00001. DOI: 10.5435/00124635-199603000-00001. PMID: 10795042.

7. Verhagen RA, Struijs PA, Bossuyt PM, van Dijk CN. 2003; Systematic review of treatment strategies for osteochondral defects of the talar dome. Foot Ankle Clin. 8:233–42. viii–ix. doi: 10.1016/s1083-7515(02)00064-5. DOI: 10.1016/S1083-7515(02)00064-5.

8. Thompson JP, Loomer RL. 1984; Osteochondral lesions of the talus in a sports medicine clinic. A new radiographic technique and surgical approach. Am J Sports Med. 12:460–3. doi: 10.1177/036354658401200611. DOI: 10.1177/036354658401200611. PMID: 6507717.
9. Clanton TO, DeLee JC. 1982; Osteochondritis dissecans. History, pathophysiology and current treatment concepts. Clin Orthop Relat Res. (167):50–64. doi: 10.1097/00003086-198207000-00009. DOI: 10.1097/00003086-198207000-00009. PMID: 6807595.

10. Saxler G, Löer F, Skumavc M, Pförtner J, Hanesch U. 2007; Localization of SP- and CGRP-immunopositive nerve fibers in the hip joint of patients with painful osteoarthritis and of patients with painless failed total hip arthroplasties. Eur J Pain. 11:67–74. doi: 10.1016/j.ejpain.2005.12.011. DOI: 10.1016/j.ejpain.2005.12.011. PMID: 16460974.

11. Mach DB, Rogers SD, Sabino MC, Luger NM, Schwei MJ, Pomonis JD, et al. 2002; Origins of skeletal pain: sensory and sympathetic innervation of the mouse femur. Neuroscience. 113:155–66. doi: 10.1016/s0306-4522(02)00165-3. DOI: 10.1016/S0306-4522(02)00165-3. PMID: 12123694.

12. Labovitz JM, Schweitzer ME. 1998; Occult osseous injuries after ankle sprains: incidence, location, pattern, and age. Foot Ankle Int. 19:661–7. doi: 10.1177/107110079801901003. DOI: 10.1177/107110079801901003. PMID: 9801079.

13. Choi WJ, Choi GW, Kim JS, Lee JW. 2013; Prognostic significance of the containment and location of osteochondral lesions of the talus: independent adverse outcomes associated with uncontained lesions of the talar shoulder. Am J Sports Med. 41:126–33. doi: 10.1177/0363546512453302. DOI: 10.1177/0363546512453302. PMID: 22859663.
14. Barnes CJ, Ferkel RD. 2003; Arthroscopic debridement and drilling of osteochondral lesions of the talus. Foot Ankle Clin. 8:243–57. doi: 10.1016/s1083-7515(03)00016-0. DOI: 10.1016/S1083-7515(03)00016-0. PMID: 12911239.

15. Choi WJ, Park KK, Kim BS, Lee JW. 2009; Osteochondral lesion of the talus: is there a critical defect size for poor outcome? Am J Sports Med. 37:1974–80. doi: 10.1177/0363546509335765. DOI: 10.1177/0363546509335765. PMID: 19654429.
16. Lee KB, Bai LB, Yoon TR, Jung ST, Seon JK. 2009; Second-look arthroscopic findings and clinical outcomes after microfracture for osteochondral lesions of the talus. Am J Sports Med. 37(Suppl 1):63S–70S. doi: 10.1177/0363546509348471. DOI: 10.1177/0363546509348471. PMID: 19843658.

17. Schuman L, Struijs PA, van Dijk CN. 2002; Arthroscopic treatment for osteochondral defects of the talus. Results at follow-up at 2 to 11 years. J Bone Joint Surg Br. 84:364–8. doi: 10.1302/0301-620x.84b3.11723. DOI: 10.1302/0301-620X.84B3.11723. PMID: 12002494.
18. Zengerink M, Struijs PA, Tol JL, van Dijk CN. 2010; Treatment of osteochondral lesions of the talus: a systematic review. Knee Surg Sports Traumatol Arthrosc. 18:238–46. doi: 10.1007/s00167-009-0942-6. DOI: 10.1007/s00167-009-0942-6. PMID: 19859695. PMCID: PMC2809940.

19. Savva N, Jabur M, Davies M, Saxby T. 2007; Osteochondral lesions of the talus: results of repeat arthroscopic debridement. Foot Ankle Int. 28:669–73. doi: 10.3113/FAI.2007.0669. DOI: 10.3113/FAI.2007.0669. PMID: 17592696.

20. Higashiyama I, Kumai T, Takakura Y, Tamail S. 2000; Follow-up study of MRI for osteochondral lesion of the talus. Foot Ankle Int. 21:127–33. doi: 10.1177/107110070002100206. DOI: 10.1177/107110070002100206. PMID: 10694024.

21. Yoon HS, Park YJ, Lee M, Choi WJ, Lee JW. 2014; Osteochondral autologous transplantation is superior to repeat arthroscopy for the treatment of osteochondral lesions of the talus after failed primary arthroscopic treatment. Am J Sports Med. 42:1896–903. doi: 10.1177/0363546514535186. DOI: 10.1177/0363546514535186. PMID: 24907287.

22. DʼAmbrosi R, Villafañe JH, Indino C, Liuni FM, Berjano P, Usuelli FG. 2019; Return to sport after arthroscopic autologous matrix-induced chondrogenesis for patients with osteochondral lesion of the talus. Clin J Sport Med. 29:470–5. doi: 10.1097/JSM.0000000000000560. DOI: 10.1097/JSM.0000000000000560. PMID: 31688177.
23. Gu W, Li T, Shi Z, Mei G, Xue J, Zou J, et al. 2017; Management of Hepple stage V osteochondral lesion of the talus with a platelet-rich plasma scaffold. Biomed Res Int. 2017:6525373. doi: 10.1155/2017/6525373. DOI: 10.1155/2017/6525373. PMID: 28401159. PMCID: PMC5376404.

24. Park KH, Hwang Y, Han SH, Park YJ, Shim DW, Choi WJ, et al. 2018; Primary versus secondary osteochondral autograft transplantation for the treatment of large osteochondral lesions of the talus. Am J Sports Med. 46:1389–96. doi: 10.1177/0363546518758014. DOI: 10.1177/0363546518758014. PMID: 29537877.

25. O'Driscoll SW. 1998; The healing and regeneration of articular cartilage. J Bone Joint Surg Am. 80:1795–812. DOI: 10.2106/00004623-199812000-00011. PMID: 9875939.
26. Robinson DE, Winson IG, Harries WJ, Kelly AJ. 2003; Arthroscopic treatment of osteochondral lesions of the talus. J Bone Joint Surg Br. 85:989–93. doi: 10.1302/0301-620x.85b7.13959. DOI: 10.1302/0301-620X.85B7.13959. PMID: 14516033.

27. Lambers KTA, Dahmen J, Reilingh ML, van Bergen CJA, Stufkens SAS, Kerkhoffs GMMJ. 2018; No superior surgical treatment for secondary osteochondral defects of the talus. Knee Surg Sports Traumatol Arthrosc. 26:2158–70. doi: 10.1007/s00167-017-4629-0. DOI: 10.1007/s00167-017-4629-0. PMID: 28687862. PMCID: PMC6061445.

28. Kim YS, Park EH, Kim YC, Koh YG. 2013; Clinical outcomes of mesenchymal stem cell injection with arthroscopic treatment in older patients with osteochondral lesions of the talus. Am J Sports Med. 41:1090–9. doi: 10.1177/0363546513479018. DOI: 10.1177/0363546513479018. PMID: 23460335.

29. Murphy EP, McGoldrick NP, Curtin M, Kearns SR. 2019; A prospective evaluation of bone marrow aspirate concentrate and microfracture in the treatment of osteochondral lesions of the talus. Foot Ankle Surg. 25:441–8. DOI: 10.1016/j.fas.2018.02.011. PMID: 30321966.

30. Ross AW, Murawski CD, Fraser EJ, Ross KA, Do HT, Deyer TW, et al. 2016; Autologous osteochondral transplantation for osteochondral lesions of the talus: does previous bone marrow stimulation negatively affect clinical outcome? Arthroscopy. 32:1377–83. doi: 10.1016/j.arthro.2016.01.036. DOI: 10.1016/j.arthro.2016.01.036. PMID: 27062010.

31. Imhoff AB, Paul J, Ottinger B, Wörtler K, Lämmle L, Spang J, et al. 2011; Osteochondral transplantation of the talus: long-term clinical and magnetic resonance imaging evaluation. Am J Sports Med. 39:1487–93. doi: 10.1177/0363546510397726. DOI: 10.1177/0363546510397726. PMID: 21372316.
32. Giannini S, Buda R, Vannini F, Di Caprio F, Grigolo B. 2008; Arthroscopic autologous chondrocyte implantation in osteochondral lesions of the talus: surgical technique and results. Am J Sports Med. 36:873–80. doi: 10.1177/0363546507312644. DOI: 10.1177/0363546507312644. PMID: 18227232.
33. Valderrabano V, Miska M, Leumann A, Wiewiorski M. 2013; Reconstruction of osteochondral lesions of the talus with autologous spongiosa grafts and autologous matrix-induced chondrogenesis. Am J Sports Med. 41:519–27. doi: 10.1177/0363546513476671. DOI: 10.1177/0363546513476671. PMID: 23393079.

34. Vuurberg G, Reilingh ML, van Bergen CJA, van Eekeren ICM, Gerards RM, van Dijk CN. 2018; Metal resurfacing inlay implant for osteochondral talar defects after failed previous surgery: a midterm prospective follow-up study. Am J Sports Med. 46:1685–92. doi: 10.1177/0363546518764916. DOI: 10.1177/0363546518764916. PMID: 29624081. PMCID: PMC5985591.

35. Hintermann B, Wagener J, Knupp M, Schweizer C, J Schaefer D. 2015; Treatment of extended osteochondral lesions of the talus with a free vascularised bone graft from the medial condyle of the femur. Bone Joint J. 97:1242–9. doi: 10.1302/0301-620X.97B9.35292. DOI: 10.1302/0301-620X.97B9.35292. PMID: 26330592.

Figure. 2
Insufficient treatment such as incomplete removal of bad tissue (A), too shallow drilling (B), too deep drilling (C) (in order) can be possible causes of failed pain relief.
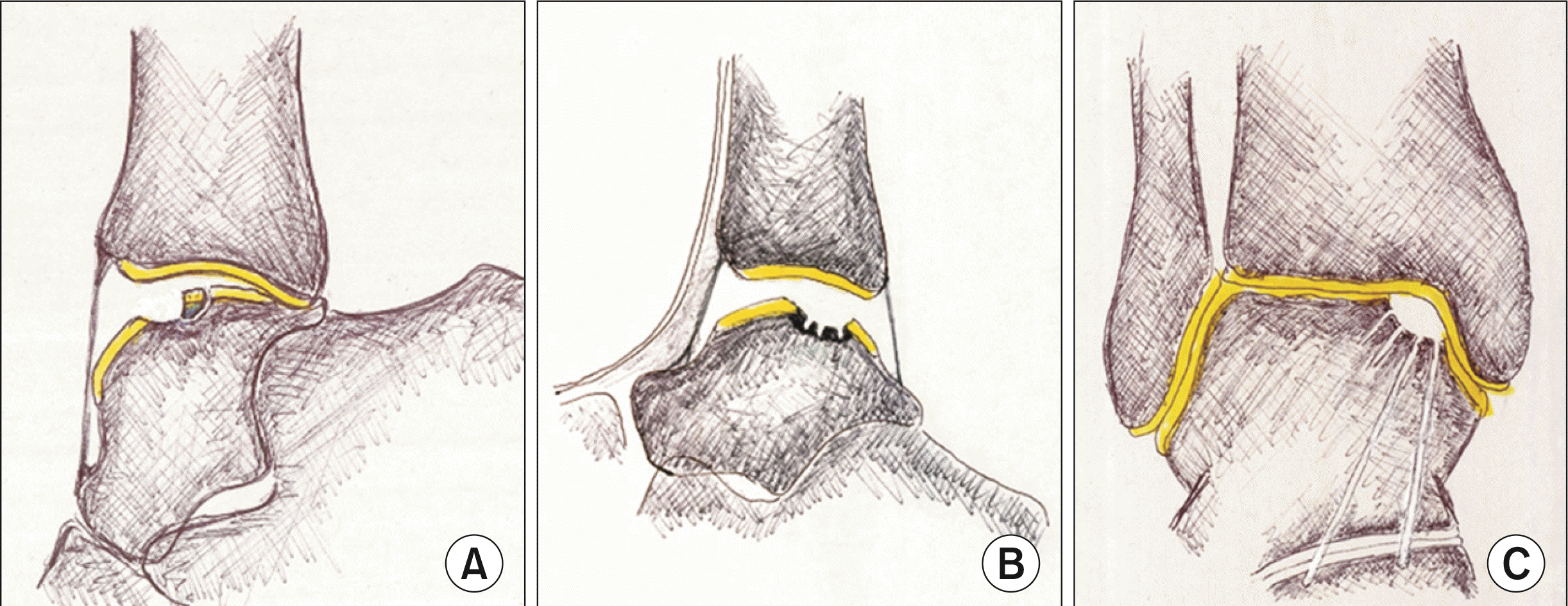
Table 1
Table 2
Success Percentages (Patients with Good/Excellent Result at Follow-up after Treatment of an Osteochondral Talar Lesion) of Review
Table 3
Categories of Failure of Treatment of Osteochondral Lesions of the Talus
Table 4
Success Rates of Secondary Treatment of Osteochondral Lesions of the Talus
Data from the article of Lambers at al. (Knee Surg Sports Traumatol Arthrosc. 2018;26:2158-70).27)




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download