Abstract
Bone marrow aspirate concentrate and matrix-induced chondrogenesis (BMIC) is an interesting treatment option for osteochondral lesions of the talus with promising short- to mid-term results. The various terminologies used to describe this surgical method need to be addressed. These include bone marrow-derived cell transplantation, matrix-induced bone marrow aspirate concentrate, and matrix-associated stem cell transplantation. BMIC is a one-stage, minimally invasive surgery performed arthroscopically or using a mini-open arthrotomy approach without a malleolar osteotomy in most cases. The lesion is replaced with hyaline-like cartilage, and treatment-related complications are rare. BMIC is a safe and effective treatment option and should be considered in large lesions or lesions with a prior treatment history.
거골 골연골병변(osteochondral lesions of the talus)에 대한 수술적 치료 방법은 미세골절술(microfracture), 자가 골연골 이식술(autologous osteochondral transfer, OATS), 자가 연골세포 이식술(autologous chondrocyte implantation, ACI)이 대표적이다. 미세골절술은 술기가 간단하면서도 양호한 경과를 얻을 수 있어 일차적인 치료 방법으로 가장 우선적으로 고려된다. 그러나 초자연골이 아닌 섬유연골로 재생되고 크기가 큰 병변에서는 예후가 좋지 않으며 다른 수술방법에 비해 짧은 수명이 단점으로 지적된다. 자가 골연골 이식술은 골유합에 의한 이식물의 생착과 초자연골로 대체되는 장점이 있지만 공여부 이환(donor site morbidity)의 문제와 접근을 위한 절골술을 요하는 경우가 많아 부담스럽다. ACI는 큰 병변도 치료할 수 있다는 장점이 있지만 연골세포 채취를 위한 1차 수술과 배양된 연골세포 이식을 위한 2차 수술이 각각 필요하다는 큰 단점이 있어 잘 시행되지 않는다.
AMIC는 ACI로부터 변형 및 발전된 방법이라고 할 수 있다. ACI는 자가연골을 채취하여 배양한 후 이를 다시 병소에 이식하는데 이때 병소를 덮기 위해 자가 골막을 떼어서 사용하였다. 이후 자가 골막 대신 인공 기질 또는 이종콜라겐지지체를 사용하여 자가 연골세포를 이식하는 방법이 개발되었고 이를 기질 유래 자가 연골세포 이식술(matrix-induced ACI, MACI)이라고 한다. 그러다가 MACI에서 자가 연골세포의 이식을 빼고 세포 없이 기질만 이식하는 방법이 개발되었는데 기질과 자가 거골골수세포를 이용해서 연골을 재생시키기 때문에 자가 기질 유래 연골 형성(autologous matrix-induced chondrogenesis, AMIC)이라고 명명하였다. 골연골 결손 부위에 채워진 기질은 미세골절술 후 골수로부터 흘러나오는 골수액을 흡수하여 병소에 그 작용을 집중시키는 역할(biologic chamber)을 하고 골수세포가 연골을 재생하기 위한 골격(skeleton) 또는 지지체의 역할을 한다.16)
주로 사용되는 기질은 하이알로파스트(Hyalofast; Anika Therapeutics S.r.l, Padova, Italy)와 콘드로가이드(Chondro-Gide; Geistlich Pharma AG, Wolhusen, Switzerland)가 있다. 하이알로파스트는 연골 기질의 단백 다당(proteoglycan)을 이루는 히알루론산(hyaluronic acid)을 주성분으로 만든 지지체로 약 2 mm 두께의 얇은 솜 같은 느낌으로 부드럽고 세포의 흡수가 빠르며 병변에 부착이 용이한 장점이 있다. 콘드로가이드는 돼지의 복막을 건조하여 만든 것으로 콜라겐 I/III을 주성분으로 하며 조밀층과 다공성층의 이중층 구조를 하고 있어 세포의 흡수성과 높은 인장력을 제공하는 장점이 있다.
Volz 등17)은 무릎의 골연골병변에 대해 미세골절술만 시행한 군과 미세골절술 및 AMIC을 시행한 군을 비교한 연구에서 수술 후 2년까지는 차이가 없었는데 5년 경과 시 두 군 간의 임상적 기능점수에서 유의한 차이가 나타났다고 보고하였다. 거골에서 시행한 AMIC도 좋은 임상적 결과가 보고되고 있다. Yontar 등3)은 크기 150 mm2 미만, 깊이 7 mm 이상의 거골 골연골병변 20예를 대상으로 골이식 없이 관절경적 AMIC만 시행하였는데 평균 20.3개월 추시 결과 시각통증점수(visual analogue scale, VAS)가 7.1±2.5에서 1.7±2.2로 감소하였고 American Orthopaedic Foot and Ankle Society (AOFAS) 점수도 57.5±9.4에서 최종 추시 시 92.5±8.4로 호전되었다고 보고하였다. Weigelt 등4)은 내과 절골술을 포함한 개방적 접근(open approach)을 이용한 AMIC을 시행하였으며, 33예 중 28예에서 자가골이식술을 함께 시행하였다. 평균 4.7년(2.3∼8.0년) 추시 결과 통증과 기능 점수가 유의하게 호전되었다. 하지만, 추시 자기공명영상(magnetic resonance imaging, MRI) 검사상 연골재생점수(magnetic resonance observation of cartilage repair tissue; MOCART)가 60.6±21.2 (0∼100)였으며 재생된 연골의 비후(hypertrophy)가 52%에서 관찰되었다고 보고하였다. Galla 등5)은 23명의 환자에게 관절절개 후 절골술 없이 K강선을 이용한 관절견인기(Hintermann retractor)를 이용하여 병변을 노출하는 방법으로 AMIC을 시행하였으며 평균 33.5±10.4개월(24∼52.9개월) 추시 결과, VAS가 7.6±1.1에서 1.4±2.2로 감소하였으며 족부족관절 기능적 불편감의 척도인 foot function index (FFI)는 46.8±14.3에서 15.9±11.4로 호전되었다. 평균 MOCART는 74.1±12.4 (50∼95)로 보고하였다. Usuelli 등6)은 관절경적 자가골 이식 및 AMIC을 시행한 20예의 24개월 추시 결과, MOCART는 12개월에 42.8±23.5, 24개월에 50.9±24.9로 다소 낮았지만 임상적 결과는 VAS, AOFAS, short-form 12 (SF12) 모두 유의한 호전을 보였다고 하였다.
한편 미세골절술 시행 후 BMAC이나 혈소판풍부 혈장(platelet-rich plasma, PRP)과 같은 생물학적 보조제를 추가하는 치료도 개발되었다. Hannon 등7)은 거골 골연골병변에 대해 미세골절술만 시행한 군(n=12)과 비교해서 미세골절술 후 BMAC을 관절강내 주입한 군(n=22)에서 수술 후 2년 경과 시 MRI상 MOCART 점수가 유의하게 높았으며(p=0.023) 재생된 조직의 경계부가 주변 정상 연골조직과 더 잘 동화(border integration)되었고 갈라짐(fissuring)이나 너덜너덜해짐(fibrillation)의 소견이 적었다고 보고하였다. Murphy 등8)은 거골 골연골병변에 대해 미세골절술만 시행한 군(n=52)보다 미세골절술 후 BMAC과 섬유소 아교(fibrin glue)를 이용하여 병변을 층층이(layer by layer) 메운 군(n=49)에서 최소 36개월 추시 시 재수술 시행률이 유의하게 더 낮음(미세골절술군 28.8%, 미세골절술 및 BMAC군 12.2%; p=0.0145)을 보고하였다.
거골 골연골병변에 대해 AMIC이나 BMAC을 단독으로 시행할 수도 있지만 기질 또는 지지체의 물리적인 역할과 BMAC의 생물학적 보조제의 장점을 모두 활용하기 위해 두 방법을 병용하는 치료 방법이 더 많이 시행되고 있다. 참고로 국내에서는 거골 골연골병변에 대한 AMIC은 허가되지 않았으며 BMAC을 시행하기 위해 기질을 사용하는 방법, 즉 BMAC과 AMIC을 동시에 시행하는 방법은 허가된 상태이다.
이러한 BMAC과 AMIC을 혼합한 치료는 최근에 발전하고 있는 방법으로 저자에 따라서 다양한 용어를 사용하고 있기 때문에 혼란을 초래하고 있다. 기술적으로 수술방법이나 사용하는 재료의 차이는 있으나 근본적으로 BMAC과 기질을 이용하여 연골재생을 유도한다는 점에서 같은 치료 방법으로 볼 수 있다. 따라서 혼란을 방지하기 위해 치료 내용을 정확히 반영하는 용어의 정립과 통일이 필요하다. Giannini 등9,12,18,19)은 골수유래세포 이식술(bone marrow-derived cell transplantation, BMDCT)이라는 용어를 사용했는데 이는 기질에 의한 연골재생의 의미를 함유하지 않고 있으며 또한 단지 골수유래 세포만 이식한 것이 아니고 BMAC에 포함된 혈소판과 platelet-derived growth factor (PDGF), transforming growth factor-β2 (TGF-β2), vascular endothelial growth factor (VEGF), interleukin (IL)-8, IL-1β 등의 성장인자와 사이토카인을 모두 이식한 것이므로 술기의 내용을 정확하게 반영하는 용어가 아니다. 같은 그룹의 다른 논문20)에서는 기질 유래 골수 흡인물 농축액(matrix-induced bone marrow aspirate concentrate, mBMAC)이라는 용어를 사용했는데 기질의 개념을 포함시켰지만 기질에서 BMAC이 유래된 것 같은 혼동을 야기한다. Richter 등1,14,21)과 Murphy 등15)은 기질 연관 줄기세포 이식술(matrix-associated stem cell transplantation, MAST)이라는 용어를 사용하였는데 실제로는 줄기세포를 포함한 BMAC을 그대로 이용하였으나 마치 줄기세포만 따로 추출하여 이식한 것처럼 보이는 오류가 있다. 따라서 본 저자는 BMAC과 AMIC의 개념을 모두 포함하는 용어로 골수 흡인물 농축액 및 기질 유래 연골 형성(bone marrow aspirate concentrate and matrix-induced chondrogenesis, BMIC) 이라는 용어를 제시하고자 한다. 물론 BMIC에는 흔히 함께 시행되는 자가골 이식의 개념이 포함되지 않았지만 이는 연골하골의 결손이 큰 경우에만 추가적으로 시행되는 술식이므로 기본 개념에는 포함되지 않는 것이 맞다고 생각된다.
BMAC와 기질을 혼합하여 사용하는 방법은 Giannini 등9)에 의해 가장 먼저 시도되었다. Giannini 등9)은 거골 골연골병변에 대해 BMAC과 콜라겐파우더 또는 히알루론산막(hyaluronic acid membrane)을 이용해 치료를 시행한 48명을 최소 24개월 추시한 결과, AOFAS 점수가 술 전 64.4±14.5에서 최종 추시 시 91.4±7.7로 증가했다고 보고하였다. 재생된 연골내 콜라겐과 물분자의 상호작용을 분석하여 연골조직의 질적인 부분을 평가할 수 있는 T2-mapping MRI 분석을 추가한 연구에서 Giannini 등2)은 재생된 조직 면적의 78%±16%에서 T2값이 초자연골과 유사(35∼45 ms)한 것으로 보고하였다. 이후 140명에 대한 후속연구에서 AOFAS 점수가 술 전 58.7±13.5에서 24개월 추시 시 90.6±8.6, 48개월 추시 시 90.9±10.7로 증가되었으며 6년 추시된 13명의 AOFAS 점수는 86.9±17.6으로 양호하였다.12) Richter 등1)은 거골 골연골병변에 대해 BMAC과 콜라겐 I/III 기질을 이용하여 치료한 후 5년 추시를 완료한 100명의 결과를 보고하였는데 통증 지수(visual analogue scale foot and ankle, VAS FA)가 수술 전 45.2 (16.4∼73.5)에서 최종 추시 시 84.4 (54.1∼100)로 호전되었다. Murphy 등15)은 골연골병변에 대한 다른 수술의 실패 경험이 있는 23명을 포함한 총 32명에 대해 자가해면골이식 및 BMAC과 콜라겐 I/III 기질을 이용한 치료를 시행한 후 평균 36.7개월 추시한 결과, 83%가 스포츠 활동으로 복귀가 가능했다고 보고하였다. Sadlik 등10,22)은 자가해면골 및 BMAC과 섬유소 아교의 혼합물을 이용하여 거골 원개(dome)의 볼록한 곡면을 재건하고 콜라겐 I/III 또는 히알루론산 지지체(hyaluronic acid-based scaffold)로 수복하는 수술 방법을 보고했다. 10명의 환자를 대상으로 평균 46.4개월 추시한 결과 AOFAS 점수가 수술 전 58.3±8.5에서 최종 추시 시 81.8±15.5로 증가했고 MOCART 점수는 69.5%±16.7%였다.
한편 동일한 기질을 사용하면서 BMAC을 이용한 BMIC군(40예)과 배양된 자가 연골세포를 이용한 MACI군(40예)을 비교한 연구에서 48개월 경과 시 두 군 모두 임상적 호전 정도는 비슷했으나 스포츠 활동으로의 복귀가 BMIC군에서 조금 더 좋았으며 T2-mapping MRI 결과, 초자연골과 유사한 조직이 MACI군(75%)보다 BMIC군(85%)에서 더 높게 나타났다.18) 수술 후 24개월 경과 후 조직학적 검사를 시행한 다른 연구20)에서는 MACI군(7예)과 BMIC군(15예) 모두 초자연골과 유사한 연골로 재생이 되었다고 보고된 바 있다.
모든 술기는 수술장에서 수술과 함께 이루어진다. 동측 장골에서 천자바늘을 이용하여 골수를 흡인한다. 이때 장골에 천자 구멍을 여러 개 낼 경우 주사기 내 음압이 걸리지 않아 흡인의 어려움이 발생할 수 있으므로 가급적 한 번에 시행하도록 주의를 요한다. 필요에 따라 바늘 끝의 방향과 깊이를 달리하면서, 제조사에 따라 총 50∼60 mL를 채취한다. 흡인물은 제조사의 프로토콜에 따라 총 15∼20분 정도 원심분리를 거쳐 줄기세포와 여러 가지 성장인자가 고농도로 함유된 층에서 최종적으로 약 6∼7 mL 정도의 농축액을 얻는다. 골수 흡인과 원심분리를 포함한 일련의 과정이 약 20분 내외로 소요되므로 이를 먼저 시행한 후 원심분리를 하는 동안 병변에 대한 수술을 시작하는 것이 좋다.
연골하 낭종 또는 골결손이 커서 골이식을 요하는 경우에는 골수 흡인이 끝난 후 천자 부위에 작은 피부 절개를 시행한 후 장골에서 필요한 만큼의 해면골을 얻는다.
병변의 위치와 크기 및 깊이에 따라 가장 적합한 수술적 접근법을 선택한다(Fig. 1). 연골하골결손이 없거나 크지 않아 골이식이 필요 없는 경우에는 관절경적으로 시행할 수 있다. 통상적인 관절경적 술기를 이용하며 최소침습적 수술의 장점이 있지만 술자의 경험과 병변의 상태에 따라 골연골병변의 모든 경계 부위를 매끈하게 정리하기가 어려울 수 있다. 관절경적 술기가 어려운 상황이거나 연골하 낭종 또는 골결손이 커서 골이식이 필요한 경우에는 개방적 접근으로 BMIC을 시행할 수 있다. 개방적 접근을 시행하더라도 과부절골(malleolar osteotomy) 없이 최소개방 관절절개(mini-open arthrotomy)로 가능한 경우가 대부분이다. 비만하지 않은 체형의 경우 3 cm 정도의 피부절개로 가능하기 때문에 수술 후 통증이나 재활에 있어 관절경적 접근과 크게 다르지 않다.
개방적 접근은 병변의 위치에 따라 전내측, 전외측, 후내측, 후외측 관절절개법 중에서 선택한다. 전내측 접근법은 전경골건의 내측으로, 전외측 접근법은 장족지 신전건과 제 3 비골근(peroneus tertius)의 외측으로 접근한다. 관절막을 절개하고 발목을 족저굴곡시키면 거골 원개 전방 40%∼50% 정도에 위치한 병변까지 접근이 가능하다. 필요에 따라 경골 전방 결절(anterior tibial tubercle)을 수 밀리미터(mm) 정도 절제(grooving)하면 병변의 접근도를 높일 수 있다. 후내측 접근법(Fig. 2)은 후경골건과 장족지 굴곡건 사이로 접근하게 되고 이때 후경골동맥과 경골신경은 장족지 굴곡건의 외측에 위치하여 안전하다. 후외측 접근법은 비복신경에 주의하면서 장비골건과 단비골건을 외측으로 젖히고 접근한다. 무릎을 굴곡시킨 상태에서 발목을 족배굴곡시키면 거골 원개 후방 35%∼40% 정도에 위치한 병변까지 접근이 가능하다. 마찬가지로 필요에 따라 경골 후방 결절(posterior tibial tubercle)의 추가적인 부분적 절제를 시행하여 병변을 완전히 노출시킨다.
거골 원개의 내측 및 외측 모두 정중앙에서 후방으로 약 10%∼20% 정도에 위치한 병변은 관절절개만으로는 완전한 노출이 어려울 수 있고 이 경우 내측은 내과절골술, 외측은 경골원위전방부 부분 절골술(chaput osteotomy)을 시행하면 해당 부위를 모두 노출시킬 수 있다.
병소를 노출하고 골연골병변을 깔끔하게 제거한다. 연골하 낭종이나 골병변이 있는 경우에는 바닥까지 꼼꼼하게 소파하고, K강선을 이용하여 다발성 천공술을 시행한다. 이때 천공의 깊이는 5∼10 mm가 적당하다.23,24) 관절경으로 시행 시에는 미세골절술용 송곳(awl)을 이용한다. 골결손이 큰 경우에는 자가해면골이식을 시행한다.
이후 연골병변의 크기와 모양에 맞춰 기질을 재단하는데 BMAC을 흡수하게 되면 기질의 부피가 증가하게 되므로 약 10%∼15% 정도 작게 재단하는 것이 좋다(Fig. 3). 재단한 기질에 BMAC을 뿌리고 BMAC이 충분히 흡수되도록 3분 이상 기다린다. 이후 BMAC과 기질 복합체를 병소에 잘 위치시키고 섬유소 아교를 이용하여 기질을 고정한다. 섬유소 아교는 주변 정상 연골의 높이와 맞도록 다듬어 과하여 튀어나오지 않도록 주의한다. 제품에 따라 병소에 섬유소 아교를 먼저 주입한 후 그 위에 기질을 올려놓는 방법도 있다. 3∼5분 정도 기다리면 섬유소 아교가 어느 정도 굳게 되는데 이때 관절 운동을 시켜서 기질이 안정되게 고정되어 있는 것을 확인한다.
관절경으로 시행 시에는 통상적인 관절경적 술기가 완료된 후 생리식염수의 주입을 막고 관절 내 생리식염수를 모두 제거한 상태에서 BMAC과 기질 복합체를 병소에 위치시킨다. 생리식염수를 제거하면 렌즈의 김 서림 현상으로 시야 확보의 어려움이 있을 수 있으나 알콜 거즈로 렌즈를 한 번씩 닦아주면 도움이 된다.
미세골절술, OATS, ACI가 거골 골연골병변에 대한 전형적인 수술적 치료 방법이라고 한다면, BMAC, AMIC, BMIC은 비교적 새로운 치료 방법이다. 이상의 모든 방법들은 서로 상대적인 장단점이 있기 때문에 어떤 한 가지 방법도 절대적으로 우월하거나 완벽하다고 할 수 없다. 또한 서로 다른 방법을 비교할 수 있는 양질의 연구 결과가 부족하기 때문에 현 상태에서는 가장 좋은 치료 방법에 대한 어떠한 결론을 내릴 수 없다.
그러나 AMIC과 BMIC에 대한 연구와 개발이 늘어나는 것과 반대로, ACI와 OATS에 대한 관심은 점차 줄어들고 있는 것이 사실이다. 두 번에 걸친 수술과 고비용을 요하는 ACI는 국내뿐만 아니라 세계적으로도 이미 거의 시행되지 않고 있다. 이는 한 번의 수술과 상대적으로 낮은 비용으로 AMIC 또는 BMIC이 ACI와 상응하는 치료결과를 나타내기 때문18,20)이다. OATS와 BMIC은 모두 크기가 큰 병변, 연골하 골결손이 큰 병변, 기존 미세골절술의 실패한 경우를 그 적응증으로 하기 때문에 서로 중복된다. OATS는 병변을 초자연골로 대체하는 장점이 있지만 공여부 부작용과 수술적 접근을 위한 절골술에 대한 부담 및 수술 후 긴 회복기간의 단점이 있다. 반면 BMIC은 초자연골과 유사한 연골로 재생이 되면서20) 공여부 부작용이 거의 없고 대부분 관절경적 수술 또는 절골술 없는 최소절개술로 시행이 가능하기 때문에 수술 후 회복이 빠르다는 장점이 있다. 또한 OATS의 경우 이식한 연골과 주변 정상 연골의 경계가 붙지 않고 그 틈으로 관절액이 스며들어 장기적으로 연골하 낭종을 유발하는 경우가 많은데 BMIC은 재생된 연골이 주변과 잘 붙기 때문에 이러한 우려가 적다.
미세골절술만 시행하는 것과 비교해서 AMIC과 BMIC 모두 추가적인 부작용이 거의 없이 재생된 연골의 질이 좋고7,11) 치료 효과가 더 오랜 기간 유지된다.17) 따라서 미세골절술이 더 이상 치료의 원칙 또는 gold standard가 아니며 크기에 대한 허가 기준이 없는 나라에서는 병변의 크기에 상관 없이 골연골병변에 대해 일차적인 치료로 BMIC을 고려해야 한다고 주장하는 저자1,21)도 있다.
기질만 얹어주는 AMIC과 기질에 BMAC을 포함하여 이식하는 BMIC 간 치료 결과의 차이 유무에 대해서는 아직 확실한 근거가 없다. 국내에서는 족관절에서의 AMIC은 아직 허가되지 않은 상태이기 때문에 고민할 필요는 없지만 이론적으로는 고농도의 자가줄기세포와 여러 성장인자 및 사이토카인을 추가해 주는 것이 치유에 더 도움이 될 것이라고 생각된다. 두 가지 방법을 직접 비교한 논문은 없지만 여러 논문에서 재생된 연골에 대한 MRI 평가 점수는 AMIC보다 BMIC에서 상대적으로 높게 보고되는 경향이 있다.2,4-6,11,12) 물론 줄기세포가 연골이 아닌 다른 원치 않는 조직으로 분화할 가능성을 배제할 수 없지만 아직까지 이러한 합병증은 보고된 바 없다.
한편 AMIC이나 BMIC은 골이식을 함께 해주는 경우가 많은데 이 경우 골이식의 치료 효과와 AMIC 또는 BMIC의 치료 효과를 정확하게 구분하기가 불가능하다. 물론 골이식은 골결손 부위를 채우는 것이고 AMIC과 BMIC은 연골결손 부위를 재생시키기 위한 것으로 의도하는 역할은 다르다. 그러나 자가해면골에는 BMAC과 비교하면 저농도이지만 BMAC과 유사하게 골수 내 줄기세포와 여러 성장인자가 함께 들어있기 때문에 이 경우 BMAC에 의한 추가적인 효과가 있는지에 대한 의문이 생긴다. 다만 BMAC을 시행하지 않고 AMIC만 시행하는 것이 허가되지 않았고 또한 골이식 시행 여부는 치료 효과가 아닌 골결손 정도에 따라 결정하게 되므로 상대적인 역할에 대한 논쟁은 불필요하다고 생각된다. 골이식의 시행 기준은 저자마다 다르나 깊이 5∼7 mm 이상이 골이식의 기준으로 많이 사용되고 있다.
현실적으로 BMIC의 가장 큰 제한점은 비용과 국내 허가기준이다. 자가 골수 흡인물 농축액을 사용하는 BMIC은 보건복지부의 BMAC에 대한 고시 기준을 따르는데,16) 15세 이상에서 50세 이하의 연령층, 2) 외상 등으로 인한 연골 손상(International Cartilage Repair Society [ICRS] grade 3∼4),3) 최대 연골 손상의 크기 2∼10 cm2의 세 가지 기준을 모두 만족시키는 경우에만 인정비급여로 시행할 수 있다. 또한 미세골절술에 비해 추가적으로 얻어지는 효과가 그 비용을 충당할 만큼 큰지에 대해서는 추가적인 연구가 필요하다.
REFERENCES
1. Richter M, Zech S, Andreas Meissner S. 2017; Matrix-associated stem cell transplantation (MAST) in chondral defects of the 1st metatarsophalangeal joint is safe and effective-2-year-follow-up in 20 patients. Foot Ankle Surg. 23:195–200. doi: 10.1016/j.fas.2016.05.318. DOI: 10.1016/j.fas.2016.05.318. PMID: 28865590.

2. Giannini S, Buda R, Battaglia M, Cavallo M, Ruffilli A, Ramponi L, et al. 2013; One-step repair in talar osteochondral lesions: 4-year clinical results and t2-mapping capability in outcome prediction. Am J Sports Med. 41:511–8. doi: 10.1177/0363546512467622. DOI: 10.1177/0363546512467622. PMID: 23221772.
3. Yontar NS, Aslan L, Can A, Ogut T. 2019; One step treatment of talus osteochondral lesions with microfracture and cell free hyaluronic acid based scaffold combination. Acta Orthop Traumatol Turc. 53:372–5. doi: 10.1016/j.aott.2019.04.002. DOI: 10.1016/j.aott.2019.04.002. PMID: 31126702. PMCID: PMC6819796.

4. Weigelt L, Hartmann R, Pfirrmann C, Espinosa N, Wirth SH. 2019; Autologous matrix-induced chondrogenesis for osteochondral lesions of the talus: a clinical and radiological 2- to 8-year follow-up study. Am J Sports Med. 47:1679–86. doi: 10.1177/0363546519841574. DOI: 10.1177/0363546519841574. PMID: 31084491.

5. Galla M, Duensing I, Kahn TL, Barg A. 2019; Open reconstruction with autologous spongiosa grafts and matrix-induced chondrogenesis for osteochondral lesions of the talus can be performed without medial malleolar osteotomy. Knee Surg Sports Traumatol Arthrosc. 27:2789–95. doi: 10.1007/s00167-018-5063-7. DOI: 10.1007/s00167-018-5063-7. PMID: 30019075.

6. Usuelli FG, D'Ambrosi R, Maccario C, Boga M, de Girolamo L. 2018; All-arthroscopic AMIC® (AT-AMIC®) technique with autologous bone graft for talar osteochondral defects: clinical and radiological results. Knee Surg Sports Traumatol Arthrosc. 26:875–81. doi: 10.1007/s00167-016-4318-4. DOI: 10.1007/s00167-016-4318-4. PMID: 27620469. PMCID: PMC5847209.
7. Hannon CP, Ross KA, Murawski CD, Deyer TW, Smyth NA, Hogan MV, et al. 2016; Arthroscopic bone marrow stimulation and concentrated bone marrow aspirate for osteochondral lesions of the talus: a case-control study of functional and magnetic resonance observation of cartilage repair tissue outcomes. Arthroscopy. 32:339–47. doi: 10.1016/j.arthro.2015.07.012. DOI: 10.1016/j.arthro.2015.07.012. PMID: 26395409.

8. Murphy EP, McGoldrick NP, Curtin M, Kearns SR. 2019; A prospective evaluation of bone marrow aspirate concentrate and microfracture in the treatment of osteochondral lesions of the talus. Foot Ankle Surg. 25:441–8. doi: 10.1016/j.fas.2018.02.011. DOI: 10.1016/j.fas.2018.02.011. PMID: 30321966.

9. Giannini S, Buda R, Vannini F, Cavallo M, Grigolo B. 2009; One-step bone marrow-derived cell transplantation in talar osteochondral lesions. Clin Orthop Relat Res. 467:3307–20. doi: 10.1007/s11999-009-0885-8. DOI: 10.1007/s11999-009-0885-8. PMID: 19449082. PMCID: PMC2772930.

10. Sadlik B, Kolodziej L, Puszkarz M, Laprus H, Mojzesz M, Whyte GP. 2019; Surgical repair of osteochondral lesions of the talus using biologic inlay osteochondral reconstruction: clinical outcomes after treatment using a medial malleolar osteotomy approach compared to an arthroscopically-assisted approach. Foot Ankle Surg. 25:449–56. doi: 10.1016/j.fas.2018.02.010. DOI: 10.1016/j.fas.2018.02.010. PMID: 30321967.

11. Eren TK, Ataoğlu MB, Eren A, Geylan DE, Öner AY, Kanatlı U. 2019; Comparison of arthroscopic microfracture and cell-free scaffold implantation techniques in the treatment of talar osteochondral lesions. Eklem Hastalik Cerrahisi. 30:97–105. doi: 10.5606/ehc.2019.64401. DOI: 10.5606/ehc.2019.64401. PMID: 31291856.

12. Vannini F, Cavallo M, Ramponi L, Castagnini F, Massimi S, Giannini S, et al. 2017; Return to sports after bone marrow-derived cell transplantation for osteochondral lesions of the talus. Cartilage. 8:80–7. doi: 10.1177/1947603516642574. DOI: 10.1177/1947603516642574. PMID: 27994723. PMCID: PMC5154421.

13. DʼAmbrosi R, Villafañe JH, Indino C, Liuni FM, Berjano P, Usuelli FG. 2019; Return to sport after arthroscopic autologous matrix-induced chondrogenesis for patients with osteochondral lesion of the talus. Clin J Sport Med. 29:470–5. doi: 10.1097/JSM.0000000000000560. DOI: 10.1097/JSM.0000000000000560. PMID: 31688177.
14. Richter M, Zech S. 2013; Matrix-associated stem cell transplantation (MAST) in chondral defects of foot and ankle is effective. Foot Ankle Surg. 19:84–90. doi: 10.1016/j.fas.2012.11.005. DOI: 10.1016/j.fas.2012.11.005. PMID: 23548448.

15. Murphy EP, Fenelon C, Egan C, Kearns SR. 2019; Matrix-associated stem cell transplantation is successful in treating talar osteochondral lesions. Knee Surg Sports Traumatol Arthrosc. 27:2737–43. doi: 10.1007/s00167-019-05452-z. DOI: 10.1007/s00167-019-05452-z. PMID: 30888452.

16. Benthien JP, Behrens P. 2010; Autologous matrix-induced chondrogenesis (AMIC): combining microfracturing and a collagen I/III matrix for articular cartilage resurfacing. Cartilage. 1:65–8. doi: 10.1177/1947603509360044. DOI: 10.1177/1947603509360044. PMID: 26069536. PMCID: PMC4440611.
17. Volz M, Schaumburger J, Frick H, Grifka J, Anders S. 2017; A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop. 41:797–804. doi: 10.1007/s00264-016-3391-0. DOI: 10.1007/s00264-016-3391-0. PMID: 28108777.
18. Buda R, Vannini F, Castagnini F, Cavallo M, Ruffilli A, Ramponi L, et al. 2015; Regenerative treatment in osteochondral lesions of the talus: autologous chondrocyte implantation versus one-step bone marrow derived cells transplantation. Int Orthop. 39:893–900. doi: 10.1007/s00264-015-2685-y. DOI: 10.1007/s00264-015-2685-y. PMID: 25662594.

19. Buda R, Castagnini F, Cavallo M, Ramponi L, Vannini F, Giannini S. 2016; "One-step" bone marrow-derived cells transplantation and joint debridement for osteochondral lesions of the talus in ankle osteoarthritis: clinical and radiological outcomes at 36 months. Arch Orthop Trauma Surg. 136:107–16. doi: 10.1007/s00402-015-2344-1. DOI: 10.1007/s00402-015-2344-1. PMID: 26471987.
20. Desando G, Bartolotti I, Vannini F, Cavallo C, Castagnini F, Buda R, et al. 2017; Repair potential of matrix-induced bone marrow aspirate concentrate and matrix-induced autologous chondrocyte implantation for talar osteochondral repair: patterns of some catabolic, inflammatory, and pain mediators. Cartilage. 8:50–60. doi: 10.1177/1947603516642573. DOI: 10.1177/1947603516642573. PMID: 27994720. PMCID: PMC5154420.
21. Richter M, Zech S. 2019; Matrix-associated stem cell transplantation (MAST) in chondral lesions at the ankle as part of a complex surgical approach- 5-year-follow-up in 100 patients. Foot Ankle Surg. 25:264–71. doi: 10.1016/j.fas.2017.11.004. DOI: 10.1016/j.fas.2017.11.004. PMID: 29409182.

22. Sadlik B, Kolodziej L, Blasiak A, Szymczak M, Warchal B. 2017; Biological reconstruction of large osteochondral lesions of the talar dome with a modified "sandwich" technique-Midterm results. Foot Ankle Surg. 23:290–5. doi: 10.1016/j.fas.2016.09.001. DOI: 10.1016/j.fas.2016.09.001. PMID: 29202990.

23. Chen H, Hoemann CD, Sun J, Chevrier A, McKee MD, Shive MS, et al. 2011; Depth of subchondral perforation influences the outcome of bone marrow stimulation cartilage repair. J Orthop Res. 29:1178–84. doi: 10.1002/jor.21386. DOI: 10.1002/jor.21386. PMID: 21671261.

24. Wang D, Shen Z, Fang X, Jiao C, Guo Q, Hu Y, et al. 2019; Vascular compromising effect of drilling for osteochondral lesions of the talus: a three-dimensional micro-computed tomography study. Arthroscopy. 35:2930–7. doi: 10.1016/j.arthro.2019.05.021. DOI: 10.1016/j.arthro.2019.05.021. PMID: 31439459.

Figure. 1
Suggested algorithm for the selection of surgical approach to treat osteochondral lesions of the talus. The surgical approach should be determined based on the necessity of bone graft and the location of the lesion. AM: anteromedial, AL: anterolateral, PM: posteromedial, PL: posterolateral.
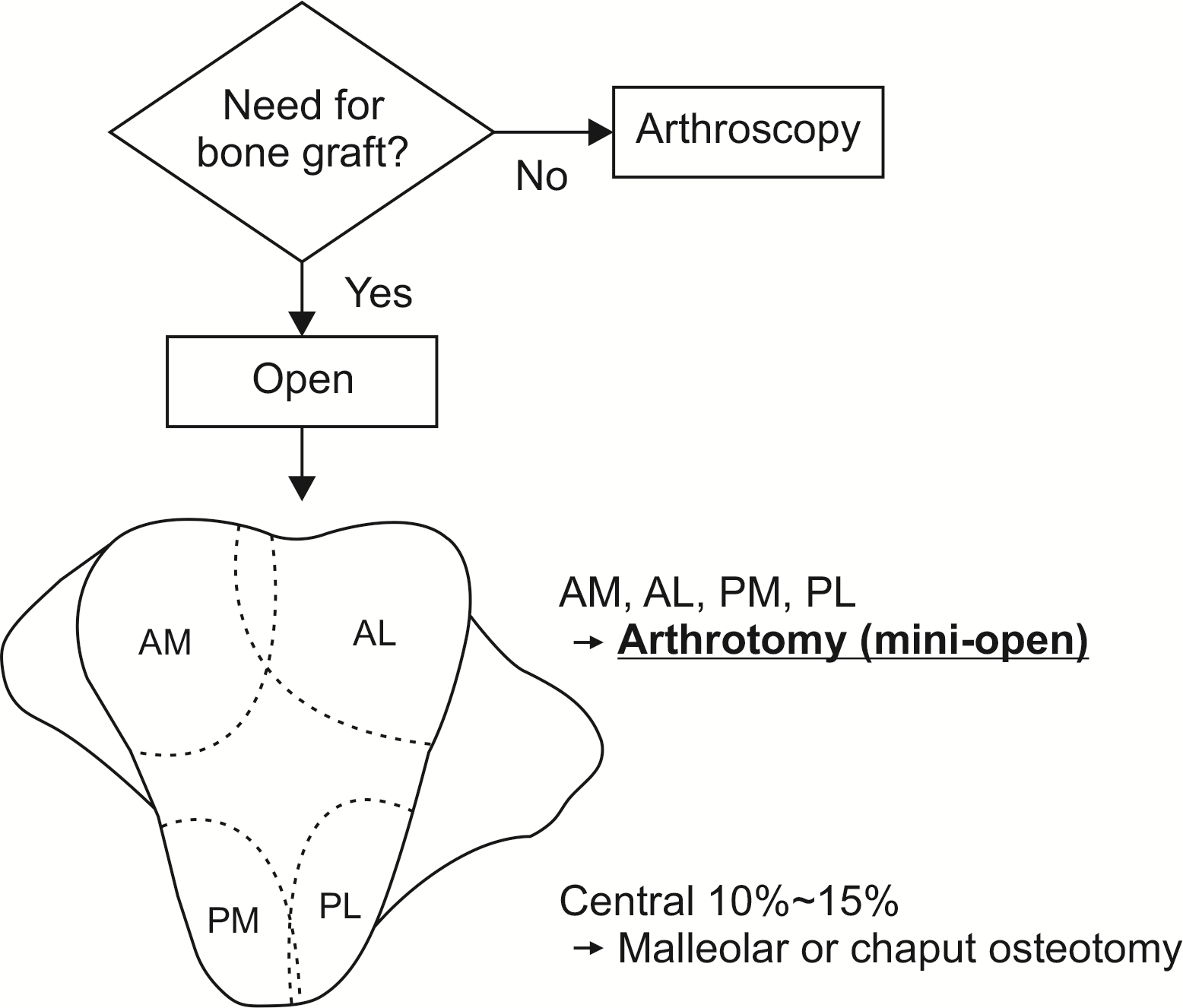
Figure. 2
Example of a bone marrow aspirate concentrate and matrix-induced chondrogenesis (BMIC) surgery performed through a posteromedial arthrotomy approach (A) without malleolar osteotomy. The lesion is clearly debrided and multiple holes have been made using a 1.2 mm Kirschner wire (B). (C) The subchondral bone defect has been filled with autologous iliac cancellous bone. (D) The lesion is covered with a matrix soaked with bone marrow aspirate concentrate.
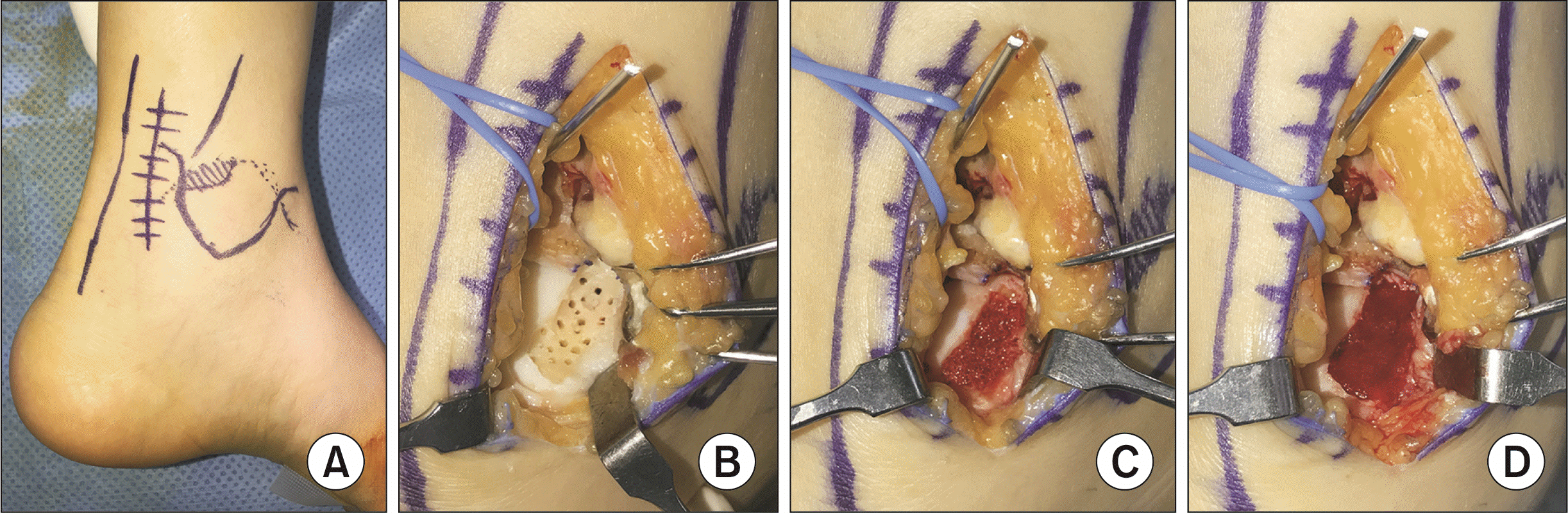
Figure. 3
Preparation of the matrix. After removal of the damaged cartilage (top), an aluminum template is designed to fit the lesion, in about 10% smaller in size (middle). The matrix is trimmed in accordance with the template (bottom). (A) Hyalofast (Anika Therapeutics S.r.l, Padova, Italy), (B) Chondro-gide (Geistlich Pharma AG, Wolhusen, Switzerland).

Table 1
Summary of Studies on BMAC, AMIC, and BMIC for the Treatment of OLT
| Author (year) | Level of evidence | Treatment | Bone Graft (n) | No. of patients | Mean size of lesion (mm2) | Approach | Mean follow-up | Preoperative | Postoperative | Others |
|---|---|---|---|---|---|---|---|---|---|---|
| Hannon et al.7) (2016) | III, retrospective comparative study | MicroFx | 0 | 12 | 111.2 | Arthroscopic | 77.3 mo | FAOS: 54.8 | FAOS: 68.3 | MOCART: 55.8 |
| MicroFx with BMAC | 0 | 22 | 103 | 48.3 mo | FOAS: 60.6 | FAOS: 77.6* | MOCART: 73.0* | |||
| Murphy et al.8) (2019) | III, retrospective comparative study | MicroFx | 0 | 52 | <150 (91%) | Arthroscopic | 58 mo | - | - | Revision: 28.8% |
| MicroFx with BMAC | 0 | 49 | <150 (92%) | 40 mo | Revision: 12.2%* | |||||
| Eren et al.11) (2019) | III, retrospective comparative study | MicroFx vs. | 0 | 22 | 165 | Arthroscopic | 44 mo | AOFAS: 69 | AOFAS: 85.5 | MOCART: 55 |
| AMIC (hyaluronan scaffold) | 12 | 40 | 197 | 27 mo | AOFAS: 52 | AOFAS: 90* | MOCART: 65 (p=0.199) | |||
| Yontar et al.3) (2019) | IV, retrospective case series | AMIC (HA scaffold) | 0 | 20 | 92.5 (depth: 10.4 mm) | Arthroscopic | 20.3 mo | AOFAS: 57.5 | AOFAS: 92.5* | - |
| VAS: 7.1 | VAS: 1.7* | |||||||||
| Weigelt et al.4) (2019) | IV, retrospective case series | AMIC (collagen I/III scaffold) | 28 | 33 | 90 | Open, medial malleolar osteotomy | 4.7 yr | VAS: 6.4 | VAS: 1.4* | MOCART: 60.6 |
| Galla et al.5) (2019) | IV, case series | AMIC (collagen I/III scaffold) | 23 | 23 | Open, arthrotomy | 33.5 mo | VAS: 7.6 | VAS: 1.4* | MOCART: 74.1 | |
| FFI: 46.8 | FFI: 15.9* | |||||||||
| Usuelli et al.6) (2018) | IV, case series | AMIC (collagen I/III scaffold) | 20 | 20 | 111.1 | Arthroscopic | 24 mo | VAS: 8.1 | VAS: 2.5* | MOCART: 50.9 |
| AOFAS: 57.1 | AOFAS: 86.6* | |||||||||
| D’Ambrosi et al.13) (2019) | IV, case series | AMIC (collagen I/III scaffold) | 26 | 26 | 146.1 | Arthroscopic | 42.6 mo | AOFAS: 54.6 | AOFAS: 87 | 80.8% returned to preinjury level sports |
| Giannini et al.9) (2009) | IV, case series | BMIC (collagen power or HA scaffold) | 48 | 0 | >150 mm2 (depth<5 mm) | Arthroscopic | 29 mo | AOFAS: 64.4 | AOFAS: 91.4* | - |
| Giannini et al.2) (2013) | IV, case series | BMIC (collagen power or HA scaffold) | 49 | 0 | 224 | Arthroscopic | AOFAS: 63.7 | AOFAS: 91.8 (at 24 mo) | T2-mapping: 78%±16% of repaired lesion area similar to hyaline cartilage | |
| AOFAS: 82.2 (at 48 mo) | ||||||||||
| Vannini et al.12) (2017) | IV, case series | BMIC (collagen power/membrane or HA scaffold) | 140 | 18 | 200 (depth: 5.1 mm) | Arthroscopic (116), arthrotomy (24) | 39 mo | AOFAS: 58.7 | AOFAS: 90.0* (at 48 mo) | 72.8% returned to preinjury level sports |
| Richter and Zech14) (2013) | IV, case series | BMIC (collagen I/III scaffold) | 23 | 3 | 110 | Arthroscopy (21), malleolar osteotomy (1) | >24 mo | VAS FA: 48.5 | VAS FA94.8* | - |
| Richter et al.1) (2017) | IV, case series | BMIC (collagen I/III scaffold) | 120 | 16 | 170 | Arthroscopy (120), malleolar osteotomy (13) | 60.2 mo (n=100) | VAS FA: 45.2 | VAS FA: 84.4* (at 5 yr; n=100) | - |
| Murphy et al.15) (2019) | IV, case series | BMIC (collagen I/III scaffold) | 32 | 170 | Malleolar osteotomy (25), arthrotomy (7) | 36.7 mo | VAS: 8.7 | VAS: 3.8* | 83% returned to sport; 23 had BMIC as a revision | |
| Sadlik et al.10) (2019) | III, retrospective comparative study | BMIC (HA or collagen I/III scaffold) | 24 | 24 | 130.6 | Malleolar osteotomy (11), open, arthroscopic-assisted (13) | 23 mo | VAS: 5.7 | VAS: 1.9 | MOCART: 67.3 |
| 120.5 | 20.9 mo | AOFAS: 57.7 | AOFAS: 54.4 | |||||||
| VAS: 7.6 | VAS: 2.0 | |||||||||
| AOFAS: 81.2 | AOFAS: 84.0 | MOCART: 70.8 |
BMAC: bone marrow aspirate concentrate, AMIC: autologous matrix-induced chondrogenesis, BMIC: BMAC and matrix-induced chondrogenesis, OLT: osteochondral lesions of the talus, MicroFx: microfracture, FAOS: Foot and Ankle Outcome Score, MOCART: magnetic resonance observation of cartilage repair tissue, AOFAS: American Orthopaedic Foot and Ankle Society, HA: hyaluronic acid, VAS: visual analogue scale, FFI: foot function index, VAS FA: visual analogue scale foot and ankle, -: not available.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download