Abstract
Many articles on operative treatment strategies for osteochondral lesions of the talus (OLT) have been published. On the other hand, there are only a few reports on the conservative treatment of OLT. Understanding the natural history of OLT is essential to establishing the correct treatment. Conservative treatment might lead to comparable clinical outcomes compared to the current options of the operative treatment in isolated OLT lesions. OLT lesions can be divided into two (or possibly three) types. Hence, the prognosis and outcome of certain operative treatments should be evaluated further. The prognosis of OLT combined with instability or malalignment appears poorer than that of isolated OLT lesions. Therefore, concomitant pathologies should be evaluated together when treating patients with OLT.
거골 골연골병변은 거골의 관절 연골과 연골하 골에 발생하는 병변으로 다양한 수술적 치료 방법과 그 결과에 대한 문헌들은 이전에 많이 보고되었다.1) 하지만 거골 골연골병변은 우연히 방사선 검사에서 발견되거나 증상이 경한 경우도 많다. 따라서 거골 골연골병변에 대한 자연 경과에 대해서는 보존적 치료를 시행했을 시의 장기 결과, 향후 병변의 크기와 증상이 더 악화되는 것인지, 거골 골연골병변이 관절염에 이르게 되는 것인지에 대해서는 이해가 부족한 실정이다. 올바른 치료를 계획하기 위해서는 자연사를 파악하는 것이 필요하다. 이에 본 종설에서는 거골 골연골병변의 자연 경과에 대해 정리해 보고자 한다.
거골 골연골병변은 다양한 이름으로 불리기도 하는데 이는 곧 거골 골연골병변을 명확하게 정의하기가 어렵다는 뜻이기도 하다. 병변의 경과를 알아보기 전에 먼저 어떻게 생기는지, 어떤 방식으로 통증을 일으키는지를 알 필요가 있다. 거골 골연골병변 발생의 주된 원인은 일회성 혹은 여러 번의 외상으로 인한 것으로 생각되며 외상 없이 허혈성(ischemic) 골괴사로 인해 일어나는 병적 골절과 연관을 짓기도 하므로 정확한 원인을 알 수 없는 경우도 많다.
병변은 거골 원개의 만성 골절과 같은 형태를 띠기도 하는데 거골의 허혈성 변화에 취약한 사람의 경우 단발성 외상 혹은 작은 반복 손상이 쌓이면서 병변의 발생을 촉발할 수 있다. 그렇게 되면 허혈성 변화는 연골하 골의 골절과 이로 인한 골 붕괴로 이어지게 된다. 연골하 낭종(subchondral cyst)과 이를 덮고 있는 연화된 연골, 골연골 골편, 관절 내 유리체(loose body) 등은 거골 골연골병변의 모든 진행 과정에서 같이 볼 수 있는 소견이다.
거골 골연골병변이 있다고 해서 항상 통증을 일으키는 것은 아니며 몇 가지 요소가 이에 관여한다고 생각된다. 연골 자체에는 신경이 없으나 골내 압력이 상승하면 손상된 연골로 인해 조직액이 체중부하되는 동안 신경이 분포된 연골하 골을 자극시켜서 통증을 일으킬 수 있다. 이러한 간헐적 조직압 상승은 골용해 및 연골하 낭종의 발생으로 이어진다.2) 통증과 연골하 낭종의 진행은 병변의 크기, 유형, 관절의 일치도(congruence), 정렬, 가해지는 압력과 전단력(shearing stress) 등에 의해 좌우된다.
보존적 치료에 대한 기존의 문헌 자료는 많지 않지만 정리를 해보면 다음과 같다.
McCullough와 Venugopal6)은 10명의 환자를 대상으로 하여 평균 15년의 추시 기간 동안 연구를 진행하였다. 보존적 치료를 시행한 6명(2명은 석고 치료, 4명은 관찰)의 환자 중 5명은 병변이 치유되지는 않았지만 상대적으로 증상이 없었다. 2명의 환자에서는 발목 관절염이 발생하였고 이를 흔하지 않은 합병증이라고 표현하였다.
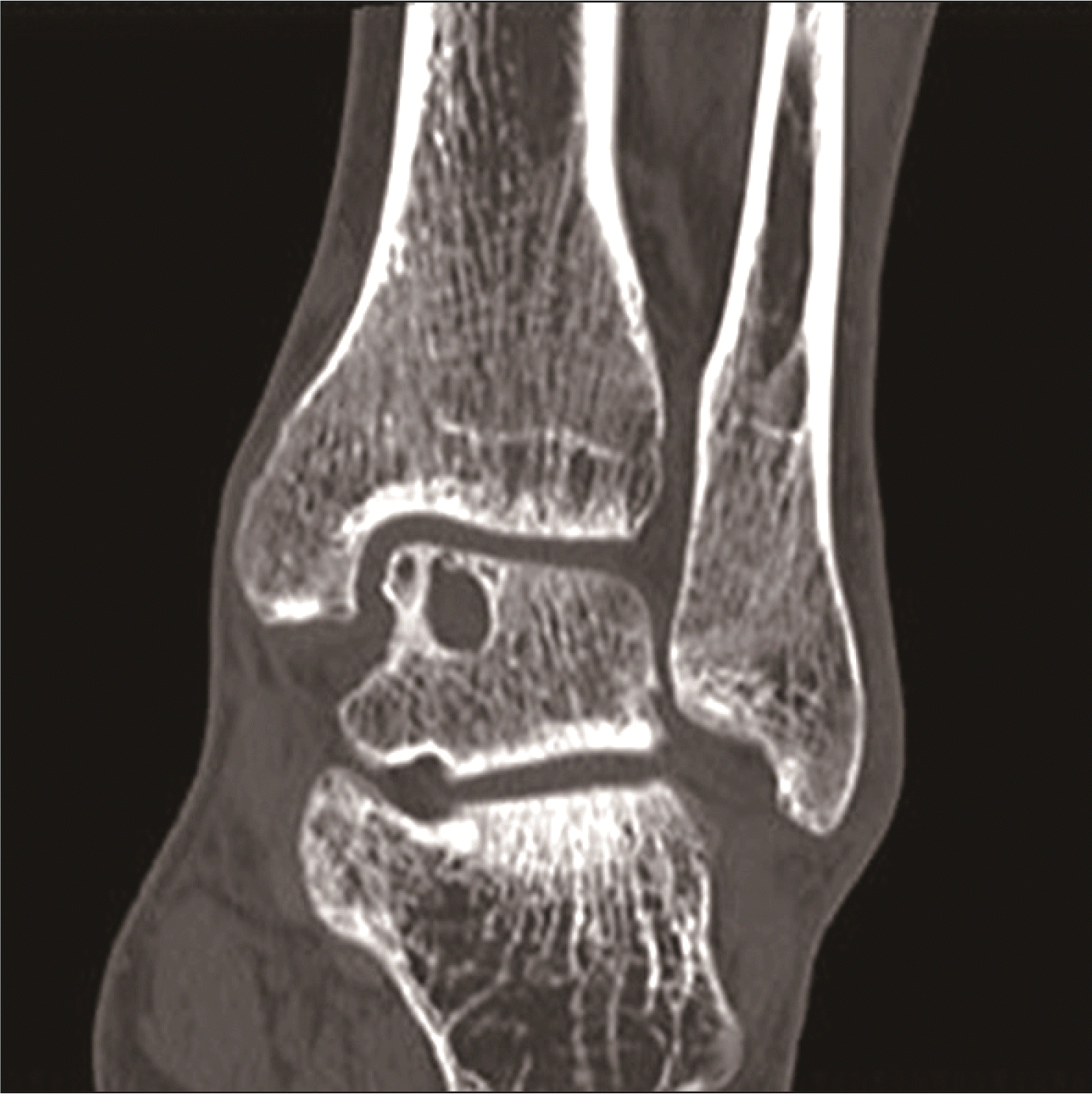
Bauer 등7)은 30명의 환자를 대상으로 평균 20년의 추시 기간 동안 연구를 진행하였다. 단 2명의 환자들만 활동을 하는 데 제한이 있었고 나머지 환자들은 만족스럽다고 보고하였다. Shearer 등8)에 의하면 방사선 투과성 결손(radiolucent defect)이 있는 만성 거골 골연골병변을 5단계(stage 5)라 지칭하였고(Fig. 1) 기존의 Berndt와 Harty9)의 4단계 분류와는 다르다고 하였다. 34명의 5단계 환자를 대상으로 진단 이후 평균 38개월 추시, 증상 발생 이후 평균 88개월 추시를 하였고 환자들의 임상 점수는 우수 이상이 54%, 보통이 17%라고 보고하였다. 대부분의 병변은 방사선적으로 안정적이며 성인에서 발병한 병변이 청소년기에서 발병한 병변보다 더 좋은 임상적 결과를 보였다고 하였다. 또한 퇴행성 변화가 다소 보였다고 하더라도 임상 결과와는 상관관계가 없었다고 하였으며 따라서 5단계의 거골 골연골병변에서는 증상이 매우 심하거나 관절 내 유리체가 있지 않는 한 초기 치료는 보존적으로 시작해보는 것을 권유하였다.
한편 Elias 등10)은 수술을 받지 않은 환자 29명의 자기공명영상(magnetic resonance imaging, MRI)을 분석하였는데 평균 13.7개월 추시한 결과, 13명은 거골 골연골병변이 진행하였고 7명은 호전, 나머지 9명은 변화가 없었다고 하였다. 결과적으로 수술적 치료 없이도 단기간 내에 진행하지는 않았으며 MRI상 보이는 골낭종이나 골부종은 시간이 지나면 좋아지는 경우가 많아서 이것이 예후를 결정짓는 요소가 되어서는 안될 것이라고 주장하였다.
Klammer 등11)은 수술을 받지 않은 48명의 환자를 대상으로 평균 52개월(최소 2년)의 추시 기간으로 후향적 연구를 진행하였다. 비록 27%에서는 경도의 골관절염이 관찰되었으나 MRI상에서는 거골 골연골병변의 정도와 크기에 변화가 없었으며 최종 추시에서 86% 환자들이 통증이 없거나 통증 정도가 낮다고 보고하였다(통증 척도 1∼3). 통증과 관련된 중요한 인자로 병변의 깊이(depth)와 연골하 낭종 유무, MRI상의 골부종이 중요하다고 하였다.
Kim 등12)에 의하면 증상이 있는 거골 골연골병변의 비수술적 치료로 평균 3.5년(범위 2∼10년) 이상 104명을 추시해 본 결과, 비교적 만족스러운 임상적 결과를 나타냈고 최종 추시에서 퇴행성 관절염의 진행은 없었으며 5.9%의 경우에서만 병변의 크기가 약간 증가하였으나 증상이 악화되지 않았다. 따라서 수술적 치료를 고려할 경우에도 충분한 기간 동안의 비수술적 치료가 선행되어야 한다고 주장하였다.
Seo 등13)에 의하면 142명의 비수술적 치료를 시행한 환자들을 평균 6년간 추시하였을 때 단순 방사선 영상 검사에서 퇴행성 관절염이 진행한 경우는 없었으며 최종 추시에서 컴퓨터 단층촬영(computed tomography, CT)을 시행한 83명의 환자 중 69명은 병변의 크기가 변하지 않았고 5명은 줄어들었으며 단 9명에서만 병변의 크기가 증가하였다고 보고하였다. 또한 최종 추시에서 유의한 임상 점수(visual analogue scale, American Orthopaedic Foot and Ankle Society score, 36-item short-form health survey)의 호전을 보여주었으며 병변의 위치나 크기는 환자의 주관적인 증세와 연관이 없다고 하였다.
한편, Choi 등14)은 골연골병변의 유형에 따른 임상 양상 차이를 분석한 바 있는데 298명의 환자를 대상으로 연구를 진행하였다. 그중 210명이 연골형 부류(chondral type)로 평균 연령이 45.5세인 반면, 88명은 골연골형 부류(osteochondral type)로 평균 연령은 28.3세라고 보고하여 쌍봉형 분포(bimodal peak)를 보여주었다. 증상은 연골형 부류에서 평균 28.3개월로 골연골형(14.4개월)보다 길었으며 연골하 낭종이나 연부조직 충돌 증후군도 연골형 부류에서 더 흔하게 발견되었다고 하였다.
거골 골연골병변은 전통적으로 단순 방사선 검사 결과에 의해 분류하였다. 1959년에 처음으로 Berndt와 Harty9)가 제안한 이 분류는 stage 1이 연골하 골의 국소적 압박, stage 2는 골연골편이 부분적으로 분리, stage 3은 골연골편이 완전 분리되었으나 전위되지 않은 상태, stage 4는 완전히 전위되어 있는 경우로 현재까지도 많이 사용되고 있다.
그러나 이러한 분류는 병변의 크기가 작거나 초기인 경우에는 병변을 놓칠 우려가 있으며, 연골의 상태를 직접적으로 평가할 수 없기 때문에 실제 상태와 많이 다를 수 있다. 따라서 이후에 관절경이나 CT, MRI 등을 이용한 분류가 제안되었다.4,15) 특히 MRI의 경우 침습적이지 않고 민감도가 높으며 골편의 안정성을 상대적으로 정확히 예측할 수 있다는 장점이 있어 널리 쓰이고 있으나 아직까지 폭넓게 이용되고 있지는 않은 실정이다.
거골 골연골병변을 위치별로 나누기도 하는데 대개 거골의 중간부부터 후내측에 많이 관찰되며 대개 이 병변은 깊고 컵(cup) 모양으로 큰 경우가 많다. 다음으로는 중간에서 전외측까지 걸쳐 있는 부분들인데 이는 대개 얕고 판(wafer) 모양이며 자주 전위되고 외상과도 더 관련성이 있다.
거골 골연골병변은 또한 발생하는 연령군에 따라 소아기(children), 청소년기(juvenile), 성인기(adult)로 분류할 수 있다. 각 군마다 병인(pathogenesis)이 조금씩 다르고 조직학적 분류와 예후도 다르다고 보고되어 있다.
소아기(6∼11세)에서의 발생률은 10만 명당 1.1명으로 알려져 있으며 주로 허혈성으로 발생하게 된다.16) 거골의 연골하 골에 손상이 발행한 후 치유 과정이 불안정하게 진행되면 거골에 경화성 조직이 발생되고 혈액 공급이 제한되어 이차적인 연골병변으로 진행되는 것이라 알려져 있다.17)
조직학적으로는 골연골형 부류이다. 성인보다 보존적 치료로 병변이 치유되고 증상이 호전될 가능성이 높은데 잔여 성장이 충분히 남은 환아의 경우에 특히 그러하다.18) Lam과 Siow19)에 의하면 평균 연령 12.3세(범위 10.8∼14세)의 환아 6명을 대상으로 평균 추시 기간 30.5개월 동안 보존적으로 관찰하였을 때 임상적으로는 100%에서 우수에서 매우 우수인 결과를 보여주었고 방사선적으로는 66.7%에서 우수 이상인 결과를 보고하였다.
한편 청소년기에 생기는 병변은 주로 외상에 의한 것이며 경쟁적인 스포츠 활동 참여와 발생 간에 연관성이 높은 것으로 알려져 있다.16) Kessler 등16)에 의하면 참여하는 스포츠 중 축구는 25.9%, 미식 축구는 12.1%, 그리고 농구는 10.3%를 차지하였다. 12∼19세에서의 발생률은 10만 명당 6.8명으로 알려져 있으며 소아기보다 약 7배 발생률이 높다.
주로 외상에 의한 연골(cartilage)이 손상되어 증상이 나타난다. 성인보다 더 좋은 예후를 보이며, 골관절염으로의 진행 가능성도 매우 낮은 것으로 보고되고 있다. Kim 등18)은 18세 이하 24명의 환자들을 대상으로 보존적 치료를 시행하였고, 만족할 만한 결과를 보고하였다. 반면, Heyse 등20)에 의하면, 평균 나이 11.4세 67명의 환아들을 추시했을 때 61%에서 보존적 치료를 실패하였다고 하였고, 이들을 분석해보니 높은 병변 단계와 많은 나이가 치료의 실패에 미치는 예후 인자라고 보고하였다.
마지막으로 성인기에서 생기는 병변은 10만 명당 2.08명의 발생률로 알려져 있다.21) 주로 퇴행성에 의한 것이며, 연골형 부류이다. Lee 등22)은 거골 골연골병변에 대하여 관절 연골부터 연골하 골의 골수까지 깊이에 따른 조직병리 소견을 분석하였는데 관절 연골은 나이테에서 분리되었으며 연골하 골에서는 골소주가 증가하며 연골이 형성되고 골수 조직은 섬유화되는 양상이 나타났다고 하였다. 즉 연골하 골의 변화가 오기 전에 관절 연골의 표층부터 퇴행성 변화를 보이며 점차로 심층 연골의 변화 과정을 거쳐 연골하 골의 변화가 오게 된다고 하였다. 이러한 퇴행성 관절염의 조직 소견은 소아 및 청소년기의 거골 골연골병변 소견과는 다르다고 할 수 있겠다.
발목의 외측 불안정성과 거골 골연골병변은 공통된 손상 기전이 존재한다. DiGiovanni 등23)과 Schäfer24)에 의하면 23%∼54%의 발목 외측 불안정성 환자들이 거골 골연골병변과 연관이 되어있다고 보고하였다. 발목이 불안정한 그룹에서 병변의 크기가 더 크고 내과(medial malleolus)의 끝 부분과 경골의 천정(tibia plafond)에 추가적인 연골병변이 발생한다고 보고하였다.25) 또한 이런 만성 외측 불안정성이 있는 환자들은 임상적으로 치료를 실패하게 되어 스포츠와 여가활동을 하는 데 떨어진다고 하였다. 반복되는 미세 외상을 최소화하기 위해서는 동반된 외측 불안정성에 대한 적극적인 치료가 필요하다.22)
한편 발목 관절에도 색소 융모 결절성 활액막염(pigmented villonodular synovitis) 병변이 10% 이하로 드물게 발생한다고 알려져 있으며 관절 연골을 파괴하고 주변 인대의 불안정성에 기여할 수 있다.26) 국소형(localized type)과 미만형(diffuse type)으로 나눌 수 있으며 현재까지 정립된 치료는 없다. 국소형의 경우 국소 절제술로도 예후가 좋고 재발도 거의 없는 것으로 알려져 있으나 미만형의 경우 재발률도 다양하게 보고되고 있다.27) Li 등28)에 의하면 미만형일 경우 개방성 절제술과 골이식이 안전하고 효율적인 방법이라고 보고하였으며 관절 연골이 심하게 손상되었을 경우에는 유합술이 권장된다고 하였다. 경우에 따라서는 종괴의 제거술 이후에 발생한 불안정에 대해서 인대 재건술이 필요한 경우도 있다.29)
부정렬(malalignment)과 거골 골연골병변이 동반된 경우가 있다. 부정렬에 의해서 발목 관절의 내측에 비대칭적인 압력이 가해지면 관절 연골에 더 큰 스트레스를 주게 된다.30) 이러한 접촉 스트레스의 증가는 국소적인 발목의 골연골 결손과 관절염을 유발할 수 있다.31) 한편, Easley와 Vineyard32)에 의하면 대부분의 증상이 있는 거골 골연골병변 환자들은 정상적인 발목 정렬을 가지고 있다고 하였다. 거골 골연골병변과 부정렬이 있는 경우에는 정렬만 교정한다면 증상이 좋아질 수 없다고 하였고 정렬과 거골 골연골병변을 모두 단계적으로 혹은 동시에 치료해야 한다고 주장하였다. 또한, 내반(varus) 발목 정렬은 만성 외측 발목 불안정성과 연관이 있기에 발목의 불안정성도 같이 평가하는 것이 좋겠다고 주장하였다.
따라서 거골 골연골병변이 있는 환자를 진료할 경우에는 동반된 다른 여러 병변들이 있는지 확인하는 것이 필요하겠다.
거골 골연골병변의 정확한 원인과 그 자연 경과에 대해서는 아직 이해가 부족하다. 거골 골연골병변은 크게 두 가지, 또는 세 가지의 부류로 나눌 수 있겠고 이들 각각의 예후와 특정한 수술 방법에 대한 결과는 향후 연구가 되어야 할 것이다. 단독 거골 골연골병변인 경우, 앞선 여러 연구에서 보존적 치료로 비교적 양호한 임상 결과를 보여주었다. 특히 안정된 피판(stable flap)의 특성을 보이는 부류는 보존적 치료에 효과가 있는 것으로 보고되었다. 하지만 거골 골연골병변과 함께 발목 불안정이나 부정렬 등이 동반되어 있는 경우, 단독 거골 골연골병변이 있는 경우와 비교하여 임상 결과가 좋지 못하기에 동반된 병변들이 있는지에 대해서도 고려해야 할 것이다. 향후 병변의 위치나 크기 등 최대한 동일 조건의 거골 골연골병변을 대상으로 보존적 치료의 효과에 대해서 수술적 치료 방법과 비교하는 연구가 필요할 것이다.
REFERENCES
1. Hannon CP, Smyth NA, Murawski CD, Savage-Elliott I, Deyer TW, Calder JD, et al. 2014; Osteochondral lesions of the talus: aspects of current management. Bone Joint J. 96:164–71. doi: 10.1302/0301-620X.96B2.31637. DOI: 10.1302/0301-620X.96B2.31637. PMID: 24493179.
2. van Dijk CN, Reilingh ML, Zengerink M, van Bergen CJ. 2010; Osteochondral defects in the ankle: why painful? Knee Surg Sports Traumatol Arthrosc. 18:570–80. doi: 10.1007/s00167-010-1064-x. DOI: 10.1007/s00167-010-1064-x. PMID: 20151110. PMCID: PMC2855020.

3. Bosien WR, Staples OS, Russell SW. 1955; Residual disability following acute ankle sprains. J Bone Joint Surg Am. 37:1237–43. DOI: 10.2106/00004623-195537060-00011. PMID: 13271470.

4. Ferkel RD, Zanotti RM, Komenda GA, Sgaglione NA, Cheng MS, Applegate GR, et al. 2008; Arthroscopic treatment of chronic osteochondral lesions of the talus: long-term results. Am J Sports Med. 36:1750–62. doi: 10.1177/0363546508316773. DOI: 10.1177/0363546508316773. PMID: 18753679.
5. Hermanson E, Ferkel RD. 2009; Bilateral osteochondral lesions of the talus. Foot Ankle Int. 30:723–7. doi: 10.3113/FAI.2009.0723. DOI: 10.3113/FAI.2009.0723. PMID: 19735626.

6. McCullough CJ, Venugopal V. 1979; Osteochondritis dissecans of the talus: the natural history. Clin Orthop Relat Res. (144):264–8. DOI: 10.1097/00003086-197910000-00045. PMID: 535235.
7. Bauer M, Jonsson K, Lindén B. 1987; Osteochondritis dissecans of the ankle. A 20-year follow-up study. J Bone Joint Surg Br. 69:93–6. doi: 10.1302/0301-620X.69B1.3818743. DOI: 10.1302/0301-620X.69B1.3818743. PMID: 3818743.

8. Shearer C, Loomer R, Clement D. 2002; Nonoperatively managed stage 5 osteochondral talar lesions. Foot Ankle Int. 23:651–4. doi: 10.1177/107110070202300712. DOI: 10.1177/107110070202300712. PMID: 12146778.

9. Berndt AL, Harty M. 1959; Transchondral fractures (osteochondritis dissecans) of the talus. J Bone Joint Surg Am. 41:988–1020. DOI: 10.2106/00004623-195941060-00002. PMID: 13849029.

10. Elias I, Jung JW, Raikin SM, Schweitzer MW, Carrino JA, Morrison WB. 2006; Osteochondral lesions of the talus: change in MRI findings over time in talar lesions without operative intervention and implications for staging systems. Foot Ankle Int. 27:157–66. doi: 10.1177/107110070602700301. DOI: 10.1177/107110070602700301. PMID: 16539895.

11. Klammer G, Maquieira GJ, Spahn S, Vigfusson V, Zanetti M, Espinosa N. 2015; Natural history of nonoperatively treated osteochondral lesions of the talus. Foot Ankle Int. 36:24–31. doi: 10.1177/1071100714552480. DOI: 10.1177/1071100714552480. PMID: 25288330.

12. Kim JS, Lee HS, Seo SG, Song JW, Seo DK. 2017; Non-operative treatment for symptomatic osteochondral lesion of the talus. J Korean Orthop Assoc. 52:153–60. doi: 10.4055/jkoa.2017.52.2.153. DOI: 10.4055/jkoa.2017.52.2.153.

13. Seo SG, Kim JS, Seo DK, Kim YK, Lee SH, Lee HS. 2018; Osteochondral lesions of the talus. Acta Orthop. 89:462–7. doi: 10.1080/17453674.2018.1460777. DOI: 10.1080/17453674.2018.1460777. PMID: 29635971. PMCID: PMC6600130.

14. Choi GW, Choi WJ, Youn HK, Park YJ, Lee JW. 2013; Osteochondral lesions of the talus: are there any differences between osteochondral and chondral types? Am J Sports Med. 41:504–10. doi: 10.1177/0363546512472976. DOI: 10.1177/0363546512472976. PMID: 23354117.
15. Mintz DN, Tashjian GS, Connell DA, Deland JT, O'Malley M, Potter HG. 2003; Osteochondral lesions of the talus: a new magnetic resonance grading system with arthroscopic correlation. Arthroscopy. 19:353–9. doi: 10.1053/jars.2003.50041. DOI: 10.1053/jars.2003.50041. PMID: 12671617.

16. Kessler JI, Weiss JM, Nikizad H, Gyurdzhyan S, Jacobs JC Jr, Bebchuk JD, et al. 2014; Osteochondritis dissecans of the ankle in children and adolescents: demographics and epidemiology. Am J Sports Med. 42:2165–71. doi: 10.1177/0363546514538406. DOI: 10.1177/0363546514538406. PMID: 24989493.
17. Vannini F, Cavallo M, Baldassarri M, Castagnini F, Olivieri A, Ferranti E, et al. 2014; Treatment of juvenile osteochondritis dissecans of the talus: current concepts review. Joints. 2:188–91. DOI: 10.11138/jts/2014.2.4.188. PMID: 25750908.

18. Kim HT, Park K, Seo CH, Ahn TY, Kim IH. 2017; Conservative treatment for juvenile osteochondritis dissecans of the talus. J Korean Orthop Assoc. 52:310–8. doi: 10.4055/jkoa.2017.52.4.310. DOI: 10.4055/jkoa.2017.52.4.310.

19. Lam KY, Siow HM. 2012; Conservative treatment for juvenile osteochondritis dissecans of the talus. J Orthop Surg (Hong Kong). 20:176–80. doi: 10.1177/230949901202000208. DOI: 10.1177/230949901202000208. PMID: 22933674.

20. Heyse TJ, Schüttler KF, Schweitzer A, Timmesfeld N, Efe T, Paletta JR, et al. 2015; Juvenile osteochondritis dissecans of the talus: predictors of conservative treatment failure. Arch Orthop Trauma Surg. 135:1337–41. doi: 10.1007/s00402-015-2260-4. DOI: 10.1007/s00402-015-2260-4. PMID: 26267077.

21. Weiss JM, Shea KG, Jacobs JC Jr, Cannamela PC, Becker I, Portman M, et al. 2018; Incidence of osteochondritis dissecans in adults. Am J Sports Med. 46:1592–5. doi: 10.1177/0363546518764676. DOI: 10.1177/0363546518764676. PMID: 29613834.

22. Lee HS, Jang JS, Lee JS, Cho KJ, Lee SH, Jung HK, et al. 2006; Histopathologic changes of articular cartilage and subchondral bone in cylindrical biopsy specimen from talar osteochondral lesions. J Korean Foot Ankle Soc. 10:117–24.
23. DiGiovanni BF, Fraga CJ, Cohen BE, Shereff MJ. 2000; Associated injuries found in chronic lateral ankle instability. Foot Ankle Int. 21:809–15. doi: 10.1177/107110070002101003. DOI: 10.1177/107110070002101003. PMID: 11128010.

24. Schäfer DB. 2003; Cartilage repair of the talus. Foot Ankle Clin. 8:739–49. doi: 10.1016/s1083-7515(03)00143-8. DOI: 10.1016/S1083-7515(03)00143-8.

25. Lee M, Kwon JW, Choi WJ, Lee JW. 2015; Comparison of outcomes for osteochondral lesions of the talus with and without chronic lateral ankle instability. Foot Ankle Int. 36:1050–7. doi: 10.1177/1071100715581477. DOI: 10.1177/1071100715581477. PMID: 25869235.

26. Stevenson JD, Jaiswal A, Gregory JJ, Mangham DC, Cribb G, Cool P. 2013; Diffuse pigmented villonodular synovitis (diffuse-type giant cell tumour) of the foot and ankle. Bone Joint J. 95:384–90. doi: 10.1302/0301-620X.95B3.30192. DOI: 10.1302/0301-620X.95B3.30192. PMID: 23450025.

27. Myers BW, Masi AT. 1980; Pigmented villonodular synovitis and tenosynovitis: a clinical epidemiologic study of 166 cases and literature review. Medicine (Baltimore). 59:223–38. DOI: 10.1097/00005792-198005000-00004. PMID: 7412554.
28. Li X, Xu Y, Zhu Y, Xu X. 2017; Surgical treatment for diffused-type giant cell tumor (pigmented villonodular synovitis) about the ankle joint. BMC Musculoskelet Disord. 18:450. doi: 10.1186/s12891-017-1824-6. DOI: 10.1186/s12891-017-1824-6. PMID: 29137617. PMCID: PMC5686795.

29. Shin JH, Lee BH, Kim GL, Kim K. 2016; Pigmented villonodular synovitis of the ankle and subtalar joint treated by surgical excision and ligament reconstructions: a case report. J Korean Foot Ankle Soc. 20:192–5. doi: 10.14193/jkfas.2016.20.4.192. DOI: 10.14193/jkfas.2016.20.4.192.

30. Knupp M, Stufkens SA, van Bergen CJ, Blankevoort L, Bolliger L, van Dijk CN, et al. 2011; Effect of supramalleolar varus and valgus deformities on the tibiotalar joint: a cadaveric study. Foot Ankle Int. 32:609–15. doi: 10.3113/FAI.2011.0609. DOI: 10.3113/FAI.2011.0609. PMID: 21733424.

31. Knupp M, Pagenstert GI, Barg A, Bolliger L, Easley ME, Hintermann B. 2009; SPECT-CT compared with conventional imaging modalities for the assessment of the varus and valgus malaligned hindfoot. J Orthop Res. 27:1461–6. doi: 10.1002/jor.20922. DOI: 10.1002/jor.20922. PMID: 19472383.

32. Easley ME, Vineyard JC. 2012; Varus ankle and osteochondral lesions of the talus. Foot Ankle Clin. 17:21–38. doi: 10.1016/j.fcl.2011.11.011. DOI: 10.1016/j.fcl.2011.11.011. PMID: 22284550.





 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download