Abstract
Among the various surgical treatment methods for osteochondral lesions of the talus, autologous osteochondral transplantation (AOT) is a useful procedure in cases of a large defect, subchondral cyst, and failed primary bone marrow stimulation procedure. Although bone marrow stimulation alone may not regenerate the damaged plate sufficiently, AOT has the advantage of being able to replace the subchondral bone plate and cartilage with a new one at a same time. Nevertheless, postoperative cyst formation or pain may persist and donor site morbidity is still a limitation of AOT.
거골의 골연골병변에 대해 다양한 치료 방법 중 자가 골연골 이식술은 병변의 크기가 비교적 크고, 연골하골의 낭종을 동반하는 경우, 일차 골수 자극술 등에 반응이 없는 경우에 양호한 결과를 얻을 수 있어 흔히 사용되는 수술 방법 중 하나이다. 그러나 공여부의 통증은 아직도 제한점이라 할 수 있고 수술 후 통증이 지속되는 경우도 있어 절대적 우위에 있는 치료 방법이라고는 할 수 없다. 여기에서는 자가 골연골 이식술의 이론적 배경, 장점 및 임상 결과, 제한점 등에 대해 알아보고 수술 방법의 결정에 도움이 되고자 한다.
골연골병변의 병태생리에 대한 연구는 오랜 시간 지속되어 왔지만 아직도 명확하게 밝혀져 있지 않다. 따라서 그 치료 방법에 대해서도 20세기 이후 지속적으로 새로운 시도들이 소개되고 있으나 연골 결손을 동반한 병변의 재생과 복원에 대해서는 아직도 명쾌하지 않다. 일차 치료로서 미세골절술, 연골하 천공술, 소파관절 성형술 등은 모두 노출된 골조직에 출혈을 유도하여 섬유연골로 재생을 유도하는 수술법이지만 이 방법은 섬유성 연골로 재생되기 때문에 장기적 추적 결과가 기대에 미치지 못할 수 있다. 그 외에도 골연골편의 핀고정술, 역행성 천공술이나 자가골 이식술 등이 사용되기도 하지만 그 결과는 병기나 연골의 상태에 따라 다양한 것으로 보고된다.1) 자가 골연골 이식술이나 자가 연골세포 이식술은 비교적 근래에 활발히 사용되어 온 치료 방법으로 손상된 초자연골의 회복을 주로 도모하는 방법들이다.2-4)
자가 골연골 이식술의 목적은 연골하골을 복원시키고 결손 연골을 건강한 연골하골의 골소주와 연결되어 있는 건강한 연골로 대체하여 병변 주변의 비교적 양호한 연골과 연속성 있게 복원하고 정렬하는 데 있다. 이 방법의 장점은 연골과 골조직의 경계부위인 타이드마크(tide-mark)가 정상이고 분화가 완료된 상태로 정상 연골을 살아있는 연골세포를 포함한 채 이식한다는 이론적 근거에 기반한다.4)
Lee 등2)의 조직학적 연구에서 거골의 골연골병변은 연골이 타이드마크에서 분리되고, 연골하골은 골수주가 증가하고 골수 내에 연골이 형성되고, 골수 조직은 섬유화된다고 보고하였고 이 변화들은 표층에서 더 심하여 연골하골에 반복되는 미세골절에서 기인된 것으로 추정하였다. 이러한 변화들은 van Dijk 등5)이 연골과 연골하골의 변화로 인하여 관절의 통증을 유발하게 되는 기전을 설명한 것과도 상통한다. 즉 연골의 손상은 연골하골판의 반복적 미세손상을 일으켜 연골하골과 골판 및 연골의 회복 불가능한 비가역적 변성을 만들고, 이러한 변화는 연골하골의 신경 말단을 자극하여 골 내 수압의 증가에 의해 혈류가 저해되고 산성화 및 탈석회화가 연골하골의 파괴를 만들면 통각수용체를 자극하여 연골 손상부의 균일하지 못한 표면은 통증을 유발하게 된다.5,6) 골연골병변이 어떻게 통증을 유발하고 비속적 변성과 파괴로 진행되는지를 고려하면 자가 골연골 이식은 매우 이상적인 치료로 보인다. 연골의 표면 연속성을 회복하여 관절면의 불균일(step off)을 해소하고 건강한 연골 및 이와 연속된 연골하골을 한번에 이식하여 연골 및 연골하골의 손상이 유발하는 파괴적 악순환을 끊을 수 있다. 재생 가능한 연골세포를 이식하여 지속적인 연골 재생산이 일어날 수 있고 연골이 소실된 병변부를 섬유연골이 아닌 초자연골로 복원한다는 점을 감안하면 매우 매력적인 수술 방법이다.
자가 골연골 이식술이 널리 쓰이기 시작한 것은 2000년대 이후이며 시험적 보고들은 1980년대부터 이루어졌다. 반면 동종 골연골 이식술에 대한 관심은 2000년대 이후에 집중되어 자가 이식이 동종 이식보다 매우 앞서 시행된 것 같이 보이지만 실제로는 동종 골연골 이식의 시작이 더 오래되었다. 연골세포는 세포 외 기질에 둘러싸여 면역 반응을 잘 일으키지 않기 때문에 작은 골연골 결손에 동종 이식은 오랜 역사를 가지고 있다. 동물에서의 골연골 이식 실험은 Judet 등에 의해, 인체에서의 적용은 Lexer에 의해 1908년 이미 보고된 바 있다.7) 슬관절에서의 골연골 결손에 대한 근대적 개념의 골연골 이식은 1980년대에 McDermott 등8)과 Meyers 등9)의 신선 동종 골연골 이식을 이용한 비교적 고무적인 보고들로부터 시작되었지만 동종 조직의 이식에 대한 규정과 관리가 엄격해지면서 오히려 사용이 줄어들었고 1960년대부터 소개되어 온 자가 골연골 이식의 개념은 Müller10)가 동일 슬관절 내에서 조직을 채취하여 골연골 결손부에 대한 이식을 시행하여 보고한 이후 Yamashita 등11)이 대퇴내과 전방에서 채취한 자가 이식을 시행하여 1985년 양호한 결과를 보고하였고 90년대에 더 많은 임상결과들이 발표되면서 골연골 결손에 대한 주요 수술 방법 중 하나로 자리잡았다.12)
골연골 이식물(plug)의 채취는 흔히 슬관절의 대퇴내과 혹은 외과의 가장자리의 슬개골과 접하지 않는 비체중부하면 혹은 과간절흔(notch)에서 채취하고 손상부에 압입(press-fit)한다. 5 mm 이하의 공여부 연골 결손은 통상적으로 관절의 퇴행성 변화를 가져오지 않는다고 알려져 있다. 2000년대 이후에는 골연골 이식편을 공여부에서 손쉽게 채취하여 압입할 수 있는 제품이 상용화되어 사용되고 있다.
자가 골연골 이식은 거골의 골연골병변에 대한 일차적 술기와 이차적 술기로써 모두 적용 가능하다.6) 통상적으로 연골 결손부의 직경이 약 1 cm 이하인 경우에는 다른 일차적 술기를 적용하여도 결과가 양호하다고 알려져 있어 공여부 합병증의 위험을 무릅쓰고 이 술식을 사용하는 일은 드물다. 골연골 이식술의 적절한 적응증은 9∼15 mm 이상의 직경을 가진 병변이며 연골하 낭종을 형성하는 경우에는 골수자극 술기만으로 빈공간에 적절한 섬유성 조직을 유도하기 어려워 크기가 작더라도 일차적 술기로서 권장된다.15)
그러나 우리나라 심사평가원에서는 1.5∼3.0 cm2를 크기의 기준으로 삼고 있고 골수 자극술로 호전이 없는 경우이거나 낭종을 형성한 경우로 한정하고 있으며 이에 더해 만 15∼50세의 연령 기준을 두고 있어 논란이 지속되고 있다. 최근 이 기준에 합당하지 않은 경우에 본인 부담금을 늘리고 일부만 보험급여의 대상이 되는 다소 보완적인 제도가 시행되고는 있지만 여전히 의사가 환자에게 경제적 부담을 가중시키는 치료 방법을 권유하게 되는 부담을 떠안아야 하므로 치료 방법 선택에 있어 임상적 장단점만을 가지고 권하거나 판단하기에 어려운 경우가 발생하곤 한다. 병변 인접 연골이 건강하고 해당 관절에 퇴행성 변화가 없다면 노령화가 가속되고 있는 우리나라에서 50세의 연령 기준을 지속하는 것이 합당한지 의문이며 이에 대해서는 연구와 근거가 더 필요할 것이다.
자가 골연골 이식편의 채취는 흔히 대퇴외과에서 이루어진다. 그 외에도 내퇴 내과 상단 내측, 과간절흔, 때로는 거골로부터 얻어지기도 하지만 거골에서의 골연골 골편 채취는 8 mm 이하로 제한되기 때문에 보통 자가 골연골 이식술을 요하는 1 cm 이상 크기의 병변에서는 적용하기 어렵다. 이식편 채취에 앞서 슬개골의 대퇴 활차에서 외측으로 치우쳐 움직이지 않는지, 외측 아탈구가 관찰되지 않는지, 슬개대퇴관절의 퇴행성 변화가 없는지 등을 확인해야 하며 슬관절의 전방 관절의 관절염이나 심한 증상이 있는 경우 등에는 이식편 채취를 피해야 한다. 일단 골연골 골편은 길이 15 mm를 사용하는 것이 좋은데 길이가 10 mm가 되면 이식편의 부하가 실패할 확률이 현저히 높아진다고 한다.4) 그러나 거골의 골연골병변을 대체하기 위한 이식편은 다소 길이가 줄어도 거골의 인접 골조직이 대퇴과보다 더 단단하여 더 안정적일 수 있으며 슬관절과 거골의 관절 연골 두께 차이 등으로 인해 12∼15 mm의 길이가 추천된다.
채취한 이식편의 직경은 수혜부의 직경보다 약 1 mm 정도 큰 것을 사용한다. 만약 동일한 크기의 이식편을 삽입하면 이식 연골의 두께가 증가하고 연골세포의 수가 증가하며 연골세포의 형태가 변해 수혜부의 인접 연골과 성상 및 두께의 차이를 만드는데 이 현상은 조금 큰 이식편을 압입하면 방지 가능하다고 보고된 바 있어16) 최근 사용되는 기구는 아예 공여부에 사용하는 기구가 1 mm 크게 디자인되어 있다.
거골의 골연골병변에서 자가 골연골 이식을 요하는 비교적 큰 크기의 병변은 거골 내연이나 외연을 접하고 있는 경우(shoulder lesion)가 많아 이식편을 채취 및 삽입하는 과정에서 관절 표면에 대해 수직 접근을 유지하기가 쉽지 않다. 따라서 이식편이 충분히 안정적으로 삽입될 수 있도록 인접 골조직의 기둥을 남기고 절제하는 것이 필요하며 거골의 병변부 관절면 경사도와 모양에 따라 슬관절에서 채취하는 장소도 각도나 경사가 유지되도록 채취해야 한다. 따라서 이 섬세한 각도 조절을 위해서는 관절경적 채취보다 개방적 접근이 유리할 때가 많다. 이식편의 채취는 이식 후 안정성을 확보하기 위해 채취기를 조심스럽게 회전시켜 얻어야 하며 상하 혹은 좌우로 흔들어 원통형 이식편의 모양이 손상되는 것을 피해야 한다.
골연골 이식편의 삽입 시 최종 관절면의 상합성 유지가 중요하다. 이식편이 조금 깊이 삽입되는 경우 1 mm를 넘지 않으면 인접 연골과 유사한 정도의 압력이 유지된다고 한다. 더 깊이 위치하면 연골의 두께나 세포수가 증가하고 2 mm 이상 낮아지면 연골의 괴사가 온다고 알려져 있다.17) 하지만 슬관절의 연골 두께는 평균 2.2 mm로 평균 1.2 mm인 거골의 연골보다 약 1 mm 정도 두껍기 때문에18) 연골의 표면 수준을 인접 연골보다 더 낮아지지 않게 삽입해야 하며 이식편을 더 낮게 삽입하면 타이드마크의 높이 차이는 더욱 커지므로 이식편의 장기적 생존에 불리할 수 있다. 이 경우 방사선 추시상에서도 연골하골의 높이 차이가 두드러지게 보이는데 병변의 진행이나 재발과 혼동될 수 있으므로 주의를 요한다.
전술한 바와 같이 골연골 이식을 필요로 하는 큰 병변은 관절 절개만으로 병변에 수직으로 도달하기 쉽지 않은 경우가 많아 내과 혹은 경골 전외측의 절골을 통한 접근을 요하는 경우가 많다. 내측 거골 원개의 병변은 전내측 접근과 경골 천정에 골구(groove)를 만들어 접근 가능한 경우도 있지만19-21) 내측 중앙부의 병변 혹은 내측 후방을 침범한 병변은 이 방법만으로는 수직 접근이 어려워 내과 절골을 필요로 하는 경우가 많다.21-23) Lee 등22)은 두 방법을 비교하여 보고하면서 내측 병변이라도 거골 원개의 최고점에서 후방으로 15°까지는 절골을 하지 않고도 접근 가능하며 절골을 하지 않은 경우가 임상 결과가 더 양호하다고 하였다. 하지만 후향적 연구에서는 절골을 필요로 했던 병변은 더 크기가 큰 경우가 많아 단순히 비교하는 것이 쉽지 않다.
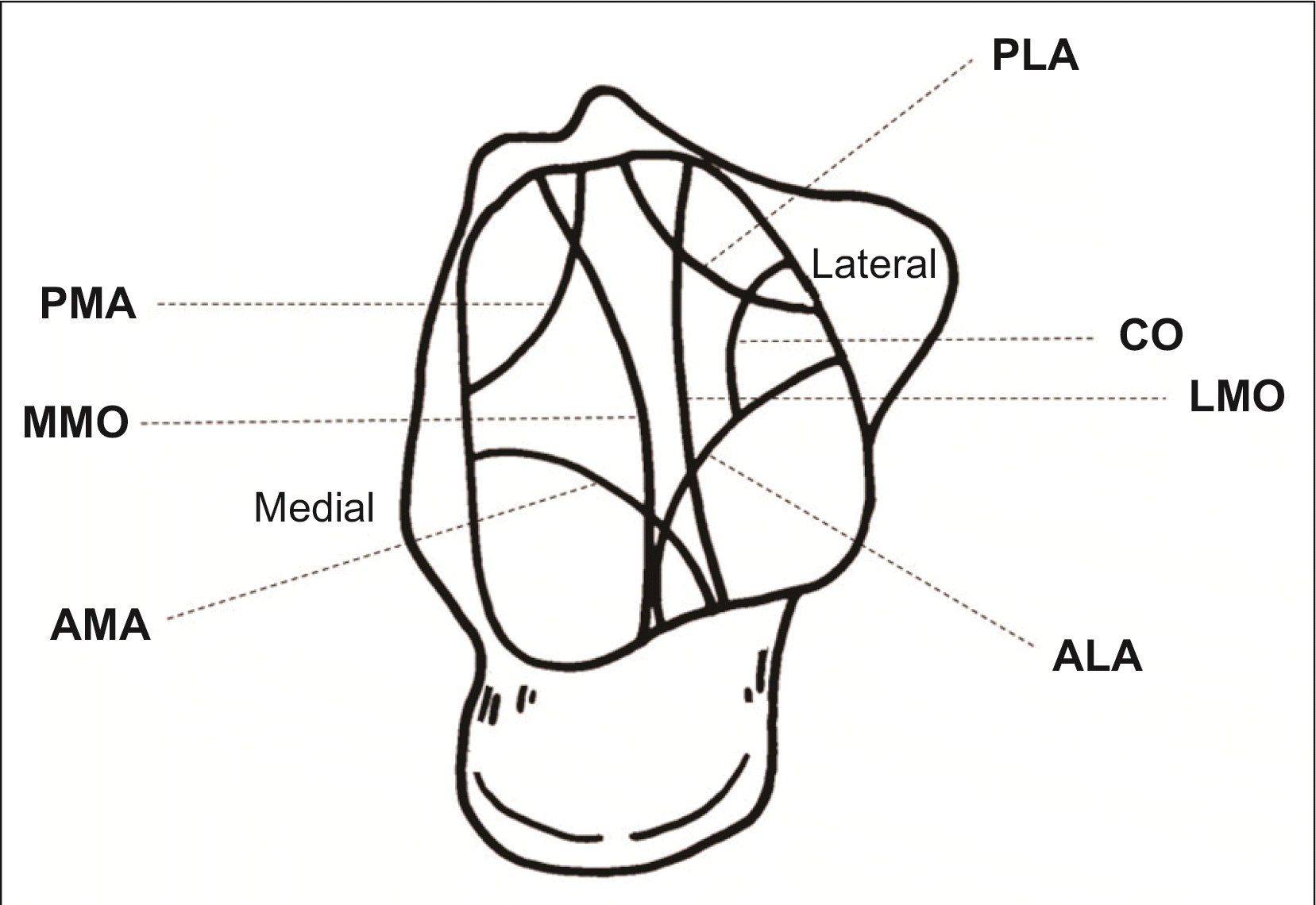
Muir 등20)은 거골의 골연골병변 중 내측 병변의 17%와 외측 병변의 20%는 절골 없이 접근이 가능하다고 하였다. 또 병변의 위치별로 접근 가능 범위를 정리하여 기술하였는데 전내측, 전외측, 후내측 및 후외측 관절 절개만으로 접근이 어려운 외측 중앙부 병변은 원위경골결절(Chaput tubercle) 절골을 통해 추가적 접근이 가능하고 내과 혹은 외과의 절골을 통해서는 전 영역의 접근이 가능하다(Fig. 1). 그러나 중앙에서 후방에 이르는 약 15% 정도의 거골 관절면은 어떤 접근으로도 표면에 수직으로 접근이 불가능하므로 이를 염두에 두고 수술 계획을 세워야 하는데20) 최근 복와위에에서 아킬레스건을 통해 후방부 병변에 접근하는 방법이 소개되기도 하였다.24)
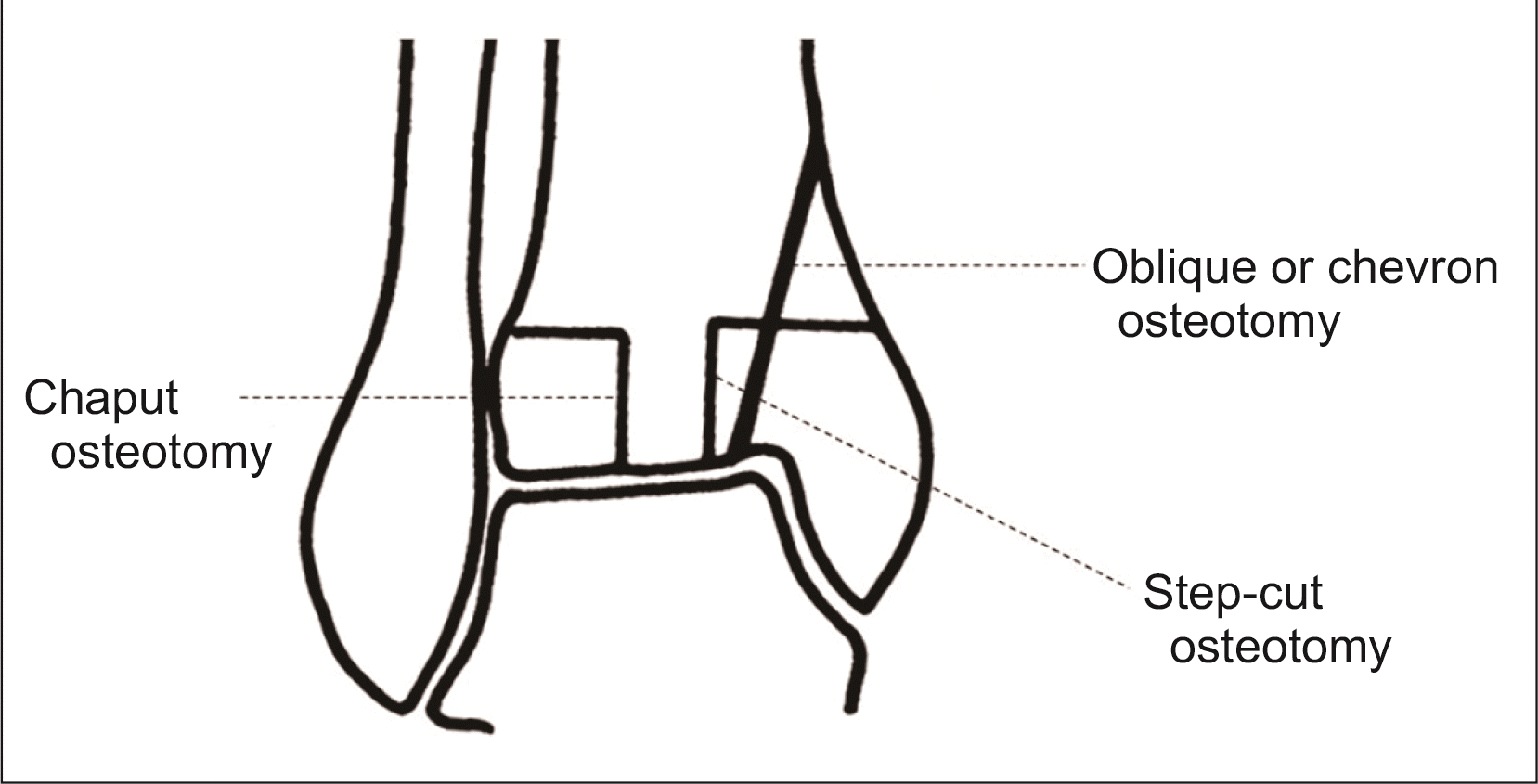
가장 흔히 사용하는 내과 절골은 절골선의 위치와 각도를 조정하여 내측에서 중간에 이르는 병변 접근이 가능하다. 절골의 형태는 단순 사선 절골 외에도 갈매기형 절골이나 계단형 절골, 창문형 절골 등이 사용되며(Fig. 2),25,26) 경골의 원위 관절면 경사를 동시에 교정하기 원하는 경우 이면 절골을 통해 과상부절골과 동시에 자가 골연골 이식술을 시행하는 술기도 소개되었다.27) 또한 경골을 관통하여 거골 체부에 접근해 이식을 시행하고 경골 터널에는 다시 골이식을 하는 방법인 경과접근법(transmalleolar approach)도 가능한데28) 이는 경골 관절면을 손상시키고 접근해야 하는 부담이 있다. 관절 절개만으로 접근이 가능한 영역의 병변은 조심스럽게 관절경만으로 수술이 가능할 수 있는데29) 관절 운동 범위, 특히 족저굴곡 범위가 충분하지 못하면 병변에 수직으로 접근하기 어려울 수 있다.
외측 병변은 관절 절개, 원위 경골 Chaput 결절의 절골, 전외측의 골구를 통한 접근 등이 가능하지만 절골 없이 도달 가능한 영역은 족저굴곡각이 충분하더라도 약 2 cm에 이르는 전방의 절반 정도이고 상면 병변에 대해 충분한 접근을 하려면 원위비골 절골을 통한 도달법을 사용하는 것이 추천된다.30)
자가 골연골 이식술의 임상 결과는 대체로 양호 혹은 우수한 결과가 90%에 가깝다고 알려져 있으며 최근의 중기 추시 보고에서도 성공률은 약 87%로 보고되었다.14) 하지만 90년대 이후 이루어진 임상 결과에 대한 연구들은 대부분 근거의 수준(level of evidence)이 미약하고 연구자마다 주장하는 바가 다양하여 합의된 의견이라고 하기 어렵다. 2018년 족관절의 연골병변에 대한 학술회의에서 전세계적 참여로 논쟁의 대상이 되는 여러 의견들에 대해 합의를 유도하고자 14개 논점에 대해 의견을 수렴한 바 있는데,15) 임상 결과에 대한 예후 인자로서 체질량지수(body mass index), 족관절 불안정성, 원위경골 관절면의 병변(kissing lesion), 부정 정렬, 제한성 병변인지(containment), 병변의 위치, 크기, 이전의 치료력, 술자의 술기 등이 제시되었다.3,15) 술기상 중요한 요소는 관절면의 합치(congruency)라는 데 이견이 없었으며 이식편의 두께는 12∼15 mm가 이상적이고, 세 개 이상의 이식편이 필요한 경우에는 공여부 합병증이 남기 쉽고 두 개 이하의 이식편 채취는 그다지 심각한 공여부 문제를 남기지 않는다는 것에 대부분 동의한다.31)
자가 골연골 이식 후 방사선 추시상 이식편 주위에 낭종이 관찰되는 경우가 드물지 않은데 이것이 임상 증상과 어떤 관계를 보이는지에 대해서는 명확하지 않다. 다만 이 낭종을 남기지 않기 위해 수혜부보다 1 mm 큰 이식편을 압입하여 충분히 안정적인 이식을 하고 열손상을 피하기 위해 가급적 전동 기구를 이용하지 않는 것은 중요하다. 전술한 2018년도 학술회의 설문에서 67%의 술자들이 골수 흡인물이나 혈소판 풍부 혈장(platelet-rich plasma, PRP) 등을 이용한 보강을 고려한다고 답했는데15) 우리나라의 현실에서는 이식편의 생착을 돕기 위한 이러한 추가 재료들의 사용이 의료비용의 증가 문제로 인해 쉽지 않다. 이런 생물학적 보강제의 사용이 85%∼90%에 달하는 양호한 예후를 더 끌어올리거나 실패율을 낮추는 데 확실히 유의한지에 대해서는 향후 추가적인 연구들이 필요할 것이다.
자가 골연골 이식술은 골수 자극술과 함께 가장 흔히 이용되는 수술 방법으로 그 결과를 비교한 연구들이 많이 있는데 그 결과는 대체로 비슷하다.32,33) 골연골 이식은 대개 활동도가 높고 연골병변의 크기가 비교적 큰 경우에 시행되어 스포츠 활동으로의 복귀 여부를 관찰한 임상 연구들이 많은데 10년 이상의 중장기 보고들에서도 대체로 활동 복귀 정도는 양호하다.31-38) 하지만 Paul 등37)의 보고를 보면 스포츠 활동을 유지하는 환자 중 30% 정도는 만족할 만한 활동의 종류나 범위를 유지하지는 못하는 것으로 보인다. 따라서 운동선수나 젊고 활동적인 환자의 수술 방법을 선택할 때는 이 점에 대한 설명이 필요하다.
공여부의 잔존 증상은 자가 골연골 이식술의 가장 큰 단점이라고 할 수 있다. 공여부 증상은 많게는 50%까지 보고되기도 했었지만39) 최근 보고들에선 약 10∼15% 정도라고 보고되고 있다.14,15) 공여부 증상의 잔존 여부에 대한 임상 결과는 일관성이 적고 매우 다양하다.38-42) 슬관절 연골병변에 대한 골연골 이식 후 잔존하는 공여부 증상은 3%∼5.9%로 비교적 드문 반면 거골로의 이식 후에는 슬관절 증상 잔존이 더 흔하다고 보고되고 있는데 아직 그 원인은 확실하지 않다.40-42) 다만 수술 후 슬관절의 통증이나 염발음(crepitation), 강직 등의 증상을 최소화하기 위해서는 이식편 채취부 주변 연골 손상을 최소화하고 대퇴외과에서 채취 후 슬관절 외측 관절낭을 조여서 봉합하지 않으며 가급적 조기에 관절 운동을 시키는 것이 중요하다.
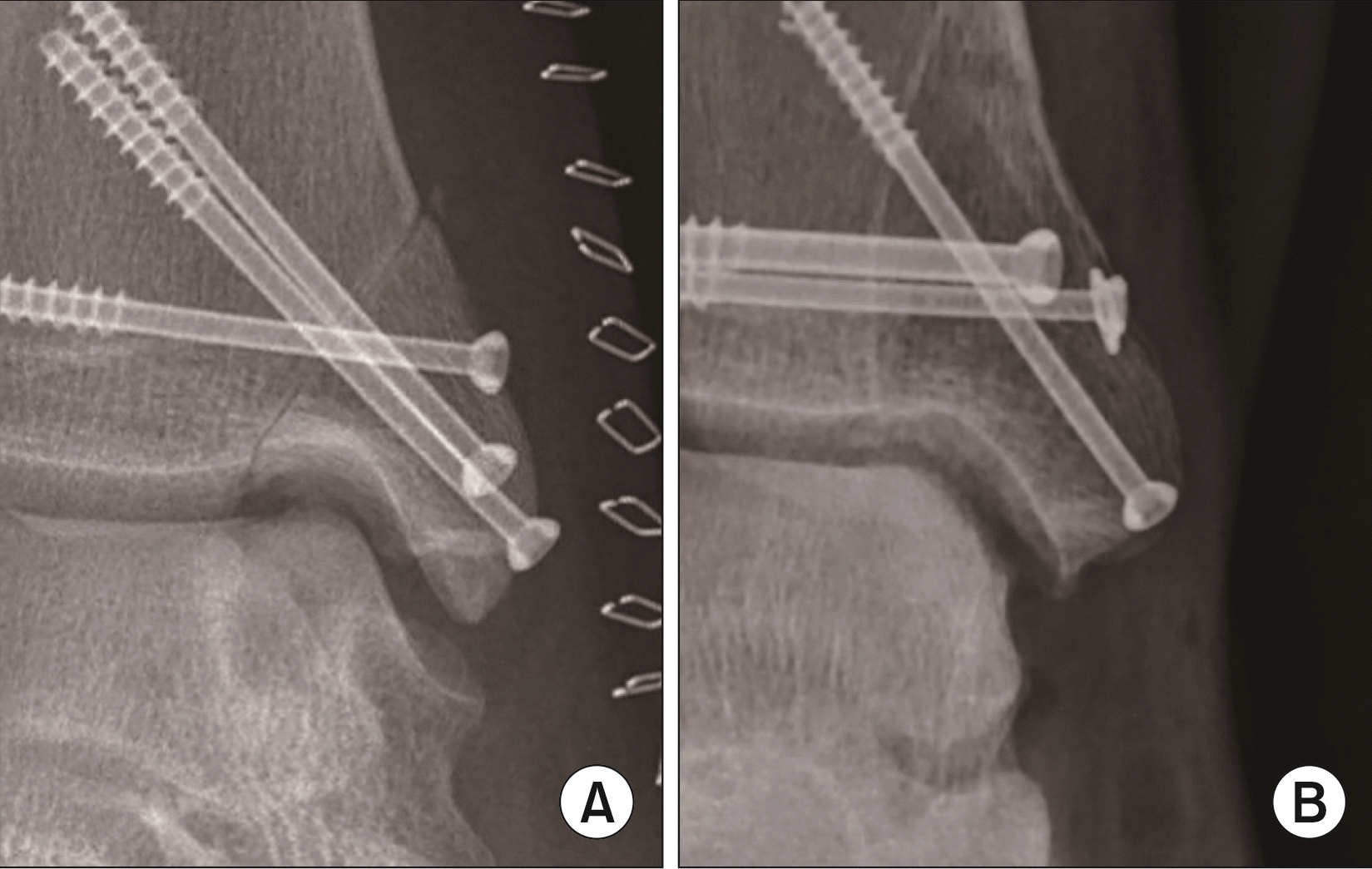
경골의 절골을 통한 접근은 공여부의 증상 못지 않은 우려를 만들기도 한다. 조심스러운 절골도 사용과, 절골 전 나사못 고정을 위한 구멍을 만들어 두고 두 개의 평행나사를 포함한 세 개 이상의 나사 고정을 통해 절골 접근에 의한 문제를 최소화할 수 있다. 내과의 사선 절골 후 나사못을 수평과 사선으로 삽입하여 고정하는 경우 사선나사를 먼저 조이면 내과 골편이 상방으로 전위되어 관절면의 불일치가 발생할 수 있으므로 반드시 수평나사를 먼저 조인 후 사선나사를 고정해야 한다(Fig. 3).
족관절의 골연골병변에 대한 자가 골연골 이식술은 직경이 1 cm 이상인 비교적 크기가 큰 병변, 낭종을 형성한 경우, 일차 치료에도 불구하고 증상이 지속되거나 병변의 진행이 관찰되는 경우에 연골과 연골하골을 한번에 이식하여 섬유성 연골이 아닌 초자연골로 복원하는 결과가 우수하고 널리 사용되는 치료 방법이다. 그러나 공여부의 증상 잔존, 공여부 및 수혜부의 연골 두께나 모양의 불일치, 병변의 수직 접근 곤란 등은 단점으로 남아있고 이식편의 생착과 장기 추시 소견에 대한 연구는 다소 부족하며 이식편과 거골의 조기 유합을 위해 사용 가능한 부가적 치료들, 즉 줄기세포나 PRP, 혹은 점성 관절액 보충 치료의 병합 등에 대해서도 추가의 연구와 관심이 필요하며 자가 이식이 어려운 큰 병변에 대한 동종 골연골 이식에 대해서도 국내 연구가 이루어져야 할 필요가 있다.
그러나 이러한 문제점들에도 불구하고 자가 골연골 이식의 이론, 합병증을 예방하기 위한 노력, 그간의 임상 결과에 대한 충분한 지식은 치료 방법 선택과 우수한 결과 도출에 유용한 자산이 될 수 있다.
REFERENCES
1. Kumai T, Takakura Y, Higashiyama I, Tamai S. 1999; Arthroscopic drilling for the treatment of osteochondral lesions of the talus. J Bone Joint Surg Am. 81:1229–35. doi: 10.2106/00004623-199909000-00004. DOI: 10.2106/00004623-199909000-00004. PMID: 10505519.

2. Lee HS, Jang JS, Lee JS, Cho KJ, Lee SH, Jung HK, et al. 2006; Histopathologic changes of articular cartilage and subchondral bone in cylindrical biopsy specimen from talar osteochondral lesions. J Korean Foot Ankle Soc. 10:117–24.
3. Lee KB. 2012; Osteochondral lesions of the talus. J Korean Foot Ankle Soc. 16:9–18. DOI: 10.1016/j.fcl.2012.12.011. PMID: 23465955.
4. Choi NH. 2008; Mosaicplasty for the treatment of the chondral defect of the knee. J Korean Arthrosc Soc. 12:147–53.
5. van Dijk CN, Reilingh ML, Zengerink M, van Bergen CJ. 2010; Osteochondral defects in the ankle: why painful? Knee Surg Sports Traumatol Arthrosc. 18:570–80. doi: 10.1007/s00167-010-1064-x. DOI: 10.1007/s00167-010-1064-x. PMID: 20151110. PMCID: PMC2855020.

6. Bae SY. 2015; Autologous osteochondral transplantation as a secondary procedure after failed microfracture for osteochondral lesion of talus. J Korean Foot Ankle Soc. 19:47–50. doi: 10.14193/jkfas.2015.19.2.47. DOI: 10.14193/jkfas.2015.19.2.47.

7. Nikolaou VS, Giannoudis PV. 2017; History of osteochondral allograft transplantation. Injury. 48:1283–6. doi: 10.1016/j.injury.2017.05.005. DOI: 10.1016/j.injury.2017.05.005. PMID: 28551056.

8. McDermott AG, Langer F, Pritzker KP, Gross AE. 1985; Fresh small-fragment osteochondral allografts. Long-term follow-up study on first 100 cases. Clin Orthop Relat Res. (197):96–102. DOI: 10.1097/00003086-198507000-00011. PMID: 3893835.
9. Meyers MH, Akeson W, Convery FR. 1989; Resurfacing of the knee with fresh osteochondral allograft. J Bone Joint Surg Am. 71:704–13. DOI: 10.2106/00004623-198971050-00010. PMID: 2659599.

10. Müller W. Hastings DE, editor. 1978. Osteochondrosis dissecans. The knee: ligament and articular cartilage injuries. p. 135. DOI: 10.1007/978-3-642-66900-2_15.

11. Yamashita F, Sakakida K, Suzu F, Takai S. 1985; The transplantation of an autogeneic osteochondral fragment for osteochondritis dissecans of the knee. Clin Orthop Relat Res. (201):43–50. DOI: 10.1097/00003086-198512000-00007. PMID: 3905131.

12. Sherman SL, Thyssen E, Nuelle CW. 2017; Osteochondral autologous transplantation. Clin Sports Med. 36:489–500. doi: 10.1016/j.csm.2017.02.006. DOI: 10.1016/j.csm.2017.02.006. PMID: 28577708.

13. Hangody L, Kish G, Módis L, Szerb I, Gáspár L, Diószegi Z, et al. 2001; Mosaicplasty for the treatment of osteochondritis dissecans of the talus: two to seven year results in 36 patients. Foot Ankle Int. 22:552–8. doi: 10.1177/107110070102200704. DOI: 10.1177/107110070102200704. PMID: 11503979.

14. Zengerink M, Struijs PA, Tol JL, van Dijk CN. 2010; Treatment of osteochondral lesions of the talus: a systematic review. Knee Surg Sports Traumatol Arthrosc. 18:238–46. doi: 10.1007/s00167-009-0942-6. DOI: 10.1007/s00167-009-0942-6. PMID: 19859695. PMCID: PMC2809940.

15. Smyth NA, Murawski CD, Adams SB Jr Jr, Berlet GC, Buda R, Labib SA, et al. 2018; ; International Consensus Group on Cartilage Repair of the Ankle. Osteochondral allograft: proceedings of the International Consensus Meeting on Cartilage Repair of the Ankle. Foot Ankle Int. 39(1_suppl):35S–40S. doi: 10.1177/1071100718781097. DOI: 10.1177/1071100718781097. PMID: 30215308.
16. Makino T, Fujioka H, Terukina M, Yoshiya S, Matsui N, Kurosaka M. 2004; The effect of graft sizing on osteochondral transplantation. Arthroscopy. 20:837–40. doi: 10.1016/j.arthro.2004.06.039. DOI: 10.1016/j.arthro.2004.06.039. PMID: 15483545.

17. Huang FS, Simonian PT, Norman AG, Clark JM. 2004; Effects of small incongruities in a sheep model of osteochondral autografting. Am J Sports Med. 32:1842–8. doi: 10.1177/0363546504264895. DOI: 10.1177/0363546504264895. PMID: 15572310.
18. Shepherd DE, Seedhom BB. 1999; Thickness of human articular cartilage in joints of the lower limb. Ann Rheum Dis. 58:27–34. doi: 10.1136/ard.58.1.27. DOI: 10.1136/ard.58.1.27. PMID: 10343537. PMCID: PMC1752762.

19. Flick AB, Gould N. 1985; Osteochondritis dissecans of the talus (transchondral fractures of the talus): review of the literature and new surgical approach for medial dome lesions. Foot Ankle. 5:165–85. doi: 10.1177/107110078500500403. DOI: 10.1177/107110078500500403. PMID: 3830846.

20. Muir D, Saltzman CL, Tochigi Y, Amendola N. 2006; Talar dome access for osteochondral lesions. Am J Sports Med. 34:1457–63. doi: 10.1177/0363546506287296. DOI: 10.1177/0363546506287296. PMID: 16636351.

21. Young KW, Deland JT, Lee KT, Lee YK. 2010; Medial approaches to osteochondral lesion of the talus without medial malleolar osteotomy. Knee Surg Sports Traumatol Arthrosc. 18:634–7. doi: 10.1007/s00167-009-1019-2. DOI: 10.1007/s00167-009-1019-2. PMID: 20020098.

22. Lee YS, Ahn GY, Nam IH, Lee YH, Lee TH, Kim DG, et al. 2017; Results of autologous osteochondral transplantation of the ostochondral lesion on the talus: a comparison study between medial malleolar osteotomy approach and anterior arthrotomy approach. J Korean Foot Ankle Soc. 21:139–43. doi: 10.14193/jkfas.2017.21.4.139. DOI: 10.14193/jkfas.2017.21.4.139.

23. Verghese N, Morgan A, Perera A. 2013; Osteochondral lesions of the talus: defining the surgical approach. Foot Ankle Clin. 18:49–65. doi: 10.1016/j.fcl.2012.12.003. DOI: 10.1016/j.fcl.2012.12.003. PMID: 23465948.
24. Orr JD, Heida KA Jr. 2017; Osteochondral autograft transfer system procedure for posterior osteochondral lesions of the talus through prone position midline Achilles tendon-splitting approach. J Surg Orthop Adv. 26:58–64. PMID: 28459426.
25. Kreuz PC, Lahm A, Haag M, Köstler W, Konrad G, Zwingmann J, et al. 2008; Tibial wedge osteotomy for osteochondral transplantation in talar lesions. Int J Sports Med. 29:584–9. doi: 10.1055/s-2007-989232. DOI: 10.1055/s-2007-989232. PMID: 18050062.

26. Oznur A. 2001; Medial malleolar window approach for osteochondral lesions of the talus. Foot Ankle Int. 22:841–2. doi: 10.1177/107110070102201013. DOI: 10.1177/107110070102201013. PMID: 11642539.
27. Li X, Zhu Y, Xu Y, Wang B, Liu J, Xu X. 2017; Osteochondral autograft transplantation with biplanar distal tibial osteotomy for patients with concomitant large osteochondral lesion of the talus and varus ankle malalignment. BMC Musculoskelet Disord. 18:23. doi: 10.1186/s12891-016-1367-2. DOI: 10.1186/s12891-016-1367-2. PMID: 28103870. PMCID: PMC5244526.

28. Largey A, Faure P, Hebrard W, Hamoui M, Canovas F. 2009; Osteochondral transfer using a transmalleolar approach for arthroscopic management of talus posteromedial lesions. Orthop Traumatol Surg Res. 95:537–42. doi: 10.1016/j.otsr.2009.06.005. DOI: 10.1016/j.otsr.2009.06.005. PMID: 19811965.

29. Luick L, Steinmetz G, Haleem A. 2020; All-arthroscopic osteochondral autograft transfer technique for osteochondritis dissecans of the talus. Arthrosc Tech. 9:e499–e503. doi: 10.1016/j.eats.2019.12.002. DOI: 10.1016/j.eats.2019.12.002. PMID: 32368470. PMCID: PMC7189212.

30. Mayne AIW, Lawton R, Reidy MJ, Harrold F, Chami G. 2018; A comparison of surgical exposures for posterolateral osteochondral lesions of the talar dome. Foot Ankle Surg. 24:107–9. doi: 10.1016/j.fas.2016.11.012. DOI: 10.1016/j.fas.2016.11.012. PMID: 29409232.

31. Nguyen A, Ramasamy A, Walsh M, McMenemy L, Calder JDF. 2019; Autologous osteochondral transplantation for large osteochondral lesions of the talus is a viable option in an athletic population. Am J Sports Med. 47:3429–35. doi: 10.1177/0363546519881420. DOI: 10.1177/0363546519881420. PMID: 31671274.

32. Emre TY, Ege T, Cift HT, Demircioğlu DT, Seyhan B, Uzun M. 2012; Open mosaicplasty in osteochondral lesions of the talus: a prospective study. J Foot Ankle Surg. 51:556–60. doi: 10.1053/j.jfas.2012.05.006. DOI: 10.1053/j.jfas.2012.05.006. PMID: 22789483.

33. Steman JAH, Dahmen J, Lambers KTA, Kerkhoffs GMMJ. 2019; Return to sports after surgical treatment of osteochondral defects of the talus: a systematic review of 2347 cases. Orthop J Sports Med. 7:2325967119876238. doi: 10.1177/2325967119876238. DOI: 10.1177/2325967119876238. PMID: 31673563. PMCID: PMC6806124.

34. Jackson AT, Drayer NJ, Samona J, Dukes CA, Chen CS, Arrington EA, et al. 2019; Osteochondral allograft transplantation surgery for osteochondral lesions of the talus in athletes. J Foot Ankle Surg. 58:623–7. doi: 10.1053/j.jfas.2018.11.020. DOI: 10.1053/j.jfas.2018.11.020. PMID: 31010770.

35. Park KH, Hwang Y, Han SH, Park YJ, Shim DW, Choi WJ, et al. 2018; Primary versus secondary osteochondral autograft transplantation for the treatment of large osteochondral lesions of the talus. Am J Sports Med. 46:1389–96. doi: 10.1177/0363546518758014. DOI: 10.1177/0363546518758014. PMID: 29537877.

36. Georgiannos D, Bisbinas I, Badekas A. 2016; Osteochondral transplantation of autologous graft for the treatment of osteochondral lesions of talus: 5- to 7-year follow-up. Knee Surg Sports Traumatol Arthrosc. 24:3722–9. doi: 10.1007/s00167-014-3389-3. DOI: 10.1007/s00167-014-3389-3. PMID: 25326766.

37. Paul J, Sagstetter M, Lämmle L, Spang J, El-Azab H, Imhoff AB, et al. 2012; Sports activity after osteochondral transplantation of the talus. Am J Sports Med. 40:870–4. doi: 10.1177/0363546511435084. DOI: 10.1177/0363546511435084. PMID: 22268232.

38. Hangody L, Dobos J, Baló E, Pánics G, Hangody LR, Berkes I. 2010; Clinical experiences with autologous osteochondral mosaicplasty in an athletic population: a 17-year prospective multicenter study. Am J Sports Med. 38:1125–33. doi: 10.1177/0363546509360405. DOI: 10.1177/0363546509360405. PMID: 20360608.
39. Valderrabano V, Leumann A, Rasch H, Egelhof T, Hintermann B, Pagenstert G. 2009; Knee-to-ankle mosaicplasty for the treatment of osteochondral lesions of the ankle joint. Am J Sports Med. 37(1 suppl):105S–11S. doi: 10.1177/0363546509351481. DOI: 10.1177/0363546509351481.

40. Szerb I, Hangody L, Duska Z, Kaposi NP. 2005; Mosaicplasty: long-term follow-up. Bull Hosp Jt Dis. 63:54–62. PMID: 16536220.
41. Andrade R, Vasta S, Pereira R, Pereira H, Papalia R, Karahan M, et al. 2016; Knee donor-site morbidity after mosaicplasty - a systematic review. J Exp Orthop. 3:31. doi: 10.1186/s40634-016-0066-0. DOI: 10.1186/s40634-016-0066-0. PMID: 27813019. PMCID: PMC5095115.

42. Nakagawa Y, Mukai S, Setoguchi Y, Goto T, Furukawa T, Nakamura T. 2017; Clinical outcomes of donor sites after osteochondral graft harvest from healthy knees. Orthop J Sports Med. 5:2325967117732525. doi: 10.1177/2325967117732525. DOI: 10.1177/2325967117732525. PMID: 29057275. PMCID: PMC5642008.

Figure. 1
Approach of talar dome. Central to posterior talar dome cannot be accessed with any approach even though osteotomies such as medial malleolar osteotomy (MMO), lateral malleolar osteotomy (LMO), and Chaput osteotomy (CO) can make better access than arthrotomies. PMA: posteromedial arthrotomy, AMA: anteromedial arthrotomy, PLA: posterolateral arthrotomy, ALA: anterolateral arthrotomy.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download