INTRODUCTION
코로나바이러스(Coronavirus)는 코로나바이러스과(Coronaviridae)에 속하는 비분절 양성 가닥 RNA 바이러스(non-segmented positive-sense RNA virus)로 RNA-의존성 RNA-중합효소(RNA-dependent RNA polymerase)를 가지고 있다(1). 코로나 바이러스는 게놈(genome) 서열에 따라 알파 코로나 바이러스(Alpha coronavirus), 베타 코로나바이러스(Beta coronavirus), 감마 코로나바이러스(Gamma coronavirus), 델타 코로나 바이러스(Delta coronavirus) 등의 네 개의 속(屬)으로 나뉜다. 알파는 다시 1a형과 1b형으로 나뉘고 베타는 2a, 2b, 2c, 2d형으로 나뉘게 된다. 알파, 베타 코로나 바이러스는 주로 포유 동물에게 감염이 된다고 알려져 있으며 감마, 델타 코로나바이러스의 경우에는 주로 조류에 감염된다고 보고되었으나, 때로는 포유류에게도 감염되기도 한다. 알파, 베타 코로나바이러스의 경우 사람에게서는 호흡기 질환을, 동물에서는 소화기계 감염 및 질환을 유발한다고 알려져 있으며, 점막(mucous membrane) 감염 및 비말 전파로 감염된다고 보고되었다(1).
미국 질병 통제 예방 센터인 CDC (Center for Disease Control and Prevention)의 발표에 의하면, 최근 발생한 SARS-CoV-2를 포함하여, 현재 총 7종의 코로나 바이러스가 사람에게 감염되는 것으로 밝혀졌으며, 7종 가운데 2종은 알파 1b형이고 나머지 5종은 베타로, 이 가운데 2a가 2종(OC43, HKU1), 2b가 2종(SARS-CoV, SARS-CoV-2), 2c가 1종(MERS-CoV)인 것으로 밝혀졌다(2) (Fig. 1).
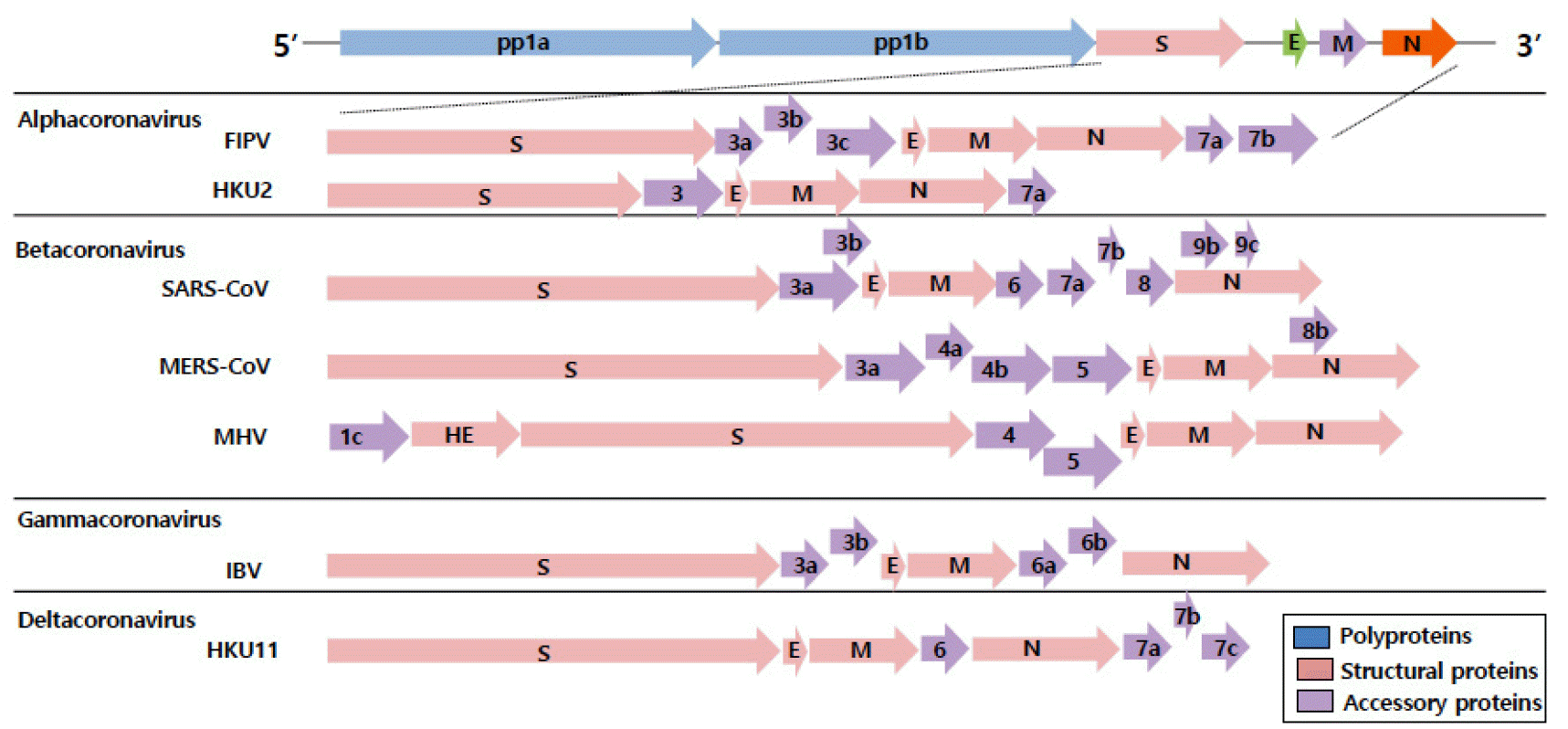 | Fig. 1The genomes, genes and proteins of different coronaviruses (8).Coronaviruses have a positive-sense, single-stranded RNA (ssRNA) genome of 27~32 kb in size. The 5'-terminal two-thirds of the genome encodes a polyprotein, pp1ab, which is further cleaved into 16 non-structural proteins that are involved in genome transcription and replication. The 3' terminus encodes structural proteins, including envelope glycoproteins spike (S), envelope (E), membrane (M) and nucleocapsid (N). Here, we summarize prototypical and representative strains of four coronavirus genera: feline infectious peritonitis virus (FIPV), Rhinolophus bat coronavirus HKU2, severe acute respiratory syndrome coronavirus (SARS-CoV), Middle East respiratory syndrome coronavirus (MERS-CoV), mouse hepatitis virus (MHV), infectious bronchitis virus (IBV) and bulbul coronavirus HKU11 (Adapted from Ref. 8).
|
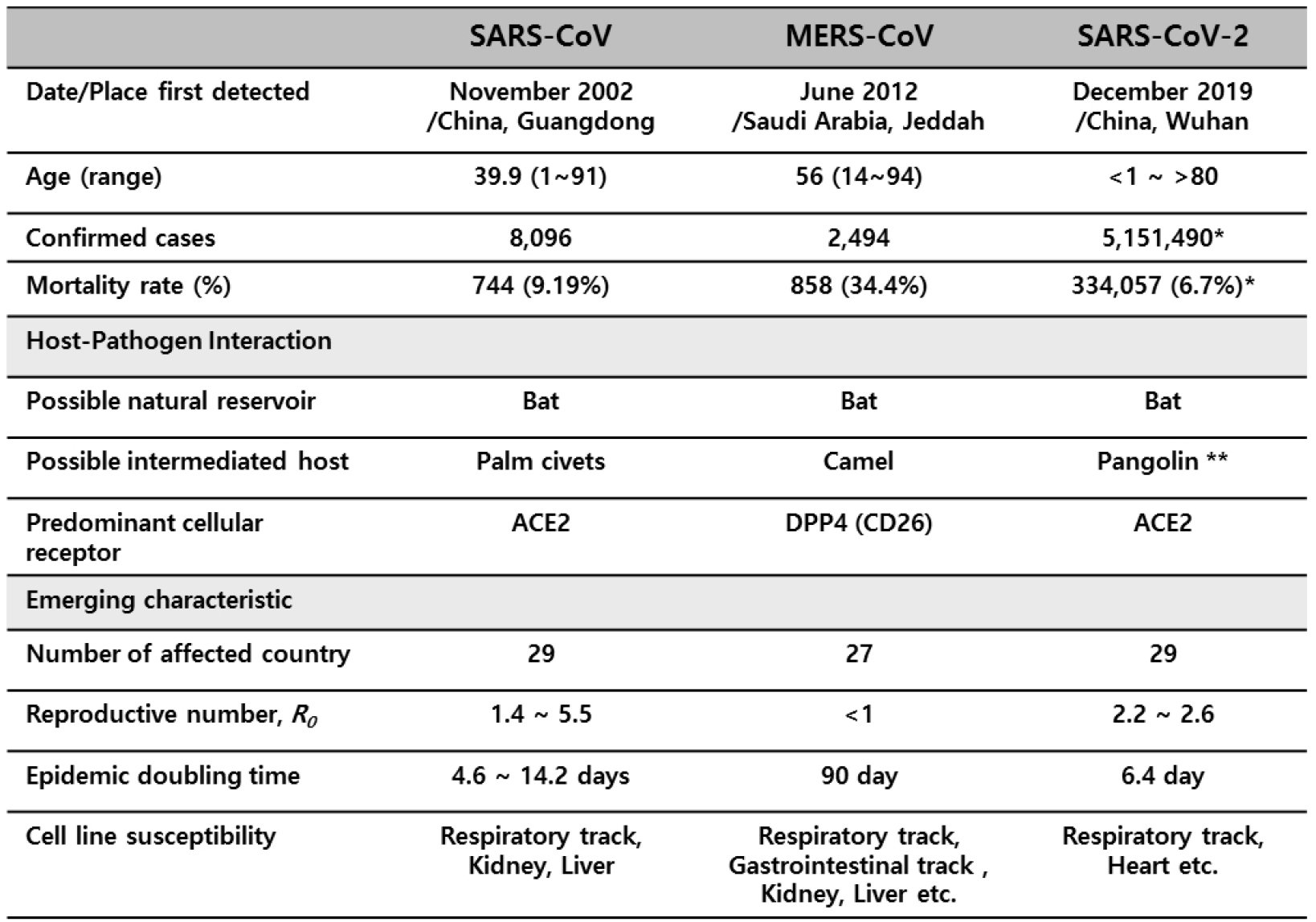
코로나바이러스의 분류와 기본적인 구조에 대해서는 1970년대에 이미 확인되었으나, 사람에게 심각한 질병을 유발하지 않아서 그다지 큰 관심을 받지 못했었다. 그러나 이러한 상황은 2002년 중국에서 발생한 SARS-CoV의 감염에 의해 발생한 급성 호흡기 증후군, 사스(Severe Acute Respiratory Syndrome: SARS)의 위협적인 대유행으로 인해 반전을 맞게 된다. SARS는 30여 개국으로 퍼져 나갔으며, 10%에 가까운 사망률로 800여 명의 사망자를 발생시켰다(3). SARS-CoV에 감염된 환자들은 고열과 기침, 호흡곤란과 같은 증상이 나타났으며, 일부 환자들에게는 설사가 동반되었다. 그 중, 증상이 2주 이상 지속된 환자들은 급성 호흡곤란 및 다기관 부전증이 발생하였다. 환자들에서 분리한 바이러스 분석을 통해 SARS-CoV 는 27.9kb 길이의 RNA genome을 가진 새로운 코로나바이러스에 의한 것임을 알게 되었으며 세계보건기구 WHO (World Health Organization)는 이 새로운 바이러스를 사스 코로나바이러스(SARS-CoV)로 명명하였다(3).
SARS의 유행 후 2012년 6월, 사우디아라비아에서 심각한 호흡기 질환을 호소하는 환자가 발생하였다. 조사결과, 코로나바이러스의 한 종류임이 확인되었으며, 발생지역을 따서 중동 호흡기 증후군(Middle East Respiratory Syndrome)인 일명 MERS(메르스) 라고 명명하였다. 메르스는 총 27개국에서 823명의 사망자가 발생하였으며 치명율은 35% 이상으로 사스에 비해 매우 높았다(4).
2019년 12월부터 중국 우한에서 SARS-CoV의 아종인 SARS-CoV-2에 의한 신종 코로나바이러스 감염증(COVID-19: Coronavirus disease 2019)이 시작되었다. 치명율은 과거 MERS나 SARS에 비하여 낮은 편이지만, 감염력이 매우 높아 전세계로 급속하게 확산되면서 2020년 5월 말까지 집계된 감염자수는 214 개국 500만명에 이르며 사망자는 32만여명을 넘어가고 있다(5), (6) (Table 1). 위와 같은 코로나바이러스의 위협적 대유행에도 아직까지 SARS-CoV, SARS-CoV-2 및 MERS-CoV에 대한 효과적인 백신 및 치료법은 개발되어 있지 않으며, 증상을 완화시키는 대증 치료에만 의존하고 있는 상황이다(7), (8). 코로나바이러스에 의한 대유행은 언제든지 예고 없이 발생할 수 있으며, 현재 유행 중인 COVID-19 (Coronavirus disease 2019)을 비롯하여 앞으로 발생할 수 있는 코로나바이러스의 대유행에 대비하기 위한 백신 및 치료법의 개발이 시급하게 필요하다. 본 논문은 현재까지 진행했던, SARS, MERS의 백신개발을 토대로 현재 진행 중인 COVID-19에 대한 치료제 및 백신 개발 현황들을 위주로 정리, 요약하였다.
Go to : 
CORONAVIRUSES
사람 코로나바이러스
사람에 감염되는 모든 코로나바이러스는 일차적으로 호흡기 감염균에 속하고, 감기나 독감 시즌 동안에 자주 등장하나 실제로 이에 대한 검사는 거의 이루어지지 않고 있다. 다만 국내에서는 질병관리본부에서 지속적으로 인플루엔자 및 호흡기바이러스 감염증 병원체 검사를 통해 코로나바이러스가 국내에서도 매년 검출되고 있는 것을 보고하고 있다(9). 이들은 전세계적으로 풍토병성 양성이며 성인의 상기도 감염의 10~30%의 원인이 된다고 알려져 있다. 그러나 21세기 들어서 베타 코로나바이러스 중 SARS-CoV 및 MERS-CoV, SARS-COV-2 와 같은 위험성이 높은 바이러스가 출현하였다. 코로나바이러스의 감염은 다양한 동물 종에서도 발견되며 생태학적으로 많은 숙주가 존재한다. 집 주변에 존재하는 포유동물들 또한 코로나바이러스의 중간 숙주가 될 수 있다(8).
SARS-CoV와 MERS-CoV의 병인론(Pathology)
일반 코로나 바이러스의 경우 감기와 비슷한 정도의 증상만 가지는 반면, SARS-CoV 및 MERS-CoV는 하기도에 심각한 감염을 일으키며 높은 치명율을 보인다. 유전자 염기서열 분석을 통해 SARS-CoV-2는 SARS-CoV와 유전적으로 79% 일치하며 MERS-CoV와는 51.8%의 유사성이 있는 것으로 밝혀졌다(10). 질병학적 측면에서 두 바이러스는 유사한 것으로 보이지만, SARS와 MERS는 역학적, 바이러스학적, 임상학적 측면에서 차이점을 지니고 있다. SARS와 MERS에 대한 임상학적, 역학적 그리고 생물학적인 특징들을 표(Table 1)에 정리하였다.
SARS-CoV-2감염으로 인한 주요 임상 증상은 열, 마른 기침, 근육통, 피로, 등이며 많은 환자들에게서 호흡 곤란 및 림프구 감소증이 발생하였다. 심각한 병원성이 있는 SARS의 경우, 그 기전은 완벽하게 알려지지 않았으나, SARS-CoV에 감염된 환자의 광범위한 폐 손상은 초기의 높은 바이러스 역가 및 단핵구, 대식세포 및 호중구의 증가에 인한 것으로 밝혀졌다(10). CXCL10, IL-2, IL-6의 과잉생성 및 IL-10부족은 폐 손상과 관련된 면역병리적 과정에 기여하는 것으로 보이며, Type 1-IFN의 지연형 발현 역시 바이러스의 증식과 연관되어 있다고 알려져 있다(10). MERS의 경우 수용체인 DPP4 (Dipeptidyl Peptidase)가 신장 상피세포, 소장, 간 및 활성화된 림프구 등에서 발현되어 있어 매우 광범위한 범위의 손상을 가져온다. MERS 역시 염증성 사이토카인 및 케모카인(TNF-a, IL-6, CXCL10, IL-8) 등이 과다 발현되어 있으며, 하기도에서 심각한 면역세포의 침윤이 관찰된다(10).
SARS-CoV의 일차 감염 타켓 세포는 폐에 존재하는 기도 상피세포, 폐포 상피세포, 혈관 내피세포 및 대식세포이며 이들 세포표면에 존재하는 angiotensin-converting enzyme 2 (ACE2)를 통하여 감염된다(11). ACE2는 폐 조직 손상을 보호하는 기능이 있는데, SARS-CoV가 ACE2를 통하여 폐세포로 감염 되면 ACE2가 세포 표면에서 줄어들게 되어 폐 손상 보호 기능이 영향을 받게 된다(11). 또한 ACE2는 renin-angiotensin system을 이용하여 혈압을 조절하는데, 바이러스 감염으로 세포 표면으로부터 ACE2가 줄어들게 되면 혈압조절이 제대로 되지 않게 된다. 이는 고혈압 같은 기저질환을 가진 사람들의 감염 예후가 더 안 좋은 이유가 될 수 있다(11). 또한 ACE2가 X 염색체 내에 존재하고, COVID-19에 저항성을 가진 대립유전자가 X 염색체 상에 존재할 가능성이 있다고 여겨진다(11). SARS-CoV-2가 폐 세포에 감염되면 폐 세포는 pyroptosis(세포 자살의 한가지 형태로 병원성 감염원의 감염에 의해 주로 발생)가 일어나면서 다양한 염증 사이토카인을 유도하게 된다(12). 또한 바이러스 RNA와 같은 pathogen-associated pattern과 파괴된 폐 세포에서 나온 ATP, DNA, ASC oligomers같은 damage-associated molecular pattern들을 폐포 세포와 폐 대식 세포가 pattern-recognition receptor를 이용하여 인식한 다음 IL-6, IFN-g, MCP1, IP-10 같은 다양한 염증 유도 사이토카인을 분비하게 된다. 이로 인해 혈액의 림프구가 바이러스가 감염된 폐 조직으로 침투하게 되어 혈액 내의 림프구 수가 줄어드는 림프구 감소증(lymphopenia) 현상이 일어나게 된다. 이외에도 바이러스 자체가 림프구에 감염되어 혈액 내의 림프구 숫자를 감소시킬 수도 있다. 폐 조직의 손상을 유도하는 다른 기전으로는 사이토카인 폭풍이라는 현상이 있으며, 이때 TNF-a 와 같은 염증성 사이토카인이 급격하게 증가하게 되고 이는 폐혈성 쇼크(septic shock)와 다기관 손상을 유도하게 된다. SARS-CoV-2 감염으로 인해 나이가 많거나 기저 질환이 있는 사람들이 더 사망률이 높은 것은 이러한 면역학적 기능 이상 때문이며 특히 노인 및 기저질환자들의 폐 미세환경의 변화로 수지상 세포의 성숙 및 림프조직으로의 이동이 영향을 받게 되고 이로 인해 T 세포가 활성을 가지지 못하게 되어 일어난다고 할 수 있다(11).
SARS-CoV와 MERS-CoV의 구조적 특성 및 생활사
코로나바이러스는 유전체로서 약 27~32kb 길이의 단일 가닥 RNA를 가지며 바이러스 유전체인 RNA 자체가 전사체로 작용하는 양성 가닥 RNA 유전자에 해당한다(13). SARS-CoV, MERS-CoV, SARS-CoV-2 게놈(genome) 유전자는 일반적으로 처음 부분에 5’-methylguanosine cap이 있고 끝부분은 3’-poly A tail 이 존재하며 그 사이에 6~8개의 유전자가 존재한다. 코로나바이러스의 게놈(genome)은 뉴클레오캡시드(Nucleocapsid, N) 단백질, 매트릭스(Matrix, M) 단백질, 외피(Small envelope, E) 단백질, 표면 돌기(Spike, S) 당 단백질 등과 같은 구조 단백질을 코딩하고 있다(Fig. 2). 뉴클레오캡시드 단백질은 바이러스 유전체 RNA와 결합하여 유전체를 안정화하고 포장하는 역할을 한다. 외피(Envelope)에 존재하는 표면돌기(Spike, S)의 당 단백질은 숙주세포의 수용체 결합에 필수적이며, 감염 숙주의 범위를 결정한다. 전자현미경 관찰 시 표면 돌기 단백질의 돌기 모양이 왕관과 같은 코로나 모양(crown-like corona)을 형성을 볼 수 있어서, ‘코로나바이러스’로 명명되었다(14).
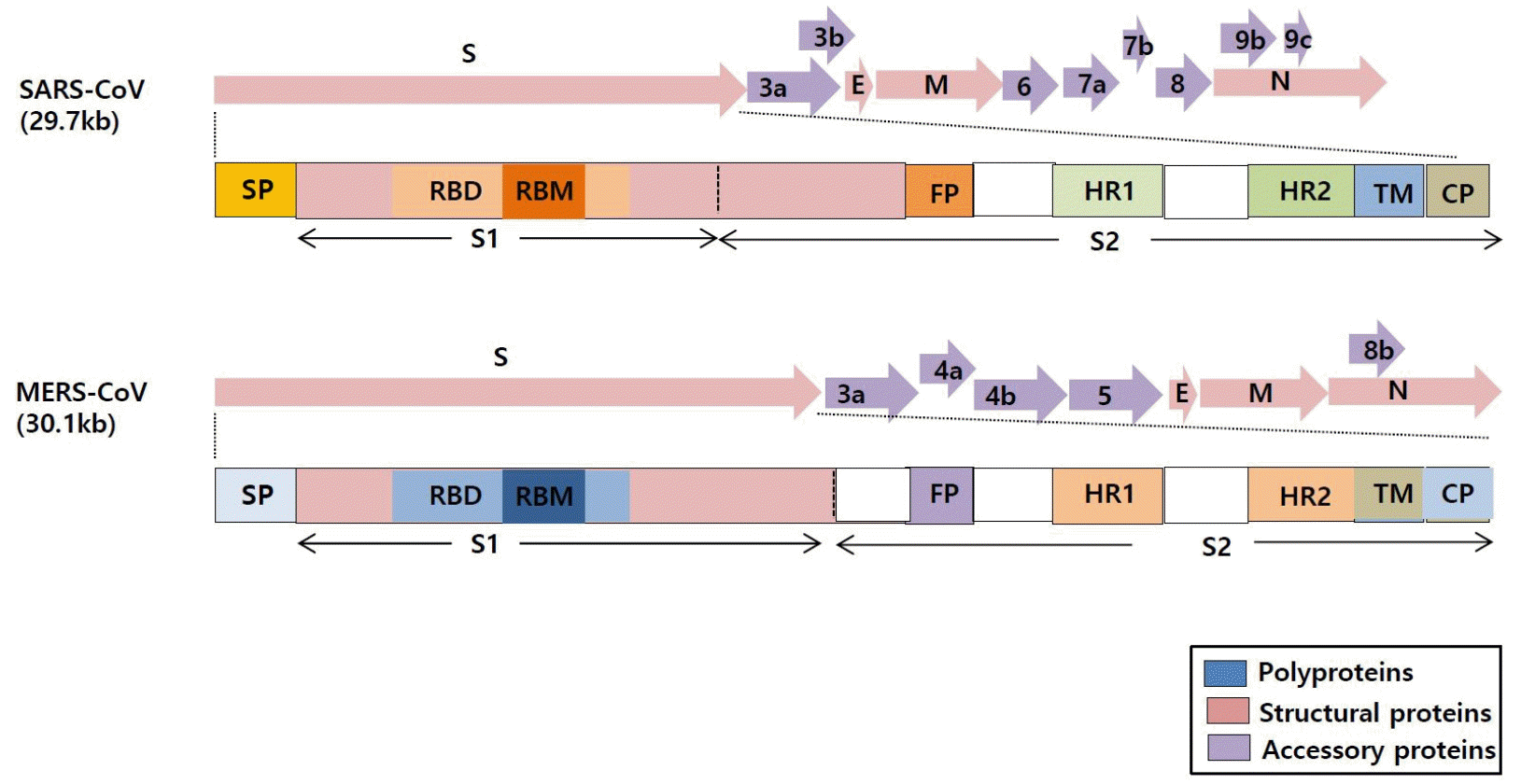 | Fig. 2Schematic representation of genome organization for SARS-CoV and MERS-CoV (14).The single-stranded RNA genomes of SARS-CoV and MERS-CoV encode two large genes, the ORF1a and ORF1b genes, which encode 16 non-structural proteins (nsp1–nsp16) that are highly conserved throughout coronaviruses. The structural genes encode the structural proteins, spike (S), envelope (E), membrane (M), and nucleocapsid (N), which are common features of all coronaviruses. The S protein contains the S1 and S2 subunits. The residue numbers in each region represent their positions in the S protein of SARS and MERS, respectively. The S1/S2 cleavage sites are indicated by dotted lines. SARS-CoV, severe acute respiratory syndrome coronavirus; MERS-CoV, Middle East respiratory syndrome coronavirus; CP, cytoplasm domain; FP, fusion peptide; HR, heptad repeat; RBD, receptor-binding domain; RBM, receptor-binding motif; SP, signal peptide; TM, transmembrane domain. FP, fusion peptide; HR, heptad repeat; RBD, receptor-binding domain; RBM, receptor-binding motif; (adapted from Ref. 14).
|
S 단백질은 숙주 세포의 프로테아제(protease)에 의해 숙주 세포 수용체에 인식될 수 있도록 잘리게 되는데, 사람의 세린 프로테아제(serine protease) TMPRSS2는 SARS-CoV 및 SARS-CoV-2의 S 단백질을 프라이밍(priming)하여, angiotensin converting enzyme 2 (ACE2) 수용체에 결합할 수 있게 한다. MERS-CoV는 또 다른 수용체인 dipeptidyl peptidase 4 (DPP4)에 특이적으로 결합한다(14).
표면 돌기(S) 단백질은 S1 도메인을 통해 숙주세포의 수용체와 결합하고 S2 도메인의 fusion peptide (FP)를 통해 막이 융합하면서 바이러스가 세포 내로 침투한다. 이후, 바이러스 RNA 게놈(genome)이 숙주세포의 세포질에서 바이러스 복제에 필요한 단백질을 합성한다. 유전체의 번역과정에 필요한 요소는 숙주의 것을 사용하며 바이러스 복제 복합체(Viral Replication Complex)가 형성되면 바이러스 복제 복합체는 전장서열의 음성가닥(negative strand) RNA를 합성한다. 합성된 음성가닥은 양성가닥 mRNA를 합성하기 위한 주형(template)으로 작용한다. 음성가닥 genomic RNA는 leader transcriptional regulatory sequence (TRS)와 body TRS를 이용하여 discontinuous transcription이라는 독특한 시스템을 통해 하나의 음성가닥 RNA로부터 7개의 분절된 sub-genomic mRNA를 만들어 내고 이들이 다양한 바이러스 단백질들을 합성해낸다(14). 세포질(Cytosol)에서 뉴클레오캡시드(N) 단백질이 유전체 RNA와 합체하면, 나선형의 뉴클레오캡시드를 형성한다. 이 핵심구조는 소포체(Endoplasmic reticulum, ER)와 골지체(Golgi apparatus)를 거치면서 막(M), 외피(E), 표면 돌기(S) 단백질 등과 결합한 후, 바이러스입자(Virion)를 함유하는 소포를 형성하고(Vesicle) 세포막에 융합하여 엑소시토시스(Exocytosis) 과정을 통해 숙주 세포 밖으로 나가게 된다(Fig. 3) (6).
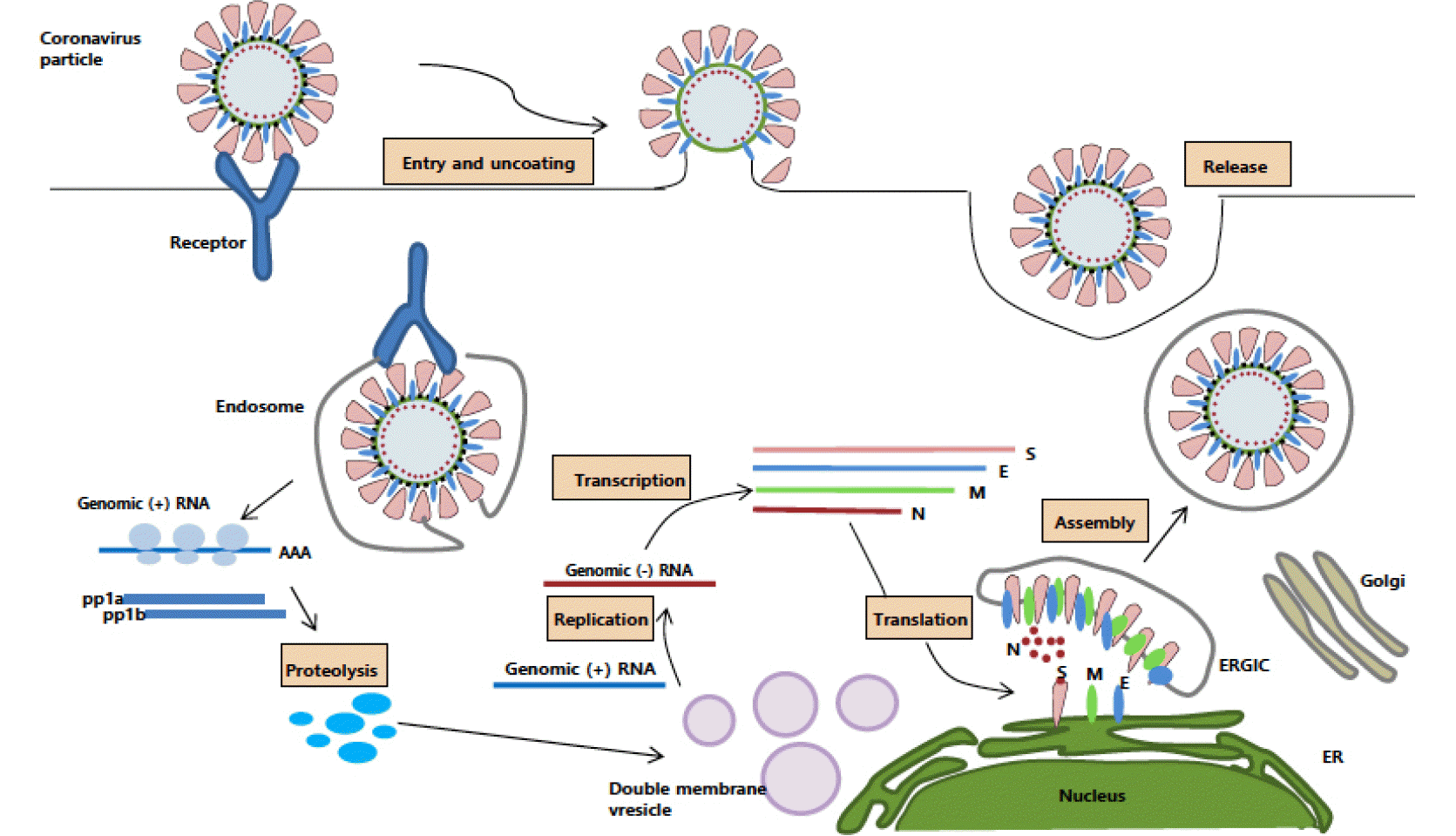 | Fig. 3The life cycle of coronaviruses (8).The process of coronaviruses entering into the host cell begins through the attachment of the S glycoprotein to the receptor in host cells. The envelope glycoprotein spike (S) forms a layer of glycoproteins that protrude from the envelope. Two additional transmembrane glycoproteins are incorporated in the virion: envelope (E) and membrane (M). Inside the viral envelope resides the helical nucleocapsid, which consists of the viral positive-sense RNA ((+)RNA) genome encapsulated by protein nucleocapsid (N). Following entry of the virus into the host cell, the viral RNA is uncoated in the cytoplasm of host cells. ORF1a and ORF1ab are translated to produce pp1a and pp1ab, which are cleaved by the proteases that are encoded by ORF1a to yield 16 non-structural protein that form the RNA replicase–transcriptase complex. This complex localizes to modified intracellular membranes that are derived from the rough endoplasmic reticulum (ER) in the perinuclear region, and it drives the production of negative-sense RNA ((-) RNA)s through both replication and transcription. During replication, full-length (-) RNA copies of the genome are produced and used as templates for full-length (+)RNA genomes.
During transcription, a subset of 7~9 subgenomic RNAs, including those encoding all structural proteins, is produced by discontinuous transcription. In this process, subgenomic (−)RNAs are synthesized by combining varying lengths of the 3′ end of the genome with the 5′ leader sequence necessary for translation. These subgenomic (−)RNAs are then transcribed into subgenomic (+)mRNAs. Although the different subgenomic mRNAs may contain several ORFs, only the first ORF (that closest to the 5′ end) is translated. The resulting structural proteins are assembled into the nucleocapsid and viral envelope at the ER–Golgi intermediate compartment (ERGIC), followed by release of the virion from the infected cell. (adapted from Ref.8).
|
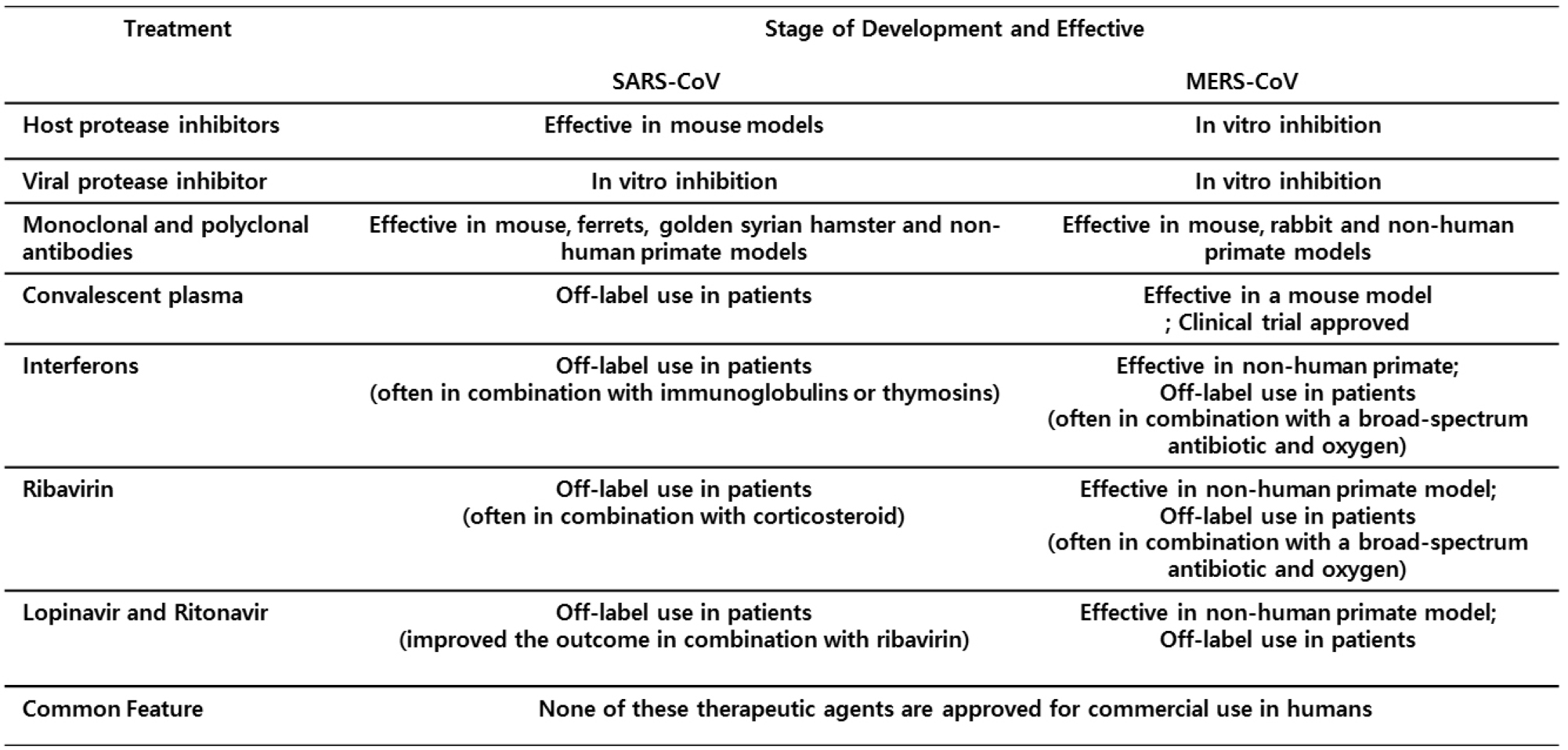
SARS 및 MERS 치료제
현재까지 코로나바이러스에 의한 급성호흡기중후군(SARS)에 직접적으로 작용하는 치료제는 개발되지 않았다. 2002년 발생했던 사스(SARS)의 경우, 리바비린(Ribavirin), 인터페론 알파(Interferon-a) 및 칼레트라(Kaletra, 로피나비르 Lopinavir +리토나비르 Ritonavir의 병행 물질)를 치료제로 사용하였다(Table 2) (15). 리바비린은 뉴클레오사이드 유사체(nucleoside analogue)로 몇몇의 RNA 및 DNA바이러스를 in vitro에서 억제한다고 알려져 있다(16). SARS 발생 초기에 리바비린을 투여한 젊은 환자들이 좋은 경과를 보였기 때문에 홍콩 및 캐나다를 비롯한 몇몇 나라들에서 리바비린을 치료제로 사용하였다. 그러나 용혈 빈혈(hemolytic anemia), 저 칼슘혈증(hypocalcaemia), 저 마그네슘혈증(hypomagnesaemia)과 같은 부작용이 보고되어 결과적으로는 SARS 치료에 추천되지 않았다(16). 인터페론은 넓은 스펙트럼의 항 바이러스제로, B형 및 C형 간염의 치료제로 사용되고 있다. 토론토에서 진행된 SARS-CoV 감염 환자를 대상으로 한 후향적 연구에서, 인터페론은 코르티코스테로이드(corticosteroid)와 병행치료 시 효과가 있는 것으로 보고되었다(17). 또 다른 치료제인 칼레트라는 로피나비르와 리토나비르로 구성된 에이즈 바이러스 치료제로 HIV 바이러스의 복제를 막는 단백질 분해효소 억제제이다. 152 명의 사스(SARS-CoV) 환자를 대상으로 한 홍콩의 연구에서 칼레트라는 초기 및 구조요법으로 사용되었으며, 리바비린 및 코티코 스테로이드로 구성된 표준요법에 추가되어 사용되었다. 연구결과, 칼레트라가 투여된 그룹은 대조군에 비해 급성호흡곤란 증후군(Acute respiratory distress syndrome, ARDS) 또는 사망률(28.8% vs 2.4%)이 낮아지는 것을 확인하였다(18).
중동호흡기코로나바이러스(MERS) 역시 높은 치명율에도 불구하고 현재 승인된 치료제는 없는 상태로 다양한 치료법 개발이 진행 중이다. 붉은 털 원숭이(Rhesus macaque) 모델에서 바이러스 치료제인 리바비린과 알파 인터페론을 병용투여 시, 바이러스의 유전자 증폭이 감소되고 폐 조직의 염증 반응이 감소되어 병의 진행이 약화된 것을 확인하였다. 하지만 대체적으로 미비한 효과를 보여주었다. 이외에도 MERS의 S 단백질의 RBD (receptor binding domain) 도메인에 결합하는 중화항체 및 단일 클론 항체의 개발이 이루어지고 있다. IgM Fab library를 이용하여 개발된 m336 항체는 RBD와 DPP4 수용체의 결합을 경쟁적으로 억제함이 증명되었다. 이 외에도, 감염된 환자의 B 세포로부터 중화항체를 생성한 연구가 진행되어 LCA60 클론이 높은 중화능이 있음이 확인되었다. 하지만 아직까지 임상실험에 들어간 단일 클론 항체 후보물질은 없는 상태이다(7).
COVID-19 치료제
2019년 발생한 COVID-19의 경우, 빠른 감염력 및 확산세로 인해 새로운 약물을 개발하기 보다는 기존에 알려진 항 바이러스 제제를 기반으로 한 약물 재창출 전략을 새우고 있다. 5월말 현재까지 ClinicalTrials.gov에 신규 등록된 COVID-19 치료제 관련 약물 임상시험은 현재 430여 개에 달하고 있다(19).
현재 COVID-19의 치료제로 주목받고 있는 것은 에이즈 치료제인 칼레트라와 에볼라 치료제인 렘데시베르(Remdesivir), 신종플루 치료제인 파빌라비르(Favilavir), 말라리아 치료제인 클로로퀸(Choloroquine) 등이 있다. 칼레트라는 COVID-19 초기 투여제로서의 가능성이 제시되었으나, 국제 학술지 뉴잉글랜드 저널 오브 메디슨(New England Journal of Medicine)에 발표된 임상시험의 결과에 따르면, 중국에서 칼레트라를 투여 받은 중증 COVID-19 환자 99명의 결과가 표준치료를 받은 환자 100명보다 통계적으로 유의한 수준의 개선이 없는 것으로 나타났다(20). 우선 치료제로 사용되고 있는 렘데시베르의 경우 바이러스의 중합효소를 교란시키고 바이러스 엑소뉴클레아제(exonuclease) 효소의 교정을 방해하는 것으로 알려져 있으며, 지난 1월 미국에서 발병한 첫 COVID-19 환자에게 투여한 결과 하루 만에 증상이 호전된 것으로 나타났다(21). 최근 발표된 대규모 임상 결과에 따르면 초기 증상 환자들에게는 의미 있는 결과가 나왔으나 증상이 심각한 환자들에게는 효과가 없어, 투약 시기가 중요한 요인임을 보여주었다(22). 따라서 근본적인 치료제이기 보다는 초기 환자의 상태를 호전하는 정도로 사용 될 것으로 예상된다.
클로로퀸은 바이러스와 세포의 융합에 필요한 엔도솜의 pH (endosomal pH)를 증가시켜 세포 수용체(receptor)의 당화작용(glycosylation)을 억제하여 바이러스의 감염을 막는 것으로 보고되어 있다(23). 클로로퀸의 효과에 대해서는 아직 논란이 있는데, 프랑스 연구팀은 코로나19 환자 26명에게 클로로퀸 600mg을 투약한 후 6일 뒤 환자의 4분의 3에게서 바이러스가 더 이상 검출되지 않았으며, 투약하지 않은 환자 16명은 10% 정도만 바이러스가 검출되지 않았다고 발표하였다(24). 그러나 이와 대조적으로 30여 명의 COVID-19 환자에게 하이드록실 클로로퀸을 투여한 중국의 임상시험 결과에서는 대조군에 비하여 투여한 그룹이CT (computed tomography) 스캔 결과에 차이가 없었으며, 체온이 정상으로 돌아오기까지의 시간을 단축시키지 못하는 것을 확인하였다(25).
신종 플루 치료제 아비간(파빌라비르) 역시 효과가 보고되었는데, 340명을 대상으로 한 중국의 임상시험에서 4일 만에 바이러스가 감소하는 효과를 확인하였다. 그러나 감염 초기에 주로 효과가 있고 중증 환자나 고령 환자에게는 효과가 적다고 보고 되었다(26).
현재까지의 연구결과를 종합하여 볼 때, COVID-19 다양한 치료제 후보 물질들 중 효과가 확실하게 규명된 것은 없다. 이를 해결하기 위해 세계보건기구(WHO)는 여러 국가가 참여하는 대규모 치료제 임상시험 계획을 발표했다. 작은 규모의 임상시험을 많이 시행한다 해도 대규모 시험이 없다면 확실한 결론을 내릴 수 없기 때문이다. 이를 통해, 렘데시비르와 칼레트라, 칼레트라와 인터페론 베타 병행 투약, 클로로퀸 등의 치료제를 테스트할 예정이다(27).
Go to : 
ANIMAL MODELS
SARS-CoV의 복제(replication)는 마우스, 햄스터, 고양이, 영장류에서 관찰, 연구되었다. 또한, 나이든 동물(aged animals)에서 심각한 증상이 관찰되었다. MERS의 경우에는 마우스, 페렛, 기니아피그, 햄스터 등이 MERS-CoV의 수용체로 기능을 못하는 homologous DPP4를 가지고 있어 바이러스 감염 실험에 이용되지 못하였다. 위 동물들을 높은 농도의 MERS-CoV로 공격했을 때에도 바이러스의 복제(viral replication)가 일어나지 않았다. 따라서 MERS의 경우 다른 동물 모델을 개발하는 것이 필요하였다(8), (14).
마우스 모델(Mouse model)
SARS-CoV의 경우에는 마우스 공격 실험 모델로 BALB/c, C57BL/6, 129SvEv 계통의 마우스가 이용되었다. 특히 SARS 마우스 적응모델에서는 늙은 마우스에게서 감염이 더 잘 일어났으며, 높은 사망률과 병변이 관찰되었다. 감염 후 2~3일 후 호흡기관에서 바이러스 복제가 가장 높게 나타났으나 심한 감염 증상은 보이지 않았으며, 감염 후 5~7일 후 바이러스는 폐 조직에서 제거되었다. SARS-CoV의 경우에는 마우스가 백신 및 항 바이러스 연구에 가장 적합한 모델로 알려져 있다. 그러나 현재까지의 연구 결과에 따르면 이번 SARS-CoV-2의 경우 마우스에서는 감염 후 바이러스의 복제가 관찰되지 않았다. 최근 연구 결과에 따르면 햄스터와 페렛, 고양이, 영장류에서 SARS-CoV-2 바이러스 복제가 이루어지는 것으로 알려져 있다. 또한, SARS와 마찬가지로 human ACE2-transgenic 마우스를 이용한 모델도 이용되고 있다(8), (14).
MERS의 경우에는 SARS와 달리 야생형(wild type) 마우스는 MERS-CoV 감염모델로 적합하지 않다. 이로 인해 여러 번의 모델 개발이 이루어졌다. 2014년 human DPP4 (hDPP4) 유전자가 들어간 재조합 아데노바이러스(rAd5-hDPP4)를 비강을 통해 마우스에 감염시켜 메르스 모델로 이용하였다(28). 이 마우스 모델의 경우 hDPP4의 분포와 발현이 제대로 조절이 되지 않는 단점을 지니고 있었다. 2015년 새로운 hDPP4 형질 전환 마우스가 만들어졌고, 최근에는 homologous hDPP4 형질전환 마우스, hDPP4 유전자 삽입(Knock-in) 마우스 등과 같이 MERS-CoV 와 더 효과적인 수용체 결합을 할 수 있는 마우스들이 개발되었다(8), (14).
페렛 모델(Ferret model)
SARS-CoV 및 SARS-CoV-2의 경우 페렛이 적합한 감염 동물모델로 알려져 있다. 바이러스 감염 후 체온이 상승하고 몸무게가 줄며 폐 조직에서 바이러스의 감염이 관찰되었다. 그러나 마우스 모델과 유사하게, 감염 후 현저한 사망률은 관찰되지 않았다. MERS의 경우에는 페렛에서 바이러스의 복제가 나타나지 않는다(8), (14). 최근 충북대학교 최영기 교수 팀에서 페렛이 SARS-CoV-2 감염 및 전파 (transmission) 동물 모델로서 가능하고 이를 토대로 백신 및 치료제 개발에 활용할 수 있음을 보고 하였다(30).
영장류 모델(Non-Human Primate model)
현재 SARS 영장류 모델에는 rhesus macaque, cynomolgus macaque, african green monkeys, 그리고 신세계 영장류인 common marmoset, squirrel monkey, mustached tamarin이, MERS의 경우에는 일반적으로 rhesus macaque, common marmoset이 주로 이용되고 있다. 그러나 영장류의 경우 제한된 샘플의 수와 생산성의 부족 및 비용적인 문제 등으로 인해 실험 동물로 이용하는 것이 쉽지 않다(8), (14). 최근 rhesus macaque를 활용하여 영국 옥스퍼드 대학교 제너 연구소에서 백신 후보 물질을 테스트한 것이 보고되었다. SARS-CoV-2 공격 실험에 대해서 rhesus macaque 모델이 사망하지는 않았으나 기관지 세척액에서 바이러스가 관찰되었고 폐 조직에서 병변이 나타나는 것으로 보아 현재까지는 인간에 가장 근접한 우수한 모델이라고 할 수 있다(31).
Go to : 
VACCINE DEVELOPMENT
항원 선택(Antigen selection)
전세포 항원(whole cell antigens, WCA)
전세포 항원이란 단백질, 지질, 다당류, 핵산 등을 포함한 바이러스의 모든 요소를 일컫는다. 전세포 항원은 불활성화(inactivated, whole-cell killed) 및 약독화(live-attenuated) 백신 개발에 사용되어 왔다. 전세포 항원은 실제 바이러스와 유사한 항원을 제시한다는 장점이 있으나, 바이러스의 모든 구성요소를 포함하고 있기 때문에 품질관리 및 일관성 평가측면에서 까다로운 부분이 있으며, 병원성이 낮거나 거의 없는 strain을 얻기 위한 엄격한 스크리닝 단계를 필요로 한다(32). 더구나 SARS-CoV-2 같은 BSL3 바이러스를 대량 배양하기 위한 생산설비의 대규모화가 쉽지 않다.
표면돌기 단백질(Spike protein, S-protein)
S 단백질(S-protein)은 현재 SARS-CoV-2 백신개발에 있어 가장 유망한 항원이다. S 단백질은 바이러스 표면에 노출되어 숙주의 면역시스템에 직접적으로 인식되는 부분이며, 숙주세포의 ACE2 수용체에 결합 후 숙주세포 안으로 들어가 병원성을 유발하는 데 필수적으로 작용한다. 이러한 이유로 SARS-CoV 및 MERS-CoV에 대한 백신개발에서 S 단백질이 사용되었다(32).
SARS-CoV-2 와 MERS-CoV의 S 단백질이 furin-like cleavage site를 가지고 있는데 반해 SARS-CoV는 가지고 있지 않다(33). 이러한 특징은 SARS-CoV-2가 SARS-CoV보다 더 높은 감염율을 가지는 이유일 것으로 추정되고 있다. 또한 cellular serine protease TMPRSS2는 SARS-CoV-2 S 단백질을 적절히 절단하여 숙주 세포로 바이러스가 들어가는 것을 도와준다.
전장 S 단백질(Full length S protein)은 단백질 본연의 형태를 유지할 가능성이 높으며, 따라서 높은 면역원성을 가진 에피토프(epitope)를 제공할 가능성이 높다. Pallesen 등의 연구결과에서 재조합 MERS-CoV S 단백질로 면역한 BALB/c 마우스는 높은 역가의 중화항체를 생성하였다(34). 또한 바큘로바이러스(Baculovirus)에 감염된 곤충세포에서 생산된 S 단백질은 나노 입자 형태로 조립될 수 있었으며, 이 나노 입자와 alum adjuvant로 면역된 마우스는 높은 역가의 중화항체를 생성하였다. Muthumani 등에 의하면, MERS-CoV의 S 단백질을 암호화하는 DNA 백신은 마우스, 낙타 및 rhesus 원숭이에서 면역성을 보였으며, 바이러스 감염 시 폐렴 및 임상적 증상을 완화시켰다(35).
SARS-CoV-2 S 단백질의 단량체(monomer)는 약 140kDa의 분자량을 갖는 1273 개의 아미노산으로 이루어져있으며, 자연적인 자가 결합을 통해, 클래스 I 바이러스 융합 단백질(class I viral fusion protein)과 유사한 형태의 동종 삼량체(homo-trimer)로 조립된다(36). S 단백질은 2개의 서브 유닛(S1 및 S2)을 포함하고 있는데, S1 서브 유닛은 N-말단 도메인(N-terminal domain, NTD) 및 C-말단 도메인(C-terminal domain, CTD)으로 다시 나뉘어 질 수 있다. 숙주세포의 수용체와 결합하는 도메인(receptor binding domain: RBD)은 C-말단 도메인에 위치한다. S2 서브 유닛은 내부 막 융합 펩타이드(internal membrane fusion protein, FP), 2 개의 7-펩타이드 반복체(two-7 peptide repeats, HR), 막 근위 외부영역(membrane proximal external region, MPER) 및 막 횡단(transmembrane, TM) 도메인 등을 포함하고 있으며, 막 융합 과정에 필요한 기본요소들을 포함한다(36).
최근 SARS-CoV-2의 S 삼량체 및 RBD 도메인과 ACE2와의 전 융합상태(pre-fusion state)에 대한 구조 분석이 완료되었다(37). 이는 S 단백질을 이용한 백신개발에 중요한 정보를 제공할 것으로 예상된다. 지금까지 백신개발에서 항원으로 사용될 가능성이 있는 구성요소들은 전장 S 단백질 이외에도, 수용체 결합 도메인(RBD), S1 서브 유닛, NTD 및 FP 등이 있다.
수용체 결합 도메인(Receptor-binding domain, RBD)
S 단백질의 RBD는 숙주세포의 ACE2 수용체와 직접적으로 결합하는 부분이다. 따라서 RBD 단백질 면역 후 생성된 항체는 수용체와의 결합을 차단하여 바이러스의 침입을 효과적으로 예방할 것으로 기대된다. SARS-CoV RBD는 193개의 아미노산(아미노산 서열 318-510)으로 구성되어 있으며, SARS-CoV-2 RBD와 아미노산 서열과 72%의 유사도를 가지고 있다(38). SARS-CoV-2 RBD는 SARS-CoV RBD보다 ACE2에 더 강하게 결합하는 것으로 보고되었다(39). 현재 개발 중인 SARS-CoV-2 서브 유닛 백신의 일부는 RBD를 항원으로 사용하고 있으며, SARS-CoV 및 MERS-CoV 백신 개발 시에도 항원으로 이용되었다. SARS-CoV 백신연구를 통해, 다수의 입체 중화 에피토프(Multiple conformational neutralizing epitopes)들로 구성된 재조합 RBD는 SARS-CoV에 대한 높은 역가의 중화 항체를 유도하는 것이 밝혀졌다(40).
N 말단 도메인(NTD)
RBD와 마찬가지로, 여러 코로나 바이러스의 S 단백질의 N-말단 도메인(NTD)은 숙주 수용체의 당과 결합하는 것으로 보고되었다. 예를 들어, 투과성 위장염 바이러스(Transmissible gastroenteritis virus)의 S 단백질의 NTD는 숙주 수용체의 시알산(sialic acid)에 결합하는 것으로 보고되었다(41). 따라서 NTD 역시 코로나 백신개발 위한 후보 항원이다. 이전에 보고된 연구에 따르면 MERS-CoV의 S 단백질의 재조합 NTD로 면역된 마우스는 세포면역반응 및 항원 특이적인 중화항체가 유도되었으며 바이러스로 공격으로부터 보호되었다(42).
S1 서브유닛(S1 subunit)
위에서 설명한 RBD와 NTD 를 모두 포함하는 S1 서브 유닛은 숙주 수용체와의 결합에 관여하며 백신 개발에도 사용되고 있다. 연구에 의하면, MF59 adjuvant 와 MERS-CoV S1으로 면역한 hDPP4-transgenic 마우스의 경우, 중화 항체를 생성하였으며 바이러스의 공격을 방어하였다(43). 또한 S1을 발현하는 아데노바이러스로 면역한 랫트의 경우 강한 항체 반응을 유도하였다(44).
융합 단백질(Fusion Protein)
S2 서브 유닛의 FP 도메인은 바이러스의 막 융합에 관여하는데, 이는 바이러스 병원성에 중요한 요소이므로 FP 역시 백신 후보 항원이 될 수 있다(45).
뉴클레오캡시드 단백질(Nucleocapsid Protein, N protein)
N 단백질은 코로나 바이러스에서 가장 많이 존재하는 약 50kDa의 단백질로 일반적으로 변이가 거의 없는 부분이다. N 단백질은 뉴클레오캡시드의 형성하여 바이러스 출아(budding)에 필요한 신호전달, RNA복제 및 mRNA 전사와 같은 기능을 수행한다(46). SARS 환자의 89%에서 N 단백질에 대한 항체를 가지고 있는 것으로 보아 N 단백질은 항원성이 높은 것으로 예측되었다(46). 또한 N 단백질의 경우 in sillico method를 활용한 데이터 분석 시, 중화항체와 T세포 면역반응에 대한 잠재성을 지닌 강력한 항원으로 예측되었다(47).
SARS-CoV의 N 단백질을 암호화하는 DNA 백신이 접종된 C57BL/6 마우스는 강력한 N 특이적인 항체반응 및 세포성 면역반응이 생성되었다(48). 또한, 조류 감염성 기관지염 바이러스(Infectious bronchitis virus)의 N 단백질은 세포독성 림프구(Cytotoxic T lymphocytes)의 유도와 관련이 있으며, 임상 징후의 감소 및 폐 바이러스의 제거와 관계가 있다고 알려져 있다(49). 이는 세포성 면역반응이 N 단백질에 의한 보호효과에 필수적이라는 것을 보여준다. 그러나 이와 대조적으로, 또 다른 연구에서는 N 단백질 면역이 중화항체 반응에 크게 기여하지 않았으며, 햄스터모델에서 바이러스 공격 시 보호효과가 없었다고 보고하였다(50). 최근에는, SARS-CoV, SARS-CoV-2 그리고 MERS-CoV의 N 단백질이 MASP-2 (Mannose associated serine protease)와 결합하여 보체반응을 활성화시킨다는 내용이 보고되었다. 이러한 결과는 백신개발에 있어 N 단백질이 사용될 수 있을지에 대한 논쟁을 불러온다(51).
막 단백질(membrane protein)
막 단백질은 약 25kDa의 분자량을 갖는 막 투과 당 단백질(transmembrane glycoprotein)로, 바이러스 조립에 관여하며 SARS-CoV 표면에서 가장 풍부한 단백질이다(52). 전장(full-length) M 단백질로 면역하였을 때, SARS 환자에서 효율적으로 중화 항체가 유도된다는 것이 보고되었으며, 면역원성 및 구조분석을 통해 M 단백질의 막 횡단 도메인(transmembrane domain)에 강력한 세포 면역 반응을 유도할 수 있는 T 세포 에피토프 클러스터(Epitope cluster)가 포함되어 있음이 밝혀졌다(53). M 단백질은 진화적으로 매우 보존된 형태이므로 백신개발을 위한 후보 항원으로 가능하다(52).
외피 단백질(Envelope protein, E)
S, N 및 M단백질과 비교하여 외피 단백질은 면역원으로 사용하기에 적합하지 않다고 여겨지고 있다. 그 이유는 여러 종류의 코로나바이러스들에서 76~109여개의 아미노산으로 다양하게 존재하며, 면역원성도 낮기 때문이다. 그러나 연구에 따르면 외피 단백질은SARS-CoV에서 주요한 독성 인자로 작용하며, 외피단백질이 없는 경우 염증성 사이토카인인IL-1, TNF, 및IL-6 의 생성이 줄어드는 것이 보고되었다(54).
백신의 종류
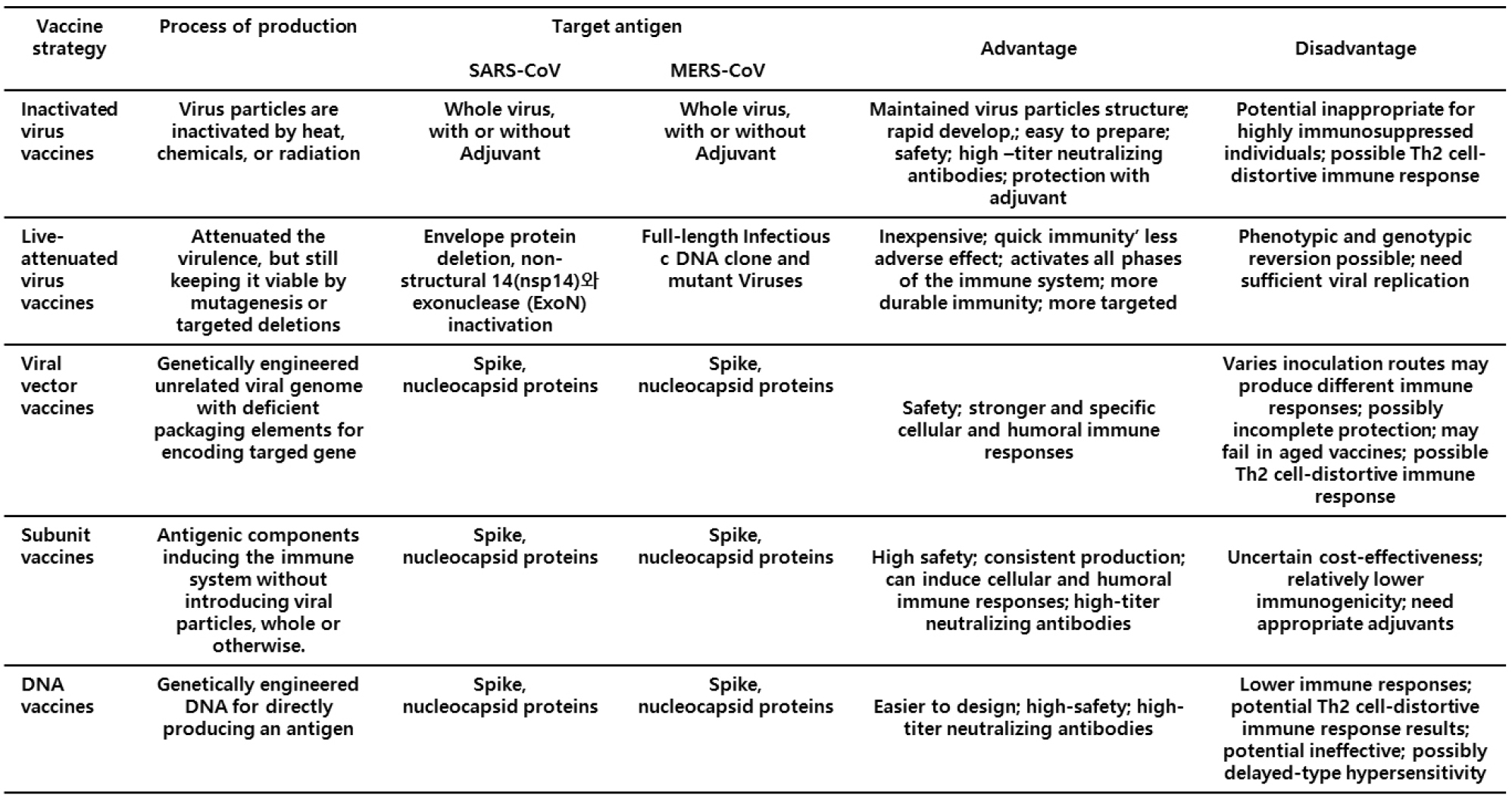
단백질 아단위 백신(Subunit vaccine)
단백질 아백신의 경우 낮은 면역원성에 불구하고도, 현재 이용되고 있는 백신들 사이에서 안전성이 가장 우수한 것으로 알려진 백신이다. 재조합 단백질을 사용한 아단위 백신 개발의 경우 S 단백질이 주요 백신 후보로 연구되고 있다(55). SARS의 S 단백질은 5개의 면역 우성 도메인(immuno-dominant domain)을 가지고 있는데 전체 S 단백질을 이용한 백신은 너무 강력한 면역반응이 유도되거나 antibody- mediated enhancement effect (ADE) 반응을 일으킬 수 있는 위험성이 있는 것으로 보고된 경우가 있어서, 단백질의 일부만을 포함하는 다양한 연구가 진행되고 있다(55). SARS-CoV 및 MERS-CoV 단백질 아백신의 경우에는 주로 S1 및 RBD가 백신 항원으로 이용되었으며, 낮은 면역원성을 높여 주기 위해서 MF59, Alum, AS03, AS04, CpG ODN 등과 같은 면역증강제(adjuvant)를 함께 면역하였다(55), (56).
Inactivated vaccine(불활성화 백신)
불활성화백신은 쉽게 생산할 수 있으며 실제 바이러스 감염 시 면역시스템이 만나게 되는 바이러스 입자와 유사한 항원을 제시한다는 장점이 있다. SARS 환자에서는 적어도 바이러스의 막에 존재하는 8개의 상이한 단백질에 대한 항체가 환자 혈청에서 관찰되는데 S, M 및 E 외에, 4 개의 다른 ORF(3a, 6, 7a 및 7b)가 구조 단백질을 암호화하는 것으로 확인되었다(57). 이는 항체의 타겟이 되는 에피토프 및 단백질이 여러 개임을 의미한다. 불활성화된 SARS-CoV 백신이 접종된 마우스는 S, N, M을 포함한 다수의 단백질에 대한 항체를 생성하였다(58). 그러나 전술한 것처럼 불활성화 백신은 생산 시 생물안전레벨 3 (biosafety level 3) 수준에서 많은 양의 병원체를 생산해야 한다는 단점이 있으며, 모든 바이러스가 성공적으로 불활성화되지 않을 위험성이 존재한다. 다수의 실험실에서 formaldehyde, UV light 또는 β-propiolactone등을 통해 불활성화 된 SARS-CoV 백신을 개발하였으며, 이 연구들을 통해 이들 백신이 SARS-CoV에 대한 중화 항체를 유도한다는 것을 보였었다(59). 그러나 실제 SARS-CoV 감염 후 백신의 효능이 입증된 경우는 드물다. 불활성화 백신은 BALB/c 마우스의 폐에서 SARS-CoV 복제를 억제하는 것으로 보고되었으나, 면역반응에 대한 특성은 발표되지 않았다(59). β-propiolactone으로 불활성화시킨 inactivated SARS-CoV (Tor-2 strain) 백신과 S 또는 N 단백질을 발현하는 아데노바이러스의 조합과 면역원성 및 효능을 마우스 모델에서 비교한 결과, 불활성화 백신은 alum adjuvant의 존재 유무에 관계없이 높은 수준의 중화항체를 유도하고 호흡기관에서 SARS-CoV 감소를 보였다(60).
또한, 면역증강제 없이 포르말린으로 비활성화된 불활성화 SARS-CoV 백신을 족제비에 면역한 결과 항체반응을 유도하고 바이러스 감염 후 바이러스의 조기 제거를 유도하였다. 그러나 공격 시험에서는 경미한 보호효과를 보였다(61). β-propiolactone으로 불활성화된 백신과 S 및 N을 발현하는 아데노바이러스 백신을 페렛모델에서 비교한 결과, 두 백신 모두 중화항체 및 상기도에서 바이러스 증식을 억제하는 것을 보였으며 흉선출혈을 감소시키고 폐렴의 중증도를 완화시켰다. 그러나, 중화항체가가 높음에도 불구하고, 시험된 모든 투여경로에서 바이러스의 공격에 대해 완벽한 보호를 하지 못했다(62). 포름알데히드로 불활성화된 SARS-CoV 백신은 rhesus macaque 원숭이 모델에서 중화항체를 유도하는 것과 안전성이 있음이 확인되었다. 그러나, 대조군으로 PBS가 접종된 원숭이 두 마리 중 하나에서만 바이러스 공격 후 임상적 징후가 나타났기 때문에 불활성화백신의 방어 효과에 대한 증거는 불충분하다(63). 불활성화된 SARS-CoV 백신을 36명의 사람에게 투여한 결과 안전성에 문제가 없으며 SARS-CoV 특이적 중화 항체를 유도할 수 있는 것으로 밝혀졌으나, 그 이후 자연적인 SARS-CoV 감염의 경우가 없었기 때문에 백신의 효능에 대한 자료는 현재 없다(59).
Live attenuated vaccine(약독화 백신)
약독화 백신은 실제 감염과 유사한 면역을 유도하기 때문에, 가장 효과적인 백신 중 하나이다. 약독화 백신은 병원성 유전자가 제거되어 면역반응은 일으킬 수 있으나 독성은 유도하지 않는다. 일반적으로 약독화 백신은 단 회 면역만으로도 충분한 방어능을 가지며, 높은 면역원성을 지니고 있다(64). 그럼에도 불구하고, 병원성 strain으로의 회귀(reversion) 될 위험과 vaccine cold chain이 절대적으로 필요하다는 단점을 가지고 있다. 또한 유아, 면역력이 저하된 사람, 노인들에게는 적절하지 않은 것으로 알려져 있다(64). MERS의 경우에는 구조 유전자 중 외피 단백질 유전자를 결여 시킨 propagation-defective live virus를 이용하여 MERS-CoV 공격으로부터 막아내는 백신 후보 물질에 대한 실험을 수행하였다(63).
Viral vector-based vaccine(바이러스 벡터 유래 백신)
바이러스 벡터 유래 백신의 경우, 단백질 아백신 또는 불활성화 바이러스 백신과 달리 숙주세포에서 면역원성을 일으킬 수 있는 항원을 예측한 후, 항원 후보의 유전자를 다양한 바이러스 벡터에 넣어 세포 내에서 발현시킨 항원을 이용하는 것이다. 따라서 체액성 면역반응뿐만 아니라 세포성 면역 반응까지 모두 활성화 시킬 수 있다는 장점을 가지고 있다(28).
바이러스 벡터 유래 백신에서는 일반적으로 재조합 아데노바이러스(rAd5와 rAd41)와 재조합 벡시니아 바이러스(recombinant MVA), 수포성 구내염 바이러스(vesicular stomatitis virus, VSV), 공수병 바이러스(Rhabdovirus), adeno-associated virus 들을 이용한다. MERS의 경우 rAd5-MERS S1을 면역했을 때 S 단백질 전체를 발현한 rAd5 백신보다 좀 더 높은 중화항체가를 얻을 수 있었다(28). 또한 BALB/c 마우스에 rAd5-S와 재조합 S 단백질을 heterologous prime-boost 면역을 진행한 경우, alum과 함께 재조합 S 단백질을 면역한 경우에 비해 Th1 반응과 Th2 면역 반응이 모두 유도되는 것을 확인하였다(31), (65). 현재 MERS S 유전자를 코딩하는 MVA 바이러스 백신과 MERS-CoV의 S 유전자를 코딩하는 ChAdOX1 (Chimpanzee adenovirus) 등의 백신이 Phase I 임상을 진행 중에 있다(28), (55). rhesus macaque를 SARS-S, N, M 단백질을 코딩하는 아데노바이러스 벡터로 면역한 경우, S에 대한 중화항체를 형성하였으며 N에 대한 T세포 반응을 유도하였다(66). 바이러스 백신 플랫폼은 대량 생산의 가능성을 가지고 있으나 특정 바이러스 벡터에 대한 면역반응이 이미 존재할 가능성이 있고, 이로 인해 면역성이 감소되어질 수 있다. 따라서 이러한 문제들을 초기 임상 시험과정에서 조정해야 한다(28). 최근 SARS-CoV-2 S 단백질을 코딩하는 침팬지 아데노바이러스(ChAdOX1 nCoV-19)를 rhesus macaque에 면역한 뒤 바이러스 공격실험 진행한 경우 ADE 없이 방어 효능을 보이는 것이 보고되었다(67). 또한, 발표된 S 전체를 발현하는 rAd5의 임상 결과에 따르면 1회 면역으로도 28일 후에 중화항체가가 4배 이상 증가한 %는 접종 양에 따라 50-75% 정도를 보여주었으며 T cell 반응도 확인되었다. 이를 통해 Ad5에 대한 중화항체가 이미 존재하여도 S에 대한 중화항체가 유도됨을 증명하였다(68).
Nucleotide vaccine(핵산 백신)
핵산 백신은 항원을 코딩하는 재조합 핵산으로 이루어져 있다. 그 중 DNA 백신의 경우에는 세포로 이를 전달하기 위해 유전자 총이나 전기충격장치를 이용하고 있다. 이러한 DNA 백신의 경우에는 단백질 기반 백신과 달리DNA 백신 자체를 제조하는 데 비용 및 기간이 매우 짧다. 따라서 낮은 생산 단가를 가질 수 있다. 핵산 백신의 주된 타켓 항원 또한 다른 형태의 백신들과 동일하게 S혹은 S1이다(28). MERS의 경우 일부 연구자들은 S 항원 전체를 발현할 경우 ADE 반응에 의한 증상의 악화와 같은 부작용이 유도될 가능성을 우려하여, S1 부분의 DNA만을 면역에 이용하였다(28).
MERS S1 및 S핵산 백신을 마우스와 영장류에 면역한 결과 인터페론 감마(IFN-g)를 생성하는 T세포의 면역을 확인하였고, 체액성 면역반응이 발생한다는 사실도 확인되었다(25). DNA 백신 중 하나인, GLS-5300은 현재 임상 진행 중에 있는 3개의 백신 후보 중 하나이며 현재 Phase I, II 임상 진행 중이다(28).
SARS의 경우, 마우스 모델에서S 단백질을 발현하는 DNA 백신은 T-세포 및 중화 항체 반응을 유도하고 폐에서 SARS-CoV의 복제를 감소시켰다(69). Splice site 및 viral RNA export 시퀀스를 가진 정교한 플라스미드는 마우스 모델에서 S-DNA백신의 효과를 증가시키는 것으로 보고되었으나 다른 동물모델에서는 테스트되지 않았다(59). N단백질DNA 백신으로 접종된 마우스는 N 특이적 항체 및 세포독성 T-림프구 세포를 활성화하였으나, 백신에서 문제가 될 수 있는 지연형 과민반응을 유발하는 것으로 보고되었다(59). DNA 백신은 다양한 장점에도 불구하고 숙주세포의 게놈(genome) 안으로 플라스미드가 중합될 우려가 있다는 본질적인 위험 때문에, 대규모로 DNA 백신을 사용하는 것에 주의가 필요하다. 또한, DNA 백신 단독투여 시, 약독화 생백신보다 면역원성이 낮기 때문에 면역 효율을 높이는 다른 방안을 고려해야만 한다(59).
최근 들어, DNA 백신 이외에 mRNA 백신에 대한 연구가 활발히 이루어지고 있다. mRNA 백신의 경우에는 DNA 백신과 비교하여 여러가지 장점이 있다. 첫째, mRNA 특성상 DNA 백신처럼 전사 과정을 위해 반드시 핵으로 들어가야 할 필요가 없이 세포질 내에서 바로 단백질을 합성하기 때문에, 더 빠르게 합성 과정이 이루어질 수 있고, 숙주 게놈과의 중합이 이루어질 가능성이 없어 DNA 백신에 비해 상대적으로 안전하다. 둘째, 선별 마커인 항생제 저항 유전자가 불필요하고 숙주 세포에 이러한 유전자가 들어가지 않아도 된다. 셋째, DNA에 비해 짧은 반감기로 인해 DNA 백신에 비해서 인체 안전성이 우수하다. 넷째, 뉴클레오사이드의 다양한 변형을 통해서 안정성과 번역율을 높일 수 있으므로, DNA 백신에 비해서 적은 양을 사용할 수 있다. 또한, LNP (lipid nanoparticle)와 같은 전달 매개체에 포장하여 면역할 경우, 세포질 내에서 빠른 흡수 및 발현을 가능하게 할 수 있다. 최근 들어, LNP와 같은 delivery system의 발달도 mRNA 백신의 개발에 있어서 큰 영향을 미치고 있다. 마지막으로 시험관 내 전사 반응을 통해서 쉽게 얻을 수 있기 때문에, 오염의 위험도도 낮으며 소규모의 GMP 시설에서 대용량의 제조가 쉽게 가능하여 매우 빠르게 생산이 가능하다는 장점이 있다. 이러한 다양한 장점에도 불구하고 외부 RNA를 인체에 접종하였을 때 인체의 선천성 면역반응의 과도한 반응으로 인해 염증성 사이토카인이 과도하게 유도 될 수 있고, 생산 단가가 다른 백신에 비해 높을 수 있으며, 대량 생산 설비가 부족하여 공급에 문제가 있을 수 있다(70), (71).
VLP vaccine (virus-like particle vaccine; 바이러스 유사체 백신)
VLP 백신은 self-assembly를 할 수 있는 바이러스의 구조 단백질로 이루어진 백신으로 바이러스의 게놈을 포함하지 않기 때문에 바이러스의 파티클과 유사한 나노 사이즈의 입자를 지니고 있지만, 복제되지 않으며(non-replicative) 따라서 비 감염성(non-infectious)이다. 일반적으로 VLP 백신의 경우 불활성화 바이러스 백신과 유사하지만, 바이러스 비 활성화 과정이 필요 없기 때문에, 생산 절차가 간단하고, 제조 과정에서 낮은 오염 환경을 가질 수 있으면서도 면역시스템에 침입하는 바이러스 입자와 유사한 항원을 제시한다는 장점이 있다. VLP 백신으로는 주로 곤충 세포 유래(Baculovirus insect cell) 발현 시스템을 이용한다. MERS S 단백질을 곤충세포에서 발현한 VLP를 recombinant adenovirus 5와 함께 heterologous prime-boost 면역을 진행하였을 때, Th1 반응과 Th2 면역 반응이 모두 유도되는 것을 확인한 연구 결과도 있다(28).
Nano-particle vaccine(나노 파티클 백신)
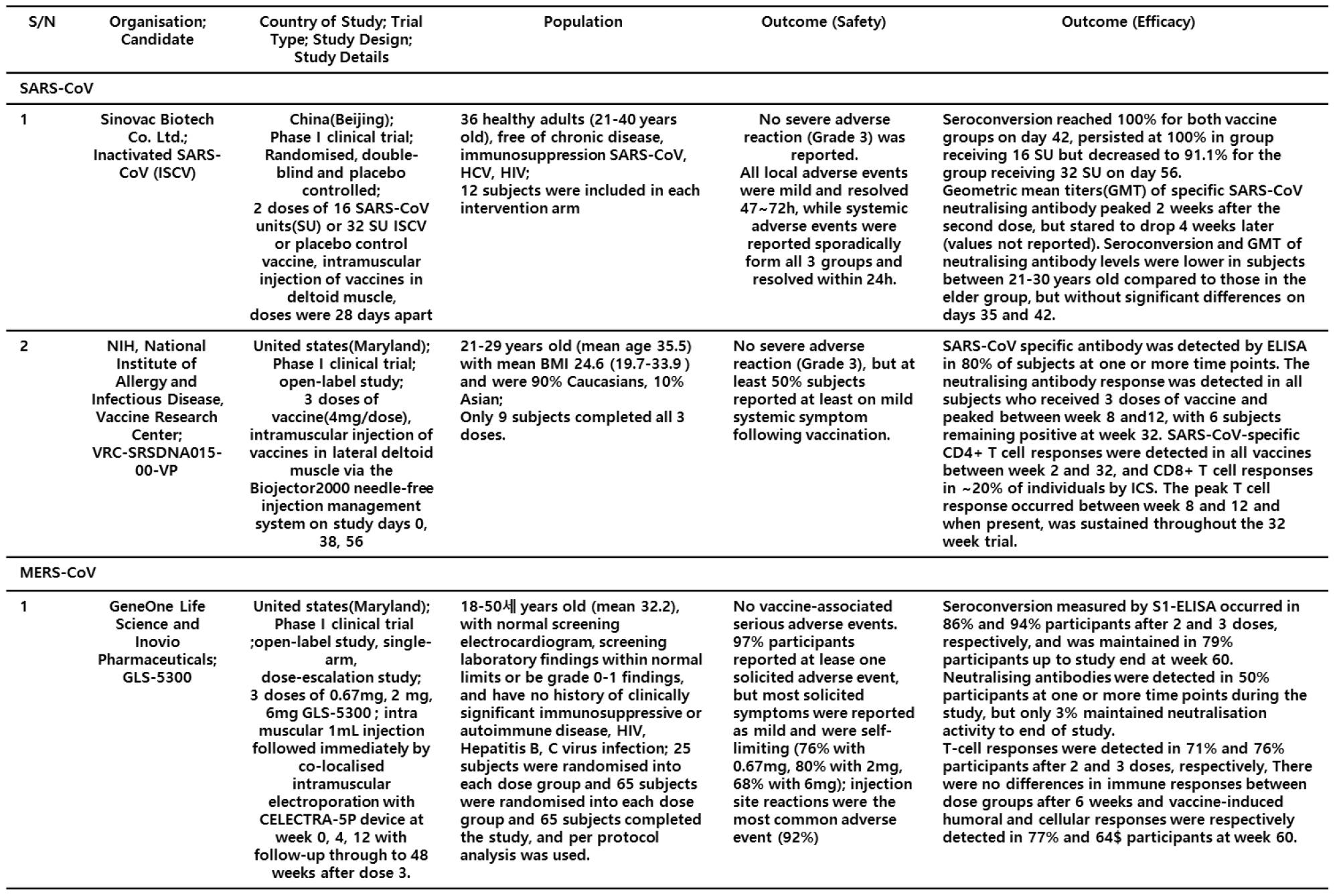
나노 파티클은 개발된 백신의 delivery vehicle로 이용될 수 있다. Baculovirus 곤충 세포에서 얻은 재조합 MERS-CoV의 S 단백질을 포함한 나노 파티클을 마우스에 면역한 경우, 면역증강제 없이도 나노 파티클에 의해서 중화항체가가 낮은 수준이지만 효과적으로 유도됨이 확인되었으며, 면역증강제로 alum이나 matrix M1을 이용할 경우에는 중화항체가가 매우 높게 유도됨이 보고되었다(72), (73). 최근 본 연구실에서도 MERS-CoV S 단백질에서 transmembrane domain을 제거한 나노 단백질과 alum 및 RNA 기반 면역증강제를 함께 면역한 마우스 및 rhesus macaque에서 1회 면역만으로도 높은 중화항체가 생성되고 Th1/Th2 반응이 균형 있게 유도됨을 보고하였다(74). 위에서 언급한 바와 같이 다양한 플랫폼을 이용하여 SARS와 MERS 백신개발에 대한 많은 연구가 진행되었으나(Table 3), 대부분의 연구는 세포 수준 또는 동물 모델 수준에서 실행되었다. 현재까지 진행된 백신 연구 중 4개가 임상1상까지 진행되었다(Table 4)(75).
Go to : 
THE COVID-19 VACCINE DEVELOPMENT LANDSCAPE
세계보건기구(WHO)가 코로나19 감염을 팬더믹으로 선언한 가운데 코로나19 백신 개발이 빠른 속도로 진행되고 있다. 5월 현재까지 임상시험에 들어간 백신 후보는 모두 8개이다(76). 모더나(Moderna)사는 신종 코로나바이러스의 염기서열이 결정된 지 42일만에 표면돌기(spike) S1 단백질을 코딩 하는 mRNA백신 후보 물질인 mRNA-1273을 개발하였으며, 현재 18세에서 55세 사이의 45 명의 건강한 성인을 대상으로 미국 국립 보건원과 함께 안전성 테스트를 위해 임상시험을 진행하고 있다(77). 45명의 피험자는 각기 다른 투여량으로 28일 간격으로 총 3회에 걸쳐 백신을 투여 받았으며, 모더나의 임상 종료 시점은 2021년 9월이다(77), (78). 이들은 최근 중간 발표를 통해 45명을 각각 15명으로 접종 용량으로 구분한 3 그룹에서 우선 각 그룹별로 4명의 중화항체가 결과를 발표하였다. 이들의 보고에 따르면 중화항체가가 잘 유도되었고 심각한 부작용은 관찰되지 않은 것으로 보고 하였으나, 방어 효능은 아직 확인되지 않았으며 각 그룹별로 남은 11명에 대한 중화항체가 결과 역시 발표하지 않았다(79).
단백질 백신이 표적 항원을 세포에서 배양해 생산하고 효과를 평가하는데 반해 모더나의 mRNA백신은 in silico에서 항원을 설계하고 신속하게 개발할 수 있으며, 제조 공정 역시 핵산 백신에서 전술 한 바와 같이 다른 백신 타입에 비하여 빠르다. 또한 모더나의 mRNA 백신은 단일 시설을 사용해 모든 mRNA 백신을 생산할 수 있도록 파이프라인 전체에 걸쳐 일관된 제조공정으로 생산한다는 장점이 있다. 화이자(Pfizer)와 바이오엔텍(BioNtech) 역시 mRNA 백신 플랫폼으로 독일에서의 첫 임상을 진행하고 있다. 바이오엔텍의 백신 후보물질 4개중 2개는 스파이크 단백질(spike protein) 서열을, 2개는 스파이크 단백질에서 최적화된 RBD를 사용하고 있으며, 18~55세 사이의 임상 참여자 200명에게 백신 후보물질을 1ug~100ug의 용량으로 투여해 임상 1/2상을 진행 중이다(77), (78). 바이오엔텍은 이번에 진행하는 임상에서 4개의 백신 후보물질 중 3개에 대해 반복 접종(repeated immunization) 효과를 평가할 계획이다(80).
모더나와 마찬가지로 큐어벡(CureVac) 역시 합성 mRNA를 사용하여 단백질 생산을 진행 중이다. 큐어벡은 비영리 연합인 CEPI (Coalition for Epidemic Preparedness Innovations)로부터 보조금을 지원받아 해당 기술을 활용하여 SARS-CoV-2 백신 개발 연구를 진행 중이며, 몇 달 안에 임상시험 준비가 될 것으로 예상하고 있다(77). 중국의 푸단대 역시 RBD 와 S 단백질을 발현하는 mRNA 백신에 대해서 동물실험을 진행 중이다(77). mRNA 백신은 mRNA를 효과적으로 보호하고 전달하기 위하여 LNP를 필요로 하는데 nanoparticle의 스케일 및 온도 안정성 또한 고려해야 할 요소이다(70). 또한 mRNA를 안전하게 전달하는 LNP의 대량 생산 및 안전성 역시 생산 및 임상 적용에 고려해야만 하는 요소이다.
이노비오(Inovio)는 DNA plasmid를 접종하는 DNA 백신을 개발 중이다. 이노비오의 DNA의약품들은 셀렉트라(Cellectra)라는 특허기기를 통해 최적화된 DNA plasmid를 근육(intramuscular) 또는 피내(intradermal)로 주입할 예정이다. 셀렉트라는 짧은 전기펄스를 사용해 세포의 작은 구멍들을 가역적으로 열고, 세포 내로 들어간 plasmid는 항원을 발현하게 된다. 이노비오의 DNA 플랫폼은 빠른 속도로 생성, 제조할 수 있으며, 보관 및 운송 시 동결이 필요 없는 제품 자체의 안정성을 가지고 있다. 이노비오는 제조업체인 Beijing Advaccine Biotechnology와 파트너 관계를 맺고 건강한 성인을 대상으로 임상 1상을 진행 중이다(80).
그러나 이러한 낙관적 움직임에도 불구하고 DNA및 mRNA 백신은 불확실성이 존재한다. 그 이유는 핵산 백신들에 대한 초기의 임상적 결과만 존재하고 아직까지 상업적으로 개발된 대규모 핵산 백신은 없기 때문이다(81).
중국의 칸시노 바이오로직스(Cansino Biologics)는 중국 군사 의학 연구소와 함께 아데노바이러스 타입 5 (Ad5)을 플랫폼으로 하여 재조합형 백신을 개발하였으며, 현재 건강한 18-60세의 성인을 대상으로 한 임상을 진행하였으며 일부 효과를 보고 하였다(82), (68). 옥스퍼드 대학이 개발한 백신 ChAdOx1 (a recombinant chimpanzee Ad vector) 역시 침팬지 아데노바이러스를 기반으로 한 백신으로 현재 임상 1,2상을 진행 중이며 일부 결과가 발표되었다(30), (83).
휴스턴 소재 Greffex사는Greffex 벡터 플랫폼을 이용하여 SARS-CoV-2 아데노 바이러스 벡터 백신을 만들었으며 현재 동물실험이 진행 중이다(30). 토닉스 제약은 Horsepox Virus (TNX-1800) 플랫폼을 기반으로 백신개발을 진행 중이며 존슨 앤 존슨 역시 AdVac®이라는 아데노바이러스 벡터 플랫폼을 이용하고 있다(30).
S 단백질에 대한 subunit 백신개발 또한 활발히 진행 중이다. 세계 최대 백신제조업체 중 하나인 GSK (GlaxoSmithKline)는 클로버(Clover Biopharmaceuticals)사와 2월에 체결된 기술이전 계약에 따라 독자적인 면역증강제(adjuvant)를 클로버사에 제공할 예정이다(80). 클로버 연구진은 코로나19의 게놈 DNA 서열을 확인하여 바이러스 스파이크(S) 단백질 유전자 합성을 완료하였으며, 포유류 세포배양(mammalian cell-culture) 기반 발현시스템을 이용해 자연상태의 삼합체(Trimer) 스파이크 단백질과 유사한S-트라이머 백신을 생성하였다(84). GSK는 전임상 연구 단계에 있는 S 트라이머 효능의 평가를 위해 판데믹 면역증강제(pandemic adjuvant)를 제공하였다. Novavax는 S 단백질을 기반으로 한 multiple nanoparticle 백신을 개발 중이며 현재 동물모델에서 테스트 중이다. 퀸즈랜드 대학은 S 단백질을 코일 형태로 고정시킬 수 있는 분자 클램프를 이용하여 백신을 개발 중이며, 존슨 앤 존슨, Pasteur Institute, Chongqing Zhifei 역시 subunit 단백질 백신을 개발 중이다(30).
시노팜(Sinopharm)은 우한 생물 제품 연구소(Wuhan institute of biological product)와 베이징 생물 제품 연구소(Beijing Institute of biological product)와 각각 불활성화 백신을 이용하여 임상을 진행하고 있으며, 시노백(Sinovac) 역시 불활성화 백신을 이용하여 임상 1, 2 상을 동시에 진행 중이다(30).
사노피(Sanofi)는 미국 보건 복지부 산하 질병 예방 대응 본부(Office of the Assistant Secretary for Preparedness and Response)의 조직인 생물 의약품첨단연구개발국(Biomedical Advanced Research and Development Authority, BARDA)과 협력하고 BARDA와 오랫동안 유지해 온 파트너십 범위도 확대할 방침이다. 사노피는 SARS-CoV-2의 S 단백질을 발현하는 재조합 DNA 백신을 제작하여 GSK의 면역증강제와 함께 사용할 예정이다. 6개월 이내에 실험실에서 백신 후보를 테스트할 것으로 예상되며 1년~18개월 이내에 임상시험이 가능할 것으로 기대하고 있다. 사노피는 승인까지 최소한 3년은 걸릴 것으로 예상하고 있으며, 이전에 이 기술을 SARS-CoV에 적용한 바 있다고 밝혔다(85).
이 외에도 synthetic peptide 또는 epitope peptide백신에 대한 연구도 진행 중이다. 이러한 형태의 백신은 특정 항원의 단편을 화학적으로 합성하는 방식으로, 준비과정이 쉽고 품질 관리에 용이하다. 그러나 낮은 면역원성으로 인해서 구조 및 전달 시스템 변형과 면역증강제(adjuvant)의 사용이 필요하다(29). 현재 홍콩 과학 기술 대학교 연구원들은SARS-CoV의 S 및 N 단백질에서 B 세포 및 T 세포에 대한 에피토프 세트들을 스크리닝 하고 있다. 이들 에피토프는 SARS-CoV-2에서도 매우 보존된 형태로, 백신개발에 도움이 될 것으로 예상하고 있다. Generex Biotechnology는 Nugenerex immune oncology 와 협력하여 바이러스의 합성 펩타이드를 강력한 면역세포의 활성화를 위해 4-개의 아미노산 Ii-Key에 연결하는 방식을 채택하였다(30).
국내의 COVID-19 예방백신은 SK바이오사이언스, 제넥신, 진원생명과학, GC녹십자, 보령 바이오파마, 스마젠, 지플러스생명과학 등을 중심으로 개발작업이 이루어지고 있다.
SK 바이오사이언스와 GC녹십자는 질병관리본부와 함께 백신개발에 착수하였다. SK바이오사이언스는 subunit 단백질 항원 개발을 진행 중이며, 제넥신사는 DNA 플랫폼을, 진원생명과학은 DNA 및 RNA 플랫폼을 모두 사용하고 있으며, 지플러스 생명과학은 특이하게 식물에 기반한 발현 플랫폼을 이용하여 S 단백질 백신 물질을 개발하겠다고 밝혔다(86).
Go to : 
FACTORS TO CONSIDER WHEN DEVELOPING COVID-19 VACCINE
효과적인 SARS-CoV-2 백신을 개발하기 위해서는 무엇보다 SARS-CoV 및 MERS-CoV의 감염에서 사람 면역 세포들이 어떻게 반응 하였는지에 대한 기초적인 사실을 이해하는 것이 중요하다.
SARS-CoV 특이적인 T cell은 주로 IFN-g, TNF, IL-2를 분비하고 이는 바이러스가 감염되면 Th1 반응이 유도되어 세포성 면역이 주로 일어남을 의미한다. 또한 수지상 세포가 SARS-CoV 펩타이드를 제시하면 바이러스 특이적인 CD4+ 및 CD8+ T cell수가 폐에서 증가하고 생존율이 증가하는 현상을 확인하였다. 이러한 T cell 반응의 중요성에도 불구하고 일부 SARS-CoV백신을 접종한 동물에서 Th2 유도 호산구 침윤 현상이 발생하여 면역 병리학적 손상이 증가하였다. 더구나 백신을 접종한 늙은 마우스에서 방어 효능 보다는 면역병리 손상 현상이 더 많이 나타났다(87), (88).
SARS-CoV가 감염된 환자들은 보통 N 단백질에 대한 B 세포 반응이 먼저 일어난 후 증세가 나타나고 나서 4-8일 안에 S 단백질에 대한 항체가 나타난다. S 단백질에서 유도된 중화항체는 2주 정도에서 나타나기 시작해서 대부분의 환자들이 3주안에는 중화항체를 유도한다. 일부 감염된 사람들은 SARS-CoV-2에 대한 장기 항체를 유도하지 못하는데 그 이유는 아직 불분명하다.
백신이나 치료용 항체를 개발하기 위해서는 반드시 부작용이 발생할 가능성을 염두에 두어야 한다. 특히 이전에 감염된 감기를 유발하는 코로나바이러스에 의해 유도된 항체가 ADE 현상을 통해서 SARS-CoV 감염을 악화시킨다는 보고를 보면 SARS-CoV-2 백신 개발에서도ADE에 대한 검토는 매우 면밀하게 이루어져야만 한다. 더구나 SARS-CoV백신으로 면역한 동물 모델에서 동일한 바이러스로 공격 시험을 하였을 때 S 단백질에 대한 중화항체가 오히려 과도한 염증 반응을 유도하여 폐 조직 손상을 악화 시킨다는 보고도 있다. 또한 SARS-CoV-2 S 단백질에 대한 중화항체의 피크가 일찍 유도된 환자들(평균 14.7일)이 20일 정도에 중화항체 피크를 유도한 사람들 보다 사망률이 높았다. 이러한 관점에서 단순히 S 단백질 전체에 대하여 항체가 높게 유도되는 백신보다는 RBD에서만 중화항체가 낮게 유도되는 백신이 낮은 면역반응으로 인해 100% 방어 효능을 보여주지 못함에도 불구하고 오히려 안전한 백신이 될 가능성도 있다. 이러한 결과들은 결국 SARS-CoV-2에 대한 중화항체의 유도가 우수한 백신의 가장 중요한 기준인 것처럼 되어있는 현재의 백신 개발 전략을 재검토하게 하고 있다.
Go to : 
DISCUSSION
현재까지 코로나바이러스 감염증에 대한 특이적인 치료법은 없으며, SARS 및 MERS는 현재 WHO에 최우선 병원균 목록에 등재되어 있다. COVID-19의 경우 다양한 플랫폼에서 백신 개발이 진행 중이다. 그 중 개발속도 면에서 가장 빠른 것들은 DNA 및 RNA 같은 핵산 기반 플랫폼이며 재조합 subunit 백신이 뒤를 잇고 있다(89). RNA 및 DNA 핵산 백신 플랫폼의 경우 배양 및 fermentation 과정이 없기 때문에 빠른 시간 내에 공정이 이루어질 수 있다는 장점이 있다. 그러나 현재까지 임상에서 승인된 핵산 백신은 없다는 문제점이 있다(81). Next generation sequencing 및 reverse genetics 기술 등의 이용을 통해서 백신 개발의 기간은 단축되고 있으며 현재 SARS-CoV-2 백신 개발에도 활용되어 항원 후보 유전자 선발 및 백신 후보 제작에 활용되었다(89). 현재의 SARS-CoV-2 백신 개발은 임상1상의 진행과 함께 2상이 동시에 준비되는 형태로 매우 빠르게 진행되고 있다. 즉 안정성 및 효능에 대한 검증을 동시에 진행하여 빠르게 상업적 제조가 가능한 수준으로 백신 개발이 이루어 질 수 있다는 것이다(89). 그러나 이러한 방식은 백신이 환자가 아닌 일반인을 대상으로 하기 때문에 안전성이 무엇보다도 중요하다는 개념에 근거하여 볼 때 SARS-CoV-2 백신 개발의 시급성에도 불구하고 대규모 사용 시 예측하지 못했던 위험성이 나타날 가능성 역시 증가한 상황이다. 따라서 이러한 빠른 진행속도와 많은 백신 개발 플랫폼에도 불구하고 SARS-CoV-2 백신 개발에는 아직 해결해야 이슈들이 존재한다. 우선 표면 돌기(Spike) 단백질이 가장 유력한 항원 후보이지만 최상의 면역반응을 유도하기 위해서는 다양한 항원의 디자인이 필요하며 아직까지 전장 단백질로 면역할 것인지 아니면 RBD 만을 이용할 것인지에 대한 논쟁 역시 존재하고 있다. 또한 이전의 SARS와 MERS 백신 후보들의 전임상 결과들을 바탕으로 한 ADE 반응에 의한 증상의 악화와 같은 부작용에 대한 우려 또한 존재한다(90). 불활성화된 SARS-CoV로 면역된 마우스 및 S 단백질을 코딩 하는 MVA로 면역된 rhesus macaque 및 전장 S 단백질을 코딩 하는 DNA 백신으로 면역된 마우스의 경우, 호산구(eosinophil)의 증가와 ADE 반응을 보였었다(88), (91). 따라서 이를 해결하기 위해 적절한 동물모델에서 안전성에 대한 테스트를 면밀이 진행해야 한다. 현재까지는 rhesus macaque, 햄스터, 페렛 등이 COVID-19에 대한 동물 모델로 이용될 수 있다. 또한, SARS와 MERS처럼 획득 면역성에 대한 데이터가 부족하기 때문에 코로나바이러스에 의해 유도되는 면역에 대한 기초 연구가 절실하다. SARS-CoV-2의 자연적 감염에 의한 면역 지속성에 대해서도 현재 확실히 알려진 바가 없으며, 1회 면역으로도 백신이 면역효과를 나타낼 수 있는지 혹은 부스팅 면역이 필요할 지에 대해서도 알지 못한다.
백신개발 과정은 시간이 필요하고 개발 비용 역시 많이 요구되는 분야이다. 2003년 SARS가 세계적으로 유행할 때 여러 국가의 다양한 연구소 및 회사에서 백신개발에 매달렸었다. 그러나 SARS가 사라지고 관심과 재원이 축소되면서 결국 SARS에 대한 백신은 개발되지 못하였고 대부분 전임상 레벨에서 중단되었다. SARS 및 MERS의 백신 개발의 교훈을 토대로 SARS-CoV-2에 의해 발생한 COVID-19 유행이 끝난다고 하여도 다음 코로나 바이러스 유행에 대비하기 위하여 백신 개발에 대한 관심과 노력은 지속되어야 한다.
Go to : 




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download