COVID-19 (Coronavirus Disease 2019)가 세계인의 생활을 바꾸었다. 2019년 12월 중화인민공화국 후베이성, 우한시에서 집단 발생한 COVID-19는 세계 각국에 광범위하게 유행하고 있다[1]. COVID-19의 임상양상, 역학적 특성이 구체적으로 밝혀질 때까지 우리나라에서는 ‘제1급 감염병 신종감염병 증후군’을 적용하여 대응하고 있다[2]. 우리나라의 대응 방향은 1) 조기인지를 통한 발생양상 파악, 2) 신속한 역학조사, 환자 및 접촉자 관리, 환경관리, 3) 예방 교육 홍보 강화로 정의되어 있으며, 구체적인 관리 정책은 감시, 역학조사, 관리, 및 교육ㆍ홍보ㆍ협력이다. 이들의 첫 단추는 환자와 집단 감염의 조기 발견이므로 신속, 정확한 검사를 통한 진단은 매우 중요하다고 하겠다. 이번 포토에세이에서는 신속 진단을 위하여 널리 사용되고 있는 검사 방법, 특히 real-time PCR과 판독에 대하여 학회원들의 이해를 돕고자 한다.
COVID-19의 진단법은 크게 유전자 검사법과 면역학적 방법이 있다. 미국 CDC에서는 유전자 검사법을 viral testing으로, 면역학적 방법은 antibody testing으로 기술하였다(Table 1) [3]. 이에서는 유전자 검사법 양성인 경우 ‘most likely’, 면역학적 방법 양성인 경우 ‘likely’로 COVID-19 감염 진단 유용성을 차등 기술하였다. 즉, viral testing은 현재의 감염 여부를 확인하는 용도이고, antibody testing으로는 과거 감염 이력 확인에 이용할 수 있다.
Table 1
CDC guideline for COVID-19 diagnosis in vitro [3]
| Result | Interpretation | |
|---|---|---|
| Viral testing (testing for current infection) | Positive | Most likely * you DO currently have an active COVID-19 infection and can give the virus to others. |
| Negative | Most likely * you DO NOT currently have an active COVID-19 infection. | |
| Antibody testing (testing for past infection with the virus) | Positive | You likely * have HAD a COVID-19 infection. |
| Negative | You likely * NEVER HAD (or have not yet developed antibodies to) COVID-19 infection. | |
| Both (antibody and viral testing) | Viral Positive, Antibody Positive | Most likely * you DO currently have an active COVID-19 infection and can give the virus to others. |
| Viral Positive, Antibody Negative | Most likely * you DO currently have an active COVID-19 infection and can give the virus to others. | |
| Viral Negative, Antibody Positive | You likely * have HAD and RECOVERED FROM a COVID-19 infection. | |
| Viral Negative, Antibody Negative | You likely * have NEVER HAD a COVID-19 infection. |
국내에서는 진단검사의학회가 질병관리본부와 함께 ‘코로나바이러스감염증-19 검사실 진단 지침’을 발표하였고, 이에서는 유전자 검사법의 적응증과 종류, 긴급 사용 승인 시약, 결과의 판독 및 보고에 대하여 설명하고 있다[4].
소개한 바와 같이, 유전자 검사법으로는 real-time reverse transcriptation PCR이 널리 사용되고 있다. 질병관리본부 감염병 분석센터와 세계보건기구(WHO)의 지침에는 E 유전자를 선별 검사로 포함하고 있으며, 확인 검사로는 ORF1b 유전자의 RdRp 부분 PCR을 권장한다. 임상검체에서 비특이적이고 약한 증폭이 관찰될 수 있으므로, 이 두 유전자가 양성인 경우에만 COVID-19 양성으로 판독하게 된다. 현재는 ORF1a gene과 N gene을 대상으로 한 시약도 긴급사용승인을 받아 사용되고 있으며, 미국에서는 E gene, ORF1a gene, ORF1ab gene, S gene, N gene 등 국내보다 다양한 유전자 부위를 사용한 시약들이 긴급사용승인을 받았다[5].
2020년 5월 18일 현재 질병관리본부 홈페이지에 공고된 COVID-19 체외 진단목적으로 긴급 사용이 승인된 시약은 코젠바이오텍, 씨젠, 솔젠트, 에스디바이오센서, 바이오세움, BioCore사의 것이다[6]. 긴급사용 승인은 신종 감염병 또는 해외유입감염병에 대처하기 위하여 긴급한 사용을 목적으로 신속한 평가 및 심의를 진행하는 제도이므로, 지속적인 질 관리가 필요하며, 자료 및 검체 수집을 통한 양성/음성 검체의 교차 분석을 통한 검사성능 평가가 필요하다.
COVID-19의 확진에는 반복검사가 필요할 수 있다. 특히 상부 호흡기 검체로 시행한 검사에서 음성이더라도, 중증 또는 진행성 경과를 보이는 경우 하부 호흡기 검체를 반복 채취하고 검사하는 것을 추천하고 있다[6].
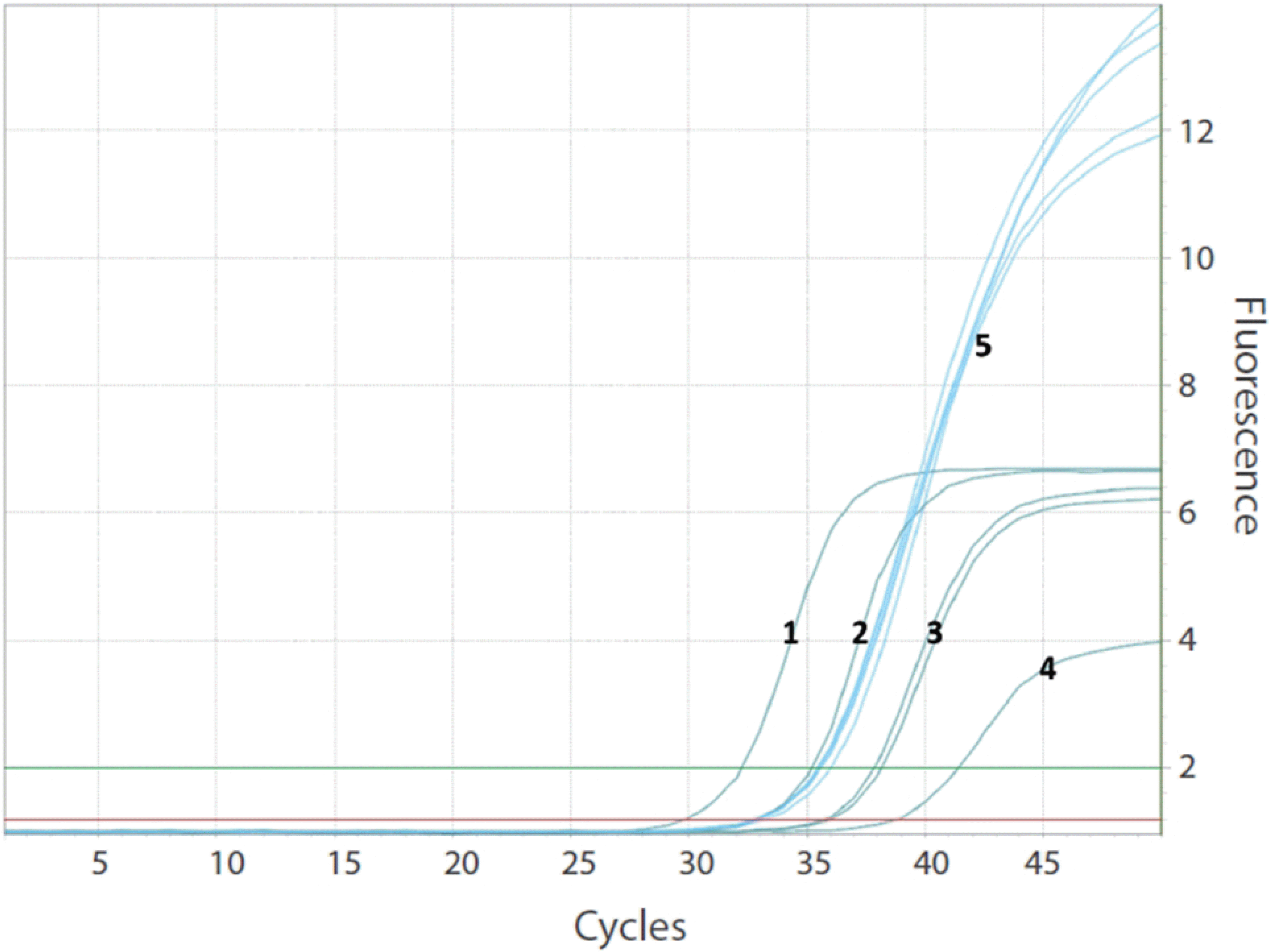
Real-time PCR은 유전자의 특정 표적 부분을 PCR의 원리로 증폭시킨 후 이를 전기영동 없이 실시간으로 측정하는 방법이다. Double strand DNA에 끼어들어가는 사이버그린 등의 intercalator를 이용하는 방법과 형광물질이 결합된 probe를 이용한 방법이 있다. 두 방법 모두 형광 신호를 측정하는데 PCR cycle이 증가함에 따라서 형광 신호가 threshold (역치) 이상으로 증가하는 지점, 즉 threshold cycle (ct) 값을 얻을 수 있다(Fig. 1). 이 ct값과 형광 신호 증가 양상에 따라서 결과를 판독하게 된다[7]. 양성대조물질은 양성, 음성대조물질은 음성 결과를 보여야만 하며, 표적 유전자가 target ct값 이하인 경우 양성으로 판정하게 된다. 양성 및 음성 대조물질의 결과가 예상과 다른 경우는 표적 유전자 결과와 무관하게 부적합(invalid)로 판정하며, 재검이 필요하다. Fig. 1에서 보이는 바와 SARS-CoV-2 real-time PCR 증폭 곡선의 예와 같이 표적 RNA의 초기 농도가 100,000 copies/mL에서 10,000 copies/ml, 1,000 copies/ml, 그리고 100 copies/ml로 감소함에 따라서 ct 값이 반비례하여 34에서 43으로 증가하는 것을 관찰할 수 있다. 이와 같이 calibration 물질을 이용하여 검량곡선을 작성하고, 이를 역으로 대입하여 ct 값에서 초기 표적물질의 농도를 계산할 수 있다. 그러나, 이에는 유전체 추출효율, 초기 검체의 양, PCR 반응 효율 등 다양한 변수가 관여하기에 해석 및 적용에 주의가 필요하다. PCR 반응이 제대로 일어났는지를 보여주는 internal control도 매 반응 tube마다 포함하여야 한다.
COVID-19 바이러스 검출 시기에 대하여는 아직 연구가 진행되고 있다. 접촉력이 분명한 환자에서 상기도 검체 1회의 음성 결과만으로 COVID-19 음성을 진단하기는 어렵다. 임상적으로 가능성이 있는 환자의 경우, 증상이 심해지거나 폐렴소견이 관찰되는 경우는 반복 검체 채취에 이은 재검이 필요하다[4]. 이와 같은 검사실에서의 업무를 이해하여 COVID-19 감염 환자와 집단발생의 조기 발견과 관리에 만전을 기하여야 하겠다.
Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download