Abstract
경피적 신루설치술은 요로폐쇄 시 수신증의 완화뿐만 아니라 요관의 누공과 협착, 경피적 신쇄석술 등 다양한 요로계 질환의 진단 및 치료에 널리 이용되고 있다. 치골상부 방광루 또한 하부요로 폐쇄나 손상, 신경인성방광 등을 가진 환자에 있어서 배뇨를 하는 좋은 방법으로 알려져 있다. 하지만 이들 시술의 빈도가 적지 않음에도 불구하고, 인터벤션 의사가 쉽고 폭넓게 이해할 수 있는 문헌은 많지 않다. 본 종설은 경피적 신루설치술과 치골상부 방광루에 대한 적응증, 해부학적 유의사항, 술기 등을 제공하고, 실제로 직면할 수 있는 문제를 해결하는 방법을 모색함으로써 이러한 시술들이 안전하고 효율적이라는 것을 알리고자 한다.
초록
Percutaneous nephrostomy is widely used for the diagnosis and treatment of various urinary tract diseases, such as ureteral fistula, stenosis, and percutaneous nephrolithotomy, and the relief of urinary obstruction. Suprapubic cystostomy is also known as a good method for bladder drainage in patients with lower urinary tract obstruction or injury and neurogenic bladder. Despite the frequent use of these procedures, reports in the literature are insufficient for an interventional radiologist to understand the procedures easily and thoroughly. In this article, the indication, anatomy, placement, and postoperative management of percutaneous nephrostomy and suprapubic cystostomy have been described, explaining that the procedures are safe and effective.
경피적 신루설치술(percutaneous nephrostomy; 이하 PCN)은 1955년 Goodwin 등(1)에 의해 처음 보고가 되어, 제방향신우조영술(antegrade pyelography) 및 Seldinger technique의 발달에 힘입어 본격적으로 이용되었다. 이후 초음파와 방사선 투시장치 등이 발달하면서, 빠르고 최소 침습적인 인터벤션 시술로서 그 적응증이 확대되었다. 경피적 신루설치술은 요로폐쇄 환자에서 가장 효율적인 초기 치료 방법으로 알려져 있으며, 추가적으로 경피적 결석제거술이나 스텐트 삽입과 같은 복잡한 치료에 선행해서 이루어져 왔다(2). 치골상부 방광루(suprapubic cystostomy)는 노인과 척추손상 등으로 인해 증가하는 추세에 있는 배뇨장애 환자의 치료 방법 중의 하나로 알려져 있다(3). 전통적으로는 Trocar puncture를 이용한 수술적 방법이 주로 행해져 왔으나 최근에는 Seldinger technique을 이용한 카테터 삽입이 이뤄지고 있다(4). 본 연구는 경피적 신루설치술과 치골상부 방광루에 있어서 기본적인 술기에서부터 합병증까지 다양한 측면에서 문헌 고찰을 하고자 한다.
경피적 신루설치술은 투시, 초음파 혹은 전산화단층촬영술(CT) 등의 영상 유도하에 피부와 신실질을 경유하여 신배(renal calyx)를 무균적으로 천자한 후, 유도 철사와 도관을 이용하여 카테터를 신우(renal pelvis) 내에 삽입하는 치료술이다. PCN의 기술적 성공(technical success)은 영상 유도하에서 카테터를 신우 내에 위치시켜 지속적인 요의 배출이 이루어지는 경우로 한다(5).
초기에 PCN은 요로폐쇄에서 일시적인 요로전환을 위해 주로 사용되었다. 하지만 시술의 신속성과 안전성이 높고, 직경이 큰 통로까지도 만들 수 있어서, 그 적응증의 범위가 넓어졌다(Table 1)(67). 가장 흔한 적응증은 주로 요로결석이나 악성종양으로 인한 요로폐쇄이며, 주로 측복부 동통을 동반한다. 요로폐색이 없는 단독수신증(isolated hydronephrosis)은 임신, 과다수액보충, 당뇨, 이뇨제 등과 연관이 있으며 보통 PCN은 시행하지 않는다(5). 이 외에 외상이나 의인성의 요관 손상으로 인한 요누출(urinary leak)이 있을 경우와 골반 내 종양, 염증, 방사선치료 등으로 인한 요루(urinary fistula)가 있을 때, 그리고 심한 출혈성 방광염 등이 있을 때에 요로전환술(urinary diversion)의 목적으로 PCN을 시행한다. PCN은 신장의 기저질환을 치료하는 데 필요한 경로를 확보할 때도 필요하다. 예를 들어, 요로결석 치료를 위한 경피적 신쇄석술(percutaneous nephrolithotomy; 이하 PNL), 요관협착의 치료를 위한 확장술이나 요관스텐트 설치술, 요루의 치료를 위한 요관폐색 등을 하기 위하여 PCN을 시술한다. 화농신장(pyonephrosis)을 동반한 요로폐쇄나 급성신부전을 동반한 수신증의 경우 응급 PCN의 적응증이 될 수 있다. 화농신장의 경우 패혈증으로 급격하게 진행할 위험성이 있고, 급성신부전을 동반한 요로폐쇄의 경우 고칼륨혈증 등이 동반되어 생명을 위협할 수 있기 때문이다(8).
절대적 금기사항은 심한 응고장애가 있는 경우로서 국제표준화비율(International Normalized Ratio)이 1.5를 초과하거나 혈소판수가 50000/cm3 미만일 경우로, 시술상 주의를 요한다. 대개 혈소판 수혈 등으로 교정 후 시술하고, 가능하면 시술 전에 항혈소판제나 항응고제를 5일 이상 중단 후 시술하는 것이 좋다(9). 상대적 금기사항으로 심각한 고칼륨혈증(> 7 mEq/L)과 같은 전해질불균형은 시술 전에 투석으로 교정하는 것이 좋으며, 수축기 혈압은 180 mm Hg 이하로 유지하는 것이 바람직하다. 드물지만 접근경로에 대장, 비장, 간 등이 위치하는 경우 주의를 요한다. 패혈증의 경우 원인이 화농신장이라면 시술 전에 항생제를 사용하고 최소한의 조작으로 시행하여야한다. 임산부의 경우 방사선 노출로 인한 태아에 대한 위험성과 시술의 필요성을 비교하여 결정해야 할 것이다(Table 2).
시술의 이유, 진정제 및 마취제의 사용, 시술 시 발생 가능한 합병증(출혈, 요누출, 패혈증, 사망)이 포함된 동의서를 받아야 한다. 시술 전 최소 4시간 이상 금식을 요하며 영상 및 병리 검사 결과를 확인한다. 또한 혈소판을 포함하는 일반혈액검사와 응고검사 결과를 확인하여야 하고, 비정상적인 경우에는 시술 전에 신선냉동혈장이나 혈소판 수혈을 통하여 출혈 위험성을 줄이도록 한다. 환자의 안정과 통증 완화를 위하여 fentanyl 25~50 µg과 midazolam 0.5~1 mg을 사용할 수 있다(8). 조영제에 알레르기가 있는 경우 시술 1시간 전에 경구 또는 정맥 내 스테로이드의 투여가 필요하다. 이미 요로감염이 있거나, 감염의 위험인자[예: 고령, 당뇨, 방광기능이상, 결석, 유치카테터(indwelling catheter), 요관장관 도관(ureterointestinal conduits)]가 존재하는 경우에는 예방적 항생제를 투여하는 게 좋다. 일반적인 예방적 항생제요법으로 1) 1 g cephazolin IV, 2) 1 g ceftriaxone IV, 3) 1.5~3 g ampicillin/sulbactam IV, 4) 2 g ampicillin with 1.5 mg/kg gentamicin IV, 5) penicillin에 알레르기반응이 있을 시 vancomycin or clindamycin and aminoglycoside가 있다(510). 진균류 감염이 의심되면 시술 전에 항진균제를 투여한다. 시술하는 동안 혈압 측정과 맥박산소측정으로 환자를 감시하며, 기타 활력징후들을 확인한다. 가능하면, 잠재적 합병증을 피하기 위해 시술 전 초음파 또는 CT를 확인해야 한다.
신장은 후복막강에서 대략 12번째 흉추와 2~3번째 요추 사이에 위치하고, 12번째 늑골이 비스듬하게 상부에 걸쳐 있다. PCN을 할 때 주의해야 할 인접장기로는 폐, 늑막, 간, 비장, 좌우측 결장이 있다. 경피적 경로로서 가장 안전한 부위는 척추 옆 근육(paraspinal muscle)의 외측 경계이다. 그보다 내측으로 접근 시 척추 옆 근육을 관통하게 되어 경로확장이 어렵고 통증을 유발할 수 있으며, 너무 외측으로 접근 시 대장 천공의 위험이 증가한다. 12번 늑골의 상부에서 천자할 때에는 늑막이나 폐에 손상을 줄 수 있으며, 신장 상부 천자의 경우 간 및 비장 손상에도 주의해야 한다(1112).
대동맥에서 나온 신동맥은 크게 앞가지와 뒤가지로 나뉘며, 앞가지는 다시 4개의 위, 위앞, 아래 앞, 아래 분절동맥(segmental artery)으로 나누어지고, 뒤가지는 후분절동맥으로 나뉘고 다시 8~12개의 엽간동맥 (interlobar artery)으로 분지 되며 신장수질과 피질 경계면에서 궁상동맥(arcuate artery)으로 분지 되어 피질로 들어간다(Fig. 1). 신동맥과 그 분지는 모두 단동맥(end arteries)이고, 서로 교통이 없다. 앞가지는 신장의 75% 이상 부위의 혈류를 공급하고 뒤가지는 신후면의 중부에만 혈류를 공급한다. 신장에 정중선의 후외측으로 30~45° 각도에 신동맥의 앞쪽과 뒤쪽 구획 분지들이 만나는 분수령 구역(watershed zone)이 있는데 이를 Brodel's avascular zone이라 하며, 이곳을 통과하여 후방 신배(posterior calyx)를 겨냥하면 PCN의 출혈 합병증을 줄일 수 있다(13). 엽간 동맥이 소신배의 누두부(infundibulum) 옆으로 지나거나 가로질러 지나므로 천자 시 바늘이 가능한 한 소신배의 원위부 끝인 원개(fornix)를 end-on puncture 하도록 해야 한다(Fig. 2). 천자의 위치에 대해서 고려를 해보았을 때, 일반적인 경피적 신루설치술에서는 하부 신배를 천자한다. 신장의 상부 신배를 통해 경피적 신루설치술을 시행할 경우, 출혈, 기흉, 호흡에 의한 카테터 빠짐이 발생할 수 있고 천자할 위치에 늑골이 위치하고 있으므로 천자 시에 늑간 동맥이나 신경의 손상을 줄 수도 있으므로 특별한 경우가 아니면 피하는 것이 좋다(14). PCN 후 신우 및 요관병변에 대한 순차적 시술(예: 요관 스텐트)이 필요한 경우에는 중부 신배를 천자하여 PCN을 시행하면 저항을 적게 받는 완만한 각도로 할 수 있어 추가적인 시술이 용이하다(Fig. 3) (2).
환자를 투시장치의 침대에 복와위로 눕힌다. 시술 이전에 촬영한 영상을 참고하거나 초음파를 통해서 해부학적 위치에 맞춰 천자할 부위를 선택하고, 보통 늑골하 접근으로 후방 신배를 천자하는 게 좋다(814). 천자 부위의 피부와 피하조직을 1~2% 리도카인(lidocaine)으로 국소마취하고, 11번 scalpel로 피부를 절개한다. 21~22G 천자바늘(Chiba needle)로 신장의 시상면으로부터 25~30° 각도에서 천자하거나 시술하는 쪽으로 환자를 25~30° 정도 돌려 엎드리게 한 후, 신장의 후방에 수직으로 천자한다. 만일 부적절한 위치에 천자되면 첫 번째 천자바늘에 조영제를 주입하여 신우배계(pelvocalyceal system)를 잘 보이게 한 후, 두 번째 천자바늘을 이용하여 적절한 위치에 천자를 시도할 수도 있다. 천자바늘이 신장의 후하방 소신배로 관통된 후 요가 배출되는 것을 확인한 후 소량의 소변을 검체로 확보한다. 0.018 inch 유도철사를 천자바늘을 통해서 넣고, 이후 경피적 접근기구(percutaneous access system: Neff, Cook, Bloomington, IN, USA 혹은 3S, Dukwoo Medical, Hwaseong, Korea)를 이용하여 통로를 확보한다. 이후 경피적 접근기구의 집(sheath)만 신우 내에 위치시킨 후 친수성 유도철사(0.035 inch)의 끝이 요관이나 다른 확장된 신배 내에 오게 삽입한다. 이후 카테터의 직경에 따라 순차적으로 더 큰 직경의 확장기를 이용하여 통로를 확장을 시킨다. 카테터 내의 metal cannula는 신배를 지나는 부위까지만 전진시키고 카테터만 유도철사를 따라 신우 내에 위치시킨다. 요의 배출을 위해서는 직경이 8~10 Fr인 카테터로 충분하지만, 감염된 요의 배출 또는 시술 중 합병된 혈뇨가 있는 경우에는 직경이 12~14 Fr인 굵은 카테터가 필요할 수 있다(615). 카테터의 끝을 고정시키기 위해 카테터의 허브(hub) 부위에서 실을 당겨 끝을 돼지꼬리 모양으로 만든다. 카테터는 봉합사나 여러 종류의 고정기구를 이용하여 고정한다. 요로감염이 의심되는 경우 조영제를 주입하기 전에 더 많은 양의 소변을 흡인 후, 신우배의 과도한 팽창을 하지 않게 조영제를 주입하여야 패혈증을 예방할 수 있다. 게다가 감염이 의심되거나 PCN 후 심한 혈뇨가 있는 경우는 추가적인 비뇨기과 시술은 하지 않는 게 좋으며, 카테터를 통한 조영술 및 추가 시술은 24~48 시간 후에 시행하는 것이 좋다.
주요 합병증 중 출혈은 약 1~4% 정도에서 발생하며, 사망률은 0.2% 이내이다(522). 경미한 혈뇨는 정상적인 PCN 이후에도 흔하게 관찰되나, 드물게 수혈이 필요한 동맥 손상, 가성동맥류, 동정맥루(arteriovenous fistula)가 발생하기도 한다. 일반적인 PCN의 경우보다 더 큰 관이 필요한 경피적 신쇄석술(PNL)을 병행할 경우 심한 출혈의 빈도가 증가한다(23). 일시적인 혈뇨는 시술 후 1~2일 내에 소실되고 카테터 자체의 tamponade 효과가 있어 경과 관찰을 하지만 지속적 출혈이 의심되고 혈역학적으로 불안정한 환자는 신혈관조영술을 통한 색전술이 도움이 될 수 있다(Fig. 4) (24). 다른 중요한 합병증은 패혈증으로 1~2.5%의 빈도를 보이지만, 화농신증이 동반된 경우 그 빈도가 25%까지 증가한다(62325). 따라서 패혈증의 위험이 있는 환자에게 PCN을 시행하기 전에 예방적 항생제를 투여하고, 시술 시에는 희석된 조영제를 사용하기 전에 신장의 집합계(collecting system)를 감압해야 하며, 유도철사와 카테터를 과도하게 조작하지 않는 것이 좋다. 기흉, 흉수, 혈흉 등의 흉막 합병증의 경우 0.1~0.3% 정도 보고되며, 주로 12번째 늑골의 상부로 접근하거나 신장의 상부 신배를 통해 경피적 경로를 만들었을 때 발생할 수 있고, 합병증이 발생한 흉곽에 흉관을 삽입하여 치료한다(2627). 정상적으로 결장은 신장의 외측에 위치하지만 일부에서 복와위를 자세를 취할 경우 결장이 내측으로 이동하여 PCN 시 천공의 위험이 높아진다. 후방 액와위선의 내측으로 접근하는 게 바람직하며, 필요시 상부 신배의 천자를 고려해볼 수 있다. 대부분의 결장 손상은 배액관을 유지하면서 보존적 치료가 가능하나 수술적 치료가 필요할 수 있다(2829). 카테터 빠짐(catheter dislodgement)은 1~2%에서 첫 1개월 내에 배액관이 빠지는 경우가 발생하며, 배액관이 상당 기간 유지되어 있었던 경우라면 카테터가 빠졌더라도 기존의 통로를 따라 0.035 inch 유도철사와 Kumpe 카테터(Cook)를 이용하면 다시 새로운 관을 삽입할 수 있으므로, 카테터가 빠진 환자는 가능한 한 빨리 인터벤션 시술실로 옮겨 기존의 통로를 확인해야 한다(30). 보통 수일 내에 카테터가 빠진 경우 기존의 경피적 통로를 찾기 힘들어 새로 경피적 신루설치술을 시행해야 한다. 보고에 의하면 카테터가 빠진 후 48시간 내에 재삽입을 시도할 경우 88% 정도의 성공률을 보였다고 한다(31). 카테터 폐쇄의 경우는 주로 Crystalline urine 환자 혹은 카테터가 잘 관리되지 못한 환자에서 발생하는데, 식염수로 세척하거나 조영제를 밀어 넣어 카테터를 뚫거나 카테터 안으로 유도철사를 밀어 넣어 막힌 부분을 뚫고 새로운 카테터로 교체도 가능하다. 유도철사로 카테터를 뚫을 수 없는 경우 peel-away sheath를 막힌 카테터를 따라 삽입 후 새로운 카테터를 삽입하거나, 카테터 옆으로 유도철사를 삽입하여 신우에 위치시키고 기존 관을 제거한 후 새 카테터를 삽입할 수도 있다(Fig. 5) (32).
신장 이식 후 10%에서 요관 폐쇄, 요누출과 같은 비뇨기계 합병증을 일으킬 수 있는데, 이 경우에 PCN을 시행한다(3334). 신장 이식 수술 직후에 요로폐쇄가 나타날 수 있는데, 이는 대부분 요관방광이음부(ureterovesical junction)의 부종으로 인한 것이다. 이러한 부종의 원인으로는 부적절한 수술 방법과 관련이 있거나, 수술 후 허혈로 인한 섬유화 또는 이식 거부에 따른 혈관염에 의해 발생할 수 있다(35). 전향적 신장조영술에서 심하게 좁고, 점점 가늘어지고, 무연동을 보일 경우 부분적 폐쇄를 의심할 수 있다(36). 이식된 신장은 주로 하복부에 위치하며, 정상적인 경우보다 피부 쪽에 더 가깝게 위치하기 때문에 PCN이 더 수월하다. 전방외측 신배를 천자해야 하며, 소장을 포함한 복막강 내 구조물을 천자할 수 있기 때문에 주의를 요한다(Fig. 6). 따라서 신이식술 시에 생긴 피부봉합선의 외측에서 접근하여 중간 또는 상부 신배를 천자하는 것이 도움이 된다. 초음파 유도하에 21–22G 바늘로 천자하고 유도철사가 원하는 위치에 들어가게 되면, 이후의 과정은 일반적인 과정과 동일하며, 기술적 성공률도 100%까지 보고된다(3738)
수술 이후 발생한 요관 누출, 요루, 비폐쇄성 결석 등과 같은 경우 신우배계의 확장이 없이 PCN을 시행해야 한다. 이런 경우 기술적으로 몇 가지 방법이 있다. Single-stick technique으로 시행할 경우 초음파 유도하에 신우를 향해 22G 천자바늘을 삽입하고, 이때 가능하면 천자바늘이 신장 피라미드(renal pyramid)의 중심과 소신배로 생각되는 부위를 통과하도록 하여 주위 조직의 손상을 최소화하도록 한다. 이후 소량의 조영제를 주입하여 적절한 위치에 천자가 되었는지를 확인한다. 초음파로 신배의 구분이 어려울 경우 furosemide와 같은 이뇨제를 주입하여 시술의 성공률을 높일 수 있다(39). 이 외에 확장되지 않은 신우배계에서 double-stick technique이 도움이 될 수 있다(Fig. 7) (17). 보통 신기능이 정상인 경우가 많기 때문에, 먼저 50~100 cc의 조영제를 정맥주사하여 신우배계에 조영제가 나타나면 투시 유도하에 22G 천자바늘로 조영된 신우를 향해 천자한다. 만약 신부전으로 조영제를 정맥 투여할 수 없다면 초음파 유도하에 신우를 천자할 수 있다. 천자바늘을 통해 신우배계를 조영제로 적절히 팽창시키고 후방 신배를 확인하기 위해 음성조영제(공기나 이산화탄소)를 주입할 수도 있다. 유도철사를 원하는 곳에 위치시킨 이후의 과정은 일반적인 과정과 동일하다. PCN만을 위해서는 중부나 하부 신배 어디를 천자해도 상관없지만 요관 누출과 같이 Double J 스텐트를 설치해야 하는 경우에는 중부 신배를 천자하는 것이 좋다.
CT 유도하 PCN은 보통 standard PCN이 어려운 경우에 시행한다. 예를 들면, 마제신(horseshoe kidney)이나 회전이상 혹은 형성이상신(malrotated/dysplastic kidneys)과 같은 해부학적 변이가 있는 경우, 심한 척추측후만증(kyphoscoliosis)을 가진 환자에서 신장과 다른 중요 장기와의 관계를 알 수 없는 경우, 신배가 확장되지 않은 경우나 환자가 심한 비만인 경우에 시행된다(40). 이때 초음파나 투시 유도로는 신장에 천자할 위치를 찾거나 다른 장기(특히 대장)의 손상을 피하는 것이 어려울 수 있다. 다만, CT 유도하 접근은 비용이 비싸고 환자에게 방사선 피폭이 높으므로 제한된 적응에서 시행해야 한다(41). 먼저 환자를 CT 테이블에 엎드려 복와위를 취한다. 만약 심폐기능이 좋지 않아 호흡곤란이 있는 환자는 배와위로도 가능하다(42). 조영 전 CT를 촬영한 후 주위 장기와의 관계를 확인하고 CT 유도하에 신배를 천자한다. 이때 위치를 확인하기 위해 CT를 반복적으로 시행할 수 있다. 천자바늘이 신배로 들어가면 소변이 나오는 것을 볼 수 있으나, 비폐쇄성 또는 늘어나지 않은 집합계인 경우에는 소량의 조영제를 주입하여 천자바늘의 위치를 확인할 수 있다. 이후 CT 촬영실에서 PCN을 시행할 수도 있고(43), 투시방으로 환자를 옮겨서 투시 유도하에 시행할 수도 있다. 환자를 투시방에 옮기기 전에 0.018 inch 유도철사를 천자바늘 안에 밀어 넣으면 안전하게 환자를 옮길 수 있다. 이후 과정은 일반적인 과정과 동일하다. 요즘은 투시장치의 C-arm CT를 이용하여 환자를 옮기지 않고 시행할 수도 있다(44).
신석의 치료는 여러 가지 방법[자연배출, 관혈적 수술, 체외충격파 쇄석술(extracorporeal shock wave lithotripsy; 이하 ESWL), PNL 등]으로 발달되어 왔다. PNL은 ESWL에 비해 침습적이지만 요석 제거율이 높고 치료기간이 짧아 자주 이용된다. 일반적인 PNL의 적응증으로는 결석이 클 때(≥ 2 cm 이상), ESWL에 반응하지 않는 신녹각석이나 신우결석, ESWL이나 요관경으로 치료가 실패한 경우, cystine으로 이루어져 파쇄하기 힘든 결석, 요석하부의 요로가 좁아진 경우에 요석제거와 동시에 협착부위를 확장하는 치료가 필요할 때, 신하극부의 신석(≥ 1.5 cm) 등이다(45). PCN은 급성기 요로폐쇄를 해결하는 동시에 PNL을 하기 위한 통로를 만드는 역할을 한다. 이때 결석의 수와 위치에 따라 천자부위를 정하는 것이 가장 중요한 일이다. 천자부위는 통상적으로 신우, 상부 및 하부 신배의 요석은 하부 신배를 천자하고, 중부 신배나 누두협착이 동반되어 고립된 신배 내에 요석이 있으면 직접 천자하는 것이 좋다. 상부요관석은 상부나 중부 신배를 통해 접근하는 것이 바람직하지만 기흉, 수흉을 조심하여야 한다. 대개 PCN을 하고 1~2일 후에 PNL을 시행하며 유도철사를 따라 30 Fr까지 경로를 확장하게 된다. PNL 시행 후 amplatz sheath 제거 시 대량 출혈이 발생할 수 있는데 이 경우 굵은 관을 유지하면 지혈된다. 만약 지연성으로 가성동맥류나 동정맥루가 발생 시 색전술이 필요할 수 있다(4647)
치골상부도관(suprapubic catheterization)은 치골 결합(pubic symphysis) 위를 통해 방광 안으로 카테터를 위치시키는 것을 말한다. 주로 요도를 통해서 카테터를 거치할 수 없거나 금기인 경우에 급성 요저류의 해소를 위한 치료로 이용된다(48)
치골상부 방광루설치술의 적응증으로 가장 흔하게는 양성 또는 악성 전립선 질환과 신경인성 방광 기능부전에 의해 2차적으로 방광출구 폐쇄가 있는 경우이다. 그 외에도 요로 손상, 방사선치료 관련 방광염, 방광-대장 누공 또는 방광-질 누공이 있는 경우, 요실금, 부인과 수술 후 회복 중인 환자, 화농성방광염으로 배액이 필요한 환자 등에서도 유용하다. 상대적 금기증으로는 혈액응고병증, 이전의 하복부 및 골반 수술로 인한 광범위한 흉터 조직, 병적인 비만, 방광이 충분히 팽창되지 않아 소장이 손상이 우려되는 경우, 방광암, 치골상부 피부감염이나 치골의 골수염 등이 있다(484950).
방광은 소변을 저장하고 배출하기 위한 구형의 장기로 용적이 보통 300~500 mL이다. 방광은 fundus, body, apex, neck으로 나뉘며, 치골 뒤쪽의 복막외공간에 위치한다. 복막이 방광의 천장을 덮고 있고 방광의 앞쪽과 치골 후면 사이에 복막외공간의 일부인 space of Retzius가 위치한다. 남성에서는 방광의 뒤쪽에 직장, 아래쪽에 전립선, 후하방에 정낭이 위치하며, 여성에서는 방광의 뒤쪽에 자궁과 질이 위치한다(50). 치골 위의 복벽은 가운데 백색선(linea alba)과 옆으로 복직근(rectus abdominis muscle)으로 구성된다. 활꼴선(arcuate line) 아래로 외복사근(external oblique muscle), 내복사근(internal oblique muscle), 복횡근(transverse abdominis muscle)의 건막(aponeurosis)이 복직근의 앞으로 지나간다. 이는 보통 방광의 천장에 접근하는 경로에 포함된다(Fig. 8). 치골상부 방광루설치술을 위한 방광천자 시에 치골결합의 상방 2~3 cm 위 또는 손가락 2개 정도 위에서 접근하고, 방광의 전벽의 중간과 하방 1/3의 경계에서 접근을 하는데, 이는 방광삼각(bladder trigone) 부위를 자극했을 때 발생하는 방광의 경련을 피해서 안전하게 방광을 천자하기 위해서이다(51). 그리고 천자할 때는 복벽의 정중선이나 약간 정중선 옆으로 접근하게 되는데 이는 복직근의 가장자리를 따라 주행하는 하복벽동맥에 손상을 주는 것을 피하기 위해서이다. 이전에 하복부 수술의 기왕력이 있거나 방광이 충분히 늘어나지 않는 경우에는 초음파 유도 하에 치골상부 복벽과 방광 사이에 위치하는 장과 같은 인접장기를 피해서 천자를 하는 것도 중요하다(52).
치골상부 방광루설치술은 Trocar technique으로도 할 수 있지만 인터벤션 의사들은 주로 초음파와 투시 유도하에 Seldinger technique으로 시행한다(Fig. 9) (51). 시술 전에 혈액응고장애를 교정하고 요도카테터를 설치한다. 시술 직전에 정맥을 통해 예방적 항생제를 주입하는 것은 패혈증의 빈도를 감소시키며(53), 필요시 진정제를 투여할 수 있다. 우선 방광을 150~500 mL 정도의 희석된 조영제로 채우게 되는데, 요도를 통해 풍선카테터가 삽입되어 있다면 이를 통해서 채우고, 그렇지 않다면 방광으로 천자된 침을 통해서 채운다. 시술할 부위를 멸균 도포 후 천자 부위에 국소마취를 하고 11번 scalpel을 이용하여 천자할 부위에 5~10 mm 정도 피부절개를 한다. 초음파 유도하에 치골상부 2~3 cm 위에서 정중선이나 그 바로 옆으로 접근하여, 방광을 향하여 수직으로 또는 다리방향으로 약간 기울여 방광을 천자한다. 이때 치골상부 정중선에 수술 흉터가 광범위하게 있다면 더 옆쪽으로 이동하여 천자를 하고, 전립선이 큰 경우에는 위쪽으로 이동하여 천자를 시행한다. 천자바늘은 18~22G를 사용할 수 있으며, 18~19G의 천자바늘의 경우 0.035 inch 유도철사를 바로 삽입이 가능하나, 20~22G의 천자바늘의 경우 0.018 inch 유도철사를 사용해야 한다. 20~22G 천자바늘집(needle sheath)을 통해서 0.035 inch stiff wire가 방광 안에서 말리도록 밀어넣는다. 이후 0.035 inch stiff wire를 따라 순차적으로 확장기를 넣어서 카테터가 들어가는 진입로를 확장한다. 급성요로폐쇄의 경우 8~10 Fr 크기의 돼지꼬리 카테터(pigtail catheter)로도 충분하지만, 장기간 도뇨를 해야 하는 경우에는 16 Fr 이상의 큰 직경의 풍선카테터를 사용해야 카테터 빠짐이나 막힘 등을 예방할 수 있다. 이때는 풍선카테터보다 2 Fr가 더 큰 peel-away sheath를 위치시킨 후, sheath 내의 확장기를 제거하고 이를 통해 방광 안으로 풍선카테터를 넣는다. 생리식염수로 풍선카테터의 풍선을 확장시키고, peel-away sheath를 제거하고 풍선카테터를 당겨서 방광 앞쪽 벽에 밀착시킨다. 비만이거나 광범위한 흉터 조직이 있는 경우에는 처음부터 큰 카테터를 넣는 것은 힘들지만, 단계적으로 두 번의 시술을 통하여 가능하다(51).
보고된 시술의 성공률은 100%이다(4954). 시술과 관련하여 발생 가능한 합병증으로는 혈뇨, 장천공, 요로감염 등이 있을 수 있다. 혈뇨의 경우에는 대개 일시적으로 나타나지만, 요도를 통해서 출혈이 있고 카테터로 소변이 나오지 않으면 카테터 끝이 요도에 박혀 있을 가능성이 있어 즉시 풍선카테터의 풍선을 감압해야 한다. 장천공은 하복부 수술의 기왕력이 있는 환자에서 유착으로 인해 위험도가 높은 것으로 알려져 있다(55). 요로감염의 경우 치골상부 방광루와 요도카테터를 가진 환자를 비교하였을 때 그 발생 빈도가 차이가 없었고(56), 척추손상 환자의 장기간 추적관찰에서 93–98%에서 증상을 동반한 요로감염이 발생하였다(57). 삽입 부위의 연조직염이나 증상이 있는 요로감염의 경우 항생제 치료가 필요하지만, 카테터 삽입부에 초록색의 분비물은 포도상구균의 증식으로 인한 것으로 특별히 치료를 요하지 않는다. 장기적으로 카테터를 거치하는 경우에는 방광 결석이 18~65%의 빈도로 발생하며 이로 인해 카테터가 자주 막히게 된다, 그 이유는 제한된 신체운동으로 인한 요저류, 요감염과 요소분해균의 증가로 인한 요산도의 알칼리성화가 침전을 조장하기 때문이다. 따라서 반복적으로 카테터가 막히는 경우 방광경으로 방광결석의 유무를 확인하는 것이 필요하다. 또 다른 장기 합병증으로 방광의 편평상피세포암이 있는데, 이는 카테터에 의한 만성적인 자극과 염증으로 인해 2.3~10%까지 발생하는 것으로 보고된다(58). 이러한 고위험 환자에 대해서는 매년 선별적 방광경(screening cystoscopy)을 시행하는 것이 추천된다(59). 첫 카테터 교체는 삽입경로가 성숙되어야 하기 때문에 최소한 4주(보통 6~12주) 이후에 시행하여야 한다(60). 또한 요로감염과 방광결석을 예방하기 위해 2~3개월 주기로 카테터의 교체를 하는 것이 추천된다. 환자와 보호자에게는 카테터를 거치하는 기간 동안에 주기적인 관리의 방법과 필요성에 대해서 교육해야 하고, 카테터 관련 합병증인 소변의 배출 중단, 소변의 누출, 카테터 빠짐 등이 생겼을 때 누구에게 문의를 해야 하는지 등의 세세한 정보를 제공해야 한다.
Figures and Tables
Fig. 1
Vascular anatomy of the kidney in the coronal plane.
1 = renal artery, 2 = superior segmental artery, 3 = anterior superior segmental artery, 4 = anterior inferior segmental artery, 5 = inferior segmental artery, 6 = posterior branch of the renal artery, 7 = interlobar arteries, 8 = arcuate artery, 9 = ureteric branch of the renal artery
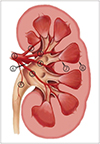
Fig. 2
Schematic anatomy of the kidney in the axial plane. The arrow indicates a needle within the posterior calyx along the plane of the Brodel's bloodless line.
1 = posterior division of the renal artery, 2 = anterior division of the renal artery, 3 = renal pelvis, 4 = Brodel's bloodless line, 5 = interlobar arteries, 6 = arcuate artery, 7 = interlobular arteries, 8 = fornix, 9 = minor calyx
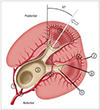
Fig. 3
Comparison of PCN performed through the inferior calyx and middle calyx.
A. A needle was percutaneously introduced in the inferior calyx (arrowheads). Under fluorosopy, PCN performed through the inferior calyx placing the catheter at a sharp angle to the urete.
B. If a subsequent ureteral stent is needed, it is better to puncture the middle calyx (arrowheads). In the PCN performed through the middle calyx, an obtuse angle is formed between the catheter and the ureter, reducing resistance during the ureteral stent placement.
PCN = percutaneous nephrostomy

Fig. 4
A 41-year-old woman presenting with fever and flank pain.
A. Contrast-enhanced CT shows pelvocalyceal dilatation with an internal air bubble (arrowhead), which suggests emphysematous pyelonephritis in the right kidney. Percutaneous nephrostomy was performed (not shown).
B. Massive hematuria occurred immediately after the procedure. Right renal arteriogram shows a direct fistula between the inferior segmental artery (arrow) and inferior renal calyx (arrowhead).
C. After embolization using microcoils (arrow), no further bleeding is seen on the right renal arteriogram. During the procedure, the microcoil migrated into the calyx (arrowhead).

Fig. 5
An 80-year-old woman with bladder cancer replacing the drain catheter due to marked decrease of urination.
A. Fluoroscopic image of the prone patient. A small amount of contrast media was injected through the catheter, but the 0.035-inch guidewire could not pass, as the catheter was clogged. Therefore, after inserting the guidewire (arrowheads) to the side of catheter, it could be advanced along the outer surface of the catheter.
B. The existing catheter was removed, and a new catheter was inserted over the guidewire.
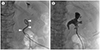
Fig. 6
A 53-year-old man with a double-J stent for ureteral stricture after kidney transplantation. At the follow-up, the patient presented with elevated serum creatinine.
A. Percutaneous nephrostomy was performed for the transplanted kidney in the left lower abdomen. Under fluoroscopy, the catheter (arrow) was inserted via the anterosuperior calyx of the transplanted kidney. Arrowheads indicate a double-J ureteral stent.
B. Two days after the procedure, the patient complained of abdominal pain, and free air was noted on the abdominal plain film (not shown). Contrast-enhanced CT shows that the catheter (arrowhead) penetrates the descending colon (arrow). Subsequently, the patient underwent primary repair for colon perforation.
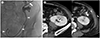
Fig. 7
Percutaneous nephrostomy using the double-stick technique in a patient with a non-dilated renal collecting system.
A. Fluoroscopic image after ultrasound-guided needle (22G) placement in the dilated pelvis of the right kidney. A small volume of urine was aspirated and an equivalent amount of diluted contrast was gently injected in the left renal collecting system.
B. After opacifying the renal calyces and identifying the posterior calyx (arrowhead), a 21G second needle (arrow) was inserted toward the posterior calyx under fluoroscopic guidance.
C. A 0.018-inch guidewire is inserted through the second needle. Once the wire was in the appropriate position, the first puncture needle was removed.
D. After inserting a percutaneous access system (Neff, Cook, Bloomington, IN, USA) over the 0.018-inch guidewire, a 0.035-inch guidewire, dilators (arrow), and an 8.5-Fr pigtail catheter were subsequently inserted. Small hematomas are seen in the renal pelvis and calyces (arrowheads).

Fig. 8
Caudal view of the pelvis and anterior abdominal wall. Circle indicates the preferred puncture site.
1 = inferior epigastric artery, 2 = rectus abdominis muscle, 3 = bladder, 4 = space of Retzius, 5 = external iliac artery, 6 = reflected peritoneum
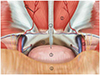
Fig. 9
A 59-year-old man presenting with urinary retention due to neurogenic bladder.
A. Fluoroscopic image in a supine patient. A 21G needle was percutaneously inserted 2–3 cm above the pubic symphysis under ultrasound guidance. If bladder is not fully inflated, diluted contrast media should be injected through the indwelling transurethral catheter or a puncture needle.
B. A 0.018-inch guidewire was inserted through the access needle (arrowheads). The needle was exchanged over the wire for the percutaneous access system (Neff, Cook, Bloomington, IN, USA), and the inner metal cannula was removed (not shown).
C. A 0.035-inch guidewire was advanced into the bladder, and serial dilatation of the tract was performed over the wire.
D. A 8.5-Fr pigtail catheter was subsequently inserted over the wire, and a small amount of contrast media was injected to confirm that the catheter was in an appropriate position.
References
1. Goodwin WE, Casey WC, Woolf W. Percutaneous trocar (needle) nephrostomy in hydronephrosis. J Am Med Assoc. 1955; 157:891–894.
2. Zagoria RJ, Dyer RB. Do's and don't's of percutaneous nephrostomy. Acad Radiol. 1999; 6:370–377.
3. Khan AA, Mathur S, Feneley R, Timoney AG. Developing a strategy to reduce the high morbidity of patients with long-term urinary catheters: the BioMed catheter research clinic. BJU Int. 2007; 100:1298–1301.
4. Mohammed A, Khan A, Shergill IS, Gujral SS. A new model for suprapubic catheterization: the MediPlus Seldinger suprapubic catheter. Expert Rev Med Devices. 2008; 5:705–707.
5. Pabon-Ramos WM, Dariushnia SR, Walker TG, D'Othée BJ, Ganguli S, Midia M, et al. Quality improvement guidelines for percutaneous nephrostomy. J Vasc Interv Radiol. 2016; 27:410–414.
6. Dyer RB, Regan JD, Kavanagh PV, Khatod EG, Chen MY, Zagoria RJ. Percutaneous nephrostomy with extensions of the technique: step by step. Radiographics. 2002; 22:503–525.
7. Funaki B, Tepper JA. Percutaneous nephrostomy. Semin Intervent Radiol. 2006; 23:205–208.
8. Regalado SP. Emergency percutaneous nephrostomy. Semin Intervent Radiol. 2006; 23:287–294.
9. Payne CS. A primer on patient management problems in interventional radiology. AJR Am J Roentgenol. 1998; 170:1169–1176.
10. Moon E, Tam MD, Kikano RN, Karuppasamy K. Prophylactic antibiotic guidelines in modern interventional radiology practice. Semin Intervent Radiol. 2010; 27:327–337.
11. Sampaio FJ, Aragão AH. Anatomical relationship between the renal venous arrangement and the kidney collecting system. J Urol. 1990; 144:1089–1093.
12. Hopper KD, Yakes WF. The posterior intercostal approach for percutaneous renal procedures: risk of puncturing the lung, spleen, and liver as determined by CT. AJR Am J Roentgenol. 1990; 154:115–117.
13. Graves FT. The anatomy of the intrarenal arteries and its application to segmental resection of the kidney. Br J Surg. 1954; 42:132–139.
14. Munver R, Delvecchio FC, Newman GE, Preminger GM. Critical analysis of supracostal access for percutaneous renal surgery. J Urol. 2001; 166:1242–1246.
15. Paul EM, Marcovich R, Lee BR, Smith AD. Choosing the ideal nephrostomy tube. BJU Int. 2003; 92:672–677.
16. Degirmenci T, Gunlusoy B, Kozacioglu Z, Arslan M, Ceylan Y, Ors B, et al. Utilization of a modified Clavien Classification System in reporting complications after ultrasound-guided percutaneous nephrostomy tube placement: comparison to standard Society of Interventional Radiology practice guidelines. Urology. 2013; 81:1161–1167.
17. Patel U, Hussain FF. Percutaneous nephrostomy of nondilated renal collecting systems with fluoroscopic guidance: technique and results. Radiology. 2004; 233:226–233.
18. Montvilas P, Solvig J, Johansen TE. Single-centre review of radiologically guided percutaneous nephrostomy using “mixed” technique: success and complication rates. Eur J Radiol. 2011; 80:553–558.
19. Sommer CM, Huber J, Radeleff BA, Hosch W, Stampfl U, Loenard BM, et al. Combined CT- and fluoroscopy-guided nephrostomy in patients with non-obstructive uropathy due to urine leaks in cases of failed ultrasound-guided procedures. Eur J Radiol. 2011; 80:686–691.
20. Gupta S, Gulati M, Uday Shankar K, Rungta U, Suri S. Percutaneous nephrostomy with real-time sonographic guidance. Acta Radiol. 1997; 38:454–457.
21. Lee WJ, Mond DJ, Patel M, Pillari GP. Emergency percutaneous nephrostomy: technical success based on level of operator experience. J Vasc Interv Radiol. 1994; 5:327–330.
22. Patel RD, Newland C, Rees Y. Major complications after percutaneous nephrostomy-lessons from a department audit. Clin Radiol. 2004; 59:766.
23. Lee WJ, Smith AD, Cubelli V, Badlani GH, Lewin B, Vernace F, et al. Complications of percutaneous nephrolithotomy. AJR Am J Roentgenol. 1987; 148:177–180.
24. Lessne ML, Holly B, Huang SY, Kim CY. Diagnosis and management of hemorrhagic complications of interventional radiology procedures. Semin Intervent Radiol. 2015; 32:89–97.
25. Stables DP. Percutaneous nephrostomy: techniques, indications, and results. Urol Clin North Am. 1982; 9:15–29.
26. Narasimham DL, Jacobsson B, Vijayan P, Bhuyan BC, Nyman U, Holmquist B. Percutaneous nephrolithotomy through an intercostal approach. Acta Radiol. 1991; 32:162–165.
27. Picus D, Weyman PJ, Clayman RV, McClennan BL. Intercostal-space nephrostomy for percutaneous stone removal. AJR Am J Roentgenol. 1986; 147:393–397.
28. Gerspach JM, Bellman GC, Stoller ML, Fugelso P. Conservative management of colon injury following percutaneous renal surgery. Urology. 1997; 49:831–836.
29. Öztürk H. Treatment of colonic injury during percutaneous nephrolithotomy. Rev Urol. 2015; 17:194–201.
30. Millward SF. Percutaneous nephrostomy: a practical approach. J Vasc Interv Radiol. 2000; 11:955–964.
31. Collares FB, Faintuch S, Kim SK, Rabkin DJ. Reinsertion of accidentally dislodged catheters through the original track: what is the likelihood of success? J Vasc Interv Radiol. 2010; 21:861–864.
32. Krohmer SJ, Pillai AK, Guevara CJ, Bones BL, Dickey KW. Image-guided nephrostomy interventions: how to recognize, avoid, or get out of trouble. Tech Vasc Interv Radiol. 2018; 21:261–266.
33. Praz V, Leisinger HJ, Pascual M, Jichlinski P. Urological complications in renal transplantation from cadaveric donor grafts: a retrospective analysis of 20 years. Urol Int. 2005; 75:144–149.
34. Lojanapiwat B, Mital D, Fallon L, Koolpe H, Raja R, Badosa F, et al. Management of ureteral stenosis after renal transplantation. J Am Coll Surg. 1994; 179:21–24.
35. Juaneda B, Alcaraz A, Bujons A, Guirado L, Díaz JM, Martí J, et al. Endourological management is better in early-onset ureteral stenosis in kidney transplantation. Transplant Proc. 2005; 37:3825–3827.
36. Bhayani SB, Landman J, Slotoroff C, Figenshau RS. Transplant ureter stricture: acucise endoureterotomy and balloon dilation are effective. J Endourol. 2003; 17:19–22.
37. Fonio P, Appendino E, Calandri M, Faletti R, Righi D, Gandini G. Treatment of urological complications in more than 1,000 kidney transplantations: the role of interventional radiology. Radiol Med. 2015; 120:206–212.
38. Saad WE, Moorthy M, Ginat D. Percutaneous nephrostomy: native and transplanted kidneys. Tech Vasc Interv Radiol. 2009; 12:172–192.
39. Gupta S, Gulati M, Suri S. Ultrasound-guided percutaneous nephrostomy in non-dilated pelvicaliceal system. J Clin Ultrasound. 1998; 26:177–179.
40. Thanos L, Mylona S, Stroumpouli E, Kalioras V, Pomoni M, Batakis N. Percutaneous CT-guided nephrostomy: a safe and quick alternative method in management of obstructive and nonobstructive uropathy. J Endourol. 2006; 20:486–490.
41. LeMaitre L, Mestdagh P, Marecaux-Delomez J, Valtille P, Dubrulle F, Biserte J. Percutaneous nephrostomy: placement under laser guidance and real-time CT fluoroscopy. Eur Radiol. 2000; 10:892–895.
42. Manohar T, Jain P, Desai M. Supine percutaneous nephrolithotomy: effective approach to high-risk and morbidly obese patients. J Endourol. 2007; 21:44–49.
43. Egilmez H, Oztoprak I, Atalar M, Cetin A, Gumus C, Gultekin Y, et al. The place of computed tomography as a guidance modality in percutaneous nephrostomy: analysis of a 10-year single-center experience. Acta Radiol. 2007; 48:806–813.
44. Jiao D, Zhang Z, Sun Z, Wang Y, Han X. Percutaneous nephrolithotripsy: C-arm CT with 3D virtual navigation in non-dilated renal collecting systems. Diagn Interv Radiol. 2018; 24:17–22.
45. Ghani KR, Andonian S, Bultitude M, Desai M, Giusti G, Okhunov Z, et al. Percutaneous nephrolithotomy: update, trends, and future directions. Eur Urol. 2016; 70:382–396.
46. Kallidonis P, Panagopoulos V, Kyriazis I, Liatsikos E. Complications of percutaneous nephrolithotomy: classification, management, and prevention. Curr Opin Urol. 2016; 26:88–94.
47. Tonolini M, Villa F, Ippolito S, Pagani A, Bianco R. Cross-sectional imaging of iatrogenic complications after extracorporeal and endourological treatment of urolithiasis. Insights Imaging. 2014; 5:677–689.
48. Corder CJ, LaGrange CA. Suprapubic bladder catheterization. Treasure Island: StatPearls Publishing LLC;2018.
49. Lee MJ, Papanicolaou N, Nocks BN, Valdez JA, Yoder IC. Fluoroscopically guided percutaneous suprapubic cystostomy for long-term bladder drainage: an alternative to surgical cystostomy. Radiology. 1993; 188:787–789.
50. Okafor HT, Nsouli IS. Percutaneous bladder catheterization (suprapubic bladder catheterization). Atlas Oral Maxillofac Surg Clin North Am. 2015; 23:177–181.
51. Papanicolaou N, Pfister RC, Nocks BN. Percutaneous, large-bore, suprapubic cystostomy: technique and results. AJR Am J Roentgenol. 1989; 152:303–306.
52. Johnson S, Fiscus G, Sudakoff GS, O'Connor RC, Guralnick ML. The utility of abdominal ultrasound during percutaneous suprapubic catheter placement. Can J Urol. 2013; 20:6840–6843.
53. Ahluwalia RS, Johal N, Kouriefs C, Kooiman G, Montgomery BS, Plail RO. The surgical risk of suprapubic catheter insertion and long-term sequelae. Ann R Coll Surg Engl. 2006; 88:210–213.
54. Aguilera PA, Choi T, Durham BA. Ultrasound-guided suprapubic cystostomy catheter placement in the emergency department. J Emerg Med. 2004; 26:319–321.
55. Ahmed SJ, Mehta A, Rimington P. Delayed bowel perforation following suprapubic catheter insertion. BMC Urol. 2004; 4:16.
56. Hunter KF, Bharmal A, Moore KN. Long-term bladder drainage: Suprapubic catheter versus other methods: a scoping review. Neurourol Urodyn. 2013; 32:944–951.
57. Katsumi HK, Kalisvaart JF, Ronningen LD, Hovey RM. Urethral versus suprapubic catheter: choosing the best bladder management for male spinal cord injury patients with indwelling catheters. Spinal Cord. 2010; 48:325–329.
58. Feifer A, Corcos J. Contemporary role of suprapubic cystostomy in treatment of neuropathic bladder dysfunction in spinal cord injured patients. Neurourol Urodyn. 2008; 27:475–479.
59. Navon JD, Soliman H, Khonsari F, Ahlering T. Screening cystoscopy and survival of spinal cord injured patients with squamous cell cancer of the bladder. J Urol. 1997; 157:2109–2111.
60. Rigby D. An overview of suprapubic catheter care in community practice. Br J Community Nurs. 2009; 14:278280282–284.




 PDF
PDF ePub
ePub Citation
Citation Print
Print






 XML Download
XML Download