Abstract
직장암의 현대적 치료는 고해상도 MRI의 해석에 따라 크게 달라지며, MRI 판독 보고서는 치료 방법 선택에 있어 중추적인 역할을 하고 있다. 특히 수술 전 화학방사선요법에 대상이 되는 환자를 선택하거나, 항문보존 수술 여부를 결정하는 일차적 치료 선택에 있어 MRI는 필수적이다. 비록 직장암 MRI 판독을 위한 몇몇 구조화된 보고서 양식이 있지만, 많은 영상의학과 의사들은 여전히 텍스트 형식의 판독문을 사용하고 있다. 이에 본 논문에서는 치료 전 직장암 MRI 판독문에 포함되어야 할 내용들을 고찰하여 판독 소견을 보다 쉽고 정확하게 기술하는 데 도움이 되고자 한다.
초록
Modern management of rectal cancer highly depends on the interpretation of high-spatial-resolution MRI, which determines the benefits from preoperative chemoradiotherapy or surgery alone. Accordingly, the baseline MRI report plays a pivotal role in planning the treatment. Although several structured reporting templates for rectal cancer staging on MRI are available, many radiologists still use the free-text format. In this review, we discuss the essential items for reporting rectal cancer on MRI before treatment to guide general radiologists in preparing a qualified report.
직장암은 비교적 흔한 소화기계 악성종양으로 전 세계적으로 남자에서 발생률 7위 여자에서 10위를 차지하는 암이다(1). 우리나라 암등록 통계자료에 따르면 2016년 11564명의 직장암 환자가 발생하여 여덟번째 많이 발생하였으나, 2010년 이후로 직장암 발생률은 0.7% 감소하는 경향을 보이고 있다(2). 최근 치료 방법의 진보, 영상의학의 발전 및 다학제(multi-disciplinary team) 진료의 활성화 등으로 치료성적이 향상되어, 직장암에서 가장 문제가 된 국소 재발률은 더 이상 쟁점이 되지 않는 시대로 접어들었다(3). 화학방사선요법(chemoradiotherapy)과 전직장간막절제술(total mesorectal excision) 도입 전 국소 재발률은 30% 정도까지 이르렀으나 수술 전 화학방사선요법 후 전직장간막절제술 시행으로 국소 재발률은 2~14% 정도까지 감소된 상태이다(456). 특히 영상의학적인 관점에서 볼 때, 최근의 구조화된 판독문의 사용은 직장암 병기결정에 대한 MRI 보고서의 질적 향상을 가져왔으며, 이는 환자의 생존율 향상에 기여할 것으로 기대된다(78). 이에 본 논문에서는 치료 전 직장암 MRI 판독문에 포함되어야 할 내용들을 고찰하여 판독 소견을 보다 쉽고 정확하게 기술하는 데 도움이 되고자 한다.
직장과 구불결장(sigmoid colon)과의 경계 부위는 논란의 여지가 있으나 임상적으로는 대개 항문연(anal verge)에서 15 cm 상방까지의 대장을 직장으로 정의하고 있다. 최근 개정된 미국 국립종합암네트워크(National Comprehensive Cancer Network)의 직장암 치료지침에서는 직장을 MRI에서 치골결합(symphysis pubis)에서 천골곶(sacral promontory)을 잇는 선의 골반강 내부에 있는 대장으로 정의하고 있어 치료 계획 수립에 있어 MRI 역할을 강조하고 있다(9). 직장벽은 대개 3층으로 T2 강조영상에서 점막층(mucosal layer)은 저신호강도, 점막하층(submucosal layer)은 고신호강도, 고유근육층(muscularis propria layer)은 저신호강도로 구분되어 보인다(Fig. 1A). 하부 직장의 고유근육층 중 바깥쪽 종주근(longitudinal muscle)의 앞쪽 부분은 톱니 모양의 경계를 보이며 얕은 고랑들이 있을 수 있어 T 병기 결정에 있어 과대평가될 수 있는 함정일 수 있음을 알아 두어야 한다(Fig. 1B).
직장을 3등분 하였을 때 상부 1/3은 전방과 측방에서 중간 1/3은 전방에서만 복막으로 덮여 있으며, 하부 1/3은 복막으로 덮여 있지 않다(Fig. 2). 이는 전방복막반전(anterior peritoneal reflection)이 직장의 앞쪽에서 발생하기 때문이며, 남성에서는 정낭(seminal vesicle)의 상부경계부위(항문연으로부터 9.0~7.0 cm) (Fig. 3A), 여성에서는 자궁경부각(uterocervical angle) 정도에(항문연으로부터 7.5~5.0 cm) (Fig. 3B) 전방복막반전이 위치하고 있다(10). 전방복막반전부는 중간 휴스턴 밸브(kohlrausch's fold)의 위치와 일치하며, 이를 경계로 상부직장(rectum/above the peritoneal reflection, Ra) 과 복막외 하부직장(rectum/below the peritoneal reflection, Rb)으로 구분하기도 한다. 전방복막반전 하방의 복막외 하부직장은 직장간막(mesorectum) 뿐만 아니라 골반측벽으로 배출되는 림프 통로를 가지고 있어 이 부위에 종양이 존재하는 경우에는 골반 측부 림프절(pelvic sidewall lymph node) 전이를 주의 깊게 살펴보아야 한다.
직장간막근막(mesorectal fascia)은 전방복막반전 하방의 직장과 혈관, 신경, 지방 및 림프관 등을 둘러싸고 있는 얇은 층의 근막으로 골반근막(pelvic fascia)의 연장이다. 전방복막반전의 하부 직장에서는 앞쪽으로 Denovillier 근막과 합쳐지며 상부 직장에서는 뒤쪽의 천골전방근막(presacral fascia)과 합쳐진다. 또한 양측에서 이 근막이 두터워져 외측인대(lateral ligament)를 형성해 직장을 골반 측벽에 부착시킨다. 직장간막근막이 임상적으로 중요한 이유는 종양을 싸고 있는 림프절, 혈관을 포함하는 직장간막을 한 단위로 일괄 절제해 내는 전직장간막절제술시 측부 절제연(circumferential resection margin)과 대개 일치하기 때문이다(Fig. 4). T2 강조영상에서 이 근막은 저신호강도의 얇은 띠로 관찰되어 비교적 쉽게 인지된다
외과적으로 항문관(anal canal)은 항문연에서 항문올림근(levator ani) 또는 항문직장륜(anorectal ring)까지로 정의하며, 약 3~4 cm 길이를 가진다. T2 강조영상 경사관상면(oblique coronal imaging)이 내항문괄약근(internal sphincter), 괄약근사이 공간(intersphincteric plane), 외항문괄약근(external sphincter)을 구분하는데 용이하다(Fig. 5). 직장의 윤상근(circular muscle) 층의 원위부 2.5~4.0 cm가 응축되어 내항문괄약근이 되며, 종주근 층은 항문직장륜 높이에서 항문 올림근 섬유들과 혼합되어 연합종주근을 형성하고 내외항문괄약근 사이를 내려와서 괄약근사이 공간으로 연결되어 섬유화된 띠로 관찰된다(11). 외항문괄약근은 내측의 평활근(smooth muscle) 전 길이를 싸고 있는 타원형의 횡문근의 원통이지만 내항문괄약근 보다는 약간 더 하부에서 끝난다
직장암은 결장암과 달리 골반강이라는 협소한 해부학적 공간 내에 비뇨생식기관 및 혈관과 신경 등이 인접해 있어 근치적 절제를 위한 수술적 절제연을 확보하기가 어려워 높은 국소 재발을 보여 왔다. 근치적 절제술 후 20~30%에 이르던 국소 재발률은 1986년 영국의 외과의사인 빌힐드(Bill Heald)에 의해 전직장간막절제술이 도입되면서 약 10%대로 감소되었다(12). 전직장간막절제술은 직장간막을 싸고 있는 장측근막(parietal fascia)과 벽측근막(visceral fascia)의 사이에 위치한 무혈관평면(avascular plane)을 따라 직장을 예리하게 박리하는 수술방법이다. 전직장간막 절제술에 수술 전 화학방사선요법을 추가함으로써 국소치료 효과는 더욱 증대되었다. German Rectal Cancer Study Group의 823명을 대상으로 한 무작위 대조군 연구(randomized controlled trial)에서 수술 후 화학방사선요법(5040 cGy + 5-Fu)의 환자가 13%의 국소 재발률을 보인 반면, 수술 전 5주간의 장기 화학방사선요법(long-course chemoradiotherapy)을 마친 후 6주 뒤에 수술을 한 환자는 6%의 국소 재발률을 보였다(13). 또한 Dutch Colorectal Cancer Group의 1861명을 대상으로 한 무작위 대조군 연구에서 전직장간막절제술만을 시행 받은 환자가 8.2%의 2년 국소 재발률을 보인 반면, 수술 전 5일간(2500 cGy) 단기방사선 요법(short-course radiotherapy) 후 전직장간막절제술을 받은 환자는 2.4%의 국소 재발률 보였다(4). 이런 결과를 바탕으로 국소 진행된 병기 II, III (cT3/4 또는 cN+)기의 직장암에서는 수술 전 화학방사선요법 후 전직장간막절제술이 직장암에서 표준 치료로 자리매김하게 되었다. 흥미로운 점은 수술 전 화학방사선요법을 받은 환자의 약 33%까지 병리학적으로 완전 관해를 보인다는 사실이다(14,15). 이론적으로만 본다면 이러한 환자들은 추가적인 수술적 절제가 필요하지 않으며, 이러한 근거를 바탕으로 최근 완전 관해로 추정되는 환자들에게 있어 수술을 하지 않고 경과만 관찰하는 국제 다기관 임상시험이 진행 중이다(16).
직장암의 병기 결정을 위한 MRI 기법은 다른 복부 MRI에 기법에 비해 매우 간단하다. 3 mm 이하의 비교적 얇은 절편(slice thickness)을 기반으로 한 시상면(sagittal imaging), 경사횡단면(oblique axial imaging), 경사관상면의 세 방향 고해상도 T2 강조영상이 근간을 이루고 있으며, 촬영 시에 종양과 수직 또는 수평의 방향으로 경사횡단면과 관상면을 얻는 것이 중요하다(Fig. 6A). 항문 괄약근을 침범한 하부 직장암의 경우에는 항문관에 수평 또는 수직방향이 되게 각도를 주어 촬영하는 것이 항문괄약근 침범 정도를 평가하기에 유리하다. 기관마다 차이가 있으나 영상 범위(field of view)를 비교적 좁게 촬영하여(160 × 160 mm~240 × 240 mm) 경사횡단면과 경사관상면을 얻는 것이 미세한 종양의 침범유무, 벽외의 정맥침범(extramural venous invasion) 및 림프절 전이 유무 해석에 도움이 될 수도 있다(Fig. 6B) (17). 하부 직장암의 경우 코일 중심부의 위치를 치골결합 직상방에 위치시킨다. 영상 촬영의 상하위 범위는 하장간동맥(inferior mesenteric artery) 기시부(origin)에서 항문연이 포함되도록 하며, 내외 범위는 양측 골반 측벽 및 서혜부(inguinal area)가 반드시 포함되게 하여 전이된 림프절, 벽외의 정맥침범 및 종양침착(tumor deposit) 등을 놓치는 일이 없도록 하여야 한다. 림프절로의 암 전이를 확인하기 위하여 경사횡단면 영상을 암종의 근위부 경계에서 최소 5 cm 상방까지를 촬영 범위에 포함시키는 것이 좋다(18). 촬영 전 방광을 비우고 장세척을 통해 잔변을 제거하고, 장운동 억제제(spasmolytic)를 근주(intramuscular injection)하여 운동인공물을 억제하는 것이 영상의 질적 향상에 도움을 줄 수 있다. 초음파 젤을 직장 내에 주입하면 종양의 강내 경계면이 좀 더 잘 보이게 되어 직장암 MRI의 판독에 익숙하지 않은 초심자들에게는 유용할 수 있으나, 직장의 연동운동 및 항문연에서부터 종양의 하부연까지의 거리를 증가시키며, 직장강의 과도한 확장이 측부절제연 예측에 영향을 줄 수도 있다는 연구가 있어 일상적으로 사용하는 것은 추천되지 않는다(192021). 더불어 정맥조영제의 사용도 논란이 있으나 일반적으로 추천되지 않는다. 항암 방사선 치료 전 확산강조영상은 기관에 따라 선택적으로 사용할 수 있으며, 치료 후에는 방사선 섬유화와 잔존암을 구분하는데 확산강조영상이 유용한 것으로 알려져 있어 추천된다(22).
직장암은 항문과 인접하여 있어 안전한 원위부 절제연을 확보하는데 상당한 제한이 있다. 이로 인해 항문연 및 항문직장륜으로 부터 암종의 원위부까지의 거리가 항문보존 수술 여부를 결정하는데 있어 매우 중요하며 이를 판독지에 반드시 기록하여야 한다. 측정 시에는 T2 강조영상 시상면에서 직장의 굴곡을 따라 직장강의 중심을 연결하는 선을 그어 항문연 및 항문직장륜에서 종양의 원위부까지의 거리를 기록하면 된다(Fig. 7A) (23). 종양의 위치에 따라 항문보존 수술의 방법이 일부 달라질 수 있으나, 일반적으로 최소 1 cm 이상의 원위부 절제연을 확보하면 종양학적으로 안전한 것으로 알려져 있어 하부 직장암의 경우 항문직장륜으로부터 1 cm 상방에 종양이 있는지의 여부가 매우 중요하다(24). 또한 원발종양의 원위부 경계가 전방복막반전의 상방 또는 하방에 위치하는지, 걸쳐 있는지를 판독지에 기록하는 것이 좋다. 이는 전방복막반전의 상방에 종양이 위치하는 경우에는 앞쪽으로는 측부절제연이 존재하지 않아 직접적인 절제가 필요하지 않으며, 상대적으로 국소 재발률이 낮아 기관에 따라서는 수술 전 화학방사선요법 없이 수술만으로 치료하는 경우도 있기 때문이다(25). 하지만 전방복막반전을 침범한 경우에는 복강 내 재발률은 높은 것으로 알려져 있다(26). 시상면 영상에서 종양의 높이를 기록하였다면, 경사횡단면 영상에서 원발 종양의 내강 내 위치를 시계방향으로 표시하여야 한다.
원발종양의 형태학적 분석은 종양이 침습하는 양상을 이해하는데 도움을 줄 수 있다. 육안적으로는 폴립양 종괴형(polypoid mass)과 궤양을 동반하는 벽비후형(wall thickening)이 대부분을 차지하고 있으며, 융모성형(villous type), 점액암종형(mucinous type), 반지세포형(signet ring cell type) 등의 특수한 경우도 있다. 특히 종양의 침습성 변연(invasive edge)을 확인하는 것이 침습 양상을 이해하는데 중요하며, 침습성 변연부를 시계방향으로 표기하여 판독지에 따로 기록할 수도 있다. 폴립양 종괴형의 경우 섬유혈관 줄기(fibrovascular stalk) 부분을 따라 종양의 침습이 이루어진다(Fig. 7B). 궤양을 동반하는 벽비후형의 경우 종양의 중심 부분을 이루는 침습성 변연부와 주변부의 융기된 말려져 있는 변연부(raised rolled edge)로 구분할 수 있으며, 침습성 변연부가 종양이 직장간막으로 자라나는 중심이 된다(Fig. 7C). 섬유혈관 줄기 부분 또는 침습성 변연부에 분석의 초점을 맞춤으로써 종양의 침습 깊이를 정확하게 분석할 수 있다(27).
T 병기는 MRI에서 가장 진단능이 높은 예후 인자로, 치료의 방향을 결정하는데 있어서도 빠질 수 없는 주요 영상지표이다. Al-Sukhni 등(28)은 19개의 연구 1986명의 환자를 바탕으로 한 메타분석에서 MRI에서 진단능은 정확도 85%, 민감도 87%, 특이도 75%로 보고하였다. 하지만 T 병기 결정에 있어서도 영상의학적으로 구분이 다소 어려운 부분들이 있으며 특히 T1과 T2 및 T2와 T3a의 구분이 어렵다. 일부 전문가들은 고해상도 T2 강조영상을 기반으로 T1 (submucosa)을 종양의 깊이(tumor depth)에 따라서 Sm1, Sm2, Sm3로 구분하고 있으나, 재현성에 관한 부분에서 충분한 연구가 이루어지지 않아 임상적으로 사용하기에는 아직 제한적이다. 하지만 세 방향 고해상도 T2 강조영상 모두에서 고유근육층과 인접한 바깥쪽 점막하층이 보존되어 보인다면 T1 암종으로 진단할 수 있다(Fig. 8). 일부 연구에서는 T1과 T2 병기를 구분하는데 있어 초음파 내시경이 도움이 된다는 보고가 있다(29). 임상적으로 T1과 T2의 구분이 중요한 이유는 항문연에서 8 cm 이내에 위치한 직장암 중 T1 Sm1/2, 고분화 또는 중등도 분화(well or moderately differentiated), 크기가 3 cm 이하, 내강의 30% 미만을 침범한 조기 직장암의 경우에 경항문 국소 절제술(transanal local excision)을 시도해 볼 수 있기 때문이다(9). 하지만 절제된 조직에서 T1 Sm3 이상, 저분화성(poorly differentiated) 암종, 림프혈관 침범(lymphovascular invasion), 신경주위 침범(perineural invasion) 등의 고위험 인자가 발견된 경우에는 추가적인 근치적 절제술이나 보조 화학방사선 요법(adjuvant chemoradiotherapy)이 필요하다(9). T2와 T3a의 구분도 쉽지 않으며, 이는 MRI에서 결합조직형성반응(desmoplastic reaction)과 암종의 침윤을 감별하기 어렵기 때문이다. 하지만 예후적인 측면에서 볼 때 두 암종은 비슷한 생존율 및 국소 재발률을 보여 치료를 달리하여야 하는가에는 논란이 있다(3031).
T3 암종의 경우에는 비록 개정된 미국합동암위원회(American Joint Committee on Cancer) 8판 TNM 병기(8th TNM staging)에서도 T3 하위분류(substage)를 따로 사용하고 있지는 않으나, 최근의 구조화된 판독문에서는 유럽과 미국 모두에서 미국합동암위원회/국제암예방연합(International Union Against Cancer) 5판에서 사용된 4단계의 T3 하위분류를 사용하고 있다(Table 2) (223233). 이는 같은 T3 암종일지라도 벽외 침범 깊이(extramural depth of invasion)에 따라 확연히 다른 예후를 보이고 있기 때문이다. Merkel 등(31)의 연구에 따르면 5 mm 이하의 벽외 침범을 가진 T3ab 암종의 경우 5년 무병생존율(disease free survival) 85% 국소 재발률 10%를 보였으나, 5 mm 초과된 T3cd 암종은 무병생존율 54% 국소 재발률 26%를 보였다. 또한 Siddiqui 등(34)은 T3 하위분류의 예후에 대한 메타분석에서 고유근육층에서 5 ± 1 mm 이상의 벽외 침범을 보인 암종이 전체 생존율(overall survival) (위험 비율 1.40), 무병생존율(위험 비율 1.49) 및 종양 특이 생존율(cancer specific survival) (위험 비율 1.22) 모두에서 나쁜 예후를 보임을 증명하였다. Magnetic Resonance Imaging and Rectal Cancer European Equivalence Group의 무작위 대조군 연구에서도 T3ab 암종에서 수술 전 화학방사선요법 없이 수술만으로도 국소 재발률 3.3%를 보여 이른바 “good T3”를 증명하였다(30). Brown 등(35)은 295명을 대상으로 한 전향적 연구에서 MRI에서 측정한 벽외 침범 깊이를 조직 병리학과 직접 비교한 결과 그 차이가 0.5 mm 이내로 나타나 고해상도 T2 강조영상에서 벽외 침범 깊이를 비교적 정확하게 측정할 수 있음을 보여주었다. 하지만 실제 T2 강조영상에서 T3 암종의 벽외 침범 깊이를 측정하는 것은 판독자의 경험에 따라 다소 어려울 수 있다. 암종의 벽외 침범 깊이측정은 고유근육층의 바깥쪽 경계를 따르는 가상의 곡선을 그린 후 그 깊이를 측정하여야 하는데, 원발 종양이 결절 형태로 직장간막을 침범한 경우에는 고유 근육층을 쉽게 인지할 수 있어 측정하기가 다소 용이하나(Fig. 9A), 직장간막으로 광범위하게 튀어 나온 경우에는 고유근육층을 확인하기 어려워 측정이 용이하지 않다(Fig. 9B). 일부 연구에서도 T3 암종의 벽외 침범 깊이를 측정하는데 있어 약 7~8 mm까지의 측정 오차가 있는 것으로 보고되어 예후 및 실질적인 치료 측면만을 고려하여 T3ab 와 T3cd의 이분화된 분류법을 사용하는 것도 좋은 방법이다(243637).
직장암에서는 전방복막반전을 침범한 경우 T4a 암종으로 정의하며, 이 경우 복강 내 암종의 재발 위험성이 높아진다(Fig. 10) (26). 주위 장기로의 침범이 있는 경우에는 T4b로 판독하며, 수술 전 화학방사선요법 후 MRI로의 재평가 후 경우에 따라 복회음절제술(extralevator abdominoperineal resection) 또는 골반장기적출술(pelvic exenteration)이 필요하다. MRI 판독문에는 침범이 있는 장기를 정확하게 따로 기술하여야 하며, Beyond TME collaborative에서 제시한 골반강의 외과적 구획에 따라 장기 침범을 기록하는 MRI 판독문을 사용하는 것도 체계적인 보고서를 작성할 수 있는 방법중의 하나이다(38). 이는 근막경계와 골반장기들의 해부학적 절제연에 따라 골반강을 다섯 가지의 외과적 구획(central above peritoneal reflection, central below peritoneal reflection, posterior, lateral, and infralevator compartment)으로 구분하여 침범된 장기를 기록하며, 침범이 있는 모든 구획을 절제할 가능성이 높아져 R0 절제와 생존율을 향상시킬 가능성이 높은 것으로 알려져 있다(Fig. 11) (38).
최근 개정된 미국합동암위원회 8판 TNM 병기에서도 N 병기에 변경된 부분은 없으며, 의심되는 전이성 림프절의 개수에 따라 분류한다. 림프절 전이가 여전히 환자의 전신 재발 및 생존율에 중요한 예후 인자이기는 하나, 국소 재발에 영향을 미치는가는 최근 논란이 되고 있다(394041). 또한 MRI가 림프절 전이에 대해 T 병기보다는 매우 낮은 진단능을 보이는 점 또한 문제점으로 대두되고 있으며, 이는 치료의 적응증을 결정하는데 있어서도 영향을 주고 있다. 전통적으로 림프절 전이에 대한 영상의학적 분석은 형태학적 분석에 의존해왔다. 림프절의 경계가 불규칙하고, 내부에 신호강도가 불균질할수록 전이성 림프절의 가능성이 높은 것으로 알려져 있다(Fig. 12A) (4243). 비록 림프절의 크기가 클수록 전이의 가능성이 높다는 부분에 있어서는 논란의 여지가 없으나, 전이성 림프절에 많은 부분이 단경 5 mm 이하에서도 발견되고, 크기의 절대적 기준을 마련하는데 있어 일치된 의견을 만들기 어려워 크기의 기준을 사용하지 않아 왔다(4244). 하지만 최근 개정된 미국(Society of Abdominal Radiology) 및 유럽 복부영상의학회(European Society of Gastrointestinal and Abdominal Radiology)의 직장암 MRI에서의 구조화된 판독문에는 형태학적 분석 및 림프절의 단경을 기준으로 한 영상 분석 지침을 제시하여 향후에 이 기준이 전이성 림프절 예측에 많은 도움이 될 것으로 기대된다. 제시한 기준에서는 림프절의 단경과 경계, 모양 및 내부 균질도에 따른 형태학적 분석의 조합에 따라 악성과 양성을 구분하고 있다. 악성 림프절을 시사하는 세 가지 형태학적 소견은 원형 모양, 불규칙한 경계와 불균질한 내부신호 강도이다. 이 기준에 따르면, 단경이 9 mm 이상인 림프절, 단경이 5 mm 이상 8 mm 이하이며 두 가지 이상 악성을 시사하는 형태를 가진 림프절, 단경이 5 mm 미만이며 세 가지 악성을 시사하는 형태를 가진 림프절들을 악성으로 간주한다(2232).
림프절 전이에서 눈여겨 보아야 할 또 다른 부분은 측부 림프절 전이이다. 측부 림프절 전이는 일반적인 전직장간막절제술의 수술 범위에 포함되지 않아 전이가 의심되는 경우에는 추가적인 절제를 따로 시행하여야 하므로 외과의가 쉽게 볼 수 있도록 판독지에 따로 기록하는 것이 좋다. 치료 전 MRI에서 측부 림프절 전이가 의심되는 경우에는 수술 전 화학방사선요법을 먼저 시행한 후 치료 반응의 평가를 시행하여야 한다. 측부 림프절 중 내장골 림프절(internal iliac node)의 경우 국소 림프절 전이로 간주하나(Fig. 12B), 외장골 림프절(external iliac node) 또는 서혜부 림프절(inguinal node) 전이는 원격 전이로 여겨진다.
항문연에서 6 cm 하방 또는 항문올림근이 기시하는 부위 아래쪽 하부 직장암에서는 항문괄약근 및 절제면의 침범 유무에 따라 항문보존 수술 가능 여부를 결정해야 하므로 특별한 주의가 필요하다. 항문괄약근의 침범은 T 병기에 따로 기술되어 있지 않으나, 최근 MRI에 기초를 둔 특별한 병기 결정 단계가 만들어져 수술 방법 결정에 도움을 줄 것으로 기대된다(Table 3, Fig. 13A) (454647). MRI에 기초한 하부 직장암의 병기 결정에 따르면, 1 또는 2기의 하부 직장암의 경우 최소 1 cm 이상의 원위부 절제연과 측부절제연 또는 항문괄약근 사이공간으로의 침범이 없는 경우 저위전방절제술(low anterior resection)과 괄약근간 절제술(intersphincteric resection) 및 결장항문문합술(coloanal anastomosis)을 이용하여 종양학적으로 안전하게 항문기능을 보존할 수 있는 것으로 알려져 있다(Fig. 13B). MERCURY II 연구에 따르면, MRI 하부 직장암 병기 1 또는 2기의 절제연이 비교적 안전한 암종의 경우 mrT3c, mrN2 그리고 mrEMVI 와 같은 불량한 예후 인자를 가지지 않는 62명의 환자에서 단지 1명(1.6%)만이 측부절제연으로의 침범이 확인되어 이 환자군의 대부분에서는 수술 전 화학방사선요법이 필요 없을 것으로 제시하였으나, 아직까지 실질적인 임상 진료와는 차이가 있어 추가적인 연구가 요구된다(48). 하지만 3 또는 4기의 하부직장암의 경우에는 종양학적으로 안전한 절제연을 확보하기 위해서는 수술 전 화학방사선 요법 및 복회음절제술 또는 골반장기적출술이 필요하다(Fig. 13C).
전직장간막절제술 후 여러 예후 인자 중에서 측부절제연의 종양 침윤 여부는 국소 또는 전신 재발, 생존율에 중요한 인자로 보고되고 있다(4950). 특히 개정된 미국 국립종합암네트워크의 직장암 치료지침에 따르면 수술 전 화학방사선요법 시행을 결정하는데 있어 측부절제연의 종양 침윤 여부 평가가 중요하며, MRI에서 측부절제연에 침범이 있는 경우에는 수술 전 화학방사선요법의 시행을 권고하고 있다(9). MRI에서 측부절제연의 침범 여부에 대한 판정은 직장간막근막 또는 항문올림근으로부터 1 mm 또는 그 이내에 암종이 있을 경우를 양성으로 판정하며(involved), 1~2 mm 이내의 경우에 침범의 위험이 높다고 여긴다(threatened) (Fig. 14) (2232). 원발 종양의 직접 침범을 비롯하여 전이성 림프절, 벽외의 정맥 침범, 또는 종양 침착에 의한 침범 등이 모두 측부 절제연 침범에 포함되며 이를 판독문에 기록하는 것이 좋다. 다만 MRI에서 악성으로 판단되는 림프절에 의해 측부절제연의 침범이 의심되는 환자의 경우에는 실제 병리학적으로 약 5% 정도의 환자에서만 측부절제연의 침범이 확인되어, 예후에 영향은 없는 것으로 알려져 있다(5152). Xie 등(53)은 14개의 연구 1600명을 대상으로 한 메타분석에서 치료 전 MRI의 직장간막근막의 침범을 예측하는 진단능을 민감도 74%, 특이도 93%로 MRI가 측부절제연을 비교적 정확하게 예측할 수 있는 것으로 보고하였다.
벽외의 정맥 침범은 비교적 최근에 확립된 예후 인자로, 고유근육층 바깥쪽 정맥에 종양세포의 침윤이 있는 것으로 정의한다. Chand 등(5455)은 14개의 연구 7262명을 대상으로 한 메타분석에서 조직학적으로 증명된 벽외의 정맥 침범의 통합 전체 유병률(pooled overall prevalence)이 26%(범위, 9~61%)라고 보고하였으며, 영국 병리학회(Royal College of Pathologist)의 지침에서도 대장암의 조직검체로 현미경적 검사를 시행하였을 때 최소 25% 이상의 증례에서 벽외의 정맥 침범이 진단되어야 최적의 검사로 간주된다. Siddiqui 등(56)은 6개의 연구 1262명을 환자를 대상으로 한 메타분석에서 MRI에서 벽외의 정맥 침범이 있는 환자의 경우 동시성 원격전이(synchronous metastasis)가 5배(오즈비 5.683), 후시성 원격전이(metachronous metastasis)가 4배(오즈비 4.016) 이상 자주 발생하는 것으로 보고하였다. 이것은 벽외의 정맥 침범이 혈행성 전이의 주요한 경로임을 알 수 있어 향후 수술 전 화학요법 또는 화학방사선요법의 적응증 중 하나로 자리 잡을 것으로 생각된다. 화학방사선요법 전 벽외의 정맥 침범을 진단하는 MRI의 진단능은 정확도 62~83%, 민감도 43~84%, 특이도 45~100% 정도로 알려져 있어, 아직까지 판독자의 수준에 따른 차이가 있는 것으로 생각된다(575859). MRI에서 벽외의 정맥 침범 소견은 T2 강조영상에서 벽외 정맥 내에 종양과 비슷한 중등도 신호를 보이는 관상의 종양이 보이는 것이며, 불규칙한 정맥벽과 정맥의 확장 소견 등이 동반될 수 있다(Fig. 15). 벽외의 정맥 침범을 보이는 정맥의 위치나 직경에 따라 예후에 미치는 영향이 다를 것으로 추정되며 이에 대한 추가적인 연구가 필요하다(60).
직장암에 있어 최근 MRI 기술의 발전과 해석능력의 향상은 영상에 기반을 둔 치료적 접근을 가능하게 하였다. 특히 최근의 구조화된 판독문의 사용은 직장암 MRI 보고서의 질적 향상을 가져왔으며, 치료 전 정확한 병기결정과 예후 인자들의 분석으로 국소 재발률의 감소와 항문보존율 향상에 기여하고 있다. 구조화된 판독문을 사용하는 것이 치료결정에 필수적인 영상의학적 요소들을 빠짐없이 보고할 수 있는 장점이 있으나 개인마다 선호도에 차이가 있을 수 있다. 하지만 치료전 직장암 MRI 판독문에 포함되어야 할 내용들을 잘 숙지하여 체계적인 판독보고서의 작성이 반드시 필요하다.
Figures and Tables
Fig. 1
Rectal anatomy on magnetic resonance imaging.
A. The three layers of the rectum wall (arrows).
B. Normal saw-tooth appearance of the anterior longitudinal muscle in the lower rectum (arrows).
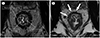
Fig. 3
Anterior peritoneal reflection on magnetic resonance imaging.
A. In men, the anterior peritoneal reflecion (arrows) is located just above the tip of the seminal vesicle (asterisk).
B. In women, the anterior peritoneal reflecion (arrows) is located at the level of the uterine cervix (asterisk).
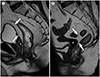
Fig. 6
Magnetic resonance imaging protocol.
A. Oblique axial and coronal images are obtained orthogonal (white arrow) or parallel (black arrow) to the long axis of the tumor (asterisk).
B. Mucinous lower rectal cancer (asterisk). Oblique axial T2-weighted image with high-resolution and small field-of-view is recommended (an example from our institution: 3 mm slice thickness, 160 mm × 160 mm field-of-view, 256 × 256 pixels, 4–6 excitations, 1.1 mm3 voxel resolution).
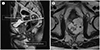
Fig. 7
Tumor height and morphology.
A. Distances from the anal verge and anorectal junction to the distal margin of the tumor (arrows) by a curvilinear measurement (straight line) along the luminal center.
B. Polypoid mass with the fibrovascular stalk (arrow) at 11 o'clock position.
C. Semi-annular wall thickening with an invasive edge (arrows) at 4–9 o'clock position and two raised rolled edges (asterisks) at 3 and 9 o'clock positions.
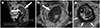
Fig. 8
T1 rectal cancer (asterisks) with preserved high-signal stripe of the submucosal layer (arrows).
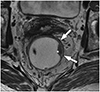
Fig. 9
T3 substage.
A. Nodular extramural extension. Extramural depth of invasion (arrow) measured by the distance from imaginary line (dashed line) of outer margin for muscularis propria layer to outer margin of tumor.
B. Broad-base bulging extramural extension. Extramural depth of invasion (arrow) measured by the distance from imaginary line (red dashed line) of outer margin for muscularis propria layer to outer margin of tumor (white dashed line).

Fig. 11
Compartments of the pelvis.
A. Sagittal image shows central compartments above/below the PR (arrow), posterior compartment, and infralevator compartment.
B. Oblique axial image shows the lateral compartment.
PR = peritoneal reflection.
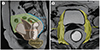
Fig. 12
Lymph node evaluation.
A. A 9 mm metastatic mesorectal node with round, irregular margin and internal heterogeneity (arrow).
B. A 13 mm metastatic internal iliac node with round and internal heterogeneity (arrow).
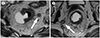
Fig. 13
Sphincter complex.
A. Illustration of magnetic resonance image staging of lower rectal cancer.
B. Stage I: lower rectal cancer (arrows) is confined to the bowel wall.
C. Stage IV: lower rectal cancer (arrows) invades the intersphincteric plane and left levator ani muscle.
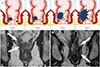
Fig. 14
Circumferential resection margin. “Involved” mesorectal fascia at 10–11 o'clock position by direct spreading of the primary tumor (arrow).
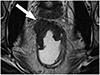
Fig. 15
Extramural venous invasion. Intermediate tumor signal intensity within the marginated, expanded extramural nodular vein contiguous to the primary tumor (arrow).
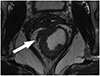
Table 2
T3 Substage in TNM Staging by The American Joint Committee on Cancer, 8th Edition

*Adapted from Hermanek et al. Berlin: Springer-Verlag 1993 (33).
References
1. Ferlay J, Colombet M, Soerjomataram I, Mathers C, Parkin D, Piñeros M, et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods. Int J Cancer. 2019; 144:1941–1953.
2. Korean Statistical Information Service. Cancer registration statistics. 2019. Accessed May 1, 2019. Available at. http://kosis.kr/statisticsList/statisticsList_01List.jsp.
3. Engelen SM, Maas M, Lahaye MJ, Leijtens JW, Van Berlo CL, Jansen RL, et al. Modern multidisciplinary treatment of rectal cancer based on staging with magnetic resonance imaging leads to excellent local control, but distant control remains a challenge. Eur J Cancer. 2013; 49:2311–2320.
4. Kapiteijn E, Marijnen CA, Nagtegaal ID, Putter H, Steup WH, Wiggers T, et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med. 2001; 345:638–646.
5. Tong T, Gollub MJ. Prognostic stratification by extramural depth of tumor invasion of primary rectal cancer based on the Radiological Society of North America. AJR Am J Roentgenol. 2014; 203:W749.
6. Wheeler JM, Dodds E, Warren BF, Cunningham C, George BD, Jones AC, et al. Preoperative chemoradiotherapy and total mesorectal excision surgery for locally advanced rectal cancer: correlation with rectal cancer regression grade. Dis Colon Rectum. 2004; 47:2025–2031.
7. Kennedy ED, Milot L, Fruitman M, Al-Sukhni E, Heine G, Schmocker S, et al. Development and implementation of a synoptic MRI report for preoperative staging of rectal cancer on a population-based level. Dis Colon Rectum. 2014; 57:700–708.
8. Tersteeg JJC, Gobardhan PD, Crolla RMPH, Kint PAM, Niers-Stobbe I, Boonman-de Winter LJM, et al. Improving the quality of MRI reports of preoperative patients with rectal cancer: effect of national guidelines and structured reporting. AJR Am J Roentgenol. 2018; 210:1240–1244.
9. Benson AB 3rd, Venook AP, Al-Hawary MM, Cederquist L, Chen YJ, Ciombor KK, et al. Rectal cancer, version 2.2018, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 2018; 16:874–890.
10. Gollub MJ, Maas M, Weiser M, Beets GL, Goodman K, Berkers L, et al. Recognition of the anterior peritoneal reflection at rectal MRI. AJR Am J Roentgenol. 2013; 200:97–101.
11. Park JG. Coloproctology. 4th ed. Seoul: Iljogak;2012. p. 25–66.
12. Heald RJ, Ryall RD. Recurrence and survival after total mesorectal excision for rectal cancer. Lancet. 1986; 1:1479–1482.
13. Sauer R, Becker H, Hohenberger W, Rödel C, Wittekind C, Fietkau R, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med. 2004; 351:1731–1740.
14. Patel UB, Brown G, Rutten H, West N, Sebag-Montefiore D, Glynne-Jones R, et al. Comparison of magnetic resonance imaging and histopathological response to chemoradiotherapy in locally advanced rectal cancer. Ann Surg Oncol. 2012; 19:2842–2852.
15. Francois Y, Nemoz CJ, Baulieux J, Vignal J, Grandjean JP, Partensky C, et al. Influence of the interval between preoperative radiation therapy and surgery on downstaging and on the rate of sphincter-sparing surgery for rectal cancer: the Lyon R90-01 randomized trial. J Clin Oncol. 1999; 17:2396.
16. Battersby NJ, Dattani M, Rao S, Cunningham D, Tait D, Adams R, et al. A rectal cancer feasibility study with an embedded phase III trial design assessing magnetic resonance tumour regression grade (mrTRG) as a novel biomarker to stratify management by good and poor response to chemoradiotherapy (TRIGGER): study protocol for a randomised controlled trial. Trials. 2017; 18:394.
17. Brown G, Daniels IR, Richardson C, Revell P, Peppercorn D, Bourne M. Techniques and trouble-shooting in high spatial resolution thin slice MRI for rectal cancer. Br J Radiol. 2005; 78:245–251.
18. Koh DM, Brown G, Temple L, Blake H, Raja A, Toomey P, et al. Distribution of mesorectal lymph nodes in rectal cancer: in vivo MR imaging compared with histopathological examination. Initial observations. Eur Radiol. 2005; 15:1650–1657.
19. Kim DJ, Kim JH, Lim JS, Chung JJ, Yu JS, Kim MJ, et al. Preoperative evaluation of lower rectal cancer by pelvic MR with and without gel filling. J Korean Soc Magn Reson Med. 2014; 18:323–331.
20. Stijns RC, Scheenen TW, De Wilt JH, Fütterer JJ, Beets-Tan RG. The influence of endorectal filling on rectal cancer staging with MRI. Br J Radiol. 2018; 91:20180205.
21. Kim SH, Lee JM, Lee MW, Kim GH, Han JK, Choi BI. Sonography transmission gel as endorectal contrast agent for tumor visualization in rectal cancer. AJR Am J Roentgenol. 2008; 191:186–189.
22. Beets-Tan RGH, Lambregts DMJ, Maas M, Bipat S, Barbaro B, Curvo-Semedo L, et al. Magnetic resonance imaging for clinical management of rectal cancer: updated recommendations from the 2016 European Society of Gastrointestinal and Abdominal Radiology (ESGAR) consensus meeting. Eur Radiol. 2018; 28:1465–1475.
23. KSAR Study Group for Rectal Cancer. Essential items for structured reporting of rectal cancer MRI: 2016 consensus recommendation from the Korean Society of Abdominal Radiology. Korean J Radiol. 2017; 18:132–151.
24. Kuvshinoff B, Maghfoor I, Miedema B, Bryer M, Westgate S, Wilkes J, et al. Distal margin requirements after preoperative chemoradiotherapy for distal rectal carcinomas: are < or = 1 cm distal margins sufficient? Ann Surg Oncol. 2001; 8:163–169.
25. Park JS, Sakai Y, Simon NS, Law WL, Kim HR, Oh JH, et al. Long-term survival and local relapse following surgery without radiotherapy for locally advanced upper rectal cancer: an international multi-institutional study. Medicine (Baltimore). 2016; 95:e2990.
26. Shepherd NA, Baxter KJ, Love SB. Influence of local peritoneal involvement on pelvic recurrence and prognosis in rectal cancer. J Clin Pathol. 1995; 48:849–855.
27. Bhoday J, Balyasnikova S, Wale A, Brown G. How should imaging direct/orient management of rectal cancer? Clin Colon Rectal Surg. 2017; 30:297–312.
28. Al-Sukhni E, Milot L, Fruitman M, Beyene J, Victor JC, Schmocker S, et al. Diagnostic accuracy of MRI for assessment of T category, lymph node metastases, and circumferential resection margin involvement in patients with rectal cancer: a systematic review and meta-analysis. Ann Surg Oncol. 2012; 19:2212–2223.
29. Puli SR, Bechtold ML, Reddy JB, Choudhary A, Antillon MR, Brugge WR. How good is endoscopic ultrasound in differentiating various T stages of rectal cancer? Meta-analysis and systematic review. Ann Surg Oncol. 2009; 16:254–265.
30. Taylor FG, Quirke P, Heald RJ, Moran B, Blomqvist L, Swift I, et al. Preoperative high-resolution magnetic resonance imaging can identify good prognosis stage I, II, and III rectal cancer best managed by surgery alone: a prospective, multicenter, European study. Ann Surg. 2011; 253:711–719.
31. Merkel S, Mansmann U, Siassi M, Papadopoulos T, Hohenberger W, Hermanek P. The prognostic inhomogeneity in pT3 rectal carcinomas. Int J Colorectal Dis. 2001; 16:298–304.
32. Gollub MJ, Arya S, Beets-Tan RG, DePrisco G, Gonen M, Jhaveri K, et al. Use of magnetic resonance imaging in rectal cancer patients: Society of Abdominal Radiology (SAR) rectal cancer disease-focused panel (DFP) recommendations 2017. Abdom Radiol (NY). 2018; 43:2893–2902.
33. Hermanek P, Henson DE, Hutter RV, Sobin LH. UICC TNM supplement 1993: a commentary on uniform use. Berlin: Springer-Verlag;1993.
34. Siddiqui MRS, Simillis C, Bhoday J, Battersby NJ, Mok J, Rasheed S, et al. A meta-analysis assessing the survival implications of subclassifying T3 rectal tumours. Eur J Cancer. 2018; 104:47–61.
35. Brown G, Richards CJ, Newcombe RG, Dallimore NS, Radcliffe AG, Carey DP, et al. Rectal carcinoma: thinsection MR imaging for staging in 28 patients. Radiology. 1999; 211:215–222.
36. Cho SH, Kim SH, Bae JH, Jang YJ, Kim HJ, Lee D, et al. Prognostic stratification by extramural depth of tumor invasion of primary rectal cancer based on the Radiological Society of North America proposal. AJR Am J Roentgenol. 2014; 202:1238–1244.
37. Park SH. Degree of error of thin-section MR in measuring extramural depth of tumor invasion in patients with rectal cancer. Radiology. 2008; 246:647. author reply 647-648.
38. Georgiou PA, Tekkis PP, Constantinides VA, Patel U, Goldin RD, Darzi AW, et al. Diagnostic accuracy and value of magnetic resonance imaging (MRI) in planning exenterative pelvic surgery for advanced colorectal cancer. Eur J Cancer. 2013; 49:72–81.
39. Quirke P, Steele R, Monson J, Grieve R, Khanna S, Couture J, et al. Effect of the plane of surgery achieved on local recurrence in patients with operable rectal cancer: a prospective study using data from the MRC CR07 and NCIC-CTG CO16 randomised clinical trial. Lancet. 2009; 373:821–828.
40. Chand M, Moran BJ, Jones RG, Heald RJ, Brown G. Lymph node status does not predict local recurrence in the total mesorectal excision era. Dis Colon Rectum. 2014; 57:127–129.
41. Ruppert R, Junginger T, Ptok H, Strassburg J, Maurer CA, Brosi P, et al. Oncological outcome after MRI-based selection for neoadjuvant chemoradiotherapy in the OCUM Rectal Cancer Trial. Br J Surg. 2018; 105:1519–1529.
42. Brown G, Richards CJ, Bourne MW, Newcombe RG, Radcliffe AG, Dallimore NS, et al. Morphologic predictors of lymph node status in rectal cancer with use of high-spatial-resolution MR imaging with histopathologic comparison. Radiology. 2003; 227:371–377.
43. Kim JH, Beets GL, Kim MJ, Kessels AG, Beets-Tan RG. High-resolution MR imaging for nodal staging in rectal cancer: are there any criteria in addition to the size? Eur J Radiol. 2004; 52:78–83.
44. Cai JH, Liu J, Ikeguch M, Yan QH, Zhou BJ, Song WQ, et al. Clinical significance of micrometastasis in lymph nodes and microinvasion in primary lesion in submucosal gastric cancer. Zhonghua Wai Ke Za Zhi. 2005; 43:161–165.
45. Salerno GV, Daniels IR, Moran BJ, Heald RJ, Thomas K, Brown G. Magnetic resonance imaging prediction of an involved surgical resection margin in low rectal cancer. Dis Colon Rectum. 2009; 52:632–639.
46. Shihab OC, Moran BJ, Heald RJ, Quirke P, Brown G. MRI staging of low rectal cancer. Eur Radiol. 2009; 19:643–650.
47. Shihab OC, Heald RJ, Rullier E, Brown G, Holm T, Quirke P, et al. Defining the surgical planes on MRI improves surgery for cancer of the low rectum. Lancet Oncol. 2009; 10:1207–1211.
48. Battersby NJ, How P, Moran B, Stelzner S, West NP, Branagan G, et al. Prospective validation of a low rectal cancer magnetic resonance imaging staging system and development of a local recurrence risk stratification model: the MERCURY II study. Ann Surg. 2016; 263:751–760.
49. Nagtegaal ID, Quirke P. What is the role for the circumferential margin in the modern treatment of rectal cancer? J Clin Oncol. 2008; 26:303–312.
50. Adam IJ, Mohamdee MO, Martin IG, Scott N, Finan PJ, Johnston D, et al. Role of circumferential margin involvement in the local recurrence of rectal cancer. Lancet. 1994; 344:707–711.
51. Shihab OC, Quirke P, Heald RJ, Moran BJ, Brown G. Magnetic resonance imaging-detected lymph nodes close to the mesorectal fascia are rarely a cause of margin involvement after total mesorectal excision. Br J Surg. 2010; 97:1431–1436.
52. Nagtegaal ID, Marijnen CA, Kranenbarg EK, Van de Velde CJ, Van Krieken JH. Pathology Review Committee. Cooperative Clinical Investigators. Circumferential margin involvement is still an important predictor of local recurrence in rectal carcinoma: not one millimeter but two millimeters is the limit. Am J Surg Pathol. 2002; 26:350–357.
53. Xie H, Zhou X, Zhuo Z, Che S, Xie L, Fu W. Effectiveness of MRI for the assessment of mesorectal fascia involvement in patients with rectal cancer: a systematic review and meta-analysis. Dig Surg. 2014; 31:123–134.
54. Chand M, Siddiqui MR, Swift I, Brown G. Systematic review of prognostic importance of extramural venous invasion in rectal cancer. World J Gastroenterol. 2016; 22:1721–1726.
55. Chand M, Palmer T, Blomqvist L, Nagtegaal I, West N, Brown G. Evidence for radiological and histopathological prognostic importance of detecting extramural venous invasion in rectal cancer: recommendations for radiology and histopathology reporting. Colorectal Dis. 2015; 17:468–473.
56. Siddiqui MRS, Simillis C, Hunter C, Chand M, Bhoday J, Garant A, et al. A meta-analysis comparing the risk of metastases in patients with rectal cancer and MRI-detected extramural vascular invasion (mrEMVI) vs mrEMVI-negative cases. Br J Cancer. 2017; 116:1513–1519.
57. Bae JS, Kim SH, Hur BY, Chang W, Park J, Park HE, et al. Prognostic value of MRI in assessing extramural venous invasion in rectal cancer: multi-readers' diagnostic performance. Eur Radiol. 2019; 01. 07. DOI: 10.1007/s00330-018-5926-9. [Epub]. Available at. .
58. Jhaveri KS, Hosseini-Nik H, Thipphavong S, Assarzadegan N, Menezes RJ, Kennedy ED, et al. MRI detection of extramural venous invasion in rectal cancer: correlation with histopathology using elastin stain. AJR Am J Roentgenol. 2016; 206:747–755.
59. Smith NJ, Barbachano Y, Norman AR, Swift RI, Abulafi AM, Brown G. Prognostic significance of magnetic resonance imaging-detected extramural vascular invasion in rectal cancer. Br J Surg. 2008; 95:229–236.
60. Sohn B, Lim JS, Kim H, Myoung S, Choi J, Kim NK, et al. MRI-detected extramural vascular invasion is an independent prognostic factor for synchronous metastasis in patients with rectal cancer. Eur Radiol. 2015; 25:1347–1355.




 PDF
PDF ePub
ePub Citation
Citation Print
Print





 XML Download
XML Download