Abstract
척수 손상은 중추 신경계의 손상으로 신경학적 회복이 어려운 것으로 알려져 있었으나 최근 그 병태 생리에 대한 이해의 발전과 함께 다양한 신경 보호적 시도 및 신경 재생에 대한 시도가 보고되어 이에 대한 새로운 치료적 접근법이 제시되고 있다. 이에 본 종설에서는 제시되고 있는 병태 생리와 함께 신경학적 재생을 위한 실험적 연구의 내용을 정리하며, 임상적 시도에 대하여 현재까지의 결과와 함께 향후 객관적이며 안전한 임상적 적용을 위한 선행 조건 등에 대하여 정리하여 보고자 한다.
초록
Recent advances in the understanding of the pathophysiology of spinal cord injury (SCI) and new therapeutic approaches have provided promising results for this incurable and debilitating central nervous system injury. Various neuro-protective and neuro-regenerative trials have been attempted to overcome SCIs. This review summarizes the reported experimental and clinical data regarding neuro-regenerative trials with the proven pathophysiology of SCI. In addition, the prerequisites for safe and effective clinical trials are discussed.
척수 손상(spinal cord injury)은 중추 신경계(central nervous system)의 손상으로서 내과적, 외과적 치료의 비약적인 발전에도 불구하고 현재까지 명확한 치료 방침이 제시된 바가 없다. 최근 들어 척수 손상과 관련된 다양한 임상 시험들이 보고되고 있으며, 시험을 통해 축적된 지식들을 토대로 향후 척수 손상 치료의 가능성을 높일 것으로 예상한다. 이러한 임상 시험 결과를 실제적으로 임상에 안전하고 효과적으로 적용하기 위해서는 객관적이고 신뢰성 있는 근거를 요하게 되는데, 이에 본 저자들은 척수 손상의 병태 생리학 및 신경 재생에 대해 최근에 보고된 임상 전 단계(preclinical) 및 임상 시험(clinical trial)을 고찰하여 척수 손상 재생에 대한 실험적 연구(therapeutic trials)의 현 주소를 알아보고자 한다.
현재 대한민국에서의 척수 손상 발병률에 대한 통계는 보고된 바 없지만, 척수 손상과 관련된 북미(North America)의 역학 조사에 의하면 척수 손상의 전체 연간 발병률은 백만 명당 15에서 40건으로 추산되며, 이로 인해 척수 손상 환자와 그 가족들의 신체적, 사회, 경제적 부담이 늘어나게 된다고 보고되었다.1) 척수 손상으로 인한 경제적 부담을 북미 기준으로 보았을 때, 25세 환자가 상부 경추 손상(high cervical injury)으로 사지 마비(tetraplegia)가 발생하였을 경우 연간 약 3백만 달러 가량의 경비가 소요된다고 보고되었다.2) 척수 손상의 주요 원인으로는 교통사고(50%), 낙상 및 산업재해(30%), 폭력 범죄(11%), 스포츠 부상(9%) 등이고, 신체 활동과 관련성이 높아 10대 및 20대에서 주로 발생한다고 알려져 있다.3) 생체 역학적 특징에 따라 상대적으로 유연한 분절, 특히 경추 분절에서 척수 손상이 호발하며, 경추에서 발생할 경우 심각한 신경학적 합병증을 동반하게 되고,4) 이어서 척추증(preexisting spondylosis)을 가지고 있던 50세 이상에서 경도의 외상으로 척수 손상이 발생하는 경우가 두 번째로 흔하다고 보고되었다. 외상성 척수 손상 외에도 종양이나 탈수초성 질환과 같은 다른 원인에 인한 척수 손상 환자가 증가하고 있으며, 전이성 종양의 경막 외 척수 압박(metastatic epidural spinal cord compression, MESCC)은 비 외상성 척수 손상의 원인 중 하나다. MESCC는 암 환자의 5%–10%에서 발생하며, 골반 이외에 전이가 있는 환자들 중 40%에서 MESCC가 발생한다고 알려져 있다.567) 외상성 척수 손상과 MESCC는 발생 기전이 다르지만 MESCC도 추후 척수 손상의 주요한 원인을 차지하게 될 것이라 생각된다. 척수 손상의 정도 측면에서는 40년 전 3분의 2가 완전 마비 환자였으나 최근 조사에서는 그 비율이 감소하여 약 45%가 완전 마비를 보인다고 보고되었다.3)
척수 손상의 병태 생리에 대한 연구는 척수 손상 조직을 인체에서 확보하는 것 자체가 제한점이 많아 대부분의 병태 생리 연구는 쥐, 영장류를 대상으로 하는 동물 실험으로 진행되었다. 실험 대상의 종에 따라 척수 손상 후 발생하는 현상은 차이를 분명히 보이지만 전반적으로 서로 유사한 것으로 알려져 있다. 현재 척수 손상의 병태 생리학은 1차 손상과 2차 손상의 두 단계로 설명하고 있다. 첫 번째 단계인 1차 손상은 척수의 기계적인 손상으로 설명하고, 두 번째 단계로는 1차 손상 이후에 오게 되는 2차 손상이 있다. 이러한 현상은 척추의 골절 탈구, 방출성 골절, 자상, 급성 추간판 파열에 의한다. 전단력(shear stress)이나 신연력(distraction stress) 역시 물리적인 손상 기전 중 하나로 설명한다. 대부분의 임상 상황에서 해부학적인 절단(anatomical severance)은 관찰되지 않는다. 그러므로 척수 손상 환자를 치료하는 데 있어서 일차 손상 후에 발생하는 2차 손상에 초점을 맞추게 되며, 이러한 2차 손상으로 인해 손상된 부위가 파급되는 것을 막는 것이 척추 손상 환자의 주된 치료 목적이 되는 것으로 알려져 있다.8) 동물 실험 결과 수상 전 축삭(axon)의 전체 양 중 5%에 해당하는 부분만 유지가 되도 신경학적 기능의 유지가 가능한 것을 보고하였다. 그러므로 신경 세포(neuronal cell)와 축삭의 소실을 최소화하는 것이 중요한 치료 목적이 되야 할 것으로 알려져 있다.910)
2차 손상 과정은 손상 이후 경과 시간과 병태 생리학적 기준에 따라 총 3단계로 나뉘며 이는 급성기(acute phase), 아급성기(또는 중간; subacute phase) 및 만성기(chronic phase)로 나뉜다(Fig. 1). 급성기는 초기의 물리적인 손상 후에 48시간 가량 지속되며, 혈관 파괴(vascular disruption), 출혈(hemorrhage) 및 그로 인한 허혈(ischemia)이 관찰된다고 보고되었다.111213) 미세 순환이 손상되면 이온 조절 장애(ionic dysregulation), 흥분 독성(excitotoxicity), 자유 라디칼(free radical)의 과도한 생성 및 염증 반응과 같은 병리학적인 변화를 보이며, 이는 신경 세포(neuron) 및 신경 교세포(glial cell)의 추가 손상과 밀접한 관련성을 가지고 있다고 알려져 있다.11141516)
첫 번째로, 흥분 독성(excitotoxicity)은 중추 신경계에서 관찰되는 독특한 병리학적인 과정으로서 흥분성 신경 전달 물질(excitatory neurotransmitters; ex., glutamate, asparate)의 과도한 활성화가 원인이며, 흥분성 신경 전달 물질의 과도한 분비는 신경 세포 및 신경 교세포, 특히 희소 돌기 아교세포(oligodendrocytes)의 세포 자멸사(apoptosis)를 유발하게 된다고 보고되었다.171819) N-methyl-D-asparate and AMPA-kainate (a-amino-3-hydroxy-5methylisoxazole-4-propionate-kainate)에 의해 매개되는 세포 내 나트륨 및 칼슘의 변화는 세포 독성 부종, 산화를 일으키며 phospholipase, protease 및 nuclease와 같은 효소들을 활성화시켜 세포 구조를 파괴하고 세포 사멸을 유도하게 된다.
둘째로, 자유 라디칼로 인한 지질 과산화(lipid peroxidation)는 세포막 손상을 일으켜 세포 용해, 신경 세포의 기능 장애 및 세포 내 이온 항상성의 조절 장애를 유발하게 된다고 알려져 있다.2021) 손상 과정 중에 형성되는 자유 라디칼 중에서 활성 산소(reactive oxygen species, ROS)가 가장 중요한데, 이들 ROS의 농도는 손상 12시간째 가장 높게 나타나며, 1주일간 상승된 채로 유지되다가 4–5주차에 기저 농도로 되돌아오게 된다고 보고되었다.21) 과도한 ROS의 생성은 허혈 이후 재관류(reperfusion)와 관련이 있다. 다양한 동물 실험들을 통해 이러한 병리학적 기전을 조절하고자 하는 노력들이 있었고, 항산화제(antioxidant)가 신경 보호(neuroprotective) 효과가 존재함을 보고하였다. 더욱이 척수 손상 후 methylprednisolone 사용은 지질 과산화를 억제하는 측면에서 신경 보호적 기능이 있다고 보고하였고, 시험적 치료에서 항산화제의 신경 보호 효과가 밝혀졌다.11)
셋째로, 척수 손상 후에는 혈액 뇌 장벽(brain blood barrier, BBB) 역시 변화하게 된다. 혈관 내피 세포의 파괴, 성상 세포(astrocyte; 중추 신경계의 BBB의 구성 요소 중 하나)의 기능 상실, 종양괴사인자 α (tumor necrosis factor-α, TNF-α) 및 interleukin-1β (IL-1β)와 같은 다양한 염증성 사이토카인에 의한 투과성의 직접 증가가 BBB 변화와 관련이 있는 것으로 알려져 있다.2223) 척수 손상 이후 2차 손상은 세포 및 호르몬과 관련된 염증 기전과 밀접한 관련성이 있으며, 내장 미세 아교세포, T-세포, 성상 세포 및 대식세포(macrophage)는 주요 염증 반응에 관여하는 것으로 알려져 있다.202425) 세포 및 호르몬의 염증 기전 활성화는 결과적으로 세포 괴사, 세포 사멸, 자유 라디칼 생성 및 BBB의 직접 또는 간접적인 투과성 증가와 같은 다른 2차 손상과 관련 있다. 최근 보고에서 염증성 사이토카인 및 대식 세포에 의해 유발되는 신경염증(neuroinflammation)의 이중 효과를 발표하였고, 유익한 면과 유해한 면이 동시에 존재함이 보고되었다.24262728)
신경 세포와 신경 교세포의 능동적 혹은 수동적 세포 사멸 기전은 신경 세포의 기능 손실과 밀접하며, 괴사로 인한 신경 세포의 손실은 주로 척추손상의 모든 단계에서 일어난다고 알려져 있다.29) 하지만 세포 자멸사 기전이 세포 사멸과 관련이 있는지 여부는 연구 중이다.303132) 특히 희소 돌기 아교세포는 세포 자멸사에 감수성이 높은 것으로 알려져 있다.3334) 희소 돌기 아교세포의 손실은 축색 탈수초(axonal demyelination)를 일으키게 되는데 이는 쥐를 대상으로 한 동물 실험에서 24시간째에 최고점을 보였다.35) 희소 돌기 아교세포 및 축색 탈수초는 임상적 증상과 관련 깊은 중요한 병리학적인 변화로 알려져 있다. 그러나 사체 연구 및 일부의 동물 연구에서는 축색 탈수초가 없거나 일부의 축색만이 탈수초화가 되어 있는 것을 발표하였는데 이는 척수 손상과 이에 따른 탈수초화와 재수초화(remyelination)의 역할을 이해하기 위해서는 더 많은 연구가 필요하다는 점을 시사한다.1036)
아급성기는 척수 손상 후 2주까지며, 이 단계에서는 식세포 반응(phagocytic response)이 특징적이다. 아급성기의 또 다른 특징으로는 성상 교세포의 반응성 증식으로서 성상 아교세포 반흔(astrocytic glial scar)의 형성을 유발하며, 이는 중추 신경계 손상 후 신경 조직의 재생을 막는다. 하지만 이 과정을 척추 손상 부위에서 비정상 시냅스가 형성되는 것을 억제하는 보호 기전으로 본다면, 성상 교세포의 반응성 증식은 유해한 면과 유익한 영향이 동시에 존재한다고 생각할 수 있다.37383940) 신경 교세포 반흔 형성 외에도 성상세포는 미세 환경 항상성(microenvironment homeostasis)의 복원에 기여한다. 이는 부종의 해소에 중요하며, BBB의 강도를 유지하여 면역 세포의 침투를 제한할 수 있도록 한다고 보고되었다.41) 이후 단계에서 성상 교세포는 transforming growth factor-β, glial cell-derived neurotrophic factor, fibroblast growth factor-β (FGF-β)와 vascular endothelial growth factor 같은 다양한 사이토카인을 만들면서 복원을 돕는다고 알려져 있다.3842) 이들 성장 인자 중 일부는 희소 돌기 아교세포 전구체 세포를 이동시키도록 하여 증식 및 분화를 촉진하도록 한다.
만성기의 정의에 대해서는 이견이 있지만 일반적으로 수상 후 6개월 이후의 기간을 만성기라고 보고 있다.43) 병변이 성숙해지면서 반흔이 형성되고 척수구멍(syrinx)이 발달되는 특징은 척수 손상 만성기의 특징적인 소견이다. 이 만성 단계에서의 치료 전략은 손상된 축색 돌기의 재생 및 다양한 약리학적 수단 또는 세포 이식 요법을 이용한 재수초화에 초점을 맞춘다. 이 단계에서의 또 다른 연구 목표는 병리학적 장벽인 아교세포 반흔을 극복하는 것이다.
척수 손상이 발생하고 난 후에는 신경 세포 및 아교세포가 사멸되는 단계를 거치는데, 이 단계로 인해 희소 돌기 아교세포가 소실되면서 탈수초화가 진행되고 신경 세포가 소실되면서 축삭의 소실이 동반되게 된다. 척수 손상으로 인하여 손상을 받은 신경 조직들을 재생시키는 데 목적을 둔 연구들은 위에 언급한 현상들에 집중하였다. 신경 조직을 이루는 세포들의 합성을 증가시키고, 신경 성장을 향상시키면서 재생을 막는 장벽을 극복하고자 하는 다양한 방법들이 신경 재생 실험 분야에서 제시되었다
척수 손상이 발생한 이후 신경 조직은 자발적인 기전으로 재수초화가 이루어지는 것으로 알려져 있다. 척수 손상 동물 모델을 이용하여 신경 전구 세포 이식 후 재수초화가 증가하는 것과 신경의 기능적 회복과는 밀접한 관련이 있는 것으로 보고되었다.444546) 조직학적으로 재수초화를 개선하기 위한 다음의 두 가지 접근법이 존재하는데, 이는 (1) 세포 이식(cellular transplantation)과 (2) 내인성 수복 과정의 향상(endogenous repair process)으로서 이와 관련한 실험이 많이 이루어졌다. 이식을 위한 세포 공급원으로 제시된 세포로는 Schwann cell, olfactory ensheathing cell, neural progenitor cells, oligodendrocyte progenitor cells (OPCs) 등이 있고 이 중에서 OPCs가 가장 널리 연구되고 있다.4748495051) Schwann cell은 말초신경계의 수초화된 세포로서 말초신경계의 재생에 핵심적인 역할을 하며, 말초 신경계에서 쉽게 채취할 수 있고 in vitro에서 배양 후 자가이식 방식으로 재이식을 할 수 있는 장점이 있으며 척수 손상에서 내인성 치료 과정에 관련된 것으로 밝혀졌다.4752) 손상된 척수 주변에서 신경 뿌리(nerve root)의 출구 주변으로 이들 세포가 이동하는 것이 관찰되었다. 또한 말초 신경 분절 이식편은 축삭 재생과 재수초화를 입증했다.53) 그러나 아교세포 반흔으로 인한 억제 작용으로 인해 이식편 뒤의 축색 돌기가 성장의 제한을 받기 때문에 임상적 적용에는 여전히 한계가 있다. 쥐의 척수 손상 모델에 인간 배아 줄기 세포(human embryonic stem cell) 유래 OPCs를 이식하였을 때 재수초화가 촉진되고 운동 기능이 향상되는 것을 보고하였다.5455) 이 연구에서는 이식 시간에 따라 결과 차이가 발생한 것을 밝혔는데, 척수 손상 1주 후, OPCs를 이식하자 백질(white matter) 전반에 걸친 희소 돌기 아교세포가 재확산되었고, 대조군의 내인성 재수초화와 비교하여 재수초화된 축색 돌기의 총량은 136% 증가한 것을 관찰할 수 있었다. 그리고 10개월 이후에 이식한 군들은 내인성 재수초화와 비교하였을 때 큰 차이를 보이지 않았다. 척수 손상 만성기에서는 조직학적으로 광범위한 astrogliosis와 성상 교세포 돌기를 통해 축삭이 이식된 소견이 관찰되고, 이는 재수초화를 억제하는 기전이 있다는 근거가 되며, OPCs 외에도 다른 세포를 이식한 실험에서도 이와 비슷한 결과를 보였다. 하지만 대부분의 연구자들은 재수초화를 촉진시킬 목적으로 세포를 이식한 후에 임상적 증상이 호전되는 기전을 설명하면서 재수초화가 세포 이식의 이점들 중 하나임을 주장했다. 이러한 임상 시험의 기능과 효과로서 신경 영양 인자, 면역계의 조절 및 내인성 OPCs 재수초화가 제시되고 있다. 잠재적 효과에 대한 명확한 기전을 밝히기 위하여 더 자세한 연구가 필요하다. 내인성 수복 과정을 향상시키는 것은 재수초화의 또 다른 중요한 점이라 할 수 있다. 척수 손상으로 인한 병적 조건에서 주변 신경 세포로부터 OPCs를 모집하는 것 외에도 상피성 줄기 세포 또는 다른 신경 줄기 세포와의 OPCs의 분화가 관찰되었다.5657) 이를 바탕으로 FGF, insulin growth factor 1, ciliary neurotrophic factor가 OPCs의 증식에 긍정적인 효과를 나타내는 것으로 보고되었다.5859)
현 시점에서 척수 손상 후 신경 재생에는 두 가지 측면에서 한계가 있음을 알 수 있다: 첫째, 신경의 내재적 재생 잠재력은 매우 제한적이며 둘째, 중추 신경은 손상 후 재생이 억제되는 면이 있다. 중추 신경과 말초 신경의 수초를 비교해보면 중추 신경의 백질(white matter)이 축색 돌기 성장을 선택적으로 억제한다는 사실이 밝혀졌다. 1980년대 후반, Caroni와 Schwab6061)은 희소 돌기 아교세포 축삭이 중추 신경계에서 축삭 성장의 주요 억제제임을 입증했다. 이들 myelin 표본(Nogo로 알려진 NI 35 및 NI 250)에서 2개의 억제 분획(35 및 250 kDa)이 확인되었으며, 이들 억제 인자를 차단하기 위해 단일 클론 항체(IN-1)가 개발되었다. IN-1 항체는 척수 손상 후 중등도의 축삭 재생 및 기능 회복 효과도 보였다. Nogo뿐만 아니라 myelin associated glycoprotein, oligodendrocyte myelin glycoprotein, semaphoring 4D 및 ephrin B3도 내인 억제 인자로 알려져 있다. 최근 분자 신경 과학의 발전으로, 축삭과 관련된 억제 인자는 신경 세포 내에서 공통 경로를 통해 작동한다는 것이 밝혀졌다. 즉 억제 인자들이 신경 세포 표면 수용체에 부착하고, 이후 Rho-A GTPase와 Rho kinase에 의해 활성화 단계가 조절된다고 보고되었다.62) Rho/ROCK 경로는 actin-myosin 네트워크의 조절을 통해 성장 억제 효과를 나타낸다. ROCK 경로의 활성화는 myosin light chain의 phosphorylation, myosin phosphase의 억제, actin-depolymerizing factor colfin의 불활성화를 통해 actin-myosin 수축성을 강화시킨다. 이러한 분자적 기전을 통해 신경 돌기 수축을 유도하고 성장 돌기 붕괴를 유도하게 된다. 이러한 재수초화 과정에 작용하는 분자학적 연쇄 반응과 효과는 동물 실험으로 증명되었다.6364) Rho/ROCK 경로의 억제는 또한 축삭 재생 및 척수 손상의 동물 모델에서 기능 향상을 나타내었다. Rho/ROCK 경로 차단제(Rho 길항제인 C3 ribosyltransferase, ROCK 특이 억제제인 Y-27632)가 개발되고 시도되고 있다고 알려져 있다.6566) 이러한 전임상 단계 시험 결과에 따르면 C3 transferase를 사용한 37명의 비통제 환자들에게서 19.4%가 6개월 후 최신 척추 손상 협회(American Spinal injury Association, ASIA) 등급이 2단계 이상으로 개선되었다고 보고되었다.67) 무작위 통제 연구에 의한 추가 연구가 필요한 시점이다. 중추 신경 손상 시 콘드로이틴 황산 프로테오글리칸(chondroitin sulfate proteoglycan, CSPG)은 축삭 재생을 억제하는 역할을 한다. CSPG는 단백질 핵과 공유 결합된 프로테오글리칸으로 구성되어 있으며 축삭 재생에 대한 화학적 및 물리적 장애와 관련이 있다. 분해 효소인 chondroitinase ABC (ChABC)는 CSPG의 핵심 단백질에서 억제성 glycosaminoglycan을 절단하여 손상되지 않은 CSPG의 축삭 성장 억제 특성을 제거한다. 이에 다양한 동물 연구를 통해 ChABC의 국소 및 전신 투여를 통해 CSPG의 분해는 손상된 중추 신경의 미세 환경을 축삭 재생이 되게끔 조성해주고, ChABC를 이용한 proteoglycan 억제를 극복하여 축삭 성장을 촉진하고 기능 회복을 향상시키는 것으로 나타났다.6869707172) 이후에도 다양한 동물 연구에서 ChABC 투여를 사용한 신경 영양 인자와 세포 치료법의 병용 요법이 보고되었다. ChABC와 관련하여 현재 진행중인 임상 시험은 없지만 ChABC는 향후 흥미로운 주제가 될 것으로 생각한다.
척수 손상에서 신경 재생 실험뿐만 아니라 다양한 세포원을 이용한 세포 치료법(cell therapy)과 이식된 세포의 다양한 조작법이 척수 손상의 치료에 광범위하게 사용되었다. 하지만 이식 세포가 기능적인 신경 세포로 분화하는지에 대한 근거는 부족한 편이다.73) 그 동안의 실험에서 이식 세포를 뉴런 및 희소 돌기 아교세포와 같은 기능성 세포로의 유도를 시도해왔지만, 이식 된 세포의 in vivo 상태에서의 역할에 대한 더 많은 연구가 필요하다. 특히 병적인 상태에서 이식된 세포의 생존 역시 고려해야 할 문제다. Nishimura 등74)은 생물 발광(bioluminescence) 기법을 이용하여 만성 척수 손상에서 세포 이식 6주 후에 약 8%의 세포만이 생존하였고, 이는 세포 이식 치료가 기능 세포로의 직접적인 분화를 기대하기 보다 이식된 세포의 간접적인 역할을 기대해야 한다는 것을 의미한다.
이식된 세포는 신경 재생을 하는 과정에서 신경 영양 물질을 분비하면서 간접적인 치료 효과를 보인다. 신경 발달 인자의 분비는 in vitro, in vivo 시험들에서 밝혀졌다. 예를 들어, in vitro 상황에서 bone marrow derived mesenchymal stem cells (BMSCs)는 세포 외 기질(extracellular matrix)을 분비하여 성인 후근신경절 신경 세포(dorsal root ganglia neuron)의 축삭 성장을 유도하였다. 2006년 Crigler 등75)은 신경 모세포종(neuroblastoma) 세포 또는 후근신경절 신경 세포와 함께 배양할 때, BMSCs는 brain derived growth factor와 nerve growth factor를 분비한다는 것을 보고하였다. 줄기 세포, 특히 MSCs와 neural stem cell (NSCs)의 이식 후 유익한 효과 중 하나로 면역 조절 효과가 제시되고 있는데, 척수 손상 급성기의 병태 생리학을 고려할 때, 면역 반응과 염증의 조절은 신경 보호 측면에서 주된 치료의 목표가 될 수 있다. 면역 조절 반응은 T-세포를 억제하고 사이토카인의 변화(IL-1β와 IL-6의 감소, IL-10 증가), 성상 교세포 및 미세 아교세포의 증식을 통해 이루어졌다고 보고되었다.7677) 그러나 위의 연구에서는 이식된 MSCs/NSCs와 숙주 세포의 상호 작용에 대한 근거를 제시하지는 못하였다. Nakajima 등78)은 좌상성 척수 손상 중심부에 MSCs/NSCs 이식이 대식 세포가 고전적인 활성화(M1)에서 대체 활성화(M2)로의 전환과 관련 있음을 밝혔다. 또한 병변 부위에서 IL-4, IL-14의 증가 및 IL-6, TNF-α의 감소와 관련 있다. 반대로 Hawryluk 등79)은 BMSCs의 척수강 내 주사는 IL-1β의 증가를 유도하여 염증의 유도를 조장하는 것으로 보고하기도 하였다. MSC/NSC의 항 세포 사멸 효과(anti-apoptotic effect)는 in vitro와 in vivo에서 증명되었다. Dasari 등80)은 척수 손상 모델에서 MSC/NSC는 세포 사멸의 감소 효과를 보여주었다. BMSC가 좌상성 척수 손상에 이식되었을 때 희소 돌기 아교세포와 신경 세포의 caspase-3 발현이 감소하고 terminal deoxynucelotidyl dUTP nick end labeling 양성 세포가 감소함을 제시했다. Pro-apoptotic factor (caspase, 3, 8, 9)의 이러한 감소 효과 이외에도 항-세포 사멸 인자(FLICE inhibitory protein, X-linked apoptosis inhibitor)의 발현이 실험적 연구에 의해 제시되었다.8081) MSCs의 항산화 작용도 많은 연구에서 밝혀졌는데, in vitro 실험에서 세포 생존력은 ROS에 의해 변하지 않았고, ROS에 대한 저항성은 glutathione 가용성과 관련이 있음을 보여졌다. Oh 등82)은 MSC/NSC 공동 배양이 serum deprivation-insult과 과산화수소 스트레스와 같은 유해한 배양 조건으로부터 NSC를 보호한다는 것을 입증했다. 또한 척수 손상에 대한 NSCs와 MSCs의 공동 이식은 병변에서 NSCs의 생존을 향상시킨다는 것을 보여주었다.
위에서 설명한 시험들 이외에도 척수 손상에서 미세 환경의 변화는 치료에 있어서 주요한 표적 중 하나로 생각되고 있다. 미세 환경 변화를 통해 이식된 세포의 생존과 내재적인 줄기 세포 유도를 목표로 한다. 척수 손상 급성기에 이식을 시도하면 이식 부위의 염증이 매우 심한 시기이므로 생착률이 매우 낮으며, 만성 단계에서의 이식을 하였을 때는 아교세포 반흔으로 인해 이식 속도가 낮아지는 제한점이 있어 세포 이식으로 척수 손상을 치료할 시기를 결정하는 것은 중요하다고 알려져 있다.83) 따라서 급성기의 염증 상태를 조절하고 이식된 세포의 생존율을 높이기 위하여 척수 손상의 급성기에 MSC와 NSC를 공동으로 이식하는 시도가 있었다. 이외에도 아교세포 반흔을 극복하기 위해 ChABC를 CSPG 분해에 사용하는 시도도 있었다. Ikegami 등84)은 만성 척수 손상에서 줄기 세포와 ChABC의 병용 요법을 발표하였는데 축삭 성장과 임상적 기능의 개선을 보고하였다. 정상적으로 생리학적 조건하의 CSPG는 안정성을 유지하고 신경 소성에 의한 비정상 시냅스 형성을 예방하는 데 중요한 역할을 하게 된다. 하지만 척수 손상 부위의 gliosis 주변부에는 CSPG가 과발현되어 있고, 이 부위에 ChABC를 투여하는 것은 CSPG의 생리학적 역할을 기초로 한다. 척수 손상에 대한 ChABC 치료가 손상되지 않은 부위의 신경 가소성(plasticity)을 촉진한다는 많은 실험적 연구가 있다. Massey 등85)은 뇌간핵을 부분적으로 탈신경시킨 성인 쥐 후방 경추 척수 손상 모델에서 ChABC 주사 후 뇌간 핵으로 기능성 순환 forelimb sensory afferents가 자라 들어가는 것을 확인했다. Cafferty 등86) 또한 ChABC가 spared-root injury model을 사용하여 척수에서 신경 소성과 기능적 축삭 발아를 촉진한다는 것을 증명했다. 이 보고서는 척수 내 CSPG가 척수 회로의 소성 변화를 막을 수 있다는 증거를 보여주었고, ChABC가 척수의 가소성을 높이고 축삭이 자라나 새로운 회로 형성이 가능함을 증명하였다. 외인성 세포 이식 대신 내인성 신경/전구 세포를 강화하는 것은 윤리적 문제와 세포 조작과 관련하여 발생할 수 있는 문제를 피할 수 있는 유용한 방법 중 하나로 각광받고 있다. 신경 재생을 위한 내인성 원천은 병리학적 조건하에서 모집되는 것으로 잘 알려져 있고, 뇌실막 세포의 뇌실 영역(subventricular zone)이 세포 모집의 원천이다. 척추의 뇌실막세포(ependymal cell)는 복부 신경관에 위치한 신경 상피 줄기 세포로부터 하행 발달하게 된다. 그러나 이 세포의 기능에 대한 지식이 아직 부족한데, 하부 척추에서 뇌실막 세포는 척수 절제 후 재생에 중요한 역할을 하는 것으로 알려져 있지만 재생 능력이 부족한 포유 동물에서의 뇌실막 세포는 재생 기능 대신 내분비 또는 보호 기능과 같은 기능을 발휘한다고 판단된다. 한 연구에서는 척수 손상 후 뇌실막 세포가 반응성 증식을 보이며, 신경 줄기 세포의 성질을 발현한다는 결과를 발표하기도 하였다.878889) 또한 뇌실막 세포에서 유래한 자손이 손상 부위로 이동하고 다계통 세포로 분화하는 것을 보고하는 등, 내인성 재생 능력과 세포의 모집에 대한 다양한 결과가 보고되었다.9091) 이에 대한 정확한 메커니즘과 그 치료 가능성을 밝혀내기 위해서는 추가적인 연구가 필요하다.
척수 손상 치료와 관련한 병태 생리학적 연구의 발전과 방대한 실험적 연구들로 척수 손상 치료의 새로운 패러다임 제시의 가능성을 열었다. 위에 언급한 보고서들을 바탕으로 하여 임상 시험을 시작했으며, 몇몇 연구는 임상적용 직전 단계까지 완성되었다. 또한 일부 실험 요법의 경우 적절한 임상 시험을 생략하고 채택되기도 하였다. 그러나 안전하고 효율적인 임상 적용을 위하여 신뢰성 있는 증거가 반드시 필요하다는 것은 분명하다. 그러므로 신뢰성이 뒷받침되는 결과 평가와 함께 설계 및 통제가 잘된 연구가 필수적이라고 할 수 있겠다. 2007년 국제 포럼(척수 손상 치료를 위한 국제 캠페인, International Campaign for Cures of spinal cord injury Paralysis)은 척수 손상에 대한 임상 실험 지침을 제시했다.9092) National Institute of Health 또한 신뢰할 수 있는 임상 시험에 대한 요건을 제시하였다. 이러한 권고 사항을 요약하자면 다음과 같다: 1) 자연 회복에 대한 이해, 환자의 적절한 선택, 검증력을 높이기 위한 환자 수 목표 설정, 2) 엄격한 포함/제외 기준 및 가능한 혹은 예상 못한 합병증에 대한 설명, 3) 표준화된 치료 프로토콜의 수립, 4) 신뢰성 높은 결과 평가 방법 및 5) 임상 시험의 적절한 단계, 특히 무작위 이중 맹검법; 최신 ASIA 점수는 치료 효과를 평가하는 임상적 평가 기준으로 사용하는데, 손상 척도 ASIA C 및 D에 해당하는 환자에서 자발적인 회복이 가능하므로 연구 대상 선택 단계에서 신경 손상 및 부류의 정확한 평가는 매우 중요하다. 덧붙여 기능적 또는 해부학적 연결성의 회복을 평가하는 다양한 평가 도구 역시 필요하며, 환자의 일상 생활 활동 및 삶의 질에 대한 평가는 임상 평가에 포함되는 것이 좋다. 마지막으로 적절한 수의 환자가 포함되고, 변수가 통제된 맹검 연구 디자인을 통해 연구 결과의 검정력을 강화할 수 있다.
척수 손상은 치료가 불가능하며 영구적인 신경학적 장애를 초래한다고 받아들여지고 있으나 최근 다양한 약물과 저체온 치료 등의 개념들은 척수 손상에 대한 새로운 치료의 가능성을 보여주고 있다. 또한 척수 손상에 대한 신경 재생 접근법에 대한 많은 연구가 제시되어 있으며, 이러한 노력의 일환으로 신경 세포 분화를 촉진하는 세포 치료 또한 새로운 치료법으로 부상하고 있고, 다양한 임상 시험에서 좋은 결과들을 보고되고 있다. 그러나 안전하고 효율적인 임상적 적용을 위해서는 해결해야 할 많은 문제가 여전히 남아 있고, 아직까지 표준화된 치료는 될 수 없는 실정이다. 한편 이러한 임상 시험에 있어서도 그 결과가 객관성이 있으며 재현성이 있는 결과로 제시되기 위하여는 많은 기초적인 연구와 함께 윤리적, 과학적인 연구 설계를 통한 임상적 연구 결과로 제시되어야 할 것이다
Figures and Tables
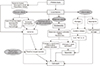 | Figure 1Pathomechanism of spinal cord injuries. Primary injury means direct mechanical injury to the spinal cord. And secondary injury means consequent injury mechanism following direct injury. Ischemia, inflammation, ionic dysfunction, excitotoxicity, and reperfusion mechanism are related to this secondary mechanism. Various trials to intervene these mechanism have been investigated to find the therapeutic strategy for spinal cord injuries. |
References
1. Sekhon LH, Fehlings MG. Epidemiology, demographics, and pathophysiology of acute spinal cord injury. Spine (Phila Pa 1976). 2001; 26:S2–12.

2. Priebe MM, Chiodo AE, Scelza WM, Kirshblum SC, Wuermser LA, Ho CH. Spinal cord injury medicine. 6. Economic and societal issues in spinal cord injury. Arch Phys Med Rehabil. 2007; 88:S84–S88.

3. Ho CH, Wuermser LA, Priebe MM, Chiodo AE, Scelza WM, Kirshblum SC. Spinal cord injury medicine. 1. Epidemiology and classification. Arch Phys Med Rehabil. 2007; 88:S49–S54.

4. National Spinal Cord Injury Statistical Center. Spinal cord injury. Facts and figures at a glance. J Spinal Cord Med. 2005; 28:379–380.
5. Barron KD, Hirano A, Araki S, Terry RD. Experiences with metastatic neoplasms involving the spinal cord. Neurology. 1959; 9:91–106.

6. Gerszten PC, Welch WC. Current surgical management of metastatic spinal disease. Oncology (Williston Park). 2000; 14:1013–1024.
7. Schaberg J, Gainor BJ. A profile of metastatic carcinoma of the spine. Spine (Phila Pa 1976). 1985; 10:19–20.

8. Rowland JW, Hawryluk GW, Kwon B, Fehlings MG. Current status of acute spinal cord injury pathophysiology and emerging therapies: promise on the horizon. Neurosurg Focus. 2008; 25:E2.

9. Fehlings MG, Tator CH. The relationships among the severity of spinal cord injury, residual neurological function, axon counts, and counts of retrogradely labeled neurons after experimental spinal cord injury. Exp Neurol. 1995; 132:220–228.

10. Kakulas BA. Neuropathology: the foundation for new treatments in spinal cord injury. Spinal Cord. 2004; 42:549–563.

11. Kwon BK, Tetzlaff W, Grauer JN, Beiner J, Vaccaro AR. Pathophysiology and pharmacologic treatment of acute spinal cord injury. Spine J. 2004; 4:451–464.

12. Tator CH, Fehlings MG. Review of the secondary injury theory of acute spinal cord trauma with emphasis on vascular mechanisms. J Neurosurg. 1991; 75:15–26.

13. Tator CH, Koyanagi I. Vascular mechanisms in the pathophysiology of human spinal cord injury. J Neurosurg. 1997; 86:483–492.

14. Ha KY, Carragee E, Cheng I, Kwon SE, Kim YH. Pregabalin as a neuroprotector after spinal cord injury in rats: biochemical analysis and effect on glial cells. J Korean Med Sci. 2011; 26:404–411.

15. Ha KY, Kim YH, Rhyu KW, Kwon SE. Pregabalin as a neuroprotector after spinal cord injury in rats. Eur Spine J. 2008; 17:864–872.

16. Schanne FA, Kane AB, Young EE, Farber JL. Calcium dependence of toxic cell death: a final common pathway. Science. 1979; 206:700–702.

17. Li S, Stys PK. Mechanisms of ionotropic glutamate receptor-mediated excitotoxicity in isolated spinal cord white matter. J Neurosci. 2000; 20:1190–1198.

18. Li S, Mealing GA, Morley P, Stys PK. Novel injury mechanism in anoxia and trauma of spinal cord white matter: glutamate release via reverse Na+-dependent glutamate transport. J Neurosci. 1999; 19:RC16.

19. Park E, Velumian AA, Fehlings MG. The role of excitotoxicity in secondary mechanisms of spinal cord injury: a review with an emphasis on the implications for white matter degeneration. J Neurotrauma. 2004; 21:754–774.

20. Donnelly DJ, Popovich PG. Inflammation and its role in neuroprotection, axonal regeneration and functional recovery after spinal cord injury. Exp Neurol. 2008; 209:378–388.

21. Xiong Y, Rabchevsky AG, Hall ED. Role of peroxynitrite in secondary oxidative damage after spinal cord injury. J Neurochem. 2007; 100:639–649.

22. Pineau I, Lacroix S. Proinflammatory cytokine synthesis in the injured mouse spinal cord: multiphasic expression pattern and identification of the cell types involved. J Comp Neurol. 2007; 500:267–285.

23. Noble LJ, Wrathall JR. Distribution and time course of protein extravasation in the rat spinal cord after contusive injury. Brain Res. 1989; 482:57–66.

24. Fleming JC, Norenberg MD, Ramsay DA, et al. The cellular inflammatory response in human spinal cords after injury. Brain. 2006; 129:3249–3269.

25. Popovich PG, Wei P, Stokes BT. Cellular inflammatory response after spinal cord injury in Sprague-Dawley and Lewis rats. J Comp Neurol. 1997; 377:443–464.

26. Bethea JR, Nagashima H, Acosta MC, et al. Systemically administered interleukin-10 reduces tumor necrosis factor-alpha production and significantly improves functional recovery following traumatic spinal cord injury in rats. J Neurotrauma. 1999; 16:851–863.

27. Kim GM, Xu J, Xu J, et al. Tumor necrosis factor receptor deletion reduces nuclear factor-kappaB activation, cellular inhibitor of apoptosis protein 2 expression, and functional recovery after traumatic spinal cord injury. J Neurosci. 2001; 21:6617–6625.
28. Yan P, Li Q, Kim GM, Xu J, Hsu CY, Xu XM. Cellular localization of tumor necrosis factor-alpha following acute spinal cord injury in adult rats. J Neurotrauma. 2001; 18:563–568.
29. Beattie MS, Hermann GE, Rogers RC, Bresnahan JC. Cell death in models of spinal cord injury. Prog Brain Res. 2002; 137:37–47.
30. Fan LH, Wang KZ, Cheng B, Wang CS, Dang XQ. Anti-apoptotic and neuroprotective effects of Tetramethylpyrazine following spinal cord ischemia in rabbits. BMC Neurosci. 2006; 7:48.

31. Lou J, Lenke LG, Ludwig FJ, O'Brien MF. Apoptosis as a mechanism of neuronal cell death following acute experimental spinal cord injury. Spinal Cord. 1998; 36:683–690.

32. Ha KY, Kim YH. Neuroprotective effect of moderate epidural hypothermia after spinal cord injury in rats. Spine (Phila Pa 1976). 2008; 33:2059–2065.

33. Stys PK, Lipton SA. White matter NMDA receptors: an unexpected new therapeutic target? Trends Pharmacol Sci. 2007; 28:561–566.

34. Agrawal SK, Fehlings MG. Mechanisms of secondary injury to spinal cord axons in vitro: role of Na+, Na(+)-K(+)-ATPase, the Na(+)-H+ exchanger, and the Na(+)-Ca2+ exchanger. J Neurosci. 1996; 16:545–552.

35. Totoiu MO, Keirstead HS. Spinal cord injury is accompanied by chronic progressive demyelination. J Comp Neurol. 2005; 486:373–383.

36. Lasiene J, Shupe L, Perlmutter S, Horner P. No evidence for chronic demyelination in spared axons after spinal cord injury in a mouse. J Neurosci. 2008; 28:3887–3896.

37. Anderson CM, Swanson RA. Astrocyte glutamate transport: review of properties, regulation, and physiological functions. Glia. 2000; 32:1–14.

38. Faulkner JR, Herrmann JE, Woo MJ, Tansey KE, Doan NB, Sofroniew MV. Reactive astrocytes protect tissue and preserve function after spinal cord injury. J Neurosci. 2004; 24:2143–2155.

39. Williams A, Piaton G, Lubetzki C. Astrocytes: friends or foes in multiple sclerosis? Glia. 2007; 55:1300–1312.
40. Karimi-Abdolrezaee S, Eftekharpour E, Wang J, Morshead CM, Fehlings MG. Delayed transplantation of adult neural precursor cells promotes remyelination and functional neurological recovery after spinal cord injury. J Neurosci. 2006; 26:3377–3389.

41. Herrmann JE, Imura T, Song B, et al. STAT3 is a critical regulator of astrogliosis and scar formation after spinal cord injury. J Neurosci. 2008; 28:7231–7243.

42. Buffo A, Rolando C, Ceruti S. Astrocytes in the damaged brain: molecular and cellular insights into their reactive response and healing potential. Biochem Pharmacol. 2010; 79:77–89.

43. McDonald JW, Becker D, Sadowsky CL, Jane JA Sr, Conturo TE, Schultz LM. Late recovery following spinal cord injury. Case report and review of the literature. J Neurosurg. 2002; 97:252–265.
44. Duncan ID, Brower A, Kondo Y, Curlee JF Jr, Schultz RD. Extensive remyelination of the CNS leads to functional recovery. Proc Natl Acad Sci U S A. 2009; 106:6832–6836.

45. Liebetanz D, Merkler D. Effects of commissural de- and remyelination on motor skill behaviour in the cuprizone mouse model of multiple sclerosis. Exp Neurol. 2006; 202:217–224.

46. Blight AR. Delayed demyelination and macrophage invasion: a candidate for secondary cell damage in spinal cord injury. Cent Nerv Syst Trauma. 1985; 2:299–315.

47. Biernaskie J, Sparling JS, Liu J, et al. Skin-derived precursors generate myelinating Schwann cells that promote remyelination and functional recovery after contusion spinal cord injury. J Neurosci. 2007; 27:9545–9559.

48. Bretzner F, Plemel JR, Liu J, Richter M, Roskams AJ, Tetzlaff W. Combination of olfactory ensheathing cells with local versus systemic cAMP treatment after a cervical rubrospinal tract injury. J Neurosci Res. 2010; 88:2833–2846.

49. Ramer LM, Au E, Richter MW, Liu J, Tetzlaff W, Roskams AJ. Peripheral olfactory ensheathing cells reduce scar and cavity formation and promote regeneration after spinal cord injury. J Comp Neurol. 2004; 473:1–15.

50. Ramer LM, Richter MW, Roskams AJ, Tetzlaff W, Ramer MS. Peripherally-derived olfactory ensheathing cells do not promote primary afferent regeneration following dorsal root injury. Glia. 2004; 47:189–206.

51. Waxman SG. Axonal conduction and injury in multiple sclerosis: the role of sodium channels. Nat Rev Neurosci. 2006; 7:932–941.

52. Guest JD, Hiester ED, Bunge RP. Demyelination and Schwann cell responses adjacent to injury epicenter cavities following chronic human spinal cord injury. Exp Neurol. 2005; 192:384–393.

53. Cheng H, Cao Y, Olson L. Spinal cord repair in adult paraplegic rats: partial restoration of hind limb function. Science. 1996; 273:510–513.

54. Keirstead HS, Nistor G, Bernal G, et al. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury. J Neurosci. 2005; 25:4694–4705.

55. Nistor GI, Totoiu MO, Haque N, Carpenter MK, Keirstead HS. Human embryonic stem cells differentiate into oligodendrocytes in high purity and myelinate after spinal cord transplantation. Glia. 2005; 49:385–396.

56. Horky LL, Galimi F, Gage FH, Horner PJ. Fate of endogenous stem/progenitor cells following spinal cord injury. J Comp Neurol. 2006; 498:525–538.

57. Lytle JM, Chittajallu R, Wrathall JR, Gallo V. NG2 cell response in the CNP-EGFP mouse after contusive spinal cord injury. Glia. 2009; 57:270–285.

58. Barres BA, Schmid R, Sendnter M, Raff MC. Multiple extracellular signals are required for long-term oligodendrocyte survival. Development. 1993; 118:283–295.

59. Tripathi RB, McTigue DM. Chronically increased ciliary neurotrophic factor and fibroblast growth factor-2 expression after spinal contusion in rats. J Comp Neurol. 2008; 510:129–144.

60. Caroni P, Schwab ME. Antibody against myelin-associated inhibitor of neurite growth neutralizes nonpermissive substrate properties of CNS white matter. Neuron. 1988; 1:85–96.
61. Caroni P, Schwab ME. Two membrane protein fractions from rat central myelin with inhibitory properties for neurite growth and fibroblast spreading. J Cell Biol. 1988; 106:1281–1288.

62. Monnier PP, Sierra A, Schwab JM, Henke-Fahle S, Mueller BK. The Rho/ROCK pathway mediates neurite growth-inhibitory activity associated with the chondroitin sulfate proteoglycans of the CNS glial scar. Mol Cell Neurosci. 2003; 22:319–330.

63. Madura T, Yamashita T, Kubo T, Fujitani M, Hosokawa K, Tohyama M. Activation of Rho in the injured axons following spinal cord injury. EMBO Rep. 2004; 5:412–417.

64. Mueller BK, Mack H, Teusch N. Rho kinase, a promising drug target for neurological disorders. Nat Rev Drug Discov. 2005; 4:387–398.

65. Borisoff JF, Chan CC, Hiebert GW, et al. Suppression of Rho-kinase activity promotes axonal growth on inhibitory CNS substrates. Mol Cell Neurosci. 2003; 22:405–416.

66. Dergham P, Ellezam B, Essagian C, Avedissian H, Lubell WD, McKerracher L. Rho signaling pathway targeted to promote spinal cord repair. J Neurosci. 2002; 22:6570–6577.

67. Benzel EC. Spine surgery: techniques, complication avoidance, and management. 3rd ed. Philadelphia: Elsevier/Saunders;2012.
68. Barritt AW, Davies M, Marchand F, et al. Chondroitinase ABC promotes sprouting of intact and injured spinal systems after spinal cord injury. J Neurosci. 2006; 26:10856–10867.

69. Bradbury EJ, Moon LD, Popat RJ, et al. Chondroitinase ABC promotes functional recovery after spinal cord injury. Nature. 2002; 416:636–640.

70. Caggiano AO, Zimber MP, Ganguly A, Blight AR, Gruskin EA. Chondroitinase ABCI improves locomotion and bladder function following contusion injury of the rat spinal cord. J Neurotrauma. 2005; 22:226–239.

71. Fouad K, Schnell L, Bunge MB, Schwab ME, Liebscher T, Pearse DD. Combining Schwann cell bridges and olfactory-ensheathing glia grafts with chondroitinase promotes locomotor recovery after complete transection of the spinal cord. J Neurosci. 2005; 25:1169–1178.

72. Shields LB, Zhang YP, Burke DA, Gray R, Shields CB. Benefit of chondroitinase ABC on sensory axon regeneration in a laceration model of spinal cord injury in the rat. Surg Neurol. 2008; 69:568–577.

73. Kim JW, Ha KY, Molon JN, Kim YH. Bone marrow-derived mesenchymal stem cell transplantation for chronic spinal cord injury in rats: comparative study between intralesional and intravenous transplantation. Spine (Phila Pa 1976). 2013; 38:E1065–E1074.
74. Nishimura S, Yasuda A, Iwai H, et al. Time-dependent changes in the microenvironment of injured spinal cord affects the therapeutic potential of neural stem cell transplantation for spinal cord injury. Mol Brain. 2013; 6:3.

75. Crigler L, Robey RC, Asawachaicharn A, Gaupp D, Phinney DG. Human mesenchymal stem cell subpopulations express a variety of neuro-regulatory molecules and promote neuronal cell survival and neuritogenesis. Exp Neurol. 2006; 198:54–64.

76. Abrams MB, Dominguez C, Pernold K, et al. Multipotent mesenchymal stromal cells attenuate chronic inflammation and injury-induced sensitivity to mechanical stimuli in experimental spinal cord injury. Restor Neurol Neurosci. 2009; 27:307–321.

77. Bartholomew A, Sturgeon C, Siatskas M, et al. Mesenchymal stem cells suppress lymphocyte proliferation in vitro and prolong skin graft survival in vivo. Exp Hematol. 2002; 30:42–48.

78. Nakajima H, Uchida K, Guerrero AR, et al. Transplantation of mesenchymal stem cells promotes an alternative pathway of macrophage activation and functional recovery after spinal cord injury. J Neurotrauma. 2012; 29:1614–1625.

79. Hawryluk GW, Mothe A, Wang J, Wang S, Tator C, Fehlings MG. An in vivo characterization of trophic factor production following neural precursor cell or bone marrow stromal cell transplantation for spinal cord injury. Stem Cells Dev. 2012; 21:2222–2238.

80. Dasari VR, Veeravalli KK, Tsung AJ, et al. Neuronal apoptosis is inhibited by cord blood stem cells after spinal cord injury. J Neurotrauma. 2009; 26:2057–2069.

81. Dasari VR, Spomar DG, Li L, Gujrati M, Rao JS, Dinh DH. Umbilical cord blood stem cell mediated downregulation of fas improves functional recovery of rats after spinal cord injury. Neurochem Res. 2008; 33:134–149.

82. Oh JS, Kim KN, An SS, et al. Cotransplantation of mouse neural stem cells (mNSCs) with adipose tissue-derived mesenchymal stem cells improves mNSC survival in a rat spinal cord injury model. Cell Transplant. 2011; 20:837–849.

83. Kim DH, Yoo KH, Yim YS, et al. Cotransplanted bone marrow derived mesenchymal stem cells (MSC) enhanced engraftment of hematopoietic stem cells in a MSC-dose dependent manner in NOD/SCID mice. J Korean Med Sci. 2006; 21:1000–1004.

84. Ikegami T, Nakamura M, Yamane J, et al. Chondroitinase ABC combined with neural stem/progenitor cell transplantation enhances graft cell migration and outgrowth of growth-associated protein-43-positive fibers after rat spinal cord injury. Eur J Neurosci. 2005; 22:3036–3046.

85. Massey JM, Amps J, Viapiano MS, et al. Increased chondroitin sulfate proteoglycan expression in denervated brainstem targets following spinal cord injury creates a barrier to axonal regeneration overcome by chondroitinase ABC and neurotrophin-3. Exp Neurol. 2008; 209:426–445.

86. Cafferty WB, Bradbury EJ, Lidierth M, et al. Chondroitinase ABC-mediated plasticity of spinal sensory function. J Neurosci. 2008; 28:11998–12009.

87. Lacroix S, Hamilton LK, Vaugeois A, et al. Central canal ependymal cells proliferate extensively in response to traumatic spinal cord injury but not demyelinating lesions. PLoS One. 2014; 9:e85916.

88. Lee HJ, Wu J, Chung J, Wrathall JR. SOX2 expression is upregulated in adult spinal cord after contusion injury in both oligodendrocyte lineage and ependymal cells. J Neurosci Res. 2013; 91:196–210.

89. Panayiotou E, Malas S. Adult spinal cord ependymal layer: a promising pool of quiescent stem cells to treat spinal cord injury. Front Physiol. 2013; 4:340.

90. Lee JY, Ha KY, Kim JW, Seo JY, Kim YH. Does extracorporeal shock wave introduce alteration of microenvironment in cell therapy for chronic spinal cord injury? Spine (Phila Pa 1976). 2014; 39:E1553–E1559.





 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download