Abstract
사지와 몸통의 연부조직 종양은 정형외과 의사가 직면할 수 있는 흔한 문제이다. 비록 연부조직 종양은 대부분 양성이지만 정형외과 의사는 양성과 악성 종양을 구별할 수 있는 특징을 알고 있어야 한다. 연부조직 종양의 임상적 특징 및 역학을 이해하게 되면 올바른 진단 및 수술적인 치료를 할 수 있게 된다. 종양의 크기와 깊이는 종양의 진단을 위해 가장 중요한 요소이다. 종양의 감별 진단을 하기 위해서 우선적으로 상세한 병력청취와 자세한 신체 검사가 필요하며, 이후 단순 방사선 촬영, 초음파, 자기공명영상(magnetic resonance imaging), 양전자 방출 단층촬영술(positron emission tomography), 컴퓨터 단층촬영(computed tomography), 뼈 스캔, 혈관 조영술 등의 다양한 영상 촬영법을 사용하여 종양을 진단하고 진단된 종양의 특성을 확인하여야 한다. 특히 초음파 검사는 외래에서도 쉽게 수행할 수 있어 유용하다. 그러나 검사자의 숙련도에 따라 검사 정확도의 차이가 발생할 수 있다는 단점이 있다. 종양의 생검을 통한 조직검사는 종양에 대한 모든 영상 검사를 시행한 후 최종적으로 시행하는 것이 원칙이다. 조직 검사를 시행할 때는 세심한 주의를 기울여야 하며, 최종적인 진단 후에는 치료를 위해 다각적인 접근을 시행하여야 하며 필요한 경우에는 경험 있는 근골격계 종양전문의사에게 의뢰하는 것이 필요하다.
초록
Soft tissue masses of the extremities and torso are a common problem encountered by orthopaedic surgeons. Although these soft tissue masses are often benign, orthopaedic surgeons need to recognize the key features differentiating benign and malignant masses. An understanding of the epidemiology and clinical presentation of soft tissue masses is needed to develop a practical approach for evaluation and surgical management. Size and depth are the two most important factors on which triage decisions should be based. In a differential diagnosis of a tumor, it is important to know the characteristics of the soft tissue mass through detailed history taking and physical examinations before the diagnostic procedures. A variety of imaging studies, such as simple radiography, ultrasound, magnetic resonance imaging, positron emission tomography, computed tomography, bone scan, and angiography can be used to diagnose tumors. Know the ledge of advantages and disadvantages of each imaging study is essential for confirming the characteristics of the tumor that can be observed in the image. In particular, ultrasonography is convenient because it can be performed easily in an outpatient clinic and its cost is lower than other image studies. On the other hand, the accuracy of the test is affected by the skill of the examiner. A biopsy should be performed to confirm the tumor and be performed after all imaging studies have been done but before the final treatment of soft tissue tumors. When a biopsy is to be performed, careful attention to detail with respect to multidisciplinary coordination beforehand, cautious execution of the procedure to minimize complications, and expedient follow-up and referral to a musculoskeletal oncologist when appropriate, are essential.
연부조직 종양에서의 이학적 검사는 매우 중요하다. 우선적으로 연부조직 종양이 양성이냐 악성이냐의 감별보다 만져지는 종양이 실제 종양인지의 여부를 확인 감별하는 것이 중요하다. 결절종이나 신경섬유종증, 흑색종 등의 경우에는 특징적으로 보이는 피부 병변의 시진을 통해 의심할 수 있다. 연부조직 종양의 경우 압통이나 염증의 소견이 없는 경우가 대부분이나 종양이 신경 주위에 위치하거나 신경에서 발생한 종양의 경우는 통증과 함께 신경증상을 유발할 수 있으며, 혈관종이나 섬유종증에서도 통증을 동반하는 경우도 있다. 종양의 위치가 천부인지 심부인지, 크기가 어떠한지(Fig. 1), 가동성인지 판단하는 것 또한 중요하다. 육종의 경우 대부분 심부에 위치하며, 5 cm 이상이고 고정되어 있는 경우가 많다.12) 농양인 경우 통증과 염증소견이 함께 관찰되고, 동맥류나 가성 동맥류인 경우 박동성이며, 소음(bruit)이 청취될 수 있다. 결절종인 경우 관절주위에서 관찰되며, 단단하고 불빛을 투과시킬 경우 투조현상(transillumination)이 관찰된다. 신경초종인 경우 Tinel's sign이 주로 관찰되나 특별한 신경증상이 없는 경우도 있다.1234) 육종의 경우 피하 지방층에 존재하는 경우는 드물지만 일부 종양은 발생할 수 있어 크기가 작고 가동성이 있으며 단단하지 않게 만져지는 등 확실한 양성의 확신이 있다면 추적 관찰할 수 있으나 증상이 있거나 크기가 점점 커지는 경우나 크기가 5 cm 이상인 경우에는 생검하는 것이 추천된다. 또한 심부에 위치한 경우는 악성의 가능성이 높기 때문에 위에서 언급한 확실한 양성 소견이 아니라면 추가 검사를 하는 것이 권장된다.1345)
단순 방사선 검사는 골의 이상 유무와 석회화, 연부조직의 음영 등을 확인할 수 있으며 이를 통하여 혈관종, 연골종, 지방종 등을 진단하는 데 도움이 된다(Table 1). 천천히 자라는 연부조직 종양인 경우 이에 의한 국소적인 압력의 증가로 인접 골의 변화가 명확히 구분되는 반응성 변연부 또는 경계와 함께 관찰할 수 있으며, 빨리 자라는 악성의 경우에는 비대칭적인 피질골 파괴가 보일 수 있다. 최근의 디지털화된 영상에서는 더 많은 정보를 얻을 수 있어 대부분 경우 단순 방사선 검사와 함께 다른 영상 검사를 시행한다.
초음파는 종물의 깊이, 밀도 또는 경도(consistency, 고체성 또는 낭종성), 크기 등을 확인하는 데 매우 유용하다. 초음파는 비침습적이고 상대적으로 다른 영상검사에 비해 비용이 낮아 널리 사용되고 있으며 방사선에 노출이 없고 실시간으로 영상을 보면서 생검을 시행할 수 있다는 장점이 있다. 그러나 깊은 위치의 종물을 검사하는 경우, 특히 골조직 근처에 존재하는 병변의 검사 시에는 오류가 발생할 수 있으며, 컴퓨터 단층촬영(computed tomography, CT)이나 자기공명영상(magnetic resonance imaging, MRI)과 비교하면 해부학적 정확성에 차이를 보인다. 초음파는 항암화학요법이나 방사선 치료 등의 비수술적인 치료에서 종양이 반응하는 정도를 종양의 크기 등을 측정하여 판단할 수 있으며, 이러한 정보는 치료의 방침을 결정하는 데 도움이 되기도 한다.6) Color, power Doppler 초음파 검사를 이용하면 근골격계 종양에서의 혈류의 상태나 변화를 알 수 있다. 전반적으로 초음파는 상대적으로 깊지 않은 곳에 위치하는 종양의 생검을 안내하는 데 유용하며, 종양이 고체성인지 낭종성인지 구별하는 데 유용하게 사용될 수 있다(Fig. 2).2)
덩어리, 열감, 부종, 통증 등의 증상이 있는 부위에 대해 초음파 검사를 시행할 수 있으나 초음파 검사를 시행하기에 앞서 반드시 상세한 병력 조사 및 신체검사가 선행되어야 한다.
병력 조사를 통하여 종양의 발현 기간 및 크기 변화, 통증 동반 유무(휴식, 활동, 만질 때 방사통)를 확인하여야 하며, 외상(혈종, 근육파열)과의 연관성과 전신증상(열, 체중감소) 동반 유무를 확인하여야 한다.7) 또한 기타 다른 암과의 연관성, 수술 또는 anticoagulation의 연관성과도 확인이 중요하다. 그 외 병력(신부전, 간경변)을 확인하는 것도 감별에 중요하다.
다음으로 신체 검사를 통해 크기, 위치(superficial, deep), 움직임, 경도, 압통, 박동(pseudoaneurysm, vascular lesion), 피부 색깔 변화, 열감, 발적 등을 확인해야 한다.
병력조사와 신체검사를 충분히 시행한 후 초음파 검사를 시행하게 되는데 병변의 위치에 따라 환자 및 검사자가 편한 자세를 취하도록 하며 환자로 하여금 증상이 있는 위치를 손으로 정확하게 가리키도록 한다. 초음파 검사는 보통 5–15 MHz 선형 탐촉자(linear transducer)를 사용하게 되며 병변의 위치에 맞게 깊이/초점을 조절하고 transverse/longitudinal scan을 시행해야 하며 초음파 검사를 하는 동안 병변이 눌리지 않도록 주의하여야 한다(Fig. 3). 병변의 크기가 큰 경우 panoramic view/extended field-of-view와 subcutaneous tissue, muscle, bone cortex까지 깊은 위치의 연부조직도 확인하는 것이 필요하다
근육 및 건(tendon)을 검사할 때에는 anisotropy artifact를 주의를 하여야 하며, muscle hernia의 경우에는 근육을 수축한 상태에서 초음파 검사를 하거나 증상이 있는 부위가 하지라면 서있는 자세에서 초음파 검사를 하는 것이 도움이 되며 부종이 있는 환자에서는 심부정맥혈전증(deep vein thrombosis) 여부도 함께 조사하여야 한다. 또한 팔다리의 경우 증상이 없는 반대편을 검사하는 것이 도움이 되기도 한다.
전반적인 연부조직 종괴의 평가는 크게 위치, 크기, echogenicity, 경계, 모양, effect on ultrasound (US) beam, compressibility, vascularity, plain radiograph로 세분화할 수 있으며 각각의 기술은 다음과 같다(Table 2).
MRI는 연부조직 종양을 진단하는 가장 유용하고 정확한 진단방법이다. 5 cm 이상의 크기를 가진 심부에 위치한 종양이 MRI에서 heterogenous signal을 나타내면 악성일 가능성이 높으며, MRI에서 피하지방(subcutaneous fat)과 동일한 signal을 homogenous하게 나타낸다면 대부분 지방종일 가능성이 크다. 최근 더욱 발전된 기술로 인해 종양과 신경혈관 구조물과의 관계를 확인할 수 있으며,8) 이로 인해서 수술 전 계획이 더 정확해지고 육종일 경우 더 안전하게 사지 구제술을 시행할 수 있으며 예측 가능한 술식을 시행할 수 있게 되었다.2) 따라서 MRI는 종양의 병기 설정에 필수적인 검사로 인정되고 있다
MRI는 CT와 비교해볼 때 더 나은 해상도와 다방면의 영상을 얻을 수 있으며 방사선의 영향이 없다는 것이 장점이다. 그러나 골에 침범된 병변이나 무기질화, 석회화가 진행되는 병변에서는 CT가 여전히 좋은 해상력을 보인다. 축면(axial) T1 weighted image (T1WI)에서는 수술 전 계획을 위해 정확한 영상을 얻을 수 있으나 T2 weighted image (T2WI)에서는 주변부의 부종 때문에 종양의 크기가 과대 측정되는 경우가 발생한다. 대부분의 연부조직 종양은 T1WI에서는 저 강도 또는 중 등도의 신호 강도를 나타내며, T2WI에서는 고 강도의 신호 강도를 보여 진단적인 특이도 자체는 높지 않은 편이다.91011) 혈종, 지방종, 저 등급의 지방육종, 혈관종, 출혈이 동반된 종양 등은 T1WI에서 고 강도를 보이기도 한다. Gadopentetate dimeglumine이나 다른 gadolinium chelate 등은 MRI의 조영제로 유용하게 사용되는데, 종양과 주변 부종을 감별하는 데 도움이 된다. 고식적인 MRI의 단점을 보완하기 위해 dynamic contrast enhancement (DCE)-MRI가 사용되기 시작하였는데, 수용성의 paramagnetic 조영제를 주입하여 혈관의 관류(perfusion)와 확산(dffusion)을 측정할 수 있어, viable tumor와 술 후/회복기의 조직 또는 nonviable tissue를 감별하는 데 유용하다.911) 따라서 생검 시에 종양 중에서 가장 공격적인 부분을 확인하거나 항암화학요법의 효과를 판정할 때, 염증성 가성종양으로부터 재발을 감별할 때 많이 사용된다.1112) 그러나 DCE-MRI를 시행하는 데 있어서 노력이나 시간을 많이 필요로 하고, 영상 촬영에 필요한 시간이 길며, 여러 가지 기술적인 면이 많이 필요하다는 단점이 있다(Fig. 4, 5).
지난 10년간 양전자 방출 단층촬영술(positron emission tomography, PET)의 활용이 비약적으로 증가, 발전되었다. 이로 인해 조직의 대사를 측정할 수 있게 되어 림프종이나 악성 흑색종의 분화나 병기를 확인할 수 있게 되었고, 재발성, 전이성 결장암을 일찍 발견할 수 있게 되었으며, 비소세포성 폐암의 병기 결정이나 고립성 폐결절을 감별할 수 있게 되었다. PET은 양성과 악성 종양의 감별, 종양 병기의 결정, 생검을 위한 위치 결정, 항암화학요법의 결과 평가, 종양 재발의 발견 등에 중요하게 사용되고 있다.21314) 생체 내에서 positron-emitting radionuclides (주로 fluorodeoxyglucose [FDG])를 이용하여 조직의 활성도 등을 측정하게 된다. 이 과정에서 주요 관심부위의 maximum과 average standardized uptake value (SUV)를 측정하게 된다. 증가된 에너지 필요양을 추정하면 일반적인 근육이나 정상 연부조직, 다른 기관들에 비해 고 등급의 연부조직 육종에 많은 양의 FDG가 축적된다. 일부 연구자들은 FDG 축적의 양이 종양의 세포질(cellularity)이나 분화도와 관련성이 있다고 생각하기도 한다.151617) PET이 양성 종양과 악성 종양을 감별하는 데 도움이 되기는 하지만 저 등급의 육종이나 공격성을 가진 양성 종양인 경우 감별하기가 힘들다. SUV 값이 1.6 이상인 경우는 고 등급, 1 이하는 양성, 그 사이는 양성이나 저 등급의 악성 종양으로 분류한다.18) 골종양인 경우도 이와 유사하다. 그러나 지방육종과 desmoids, 거대 세포종, 신경초종 사르코이드증과는 mean SUV 값에 유의한 차이가 없다. 하지만 이러한 단점에도 불구하고 FDG-PET은 저 등급의 병변과 고 등급의 병변을 구별하는 데 유용하게 사용된다. PET은 비용, 다양한 false-positive나 false-negative, 흉부(chest) CT와 비교하면 폐 전이를 찾아내는 데 좀 미진한 부분이 있으나 연부조직 육종의 진단, 관찰, 치료에 유용하게 사용된다.21314151619)
CT는 단순방사선 사진 후에 시행할 수 있는 영상검사 중 골조직의 형태, 골의 재형성, 골막 반응을 정확히 살펴볼 수 있는 검사법이다. 연부조직 종양을 검사하는 데에는 어느 정도 한계점이 있지만 연부조직에 석회화가 발생한 경우나 주위 피질골의 미묘한 미란, 골막 반응 등을 관찰하는 데에는 유용하다. CT는 복부와 같은 지방이 풍부한 부위에서의 연부조직 종양을 감별해내는 데에도 유용한 검사법이다. 지방과 비지방조직과의 경계를 비교적 정확하게 알아낼 수 있는 장점이 있고, MRI가 금기인 환자에게서도 좋은 검사법이다.612) 또한 폐전이에 민감한 검사법으로 병기를 결정하는 데 중요한 역할을 한다. 정맥내 조영술을 이용하는 경우 연부조직 종양의 혈관분포를 측정하고 주변조직과의 경계를 분명히 하는 데 도움이 된다.12) CT guided needle biopsy는 척추주위나 골반부와 같이 심부에 위치한 복잡한 구조물에 병변이 있을 때 유용하게 사용될 수 있다.
99m Tc bone scan은 연부조직 종양을 진단하는 데에는 한계가 있으며, 병기를 결정하는 데에도 특별히 사용되는 편은 아니다. 연부조직 육종은 주로 폐로 원격 전이되며 드물게 림프관으로 전이되기도 하지만 다른 골로의 전이는 극히 드물다. 연부조직 육종 주위의 골로의 섭취가 증가된 경우는 주로 피질골에 침범된 경우 관찰될 수 있으며 이러한 경우에는 CT나 MRI로 판단할 수 있다.
혈관조영술은 현재는 자주 사용되는 검사법은 아니지만, 종양이나 그 주변 구조물의 혈액 공급이나 구조물을 살펴보는 데 유용한 검사법이며, 해부학적인 구조 외에도 국소 효과, 동맥혈 공급이나 정맥혈 배액 등의 상태를 살펴볼 수 있다. 이러한 장점들은 수술을 계획하거나 중재술을 시행할 때에 도움이 되며, MRI나 자기공명 혈관조영술(magnetic resonance angiography) 등을 통해서 더 많은 정보를 얻을 수 있다. 일부에서는 혈관조영술의 양상에 따라 진단에 도움이 되기도 한다. 예를 들면 혈관주위세포종(hemagiopericytoma)은 혈관조영술에서 매우 독특한 과다혈관성(hypervascular) 양상을 나타낸다. 그러나 혈관조영 검사는 대부분의 연부조직 종괴에서 특별한 병리 진단을 내리기에는 부족하여, 혈관 중재술을 통한 수술 전 색전술을 시행하여 혈관이 풍부한 연부조직 종괴의 수술적 치료 시 다량의 출혈을 방지하는 데 사용하고 있다.
생검은 심부에 위치한 큰 크기의 연부조직 종양의 최종 치료 시작 전에, 모든 영상 검사가 시행된 이후에 시행하여야 한다. 중요한 것은 적절한 검사나 평가 없이 종양을 양성으로 판단하는 것은 위험한 일이며, 생검이 필요하지 않다고 강하게 생각되는 경우 계획을 수립하여 정확히 추시하는 것이 필요하며 이 경우 종양에 대해 정확하게 기술하여야 추후에 종양의 성상을 비교할 수 있다.12342021)
환자가 내원했을 때 처음부터 종양의 크기와 위치, 성상 등을 정확히 기술하는 것이 중요하며 피하지방층에 위치한 종양도 그 크기가 커지는 경우 적절하게 평가하고 검사하는 것이 중요하다. 우선적으로 정확하게 환자의 병력과 이학적 검사를 시행한 후에 영상검사를 시행하게 된다.320) 단순 방사선 검사로 골 종양과의 감별이 가능하고, 석회화나 골화, 주변 골조직으로의 영향과 이물질 등을 관찰할 수 있다. MRI로 종양이 양성인지 또는 악성인지 정확히 감별하기는 쉽지 않지만 해부학적 경계, 주위 신경혈관과의 관계, 종양의 signal characteristics를 알 수 있어서 감별진단이나 적절한 생검을 위한 계획을 세우는 데 도움이 된다. 부적절한 생검을 하는 경우 주위조직의 오염이 발생하고 이로 인해 사지 구제술이 어려워지는 경우가 발생할 수 있어 항상 주의하여야 한다.12021) ‘Nononcologic biopsy’가 시행되는 경우 이는 국소재발, 광범위한 방사선 치료 등의 좋지 않은 결과로 이어질 수 있기 때문에 근골격계 종양 치료의 경험이 풍부한 의사가 시행하는 것이 치명적인 오류를 줄일 수 있다. 생검 시의 통로는 추후 육종의 최종적인 수술 시에 모두 en bloc으로 한 번에 제거되어야 한다.
근골격계 연부조직 종양 조직채취방법의 gold standard이다. 종양 외부에 직접적인 절개를 가한 후에 단일 구획이나 근육을 통해 직접 접근한다. 조직 채취 후에 술 후 출혈에 의한 오염을 방지하기 위해 철저한 지혈이 필수적이다. 생검 방법 중에서는 제일 정확한 방법이며 동결절편 검사를 함께 시행하면 100% 가까운 정확도를 얻을 수 있다.
연부조직 육종은 주로 대퇴부나 proximal limb girdle에 발생하게 되며, 많은 수의 종양들이 심부에 위치해있고, 촉진하기 어려우며, 후복막강에 위치하고 있어 percutaneous needle biopsy를 시행하는 데 있어 어려움이 많다. 종양의 정확한 위치를 찾는 데에도 어려움이 많으며 종양의 주위에 신경 및 혈관이 위치하는 경우 원하지 않는 합병증이 발생할 수도 있다. 이러한 경우 안전을 도모하고 진단적 정확성을 높이기 위해서 CT guided biopsy를 시행할 수 있으며, 이런 경우 골반 내에 위치한 악성 종양의 경우 진단의 정확성이 81%에서 90%로 상승한다는 보고가 있다.2) US guided biopsy 또한 정확하고 안전한 방법이며 악성과 양성을 감별하는 정확성이 98%로 높은 정확성을 보고하고 있다. MRI를 이용하는 방법도 일부에서 시도하고 있으나 비용적인 측면에서 경제적인 부담이 상승하여 잘 사용되고 있지 않다.
영상유도 생검은 생검 시 시행하는 바늘의 크기에 따라 세침흡인 생검과 중심부 바늘 생검으로 나눌 수 있다.
(1) 세침흡인 생검(fine needle aspiration biopsy, FNAB): 경피적으로 종양에 바늘을 삽입하여 조직을 얻으며, 외래에서도 시행할 수 있는 장점이 있다. 일반적으로 널리 사용되는 술식으로 술기가 간편하며, 최소침습의 술식이고, 주위조직의 오염을 최소화할 수 있어 합병증이나 질환율을 줄일 수 있고 상대적으로 경제적이다. 그러나 종양의 이질성(heterogenisity)으로 절개 생검법에 비해 진단적 정확성이 떨어지고, 검사를 위해 근골격계 종양을 전공한 숙련된 영상의학과 전문의가 필요하며 검사를 시행하는 영상의학과 전문의에게 주치의는 환자에 대한 세세한 정보를 제공해야 한다는 단점이 있다. 숙련된 병리학자의 경우 양성과 악성의 감별은 84%에서 95%의 정확성을 보이며 등급이나 조직학적 분류의 경우는 더 낮은 정확성을 보인다. 최근의 보고에 의하면 질환을 판단하는 데에는 88%, 정확한 진단은 64%, 등급결정은 78%, 조직학적 아분류는 90%의 정확성을 나타낸다. FNA는 연부조직 종양의 재발을 평가하는 데 유용하며, 재발과 주위 조직의 염증성 변화를 감별하는 데에도 유용하게 사용된다.1220)
(2) 중심부 바늘 생검(core needle biopsy): Wide needle biopsy나 Trochar biopsy로 불리우기도 하며, 크기가 큰 구멍의 바늘로 시행한다. Tru-cut needle을 이용할 경우 가장 많은 조직을 얻을 수 있으며, FNA에 비해 진단의 정확도를 높일 수 있다.2021) 일부에서는 절개 생검의 정확도에 근접한 결과를 보인다고 보고하기도 한다. 장점으로는 FNA와 유사하여 술기가 간편하며, 최소침습의 술식이고, 주위조직의 오염을 최소화할 수 있어 합병증이나 질환율을 줄일 수 있으며, 수술실 이외의 장소에서 행해질 경우 상대적으로 경제적이다. 절개 생검에 비해 상대적으로 얻을 수 있는 조직의 양이 적다는 단점이 있어 많은 경험이 필요하다.
신체의 사지 및 체간에 발생하는 연부조직 종양은 정형외과 의사가 일상에서 마주할 수 있는 흔한 질환 중 하나이다. 대부분 연부조직 종양은 양성 종양일 가능성이 높지만 반드시 악성 종양과의 감별 진단을 필요로 한다. 정형외과 의사는 양성 종양과 악성 종양의 감별 진단에 필요한 핵심적인 요소들을 알고 있어야 하며, 이를 통하여 위에서 설명한 병력조사와 신체 진찰, 영상 검사 및 생검 등을 시행하여 양성 종양과 악성 종양을 감별 진단할 수 있어야 한다. 또한 종양의 진단을 위하여 생검을 시행할 때에는 의심되는 종양과 관련이 있는 진료과와의 긴밀한 협력 진료가 필요하며 생검 시행 시 발생할 수 있는 여러 합병증들을 최소화할 수 있도록 세심한 주의를 기울여야 한다. 아울러 추후 종양의 추적 관찰 방법의 설정을 위해 근골격계 종양전문의의 협력 진료도 필요하다. 결국 연부조직 종양의 평가와 수술적 치료의 실제적인 접근을 위해서는 정형외과 의사 개인이 종양의 역학 및 임상 양상을 이해하고, 주의 깊게 술기를 시행해야 하며, 타과 및 종양전문의의 협력 진료가 동반되어야 함을 알아야 한다.22)
Figures and Tables
Figure 1
Size description of soft tissue masses (baseball 7.2 cm, golf ball 4.6 cm, table tennis ball 4 cm).

Figure 2
Ultrasonography findings of soft tissue masses. (A) These appearances are characteristic of lipoma. (B) Well differentiated liposarcoma. Ultrasound image shows an encapsulated subcutaneous mass isoechoic to the adjacent subcutaneous fat and fine internal echogenic striations parallel to the long axis of the mass. Lipoma and well differentiated liposarcoma are difficult to differential diagnosis completely by ultrasound.
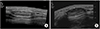
Figure 3
Sonographic images of schwannoma. (A) Longitudinal forearm ultrasound shows a fusiform heterogeneous, hypoechoic mass in continuity with the ulnar nerve with posterior acoustic enhancement. Note the entering and exiting components of the ulnar nerve. (B) Transverse color Doppler ultrasound of the same lesion shows a moderate degree of intralesional hypervascularity. Note the moderate posterior acoustic enhancement. (C) Oval shaped mass with heterogeneous echogenicity with no continuity with the nerve of shoulder lesion. (D) Well-defined, lobulated, low echoic mass ulnar to the 5th distal interphalangeal joint with no increased vascularity.
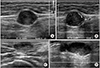
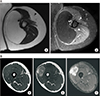
Figure 4
Magnetic resonance imagings of leiomyosarcoma. Relatively well-defined superficial soft tissue mass in the posterolateral aspect of the right buttock at the greater trochanteric level, (A) T1 weighted image with intermediate signal intensity (higher signal to the muscle), (B) T2 weighted fat suppressed image with bright high signal and intermediate signal intensity, (C) T1 weighted fat suppressed contrast enhancement image with strong enhancement (no enhancement in the bright high signal portion on T1 weighted image.

Figure 5
Magnetic resonance imagings (MRIs) of lipoma (A), liposarcoma (B, pleomorphic). (A-a) Axial T2 weighted image (T2WI) MRI shows a homogeneous, high signal, fatty mass along the medial aspect of the proximal arm. The mass has the same signal intensity as the adjacent subcutaneous fat. No nodules or thick septa can be seen. A blood vessel is present along the deep border of the mass. (A-b) Axial T1 weighted fat suppressed image (T1WI FS MRI) with contrast enhancement shows the signal intensity of the lipoma is entirely suppressed, similar to the subcutaneous fat, to become homogeneously low. The single high signal focus is vascular. (B-a) Axial T1WI MRI shows an irregular and lobulating intramuscular mass in the anterolateral portion of the mid-thigh, heterogeneously, iso to low signal intensity. (B-b) Axial T2WI shows mixed signal intensity. (B-c) T1WI FS MRI shows heterogeneous enhancement. A malignant finding in MRI, pleomorphic liposarcoma in the pathology examination.
References
1. Springfield D. Evaluation of soft tissue tumors. Instr Course Lect. 1999; 48:617–619.
2. Silverstein E, Gibbs CP. Classification and imaging of soft-tissue tumors. In : Schwartz HS, editor. Orthopaedic knowledge update. Musculoskeletal tumors 2. 2nd ed. Rosemont (IL): American Academy of Orthopaedic Surgeons;2007. p. 289–299.
3. Frassica FJ, McCarthy EF, Bluemke DA. Soft-tissue masses: when and how to biopsy. Instr Course Lect. 2000; 49:437–442.
4. Frassica FJ, Thompson RC Jr. Evaluation, diagnosis, and classification of benign soft-tissue tumors. J Bone joint Surg. 1996; 78:126–140.
5. Sim FH, Frassica FJ, Frassica DA. Soft tissue tumors: diagnosis, evaluation, and management. J Am Acad Orthop Surg. 1994; 2:201–211.
6. Schuetze SM. Imaging and response in soft tissue sarcomas. Hematol Oncol Clin North Am. 2005; 19:471–487. vi.

7. Manaster BJ. Soft-tissue masses: optimal imaging protocol and reporting. AJR Am J Roentgenol. 2013; 201:505–514.

8. Jones BC, Fayad LM. Musculoskeletal tumor imaging: focus on emerging techniques. Semin Roentgenol. 2017; 52:269–281.

9. Shapeero LG, Vanel D, Verstraete KL, Bloem JL. Fast magnetic resonance imaging with contrast for soft tissue sarcoma viability. Clin Orthop Relat Res. 2002; 397:212–227.

10. Vanel D, Bonvalot S, Guinebretière JM, Petrow P, Dromain C, Caillet H. MR imaging in the evaluation of isolated limb perfusion: a prospective study of 18 cases. Skeletal Radiol. 2004; 33:150–156.

11. Weiss SW, Goldblum J, Enzinger FM. Enzinger and Weiss's soft tissue tumors. 4th ed. St. Louis (MO): Mosby;2001.
12. Peabody TD, Gibbs CP Jr, Simon MA. Evaluation and staging of musculoskeletal neoplasms. J Bone Joint Surg Am. 1998; 80:1204–1208.
13. Aoki J, Endo K, Watanabe H, et al. FDG-PET for evaluation musculoskeletal tumors: a review. J Orthop Sci. 2003; 8:435–441.
14. Aoki J, Watanabe H, Shinozaki T, et al. FDG-PET for preoperative differential diagnosis between benign and malignant soft tissue masses. Skeletal Radiol. 2003; 32:133–138.

15. Aoki J, Watanabe H, Shinozaki T, et al. FDG PET of primary benign and malignant bone tumors: standardized uptake value in 52 lesions. Radiology. 2001; 219:774–777.

16. Dimitrakopoulou-Strauss A, Strauss LG, Schwarzbach M, et al. Dynamic PET 18F-FDG studies in patients with primary and recurrent soft-tissue sarcomas: impact on diagnosis and correlation with grading. J Nucl Med. 2001; 42:713–720.
17. Satoh K, Sadowski SM, Dieckmann W, et al. 18F-FDG PET/CT volumetric parameters are associated with tumor grade and metastasis in pancreatic neuroendocrine tumors in von hippel-lindau disease. Ann Surg Oncol. 2016; 23:S714–S721.

18. Tomimaru Y, Eguchi H, Tatsumi M, et al. Clinical utility of 2-[(18)F] fluoro-2-deoxy-D-glucose positron emission tomography in predicting World Health Organization grade in pancreatic neuroendocrine tumors. Surgery. 2015; 157:269–276.

19. Vernon CB, Eary JF, Rubin BP, Conrad EU 3rd, Schuetze S. FDG PET imaging guided re-evaluation of histopathologic response in a patient with high-grade sarcoma. Skeletal Radiol. 2003; 32:139–142.

20. Mankin HJ, Lange TA, Spanier SS. The hazards of biopsy in patients with malignant primary bone and soft tissue tumors. J Bone Joint Surg Am. 1982; 64:1121–1127.
21. Mankin HJ, Hornicek FJ. Diagnosis, classification, and management of soft tissue sarcomas. Cancer Control. 2005; 12:5–21.

22. Canter RJ. Surgical approach for soft tissue sarcoma: standard of care and future approaches. Curr Opin Oncol. 2015; 27:343–348.




 PDF
PDF ePub
ePub Citation
Citation Print
Print





 XML Download
XML Download