This article has been corrected. See "ERRATUM: Correction of Funding Resource: Development of Aspergillus fumigatus -induced chronic atopic dermatitis mouse model" in Volume 7 on page 222.
Abstract
Purpose
Atopic dermatitis (AD) is the most common chronic and relapsing inflammatory skin disease with skin barrier defects and altered immune responses. Chronic inflammation leads to irreversible fibrosis in the skin and there is no treatment to completely abolish the inflammation and fibrosis. To prevent or treat the chronic process of AD, it is necessary to develop a murine model of AD that reflects the chronic process to identify the mechanism. The aims of this study were to develop a chronic AD model with a crude extract Aspergillus fumigatus (Af) antigen.
Methods
We applied Af extract (40 µg) epicutaneously to the dorsal skin of BALB/c mice for 5 consecutive days per week during a period of 5 weeks for a chronic AD model, and 5 consecutive days repeatedly with 2 weeks interval for an acute AD model.
Results
The clinical score and transepidermal water loss were more increased in the chronic AD model than in the acute AD model. Histologic findings showed that more increased epidermal thickness, neutrophil infiltration and hyperkeratosis in the chronic model than in the acute model. Skin fibrosis was more prominent in the chronic model than in the acute model. The mRNA expression levels of transforming growth factor (TGF)-β, thymic stromal lymphopoietin, and interleukin-33 were increased in the skin of the chronic model compared to the acute model. The levels of total IgE, Af-specific IgE, IgG1, and IgG2a were significantly increased in the chronic model compared to controls.
아토피피부염은 만성재발성피부염증질환으로 가려움, 피부 건조함, 연령에 따른 전형적인 습진성피부병변을 특징으로 한다.1234 또한 알레르기항원에 대한 IgE 매개 피부 염증반응을 보이며, 피부조직에서 호산구와 비만세포 침윤을 관찰할 수 있다.56 면역학적으로 급성기에는 T helper cell type 2 (Th2) 면역 반응이 주를 이루며 만성기에는 Th1, Th17, Th22가 중요한 역할을 한다.
아토피피부염은 미생물에 의한 발생과 악화가 보고되었는데, 그중 대표적인 것으로 포도상구균은 아토피피부염을 악화시키고, 피부 상재 진균인 Malassezia 감작은 아토피피부염의 병인론에 관여하는 것으로 알려져 있다.78 진균과 아토피피부염과의 관계에 대한 연구로 학동기 진균 노출이 아토피피부염의 위험을 증가시킨다는 보고가 있으며,9 생후 초기 진균 노출이 학동기 아토피피부염과 관계가 있고,10 임신 중 진균 노출이 영아 아토피피부염을 증가시킨다는 보고가 있어11 이른 소아 시기의 진균 노출이 이후의 아토피피부염 발생과 관련이 있을 수 있음을 제시하고 있다. Aspergillus fumigatus (Af)는 천식과 연관이 있는 실내 진균으로 밝혀진 Aspergillus niger, Aspergillus ochraceus, Aspergillus unguis를 대변할 수 있는 진균으로,12 Af의 피부 적용을 통해 아토피피부염 유사 염증을 유발함이 이미 보고되었다.13
아토피피부염에 대한 근본적인 치료 방법이 없는 상황에서 아토피피부염은 호전과 악화를 반복하면서 만성화 과정을 거쳐 피부 조직의 섬유화를 보이므로 이러한 만성화를 예방하거나 치료하기 위해서 우선적으로 필요한 것은 만성화를 반영하는 아토피피부염 동물 모델의 개발이다. 이에 이 연구는 대표적인 실내 진균인 Af 항원을 이용하여 만성아토피피부염을 반영할 수 있는 동물 모델을 개발하고, 그 기전을 규명하고자 한다.
8주령의 BALB/c마우스(OrientBio, Seongnam, Korea)를 specific pathogen free 조건에서 사육하였고, Zoletile50 (Vibac Laboratories, Carros, France) 60 mg/kg으로 마취 후 전기면도기로 등쪽의 털을 제거하였고 등의 정 중앙부위 1 cm×1 cm 면적에 Af 추출물(Greer Laboratories Inc., Lenoir, NC, USA) 40 µg (20 µL)을 일주일에 5회씩 5주간 피펫으로 피부에 적용한 만성군과 비교를 위해 일주일에 5회(0, 1, 2, 3, 4일) 적용 후 2주 쉬고 5회(19, 20, 21, 22, 23일) 적용한 급성군을 두었다. 음성대조군은 생리식염수를 동일하게 피부에 적용시켰다. 각 군의 대상 수는 6마리로 하였다. 실험일 24, 33일째 피부조직, 임파선, 혈액을 채취하였다(Fig. 1A, B).
모든 절차는 서울아산병원 동물연구위원회에서 승인받아(IACUC승인번호: 2014-12-064) 규정에 따라 연구를 진행하였다.
Af 추출물을 적용한 부위의 피부임상점수를 실험(0, 5, 12, 19, 24, 26, 33일)일에 관찰하였다. 피부임상점수는 건조(dryness), 인설(scaling), 미란(erosion), 찰과상(excoriation), 출혈 5가지 항목으로 나누어 각 항목에서 병변이 없는 상태를 0점, 경증 1점, 중등도 2점, 중증 3점을 준 후 합산하였다. 또한 동일한 날에 피부장벽 손상을 평가하기 위해 경피수분손실(transepidermal water loss, TEWL)을 VapometerSWL-3 (Delfin Technologies Ltd., Kuopio, Finland)을 이용하여 측정하였다.
Af 추출물과 생리식염수를 적용한 모든 군의 피부조직을 잘라내어 10% formaline 용액으로 고정하고 파라핀블록을 제작한 후, 5 µm 간격으로 피부조직을 종 단면으로 절편하였다. 피부조직의 변화와 염증세포 침윤을 관찰하기 위하여 hematoxylin and eosin (H&E), 비만세포 침윤을 관찰하기 위해 toluidine blue로 염색하고 현미경 400배에서 관찰하였다. 표피와 진피의 두께는 IMT i-Solution software(IMT Inc., Vancouver, BC, Canada)를 사용하여 측정하였다. 감별세포 수는 각기 다른 총 8번의 400배 확대 시야에서 호산구, 호중구, 림프구, 비만세포를 세어 합계를 구한 후 8로 나눈 값을 사용하였다.
Af 추출물과 생리식염수를 적용한 모든 군의 섬유화의 정도는 섬유조직(fibrous tissue)을 파란색으로 염색시키는 Masson's Trichrome으로 염색한 후 진피 및 피하지방 내에서의 염색의 정도에 따라 없음 0점, 아주 약함 1점, 약함 2점, 보통 3점, 심함 4점을 준 후 합산하였다.
또한 모든 군의 피부조직에 콜라겐이 얼마나 함유되어 있는지를 측정하기 위하여 Sircol soluble collagen assay kit (Biocolor, Belfast, UK)를 구입하여 콜라겐 assay를 하였다. 동일한 무게로 정량한 피부조직을 갈아 pepsin과 0.5M acetic acid (1:10 ratio of pepsin/tissue wet weight)를 넣어 4℃에서 overnight한 후 Sircol dye reagent 100 µL를 첨가하여 30분 동안 흔들어 준 후 12,000 rpm에서 10분간 원심분리하였고 acid-salt wash 750 µL를 첨가하여 수세하였다. Alkali reagent를 넣어 가볍게 mixing 후 microplate reader 555 nm에서 측정하였다.
콜라겐 calibration standard curve를 위해 콜라겐 standard solution(0.5 mg/mL)을 0, 5, 10, 15 µL씩 넣어 기준점을 정하였다.
마우스 피부조직에서의 RNA추출은 Genomic RNA mini kit (ALPHαGENE, Seongnam, Korea)를 사용하였으며 deep freezer에 냉동보관하였던 피부조직을 저온인 상태에서 buffer TR을 첨가한 후 tissue lyser를 사용하여 갈았다. 실온에서 5분간 incubation시킨 후 chloroform 200 µL를 첨가하여 실온에서 3분간 방치 후 12,000 rpm, 4℃, 10분간 원심분리하였고 상층액 500 µL를 취한 후 100% ethanol 250 µL를 첨가하여 12,000 rpm, 4℃, 1분간 원심분리 후 buffer RPI와 buffer RW를 사용하여 남은 RNA pellet을 DEPC (diethylpyrocarbonate)로 희석하여 NanoDrop software를 이용하여 RNA를 정량하였다.
WizScript cDNA Synthesis kit (Wizbio Solutions, Seongnam, Korea)를 사용하였으며 kit에서 제공하는 protocol에 따라 total RNA 양이 2 µg이 되도록 RNA sample을 넣고 oligo dT, dNTP, RNase free water를 넣은 후 각각 65℃, 4℃에서 5분을 유지한다. 나머지 reaction buffer를 넣은 후 42℃에서 5분간, 42℃에서 60분간, 70℃에서 10분간 가열하여 반응시켰다.
Real-time reverse transcription-polymerase chain reaction (PCR)은 384-well plates에서 ABI PRISM 7900HT Sequence Detection System (ABI, Foster City, CA, USA)을 이용하여 실험하였다. 18S로 standard 기준점을 잡았으며 transforming growth factor (TGF)-β, interleukin (IL)-13, IL-17A, thymic stromal lymphopoietin (TSLP), IL-25, IL-33, interferon (IFN)-γ와 피부장벽 손상에 대한 filaggrin을 측정하였다.
Primers는 TaqMan Gene Expression Assays 제품(Applied Biosystems, Foster City, CA, USA)을 사용하였으며 각각에 대한 primer/probe는 18S (Mm039-28990_g), TGF-β (1Mm01178820_m1), IL-13 (Mm00434204_m1), IL-17A (Mm00439618_m1), TSLP (Mm01157588_m1), IL-25 (Mm00499822_m1), IL-33 (Mm005 05403_m1), IFN-γ (Mm01168134_m1), filaggrin (Mm01716522_m1)이다.
혈액의 채취는 개복 후 needle을 삽입하여 0.5–0.7 mL가량의 혈액을 후대정맥에서 채혈하였고, 분리한 혈액은 원심분리 후 혈청만을 분리하여 −70℃에 보관하였다. 혈청 총IgE는 BD OptEIA ELISA set (BD Biosciences, San Diego, CA, USA)를 사용하여 측정하였고, Af 특이 IgE, IgG1, IgG2a는 Mouse IgG1, G2a Ready-SET-Go! (e-Bioscience, San Diego, CA, USA)로 측정하였으며, Af 추출물 100 µg/mL로 코팅하여 총IgE와 동일한 방법으로 측정하였다.
급성군과 만성군에서 육안적으로도 건조, 인설, 미란, 찰과상을 관찰할 수 있었고 음성대조군은 피부염증 소견이 없는 것을 관찰할 수 있었다. 실험 0, 5, 24일에 측정한 급성군에서의 피부임상점수는 시간이 지날수록 증가함을 보였고 실험 0, 5, 12, 19, 26, 33일에 측정한 만성군에서의 피부임상점수도 시간이 지날수록 증가하였으나, 음성대조군에서는 시간에 따른 변화가 없었다(만성군: 0일, 0.0±0.0; 5일, 1.17±0.17; 12일, 2.00±0.0; 19일, 3.67±0.21; 26일, 4.83±0.17; 33일, 5.00±0.0; 급성군: 0일, 0.0±0.0; 5일, 1.00±0.0; 24일, 2.00±0.26; 음성대조군: 0일, 0.0±0.0; 5일, 0.0±0.0; 12일, 0.0±0.0; 19일, 0.0±0.0, 26일, 0.0±0.0; 33일, 0.0±0.0). 또한 각 시점에서 두 군 간의 임상점수를 비교했을 때, 급성군은 실험 5일째 음성대조군에 비해서 높은 점수를 보였고(P<0.001), 만성군은 5일째부터 시간이 지날수록 음성대조군에 비해 유의하게 높은 점수를 보였다(P<0.001). 그리고 만성군에서 실험 33일째 임상점수는 급성군의 24일째보다 유의하게 증가하였다(P<0.01) (Fig. 1C).
마찬가지로 피부장벽 손상을 확인하기 위해 측정한 TEWL도 급성군과 만성군에서 시간이 지날수록 증가하였고 음성대조군에서는 변화가 없었으며, 각 시점에서 두 군 간의 TEWL을 비교했을 때에도 급성군에서 실험 5일째 음성대조군에 비해서 높은 수치를 보였으며 만성군에서는 5일째부터 음성대조군보다 유의하게 높은 수치를 보였다. 그리고 만성군에서 실험 33일째 TEWL은 급성군의 24일째보다 유의하게 증가하였다(P<0.01) (만성군: 0일, 1.18±0.09 g/m2h; 5일, 11.52±0.68 g/m2h; 12일, 15.93±1.31 g/m2h; 19일, 22.62±1.04 g/m2h; 26일, 25.47±0.47 g/m2h; 33일, 25.02±0.91 g/m2h; 급성군: 0일, 1.98±0.14 g/m2h; 5일, 12.17±0.61 g/m2h; 24일, 12.10±1.12 g/m2h; 음성대조군: 0일, 1.85±0.19 g/m2h; 5일, 3.55±0.11 g/m2h; 12일, 3.00±0.12 g/m2h; 19일, 2.82±0.12 g/m2h; 26일, 2.77±0.10 g/m2h; 33일, 2.87±0.46 g/m2h) (Fig. 1D).
음성대조군과 비교하여 급성군과 만성군에서 실제 아토피피부염의 대표적 조직 소견인 표피층 및 각질층에서의 과증식과 진피층에서 염증세포와 비만세포의 침윤을 관찰할 수 있었다(Fig. 2A).
표피층, 진피층 및 각질층의 두께를 측정하였을 때, 급성군은 표피와 진피 및 각질층의 두께가 음성대조군과 비교하여 두꺼워진 것을 관찰할 수 있었고(각각 P<0.01, P<0.05, P<0.01), 만성군의 표피와 진피 및 각질층의 두께는 음성대조군과 비교하여 뚜렷하게 두꺼워진 것을 관찰할 수 있었다(모두 P<0.01). 만성군은 급성군과 비교하여 표피와 각질층의 두께가 유의하게 증가하였다(각각 P< 0.05, P<0.01) (Fig. 3B) (표피층 두께: 만성군, 104.88±21.24 µm; 급성군, 57.91±4.07 µm; 음성대조군, 19.64±2.77 µm; 진피층 두께: 만성군, 354.50±54.35 µm; 급성군, 255.30±7.69 µm; 음성대조군, 158.97±25.15 µm; 각질층 두께: 만성군, 24.65±8.54 µm; 급성군, 8.80±0.56 µm; 음성대조군, 3.70±0.13 µm) (Fig. 2B).
피부조직을 400배 현미경 시야에서 염증세포수를 측정한 결과, 만성군과 급성군은 음성대조군과 비교하여 호산구(만성군, 11.59±0.48 mm2; 급성군, 10.63±0.42 mm2; 음성대조군, 1.02±0.07 mm2), 림프구(만성군, 7.65±0.41 mm2; 급성군, 6.65±0.54 mm2; 음성대조군, 1.92±0.29 mm2), 비만세포(만성군, 10.30±1.33 mm2; 급성군, 10.23±0.84 mm2; 음성대조군, 1.36±0.16 mm2), 호중구(만성군, 13.50±0.37 mm2; 급성군, 9.71±0.24 mm2; 음성대조군, 1.15±0.08 mm2) 모두 증가한 소견을 보였으며(모두 P<0.01). 만성군은 급성군과 비교하여 호중구가 유의하게 증가한걸 볼 수 있었으나(P<0.01), 호산구와 림프구, 비만세포는 유의하게 증가하지 않았다(Fig. 2C).
음성대조군과 비교하여 진피 및 피하지방 조직섬유화의 증가를 Masson's trichrome 염색에서 급성군과 만성군에서 관찰할 수 있었다(Fig. 3A). 피부조직 섬유화 점수(fibrosis score)는 급성군(2.17±0.17)과 만성군(3.33±0.49)에서 음성대조군(0.17±0.18)과 비교하여 유의하게 높은 점수를 보였고(P<0.01), 또한 만성군은 급성군과 비교하여 유의하게 높은 점수를 보였다(P<0.05) (Fig. 3B). 피부조직에서의 콜라겐의 함량은 만성군이 급성군과 음성대조군에 비해 유의하게 높게 나왔으며 급성군과 음성대조군은 콜라겐 함량에 유의한 차이는 없었다(만성군, 5.27±0.14 µg/mg; 급성군, 3.60±0.10 µg/mg; 음성대조군, 3.85±0.23 µg/mg; P<0.01) (Fig. 3C).
급성군의 피부조직에서 음성대조군과 비교하여 IL-25와 filaggrin mRNA 발현이 유의하게 증가하였다(P<0.01). 만성군의 피부에서는 TGF-β, IL-13, TSLP, IL-33, filaggrin이 음성대조군과 비교하여 유의하게 증가하였다(P<0.01). 만성군은 급성군과 비교하여 TGF-β, TSLP, IL-33 발현이 유의하게 증가하였다(Fig. 4).
혈청 총 IgE에서 급성군(1,752.42±82.09 ng/mL)과 만성군(2,032.35±22.06 ng/mL)은 음성대조군(414.06±24.52 ng/mL)에 비해 증가하였으나(P<0.001), 급성군과 만성군 사이에서는 유의한 차이가 없었다. Af-특이 IgE 수치도 급성군(31.81±7.96 ng/mL)과 만성군(29.26±4.24 ng/mL)에서 음성대조군(3.71±0.12 ng/mL)과 비교하여 유의하게 증가하였으나(P<0.001), 급성군과 만성군 사이에서는 유의한 차이가 없었다. Af-특이 IgG1, IgG2a는 만성군에서 각각 66.82±8.13 ng/mL, 95.92±5.17 ng/mL로 급성군(Af-특이 IgG1, 26.94±0.54 ng/mL; Af-특이 IgG2a, 32.78±0.90 ng/mL)과 음성대조군(Af-특이 IgG1, 24.73±1.51 ng/mL; Af-특이 IgG2a, 31.49±2.27 ng/mL)의 수치와 비교하여 유의하게 증가하였으며(모두 P<0.01), 급성군과 음성군의 차이는 없었다(Fig. 5).
이 연구에서는 대표적인 실내 진균인 Af 항원을 이용하여 만성아토피피부염을 반영할 수 있는 동물 모델을 개발하였다. 개발된 만성아토피피부염 모델은 급성아토피피부염 모델에 비해 피부임상점수와 경피수분손실이 유의하게 증가하였고, 피부조직에서의 표피와 각질층의 두께 또한 급성과 비교하여 유의하게 증가하였다. 피부 섬유화와 피부 조직 내 TGF-β mRNA 발현 또한 급성과 비교하여 유의하게 증가하였다. 그리고 호중구 침윤도 만성아토피피부염 모델에서 급성보다 증가하였다.
확립된 만성아토피피부염 모델은 급성 모델과 비교하여 그 중증도가 심하고, 조직의 섬유화를 특징적으로 보였다. 인간에서 아토피피부염은 만성적인 경과를 보이면서 급성 악화를 반복하는 특징을 가지고 있다.14 따라서 기존의 아토피피부염 동물 모델이 보여주지 못한 섬유화를 특징적으로 보여주는 모델은 인간의 아토피피부염을 보다 더 잘 반영하고, 향후 섬유화 관련된 연구에 사용할 수 있을 것이다. 아토피피부염의 섬유화와 관련해서는 그 기전이 잘 알려져 있지 않다. 다른 질환들에서처럼 Th2와 Th17 면역반응이 그와 관련된 것으로 알려져 있고,151617 Th2 면역 반응의 영향하에 TGF-β의 분비에 의해 섬유아세포가 근섬유아세포로 분화되어 collagen 등을 많이 분비하여 발생하는 것으로 알려져 있다.61819 우리 모델에서도 피부 조직 내 TGF-β mRNA 발현이 증가한 점은 일반적인 섬유화 기전을 잘 따르는 소견이다. 우리 모델에서 TGF-β를 분비하는 주 세포가 무엇인지, 그리고 어떤 세포에 작용하여 섬유화가 유도되는지에 대해서는 향후 연구가 필요한 부분이다.
피부조직에서 TGF-β뿐만 아니라 만성 아토피피부염 모델에서 IL-13, TSLP, IL-33의 mRNA 발현의 증가를 관찰할 수 있었는데, IL-13의 경우 이미 섬유화와 관련이 있는 것으로 잘 알려진 반면,2021 TSLP, IL-33은 Th2 면역반응을 유도하는 것으로 알려져 있으나 직접적으로 섬유화 관련되어 있지는 않다.22 그러나 최근 innate lymphoid cell type 2 (ILC2)가 간에서 섬유화와 관련된 보고가 있고,23 TSLP와 IL-33는 ILC2를 유도하는 것으로 알려져 있으므로2324252627 섬유화의 기전으로 ILC2의 관여를 고려해야 할 것이다.
천식과 같은 알러지질환에서 호중구의 증가는 Th17이 관여하는 것으로 알려져 있다.28 하지만, 이 연구의 만성 모델에서 호중구의 침착은 확인하였으나, Th17의 주 사이토카인인 IL-17의 증가는 확인할 수 없었다. 인간의 아토피피부염에서 급성기에는 주로 Th2 면역반응이 관여하여 호산구가 침착하나,5 만성기에는 Th1, Th17인 관여하는 것으로 알려져 있기 때문에 이 모델에서의 호중구 침착은 만성적인 진균의 노출에 따라 면역반응이 Th2에서 호중구를 증가시키는 쪽으로 변화하였을 가능성을 의미할 수 있다.
만성아토피피부염 모델에서 혈청 total IgE, Af-특이 IgE, Af-특이 IgG1, Af-특이 IgG2a도 음성대조군보다 유의하게 증가하였고, Af-specific IgG1, Af-specific IgG2a 수치는 급성과 비교하여 유의하게 증가하였다. Af-특이 IgE는 Af라는 알레르기 항원을 노출시킨 당연한 결과라 할 수 있을 것이다. 그러나 Af-특이 IgG2a는 흥미로운 소견인데, 일반적으로 IgG2a가 반영하는 것은 Th1 면역반응이므로 만성적인 Af 노출은 Th2뿐만 아니라 Th1 면역반응을 유도할 수 있음을 의미하며, 앞에서 언급한 것처럼 인간의 아토피피부염 만성기를 우리 모델이 반영할 수 있음을 보여주는 소견이다.
이 연구에서 확립된 만성아토피피부염모델은 임상 소견 및 경피수분손실의 증가, 그리고 조직의 뚜렷한 섬유화, Th2 면역반응에 의한 호산구뿐만 아니라 호중구의 침착, Af-특이 IgG2a의 증가 등 실제 인간 아토피피부염의 병태생리와 유사하여 향후 아토피피부염의 만성화 기전을 밝히고, 이를 바탕으로 아토피피부염 치료제를 개발하는 데 유용하게 사용될 수 있을 것으로 기대한다.
Figures and Tables
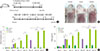 | Fig. 1Models of Aspergillus fumigatus (Af)-induced atopic dermatitis (AD). (A) Schematic protocol of this study. Af extract (40 µg) was epicutaneously applied to the dorsal skin of mice for 5 consecutive days repeatedly with a 2-week interval (acute model) and 5 consecutive days per each week during 5 weeks (chronic model). (B) Macroscopic cutaneous manifestations in the control and Af-induced AD groups. Skin lesions such as erythema, erosions, crusts, and scale were more severe in the chronic mouse model than in the control and acute mouse model. (C, D) Clinical symptom scores and transepidermal water loss in acute and chronic model of Af-induced atopic dermatitis. Clinical symptom scores and transepidermal water loss were increased over time in chronic and acute mouse model. Clinical symptom scores and transepidermal water loss were significantly increased at day 33 in chronic model, compared to those at day 24 in acute mouse model. **P<0.01. ***P<0.001. |
 | Fig. 2Histopathological features of Aspergillus fumigatus (Af)-induced atopic dermatitis models. (A) Skin lesions were stained with hematoxylin & eosin (H&E) to identify eosinophils, neutrophils, and lymphocytes and toluidine blue to identify mast cells (original magnification, ×400; scale bars: left panel=100 µm, right panel=20 µm). (B) Thickening of the epidermal, dermal and hyperkeratosis layers from acute and chronic mouse model showed increased compared to the control mouse model. (C) Numbers of eosinophils, neutrophils, mast cells and lymphocytes were counted under a microscope at ×200 magnification. Data are expressed as mean±standard error of the mean (n=6 per group). *P<0.05. **P<0.01. |
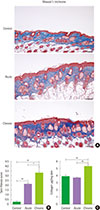 | Fig. 3Fibrosis features of Aspergillus fumigatus (Af)-induced atopic dermatitis models. (A) Skin collagen deposition from acute and chronic mouse model showed increased compared to control mouse model by Masson's Trichrome staining (original magnification, ×400; scale bars: 100 µm). (B) Fibrosis score from acute and chronic mouse model was significantly increased compared to the control mouse model and that of chronic mouse model was significantly increased compared to the acute mouse model. (C) Collagen content was increased in chronic mouse model compared to the control and acute mouse model. Data are expressed as mean±standard error of the mean (n=6 per group). *P<0.05. **P<0.01. |
 | Fig. 4mRNA expression of transforming growth factor (TGF)-β, interleukin (IL)-13, IL-17A, thymic stromal lymphopoietin (TSLP), IL-25, IL-33, interferon (IFN)-γ, filaggrin in the skin of acute and chronic atopic dermatitis mouse models. The expression of TGF-β, TSLP, and IL-33 mRNA in chronic mouse model was increased compared to acute mouse model. Data are expressed as mean±standard error of the mean (n=6 per group). *P<0.05. **P<0.01. |
 | Fig. 5Serum total IgE, and Af-specific IgE, IgG2a, and IgG1 levels in acute and chronic allergic dermatitis (AD) mouse models. Serum total IgE, and Af-specific IgE levels of both AD models were higher than control mouse model. Af-specific IgG2a and IgG1 levels in chronic mouse model were significantly increased compared to the control and acute mouse model. Data are expressed as mean±standard error of the mean (n=6 per group). **P<0.01. ***P<0.001. |
References
1. Dokmeci E, Herrick CA. The immune system and atopic dermatitis. Semin Cutan Med Surg. 2008; 27:138–143.

2. Spergel JM, Paller AS. Atopic dermatitis and the atopic march. J Allergy Clin Immunol. 2003; 112:6 Suppl. S118–S127.

4. Spergel JM. Epidemiology of atopic dermatitis and atopic march in children. Immunol Allergy Clin North Am. 2010; 30:269–280.

5. Oyoshi MK, He R, Kanaoka Y, ElKhal A, Kawamoto S, Lewis CN, et al. Eosinophil-derived leukotriene C4 signals via type 2 cysteinyl leukotriene receptor to promote skin fibrosis in a mouse model of atopic dermatitis. Proc Natl Acad Sci U S A. 2012; 109:4992–4997.

6. Leung DY, Boguniewicz M, Howell MD, Nomura I, Hamid QA. New insights into atopic dermatitis. J Clin Invest. 2004; 113:651–657.

7. Yu J, Oh MH, Park JU, Myers AC, Dong C, Zhu Z, et al. Epicutaneous exposure to staphylococcal superantigen enterotoxin B enhances allergic lung inflammation via an IL-17A dependent mechanism. PLoS One. 2012; 7:e39032.

8. Breuer K, Kapp A, Werfel T. Bacterial infections and atopic dermatitis. Allergy. 2001; 56:1034–1041.

9. de Meer G, Janssen NA, Brunekreef B. Early childhood environment related to microbial exposure and the occurrence of atopic disease at school age. Allergy. 2005; 60:619–625.

10. Ibargoyen-Roteta N, Aguinaga-Ontoso I, Fernandez-Benitez M, Marin-Fernandez B, Guillen-Grima F, Serrano-Monzo I, et al. Role of the home environment in rhinoconjunctivitis and eczema in schoolchildren in Pamplona, Spain. J Investig Allergol Clin Immunol. 2007; 17:137–144.
11. Miyake Y, Ohya Y, Tanaka K, Yokoyama T, Sasaki S, Fukushima W, et al. Home environment and suspected atopic eczema in Japanese infants: the Osaka Maternal and Child Health Study. Pediatr Allergy Immunol. 2007; 18:425–432.

12. Reponen T, Lockey J, Bernstein DI, Vesper SJ, Levin L, Khurana Hershey GK, et al. Infant origins of childhood asthma associated with specific molds. J Allergy Clin Immunol. 2012; 130:639–644.e5.

13. Akei HS, Brandt EB, Mishra A, Strait RT, Finkelman FD, Warrier MR, et al. Epicutaneous aeroallergen exposure induces systemic TH2 immunity that predisposes to allergic nasal responses. J Allergy Clin Immunol. 2006; 118:62–69.

14. Matsushima H, Hayashi S, Shimada S. Skin scratching switches immune responses from Th2 to Th1 type in epicutaneously immunized mice. J Dermatol Sci. 2003; 32:223–230.

15. Heratizadeh A, Werfel T, Rösner LM. Adaptive immune response and associated trigger factors in atopic dermatitis. Hautarzt. 2015; 66:96–102.

16. Batista DI, Perez L, Orfali RL, Zaniboni MC, Samorano LP, Pereira NV, et al. Profile of skin barrier proteins (filaggrin, claudins 1 and 4) and Th1/Th2/Th17 cytokines in adults with atopic dermatitis. J Eur Acad Dermatol Venereol. 2015; 29:1091–1095.

17. Dhingra N, Guttman-Yassky E. A possible role for IL-17A in establishing Th2 inflammation in murine models of atopic dermatitis. J Invest Dermatol. 2014; 134:2071–2074.

18. Toda M, Leung DY, Molet S, Boguniewicz M, Taha R, Christodoulopoulos P, et al. Polarized in vivo expression of IL-11 and IL-17 between acute and chronic skin lesions. J Allergy Clin Immunol. 2003; 111:875–881.

19. Ishida Y, Kimura A, Kondo T, Hayashi T, Ueno M, Takakura N, et al. Essential roles of the CC chemokine ligand 3-CC chemokine receptor 5 axis in bleomycin-induced pulmonary fibrosis through regulation of macrophage and fibrocyte infiltration. Am J Pathol. 2007; 170:843–854.

20. Oh MH, Oh SY, Yu J, Myers AC, Leonard WJ, Liu YJ, et al. IL-13 induces skin fibrosis in atopic dermatitis by thymic stromal lymphopoietin. J Immunol. 2011; 186:7232–7242.

21. Zheng T, Oh MH, Oh SY, Schroeder JT, Glick AB, Zhu Z. Transgenic expression of interleukin-13 in the skin induces a pruritic dermatitis and skin remodeling. J Invest Dermatol. 2009; 129:742–751.

22. Jessup HK, Brewer AW, Omori M, Rickel EA, Budelsky AL, Yoon BR, et al. Intradermal administration of thymic stromal lymphopoietin induces a T cell- and eosinophil-dependent systemic Th2 inflammatory response. J Immunol. 2008; 181:4311–4319.

23. McHedlidze T, Waldner M, Zopf S, Walker J, Rankin AL, Schuchmann M, et al. Interleukin-33-dependent innate lymphoid cells mediate hepatic fibrosis. Immunity. 2013; 39:357–371.

24. Salimi M, Barlow JL, Saunders SP, Xue L, Gutowska-Owsiak D, Wang X, et al. A role for IL-25 and IL-33-driven type-2 innate lymphoid cells in atopic dermatitis. J Exp Med. 2013; 210:2939–2950.

25. Kim BS, Siracusa MC, Saenz SA, Noti M, Monticelli LA, Sonnenberg GF, et al. TSLP elicits IL-33-independent innate lymphoid cell responses to promote skin inflammation. Sci Transl Med. 2013; 5:170ra16.

26. Hams E, Armstrong ME, Barlow JL, Saunders SP, Schwartz C, Cooke G, et al. IL-25 and type 2 innate lymphoid cells induce pulmonary fibrosis. Proc Natl Acad Sci U S A. 2014; 111:367–372.





 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download