Abstract
Purpose
The purpose of this study was to examine the effects of oral cryotherapy on oral mucositis, reactive oxygen series, inflammatory cytokines, and oral comfort in patients undergoing chemotherapy for gynecologic cancers.
Methods
Participants were randomly assigned to the experimental group (n=25, receiving oral cryotherapy during chemotherapy) and the control group (n=25, receiving the usual care consisting of 0.9% normal saline gargles three times before meals). Oral mucositis was assessed using the oral assessment guide, while oral comfort was assessed using the oral perception guide. Reactive oxygen series was measured as total oxidant stress, and the level of two inflammatory markers, interleukin-6 (IL-6) and tumor necrosis factor-alpha (TNF-α), were examined. The data were analyzed using t-test, chi-square test, Fisher's exact test, Mann-Whitney U-test, and repeated measures analysis of variance.
Results
There was a significant difference in the oral mucositis score, reactive oxygen series score, TNF-α level, and oral comfort score between the two groups, and there were significant changes over time and in the group-by-time interactions. There was a significant difference in the IL-6 score between the two groups, but there were no significant changes over time or in the group-by-time interactions.
항암화학요법은 부인암 환자들의 60~70%에게 적용되는 치료법으로[1], 환자의 생존율은 증가시키지만 암세포뿐만 아니라 정상 세포에도 독성을 미치며, 구내염, 오심 및 구토, 발열, 통증과 같은 부작용을 야기시킨다[2]. 구내염은 항암화학요법과 같은 독성 치료로 인해 발생하는 활성 산소로 인해 구강 상피세포가 손상을 받고, 점막 조직의 사멸 과정에서 발생하는 염증성 사이토카인의 영향으로 발생하게 된다[3]. 항암화학요법 중 Cisplatin과 Gemcitabine의 항암제를 사용하는 경우 3등급 이상의 구내염 발생빈도는 47%로[4] 구내염으로 인한 타액 변화 및 작열감[56], 연하 곤란[7]의 구강 불편감은 영양 섭취 저하[8], 통증 및 전신 패혈증[910]을 야기시킬 수 있다. 이는 항암제 용량 감량이나 암 치료 기간이 연장되는 결과를 초래할 수 있으므로[11], 항암화학요법을 받는 암환자들에게 구강안위감을 저해하는 요인을 감소시켜 줄 수 있는 간호가 치료 시작 이전에 선행되어야 한다[12]. 구내염의 강도나 발생빈도에 영향을 미치는 요인으로는 화학 요법제의 종류와 투여 용량[9], 환자의 연령[10], 암의 유형 및 환자의 혈액학적 상태[11], 화학요법 이전의 환자의 구강상태 및 화학요법 동안의 구강간호 등이 있으며[12], 이 중 구강간호는 구강 합병증의 예방과 증상완화에 가장 중요한 요인이다[13]. 구강 상태의 변화는 환자가 받고 있는 치료 결과나 구강 간호의 지표가 될 수 있으므로[12], 항암화학요법의 부작용으로 나타나는 구내염 발생 과정을 억제하는 것이 필요하다. 구내염은 암환자의 치료 결과 및 생명을 위협하는 증상으로[7], 항암화학요법을 받는 환자들에게 구내염 예방을 위한 효과적인 구강 간호가 제공되어야 한다[13]. 그러나 실제 임상에서는 예방적인 간호보다 구내염 발생 후 치료적 중재 접근을 주로 하고 있는 실정이다[11]. 부인암 환자의 경우 항암화학요법으로 인한 호중구 감소증이 장기간 지속되므로, 구내염을 비롯한 전신 감염의 위험성이 높다[1].
구내염 예방과 합병증 관리를 위한 국내·외 근거 중심 가이드라인에는 기본 구강간호, 구강사정 및 구강관리 교육을 강조하고 구내염예방 및 치료에 효과가 있는 생리식염수, 클로로헥시딘액, 베타딘액, 니스타틴액과 같은 구강 함수제 및 치료제 적용, 항암화학요법시 구강 냉요법을 제안하고 있다[1415]. 이 중 구강 냉요법은 국소적으로 혈관을 수축시켜서 구강 점막으로 가는 혈류를 감소시키고[5], 항암제나 방사선으로 인하여 세포 내에서 활성산소가 발생되는 과정을 차단한다[3]. 이 후 점막조직이 사멸되는 과정에서 발생하는 염증성사이토카인의 발현을 감소시킴으로써[516] 항암제의 독성 노출을 감소시키는 효과를 가져 올 수 있다. 항암화학요법을 받는 암환자의 구강 합병증 예방을 위한 중재 연구에서 얼음조각을 이용한 구강 냉요법은 구강내 저온을 유지하고 구강 내 혈류를 감소시킴으로써 염증 완화 효과와 항암제 독성노출을 감소시키는 효과를 보였다[616]. 국제적인 암환자 진료 및 간호 지침인 MASCC/ISOO (Multinational Association of Supportive Care in Cancer)권고안[11]에서는 구강 냉요법을 근거 수준 5단계 중 Level II 또는 III 단계 수준으로 권고하고 있다. 그러나 무작위 대조군 실험연구나 메타분석에 의한 결과보다는 예비 실험 연구[17]나 사례 연구[59]에서 도출된 근거이며, 구내염이 발생된 이후 증상 완화 치료에 대한 연구들이었다. 따라서 구강 합병증 예방을 위한 무작위 대조군 실험연구를 통하여 과학적 근거에 기반한 적극적인 중재가 제공되어야 한다.
구내염을 유발하는 경로에서 활성 산소와 염증성 사이토카인(Interleukin-6 (IL-6), Tumor necrosis factor-α (TNF-α))은 정상세포를 손상시키고 염증성 매개 물질을 세포 내로 확산시키는 주된 역할을 한다[3]. 구내염의 발생기전은 세포가 항암제나 방사선으로 인해 발생하는 활성산소로 인해 직접적인 손상을 받는 초기 단계, 이후 손상받은 세포에서 활성산소를 발생시키고 염증성 사이토카인(TNF-α, IL-6)의 생성을 높여 조직손상을 일으키는 5가지 단계이다[3]. 세포 내로 유입된 항암제로 인해 발생되는 활성산소는 직접적으로 각종 세포와 점막, 조직, 혈관에 손상을 가하고 염증성 반응을 촉진시키는 사이토카인 인자들을 활성화시킨다[12]. 선행 연구 결과에서 활성산소와 염증성 사이토카인을 효과적으로 억제하거나 제거하는 약제들이 점막의 손상을 지연시켰다[17]. 따라서 구내염 발생과정을 생리학적 기전에서 탐색하고, 암환자 구강간호에 사용되는 구강 냉요법이 항암화학요법에 의해 발생된 구강 상피세포의 활성산소 발생 차단과 염증성 사이토카인 발생에 미치는 영향을 객관적 지표로 확인하는 것이 필요하다. 그러나 구강 냉요법 간호 중재를 통한 구강 관리 수행 정도[14], 암환자의 통증 및 영양 상태[17] 등에 대한 연구는 시행된 반면 구강 냉요법의 효과를 과학적 검증을 통하여 확인한 자료가 부족한 실정으로, 구강 냉요법 간호 중재의 효과와 관련하여 기초 간호학적 지식을 제공하고 실무에 적용하기 위해서는 실증적 검증자료가 필요하다.
그러므로 항암화학요법을 받는 과정에서 초래되는 구내염을 예방하고 구강 불편감을 완화시키는 중재가 필요하며, 구내염 진행 과정에서 생리적 지표를 감소시킬 수 있는 간호 전략이 요구된다. 또한 간호 중재의 효과가 나타나는 시점과 시간의 흐름에 따른 효과의 변화를 검증하는 것은 항암화학요법을 받는 환자의 구내염 관리에 유용할 것이다
따라서 본 연구에서는 항암화학요법을 받는 부인암 환자를 대상으로 구강 냉요법을 적용하여 구내염과 활성산소, 염증성 사이토카인, 구강 안위감에 미치는 효과를 확인하여 구강 합병증 예방을 위한 중재로서의 근거를 마련하고자 한다.
본 연구의 목적은 Sonis [3]의 구내염 발생 모델에 근거하여 항암 화학요법을 받는 부인암 환자를 대상으로 구강 냉요법이 구내염, 활성 산소, 염증성 사이토카인, 구강 안위감에 미치는 효과를 확인하기 위함이다.
본 연구의 구체적인 가설은 다음과 같다.
1) 제 1가설: 구강 냉요법을 받은 실험군은 구강 냉요법을 받지 않은 대조군보다 측정시기에 따른 구내염의 점수가 낮을 것이다.
2) 제 2가설: 실험군은 대조군보다 측정시기에 따른 활성산소 발생량이 적을 것이다.
3) 제 3가설: 실험군은 대조군보다 측정시기에 따른 염증성 사이토카인 수치가 낮을 것이다.
3-1가설: 실험군은 대조군보다 측정시기에 따른 IL-6 수치가 낮을 것이다.
3-2가설: 실험군은 대조군보다 측정시기에 따른 TNF-α 수치가 낮을 것이다.
4) 제 4가설: 실험군은 대조군보다 측정시기에 따른 구강 안위감의 점수가 낮을 것이다.
본 연구는 Sonis [3]의 구내염 발생 모델에 근거하였다(Figure 1A). 문헌고찰에 근거하여, 구강 냉요법을 이용하여 활성 산소를 차단하고 염증성 사이토카인 발생을 감소시켜 구내염을 감소시키는 기전에 근거하였다. 구내염의 발생기전은 세포가 항암제나 방사선으로 인해 발생하는 활성 산소로 인해 직접적인 손상을 받는 초기 단계, 이후 손상 받은 세포에서 활성산소를 발생시키고 염증성 사이토카인(IL-6, TNF-α)의 생성을 높이는 단계, 세포를 괴사시킴으로써 조직 손상을 증폭시키는 단계, 궤양이 형성되면서 세균의 집락 형성이 일어나는 단계, 구강 점막층이 회복되는 5가지 단계이다[3]. 본 연구에서는 구강 냉요법을 이용하여 항암화학요법으로 발생하는 활성산소 발생을 차단하고 염증성 사이토카인 발생을 억제시켜 구내염, 활성 산소, 염증성 사이토카인, 구강안위감에 미치는 효과를 확인하려 한다.
본 연구는 구강 냉요법이 항암화학요법을 받는 부인암 환자의 구내염, 활성산소, 염증성 사이토카인, 구강안위감에 미치는 효과를 알아보기 위한 무작위 대조군 전후 시차 실험 설계이다.
본 연구의 대상자 선정 기준은 1) 만 20세 이상 65세 미만으로 자궁경부암, 난소암, 자궁내막암을 진단받고 처음 Cisplatin과 Gemcitabine 항암화학요법을 받기 위해 입원한 환자, 2) 백혈구, 호중구, 헤모글로빈, 혈소판, 알부민, 크레아틴, 간수치 검사가 정상 범위에 있는 환자, 그리고 3) 구내염 사정시 정상범위(Oral A ssessment Guide: OAG 8점)에 있는 자로 자가 구강관리가 가능하고 연하 장애 없이 30초 이상 구강 함수가 가능하며 얼음을 입안에 넣고 녹여 삼킬 수 있는 환자이다.
제외 기준은 1) 항암화학요법 전 치과적인 문제가 있는 환자, 2) 방사선 치료의 경험이 있는 환자, 그리고 3) 흡연 경험이 있는 환자이다. 본 연구에서는 2017년 6월부터 11월까지 S시에 소재한 900병상 규모의 일 종합병원 부인암 센터 외래 및 병동에 연구대상자 모집 광고문을 게시하여 대상자를 모집하였다. 대상자 선정기준에 적합하며, 연구 참여에 자발적으로 동의한 환자를 대상으로 실험 참여 동의서, 진료기록 열람 동의서에 서명을 받았다. 대상자에게 번호를 부여하고 엑셀 프로그램을 이용한 난수 생성 리스트를 사용하여 무작위 배정을 하였다. 표본의 크기는 G*Power 3.1.2 프로그램을 이용하여 구강 냉요법에 효과가 있었던 Kakoei 등[18]의 연구에서 도출된 효과크기 0.4를 근거로 유의수준(a) .05, 검정력(1−β) 0.8, 효과크기(f) 0.4, 반복 측정시 사이의 상관계수 0.5, 반복측정 횟수 4회, 두 집단 간(between) 반복측정 분산 분석의 기준으로 산출한 결과 각 집단에 최소인원은 17명이었으며 탈락률 30%를 고려하여 집단별로 최소 23명을 선정할 예정이었으나, 총 60명의 대상자가 모집되었다.
60명 중 방사선 치료경험자 1명과 흡연자 2명이 탈락하였으며, 57명을 실험군 29명, 대조군 28명으로 무작위 배정하였다. 무작위 배정은 엑셀 프로그램에서 생성한 난수표를 이용하여 그룹 수 2, 표본 수 57명으로 하여 랜덤 리스트를 생성하였고, 등록된 대상자 순으로 난수표에 배정된 실험군 또는 대조군으로 동등하게 배정되도록 하였다. 중재 오염의 위험을 줄이기 위해 대조군 배정을 우선적으로 하여 측정을 완료한 후 실험군을 모집하여 중재를 제공하였으며, 실험자 효과를 최소화하기 위해 연구자는 구강 냉요법의 중재를 시행하였고, 보조 연구자 1인이 사전 조사와 중간조사, 사후조사를 실시하였다. 보조 연구자에게 대조군과 실험군을 밝히지 않는 맹검법을 적용하여 연구의 타당도를 높이기 위하여 노력하였다. 연구 진행 중 실험군에서 백혈구 감소로 인한 치료중단 및 구강 냉요법 거부, 채취한 혈액의 용혈로 인하여 4명이 중도 탈락하였고, 대조군에서 백혈구 감소로 인한 치료 중단과 채취한 혈액의 용혈로 3명이 탈락하였다. 실험군 25명, 대조군 25명 총 50명의 자료를 분석하였다(Figure 2).
본 연구에서는 Eilers 등[19]이 개발한 Oral Assessment Guide (OAG)를 이용하였다. OAG는 8개 영역(목소리, 연하, 입술, 혀 ,타액, 점막, 잇몸, 치아/의치)의 영역의 변화를 의료진이 시진과 촉진으로 객관적으로 사정하는 것으로, 각 항목당 1점은 정상범위, 2점은 부종, 발적, 색의 변화, 타액의 점도의 변화가 생기는 중등도의 변화, 3점은 궤양, 출혈, 감염이 생기는 중증의 상태를 의미한다. 8개 영역의 평가점수를 합산하여 8점 이하면 정상, 9점에서 16점까지는 경증 구내염, 17점에서 24점까지는 중증 구내염으로 분류하였다. 점수가 높을수록 구내염이 심각한 것을 의미하며, 점수범위는 8점에서 24점이다. 개발 당시 Eilers 등[19]의 연구에서 Ken-dall의 일치도 계수 W값은 .91이었으며, 본 도구의 Cronbach's α값은 .89이었다.
본 연구에서는 활성산소를 측정하기 위해 환자의 Median cubital vein에서 혈액을 2 ml를 채혈하고 Total Oxidant Stress (TOS, Callegari, Parma, Turkey) 전용 키트를 이용하여 원심분리검사를 통하여 측정하였다. 활성산소는 채혈한 정맥혈을 헤파린이 처리된 전용 모세관 튜브에 넣고 혼합한 후 원심분리기에 10분 동안 원심분리한 후 분리된 상층액 혈장을 장비의 Reading cell (Toshiba-250FB)에 놓은 후 6분간 자동검사를 실시하였다. 활성산소의 정상범위는 4.0 mol/h202~6.0 mol/h202이며, 동일 검체를 5회 이상 반복 측정할 때, 변이 계수값은 ±5%이다.
본 연구에서는 염증성 사이토카인을 측정하기 위해 Median cubital vein에서 혈액을 2 ml를 채혈하고 혼합한 후 전용 Kit (Diagnostic System Labaratory Inc, Q-PlexTM Array, Quansys-bio, USA)에 넣고 효소면역 분석법(ELISA)을 통하여 Interleukin-6 (IL-6), Tumor Necrosis Factor alpha (TNF-α) 값을 측정하였다. 채취한 혈액은 원심분리기에 10분동안 원심분리한 후 분리된 상층액 혈장 2 ml를 마이크로튜브에 옮겨 −70℃의 초저온 냉장고에 보관하였으며, 이후 Tetra-methyl benzidine을 첨가하여 발색시킨 다음 ELISA reader로 450 nm에서 흡광도를 측정하였다.
IL-6의 정상범위는 5~15 pg/ml으로, 분석내 상관변이는 1.6%~4.2%이며, 집단간 상관변이는 3.3%~6.4%이고, 민감도는 0.70 pg/ml이다. TNF-α의 정상범위는 0~6 pg/ml으로, 분석내 상관변이는 4.2%~5.2%이며, 집단간 상관변이는 4.6%~7.4%이며, 민감도는 1.6 pg/ml이다.
본 연구에서는 Beck [20]의 구강안위감 측정도구(Oral perception guide)로 측정하였다. 이 도구는 항암화학요법을 받는 암환자가 구강점막의 변화에 따라 인지한 안위감 정도를 측정하기 위해서 개발되었으며, 입술, 혀, 잇몸, 타액, 치아, 입맛, 목소리, 식사시 불편감의 8가지 항목의 4점 척도로 구성되어 있다. 점수는 8점에서 32점까지이며 8개 영역의 평가점수를 합산하여 점수가 높을수록 구강 안위감이 나쁨을 의미한다. 개발 당시 Beck [20]의 연구에서 도구의 타당도와 신뢰도는 제시되지 않았다. 본 도구를 한국어로 번안한 Park과 Hong [21]의 연구에서 Cronbach's α값은 .74이었으며 본 연구에서는 .76이었다.
대조군과 실험군 모두에게 근거기반 임상간호 실무지침 중 암환자 구강간호와 선행연구[15]를 근거로 프로토콜에 따라 1일 3회 매 식전 상온의(15~22℃) 0.9% 생리 식염수 20 cc를 구강에 함수하여 30초 이상 헹군 후 뱉어내고 1일 4회(매 식사 후, 취침 전) 3분씩 동일한 제품의 부드러운 칫솔과 치약으로 양치질을 하도록 하였다. 구강간호방법은 연구자가 직접 시범을 보이고 대상자가 실제로 정확하게 시행하는지 확인하였다. 각 군에 적용하는 생리 식염수 용액은 본 연구자가 직접 대상자에게 제공하였다. 실험군과 대조군 모두에게 항암치료가 시작되는 첫날부터 항암치료가 끝날 때까지 1일 3회 생리식염수 함수와 1일 4회 양치질을 수행하게 하였다. 또한 실험군과 대조군 모두에게 항암화학요법을 받는 기간 동안 구강점막에 자극을 줄 수 있는 상업용 구강 함수제를 사용하지 않도록 교육하고, 중재에 필요한 얼음 이외에는 구강 점막의 온도를 변화시킬 수 있는 차가운 음료, 음식은 제한하였다.
실험군에게 구강 냉요법은 항암화학요법 치료일에 생수 얼음을 이용하여 Cisplatin과 Gemcitabine 투여 5분 전부터 투여 후 30분까지 총 65분동안 1일 2회 실시하였고, 항암화학요법 주기에 맞추어 2주 간격으로, 3차례 실시하였다(Figure 1B). 실험군이 사용한 얼음은 생수 10 ml를 직경 2.5 cm의 원형 크기의 얼음 아이스 보틀에 담아서 대상자에게 중재 기간 동안 제공하였다. 실험군의 대상자에게 반좌위를 취해주고 펜라이트를 비추어 설압자로 구개반사를 확인한 후 얼음을 제공하였다. 입 안에서 얼음을 굴려 녹이면서 삼키도록 하였다. 실험군에게 얼음이 녹으면 새로운 얼음을 요청할 수 있도록하여 연구자가 직접 제공하였고, 처음 얼음을 제공한 후 얼음을 녹이면서 삼키는 과정에서 불편감이 없는지를 확인하였다.
자료수집 기간은 2017년 6월 27일부터 2017년 11월 30일까지 약 5개월간 진행하였다. 연구자와 보조 연구자 1인은 종합 병원의 수간호사와 경력 간호사로서 항암화학요법을 받는 환자들을 15년 이상 간호한 경험이 있으며, 본 연구를 실시하기 위해 구강안면외과 교수에게 구내염 사정 훈련을 받았다. 사전 조사는 1차 항암화학요법을 받기위해 입원한 당일에 측정하였으며, 사후 조사는 외래 방문날짜인 항암화학요법이 끝난 1주일 후, 1차부터 3차에 걸쳐 측정하였다.
본 연구의 내용과 방법에 대하여 해당 병원의 임상시험심사 위원회의 승인을 받아 진행하였다(IRB No. CHAMC 2017-06-027). 자료 수집시 대상자에게 목적, 연구방법을 설명하고 설명서 및 동의서를 받았다. 설문에 참여하여 제공되는 금전적인 보상은 없었으나 소정의 선물을 증정하였고, 구강 냉요법시 불편감을 느끼거나 대상자가 원하면 언제라도 참여를 철회할 수 있음을 설명하였다. 연구자는 무기명으로 번호로 코드화하여, 익명화된 설문지로 자료수집을 진행하여 대상자의 신원정보가 노출되지 않도록 할 것임을 알려주었다. 수집된 자료는 기밀유지를 위하여 공개적으로 열람되지 않음을 밝히고, 연구목적으로만 사용할 것과 자료는 연구 논문이 발표된 후 폐기할 것이라는 점을 설명하였다.
수집된 자료는 SPSS WIN 24.0 Program을 이용하여 분석하였다. 실험군과 대조군의 일반적 특성, 질병관련 특성, 구강 건강 관련 특성은 실수와 백분율, 평균과 표준편차를 구하였다. 실험군과 대조군의 일반적 특성, 질병관련 특성에 대한 두 집단간의 동질성 검정은 Chi-square test와 independent t-test, Fisher's exact test로 분석하였다. 실험군과 대조군의 활성산소, 염증성 사이토카인, 구강 안위감의 정규성 검정은 Shapiro-Wilk 정규성 검증을 이용하여 분석하였으며, 실험군과 대조군의 활성산소, 염증성 사이토카인, 구강 안위감의 동질성 검정은 independent t-test, Mann Whitney U test를 이용하여 분석하였다. 실험군과 대조군의 시점에 따른 구내염, 활성산소, 염증성 사이토카인, 구강 안위감의 집단간 차이와 시점간 변화량의 차이는 independent t-test를 이용하여 분석하였다.
실험군과 대조군의 구내염과 활성산소, 염증성 사이토카인, 구강안위감의 변화는 Repeated measures ANOVA로 확인하였고, 구형성 가정을 만족하지 않는 경우 Greenhouse-Geisser 결과를 적용하여 분석하였다.
실험군과 대조군의 일반적 특성, 질병관련 특성 및 구강 관련특성은 유의한 차이가 없어서 두 군은 동질한 것으로 나타났다(Table 1).
본 연구의 종속변수인 활성산소, 염증성 사이토카인, 구강 안위감은 실험군과 대조군간에 유의한 차이가 없어서 두 군이 동질한 것으로 나타났다(Table 2).
실험군과 대조군의 구내염 정도는 두 군 모두 시간이 경과함에 따라 나빠졌으나(p=.003), 집단과 시점 간의 유의한 교호작용이 있었다(p=.015). 2차 항암화학요법 후(p=.009)와 3차 항암화학요법 후 (p=.008) 구내염 정도는 실험군이 대조군보다 낮았다. 또한 2차 항암화학요법 후(p=.022)와 3차 항암화학요법 후(p=.019) 구내염이 증가한 정도는 실험군이 대조군보다 유의하게 작았다(Table 3).
반복 측정 분산분석 결과 구내염은 집단간(F=5.51, p=.022), 측정 시기(F=7.32, p=.003), 시간과 집단의 상호작용(F=2.72, p=.015)에서 통계적으로 유의미한 차이가 있었다. 따라서 1가설은 지지되었다. 시점에 따른 집단간 구내염의 변화량 차이는 2차 항암화학요법 후와 1차 항암화학요법 후(t=1.13, p=.022)와 3차 항암화학요법 후와 1차 항암화학요법 후(t=1.95, p=.019)가 통계적으로 유의하였다.
실험군과 대조군의 활성산소 발생량은 두 군 모두 시간이 경과함에 따라 증가하였으나(p<.001), 집단과 시점 간의 유의한 교호작용이 있었다(p<.001). 2차 항암화학요법 후(p=.044)와 3차 항암화학요법 후(p<.001) 활성산소 발생량은 실험군이 대조군보다 낮았다. 또한 1차 항암화학요법 후(p=.013), 2차 항암화학요법 후(p<.001)와 3차 항암화학요법 후(p<.001) 활성산소 발생량이 증가한 정도는 실험군이 대조군보다 유의하게 작았다(Table 3).
2차, 3차 항암화학요법 후 시점간 통계적으로 유의한 차이가 있는 것으로 나타났다(F=28.17, p<.001). 또한 시간과 집단간 상호작용에서도 통계적으로 유의미한 것으로 나타났다(F=10.94, p<.001). 따라서 제 2가설은 지지되었다. 시점에 따른 집단간 활성산소변화량의 차이는 2차 항암화학요법 후와 사전 조사시(t=2.07, p=.044), 3차 항암화학요법 후와 사전 조사시(t=7.26, p<.001) 통계적으로 유의한 차이가 있었다.
실험군과 대조군의 IL-6 수준은 시간이 경과함께 따라 증가하는 경향이 있었으며, 실험군이 대조군보다 낮았으나(p=.009) 집단과 시점 간의 유의한 교호작용은 없었다.
실험군과 대조군의 TNF-α는 두 군 모두 시간이 경과함에 따라 증가하였으나(p<.001), 집단과 시점 간의 유의한 교호작용이 있었다(p=.009). 2차 항암화학요법 후(p=.011)와 3차 항암화학요법 후 (p<.001) TNF-α 수준은 실험군이 대조군보다 낮았다. 또한 1차 항암화학요법 후(p=.004), 2차 항암화학요법 후(p=.020)와 3차 항암화학요법 후(p<.001) TNF-α 수준이 증가한 정도는 실험군이 대조군 보다 유의하게 작았다(Table 3).
반복 측정 분산분석 결과 TNF-α는 집단간(F=11.15, p=.002), 측정 시기(F=26.92, p<.001), 시간과 집단의 상호작용(F=7.41, p=.009)에서 통계적으로 유의미한 차이가 있었다. 따라서 가설은 지지되었다. 시점에 따른 집단간 TNF-α의 변화량 차이는 1차 항암화학요법 후(t=3.01, p=.004)와 2차 항암화학요법 후(t=2.41, p=.020)와 3차 항암화학요법 후(t=3.87, p<.001)와 사전 조사간에 통계적으로 유의하였다 따라서 제 3가설은 부분적으로 지지되었다.
실험군과 대조군의 구강 안위감은 두 군 모두 시간이 경과함에 따라 증가하였으나(p<001), 집단과 시점 간의 유의한 교호작용이 있었다(p<.001). 또한 2차 항암화학요법 후(p=.033)와 3차 항암화학요법 후(p<.001) 구강 안위감이 증가한 정도는 실험군이 대조군보다 유의하게 작았다(Table 3).
반복 측정 분산분석 결과 구강 안위감은 집단간(F=4.52, p=.039), 측정 시기(F=32.88, p<.001), 시간과 집단의 상호작용(F=11.55, p<.001)에서 통계적으로 유의미한 차이가 있었다. 따라서 제 4가설은 지지되었다. 시점에 따른 집단간 구강 안위감의 변화량 차이는 2차 항암화학요법 후(t=1.14, p=.033)와 3차 항암화학요법 후(t=4.40, p<.001)와 사전 조사간에 통계적으로 유의하였다.
본 연구에서 구내염은 시간이 경과함에 따라 실험군과 대조군 모두 악화되었다. 본 연구에서 1차 항암화학요법 후 실험군의 구내염 점수는 대조군보다 높았으나, 2차 항암화학요법 이후 대조군의 구내염이 악화되었다. 이는 같은 도구로 항암화학요법을 받기 위해 입원한 암환자들의 구내염 정도를 조사한 연구에서 항암화학요법 1차 시기에 10.02점, 2차 시기에 12.28점 증가하여[22] 항암화학요법의 차수가 많아질수록 구내염이 악화되는 것을 확인할 수 있었다. 그러나 5-Fu Bolus 항암화학요법을 받는 환자에게 항암제 투여 5분 전부터 투여 30분까지 얼음조각을 적용한 연구에서 중재 적용 1주 후 대조군 모두 구내염이 악화되었다가 3주 후 두 군 모두 감소되었던 것과 달랐다[23]. 구내염은 항암화학요법 후 3~4일 정도에 발생하여 7~10일정도 가장 악화되며 14일 이후부터 감소하는 것을 고려해 볼 때[3], 선행연구에서는 항암치료 후 구내염이 완화되는 기간을 지나 구강점막이 치유가 된 3주차 간격을 두고 구강 점막을 관찰한데 반하여 본 연구에서는 항암화학요법 후 구내염이 악화되는 시기인 1주 후에 관찰하였으므로 연구결과에 차이가 있었던 것은 항암제 독성이 나타나는 시기와 관련이 있는 것으로 추정된다. 구강간호는 항암화학요법 시작 전부터 14일 이후까지 시행해야 한다고 한 연구[13]도 있으므로 추후 치료 시기별 구내염 수준을 고려하여 구강간호를 시행하는 것이 필요하다고 생각한다.
본 연구와 약물이 달라서 직접적인 비교는 어렵지만, 5-Fu, Cyclophosphamide, Adriamycin, Methotrexate (MTX)약물을 투여받는 암환자를 대상으로 구강 냉요법을 실시한 연구에서도 실험군의 45.0%에서 Grade 2의 구내염이 발생한 것에 비해 대조군의 77.5%가 Grade 2이상의 구내염이 발생하였다는 결과[6]와 같은 맥락이었다. 그러나 암환자를 대상으로 구내염 예방 함수액으로 클로로헥시딘 사용군, 구강 냉요법군, 대조군 간의 구강간호 효과를 비교한 연구결과[8], 구강 냉요법군이 구내염으로 식이섭취가 지연된 기간이 12.13일이었고, 대조군이 13.53일, 클로로헥시딘군이 8.53일이었던 것과는 달랐다. 이는 본 연구의 대상자는 처음 항암화학요법을 시행하는 환자로서 흡연력이 없는 여성이었으나 선행 연구에서는 항암화학요법을 받고 있거나 흡연하는 대상자가 포함되었기 때문으로 추정된다.
조혈모 이식을 받는 혈액암 환자들을 대상으로 한 무작위 대조군 연구에서 구강 냉요법은 중증 구내염을 감소시켰고, Melphalan 투여 시 구내염을 예방할 수 있는 효과적인 구강간호로 확인되었다[2425]. Toro 등[25]의 연구에서는 구강 냉요법을 받은 실험군의 90.0%가 구내염이 발생하지 않았지만, 생리 식염수 함수를 한 대조군에서는 34.0%만이 구내염이 발생하지 않았다. 또한 항암화학요법 시작 후 9일째 구내염 사정에서 구강 냉요법을 받은 실험군에서는 World health organization scale for oral mucositis (WHO scale)이 평균 0.43 등급이었으나 양치질, 구강 함수만을 시행한 대조군에서는 평균 1.14 등급으로 구내염 수준이 낮았다[24]. 이와 같이 얼음을 이용한 구강 냉요법이 항암화학요법을 받는 암환자의 객관적인 구강상태를 증진시키고 구강 합병증 예방에 효과적임을 알 수 있었다.
본 연구에서 구강 냉요법은 활성산소의 발생량의 감소에 효과가 있는 것으로 나타났다. 활성산소 수치의 정상 범위는 4~6 mol/h202인데, 실험군과 대조군은 연구기간 동안 10 mol/h202 이상이었으며, 1차, 2차, 3차 항암화학요법 후 모두 증가하였으나 집단과 시점간에 유의한 교호작용이 있었다. 시점에 따른 활성산소의 변화를 살펴본 결과, 2차, 3차 항암화학요법 후 측정한 활성산소가 증가한 정도는 실험군이 대조군보다 적었다. 5-Fu와 10.0% 아세트산을 실험용 쥐의 구강 점막에 투여하고 구내염의 진행에 따른 활성산소 발생을 조사한 선행 연구에서도 실험 7일 이후부터 실험군과 대조군의 활성산소 발생량에 차이가 있었다는 결과와 유사하였다[26]. 이는 이전 항암화학요법의 경험이 항암화학요법으로 인한 구내염에 영향을 미치는 요인이라는 점을 고려해 볼 때[13], 본 연구의 대상자들은 모두 처음 항암화학요법을 받았으므로 2차 항암화학요법 이후부터 이전 항암화학요법으로 인한 면역력 저하 및 세포 파괴가 가중되었을 것으로 추정된다. 구강 냉요법이 항암화학요법으로 인한 구내염의 발생 기전 중에서 활성산소 발생 차단에 어떠한 영향을 미쳤는지를 인간을 대상으로 규명한 연구는 부족하지만 활성산소는 불안정하고 반응력이 높은 유해산소로 세포와 조직에 비가역적인 손상을 초래하는 물질이며 화학적 반응을 통해 Superoxide anion radical, Hydroxyl radical로 환원될 때 온도가 낮아질수록 쉽게 반응할 수 없다[27]. 따라서 온도 저하를 통해 감소된다는 원리에 근거하여 보았을 때, 항암화학요법으로 구강 점막에 영향을 주는 활성산소 발생을 구강 냉요법을 통해 차단할 수 있다고 사료되며, 현재 실무에서 행하고 있는 간호 중재에도 근거를 제공할 수 있다고 본다. 본 연구는 구강냉요법이 구강 점막에 미치는 효과를 과학적 근거인 생리적 지표로 검증하였다는 점에서 의의가 있으나 대상자 수를 확대한 추후 연구가 더욱 필요하다고 본다.
본 연구에서 구강 냉요법은 두 군간 IL-6의 변화에 유의한 효과가 없었다. 실험군에서 1차, 2차 항암화학요법 후 증가하였으나 3차 항암화학요법 후 감소하였고, 대조군에서는 1차, 2차, 3차 항암화학요법 후 모두 증가하였다. IL-6는 집단과 시점간의 유의한 교호작용이 없었다. 이는 구강 냉요법을 항암화학요법을 받는 환자에게 IL-6를 확인한 연구가 없어 직접적인 비교는 어렵지만, 질환이 없는 성인집단을 대상으로 실시한 연구에서도 구강 냉요법은 IL-6의 감소에 효과가 없었다는 선행 연구결과[28]와 류마티스 질환 환자를 대상으로 한 연구의 결과와 유사하였다[29]. 하지만 류마티스 질환 환자에게는 찬 공기를 주입하여 냉요법을 시행하였고[29], 질환이 없는 성인 집단을 대상으로 한 연구에서는 본 연구와 동일하게 얼음 조각을 구강 내에 넣고 차가운 온도를 유지하게 하였으나, 타액으로 IL-6를 측정하였다는 점에서 차이가 있다[28]. 또한 본 연구에서 Cisplatin은 암세포의 세포독성효과를 약화시키는 Extra cellular signal regulated kinase 경로를 활성화하는 약물로[2], 항암화학요법시 저항성을 나타낼 수 있으므로 부인암 환자들의 종양 소멸이나 진행과정에 따른 IL-6의 변화는 부인암 암의 종류, 암 진단 병기, 전이 여부 등의 특이성을 고려하여 분석해야 할 필요가 있다. 또한 구내염의 진행과정에서 두 번째 단계인 염증기와 혈관기에서 NF-κB의 활성화를 통하여 IL-6, TNF-α등의 염증성 사이토카인의 생성이 촉진되어 조직이 손상되는 과정으로 진행되지만[3], 구내염 발생 과정에서 항암화학요법을 받는 대상자의 IL-6의 생성과 관련된 연구가 부족하므로 추후 연구를 통해 규명할 필요가 있다.
본 연구에서 구강 냉요법은 TNF-α의 차이에 효과를 미치는 것으로 나타났다. TNF-α의 정상범위는 0~6 pg/ml인데, TNF-α는 9 pg/ml로 실험군과 대조군에서 1차, 2차, 3차 항암화학요법 후 모두 상승하였다. 그러나 집단과 시점간에 유의한 교호작용이 있었다. 이는 인간을 대상으로 구강 냉요법을 적용하여 염증성 사이토카인을 측정한 연구가 없어 직접적인 비교는 어렵지만, 류마티스 질환 환자를 대상으로 냉요법을 실시한 연구에서 TNF-α의 수치가 대조군보다 실험군에서 유의하게 감소하였던 결과와 유사하였다[29]. 이는 구강 냉요법이 구강 점막에 미치는 효과를 생리적 지표로 검증하였다는 점에서 의의가 있다고 생각된다.
본 연구에서 구강 냉요법은 구강 안위감의 차이에 효과를 미치는 것으로 나타났다. 구강 안위감은 실험군과 대조군에서 1차, 2차, 3차 항암화학요법 후 모두 저하되었다. 그러나 집단과 시점간에 유의한 교호작용이 있었다. 구강 안위감은 실험군과 대조군 모두에서 3차 중재 후 가장 좋지 않은 것으로 나타났다. 이러한 결과는 동일한 조건의 대상자가 아니므로 비교하기는 어려우나, 항암화학요법을 받는 대상자들의 40.0%가 구강 건조, 입맛 변화, 섭취 곤란의 증상과 같은 구강 불편감을 호소하고 있으며 항암화학요법의 차수가 증가할수록 불편감도 높아졌다는 연구와 같은 맥락이라고 할 수 있다[30]. 또한 2차 항암화학요법 후 실험군의 구강 안위감이 대조군보다 좋았는데, 구강 냉요법이 항암화학요법으로 인해 발생하는 활성산소 발생을 차단하고 염증성 사이토카인 발생을 일부 억제시켜 나타난 결과로 사료된다. 이러한 결과는 구강 불편감은 구내염의 진행에 따라 가중될 수 있으며[12], 항암제의 종류[9], 구강 간호 방법[28]에 따라 영향을 받을 수 있다는 연구결과와도 일맥상통한다. 부인암 환자와 같은 고형암 환자의 경우 구내염이 3~5일 이내에 주로 발생하고, 7일경 가장 심해지는 특성을 고려하여 보았을 때[15] 부인암 환자 간호시 항암화학요법 후 1주에 좀 더 적극적이고 효과적인 구강간호를 제공해야할 필요가 있다고 사료된다. 또한 구강 안위감은 항암화학요법이 반복될수록 저하된다는 선행 연구결과를 고려해 보았을 때[30], 항암제의 주기와 항암화학요법 진행에 따른 혈액학적 변화[11]등 구강 안위감에 영향을 미칠 수 있는 다른 외생변수들을 통제한 연구를 확인하여 비교해 볼 필요가 있다.
이와 더불어 본 연구는 단일기관에서 대상자를 모집하여 그 표본수가 작기 때문에 표본의 대표성을 높이기 위해 다기관 연구로 대상자 수를 확대하여 구강 냉요법의 효과를 재검증할 것을 제언한다. 또한 본 연구는 항암제 종류와 항암화학요법의 주기를 통제하여 구 강냉요법이 효과가 있음을 확인하였으나 연구 대상자가 구강 냉요법 실험에 참여한다는 실험 효과는 통제하지 못하였다. 따라서 플라시보 대조군을 선정하여 이중 맹검을 유지하고 구강 냉요법의 효과에 따른 구내염, 활성산소, 염증성 사이토카인, 구강 안위감의 변화를 확인하는 추후 연구를 제언한다.
본 연구를 통해서 구강 냉요법이 항암화학요법을 받는 부인암 환자의 구내염, 활성산소, 염증성 사이토카인 중 TNF-α, 구강 안위감에 효과가 있음을 확인하였다. 이에 구강 냉요법은 임상실무에서 활용될 수 있는 근거기반 중재로 제안한다.
본 연구는 구강 냉요법의 효과를 객관적 관찰 도구와 주관적 설문도구로 구강 상태를 파악하고 생리적인 지표를 확인하여 검증하였다는데 의의가 있다. 또한, 실험 연구의 검정력을 높이기 위해 단일맹검, 무작위 배정 대조군 설계로 구강 냉요법의 효과를 검증하였다는 점과 구내염 관련 혈액검사를 이용하여 과학적 근거를 마련하였다는 측면에서도 의의가 있다. 추후 항암화학요법을 받는 암환자들에게 구강 냉요법이 하나의 필수적인 간호로서 기본 간호학 이론 및 실습 교육에 기초 자료로 활용되기를 기대한다. 또한 본 연구는 항암화학요법을 받는 암환자들의 구강 간호를 임상 현장에서 중재함으로써 구강간호 수가산정의 기초 자료로서 제안하여, 간호사가 구강간호를 통해 경제적 가치를 창출할 수 있게 하고, 암환자를 위한 구강 간호가 제도적으로 정착하는데 도움이 될 것으로 기대한다.
Figures and Tables
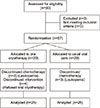 | Figure 2Flow diagram of the process through the phase of a randomized trial (based on CONSORT statement). |
Table 2
Homogeneity of Reactive Oxygen Series, Inflammatory Cytokines, and Oral Comfort between Experimental and Control Group (N=50)

Notes
References
1. Yilmaz SD, Bal MD, Beji NK, Arvas M. Ways of coping with stress and perceived social support in gynecologic cancer patients. Cancer Nursing. 2015; 38(2):E57–E62. DOI: 10.1097/NCC.0000000000000186.

2. Costello BA, Borad MJ, Qi Y, Kim GP, Northfelt DW, Erlichman C, et al. Phase I trial of everolimus, gemcitabine and cisplatin in patients with solid tumors. Investigational New Drugs. 2014; 32(4):710–716. DOI: 10.1007/s10637-014-0096-3.


3. Sonis ST. The pathobiology of mucositis. Nature Reviews Cancer. 2004; 4(4):277–284. DOI: 10.1038/nrc1318.


4. Jang JS, Kim HK, Cho BC, Lee KH, Yun HJ, Woo IS, et al. Randomized phase II study comparing weekly docetaxel-cisplatin vs. gemcitabine-cisplatin in elderly or poor performance status patients with advanced non-small cell lung cancer. Cancer Chemotherapy and Pharmacology. 2017; 79(5):873–880. DOI: 10.1007/s00280-017-3289-6.

5. Kanuga S. Cryotherapy and keratinocyte growth factor may be beneficial in preventing oral mucositis in patients with cancer, and sucralfate is effective in reducing its severity. The Journal of the American Dental Association. 2013; 144(8):928–929. DOI: 10.14219/jada.archive.2013.0211.


6. Heydari A, Sharifi H, Salek R. Effect of oral cryotherapy on combination chemotherapy-induced oral mucositis: A randomized clinical trial. Middle East. Journal of Cancer. 2012; 3(2&3):55–64.
7. Erdem Ö, Güngörmüş Z. The Effect of royal jelly on oral mucositis in patients undergoing radiotherapy and chemotherapy. Holistic Nursing Practice. 2014; 28(4):242–246. DOI: 10.1097/HNP.0000000000000033.


8. Erden Y, Ipekcoban G. Comparison of efficacy of cryotherapy and chlorhexidine to oral nutrition transition time in chemotherapy-induced oral mucositis. European Journal of Cancer Care. 2017; 26(5):e12495. DOI: 10.1111/ecc.12495.

9. Chaveli-López B, Bagán-Sebastián JV. Treatment of oral mucositis due to chemotherapy. Journal of Clinical and Experimental Dentistry. 2016; 8(2):e201–e209. DOI: 10.4317/jced.52917.
10. Kung AYH, Zhang S, Zheng LW, Wong GHM, Chu CH. Oral health status of Chinese paediatric and adolescent oncology patients with chemotherapy in Hong Kong: A pilot study. The Open Dentistry Journal. 2015; 9:21–30. DOI: 10.2174/1874210601509010021.


11. Lalla RV, Bowen J, Barasch A, Elting L, Epstein J, Keefe DM, et al. MASCC/ISOO clinical practice guidelines for the management of mucositis secondary to cancer therapy. Cancer. 2014; 120(10):1453–1461. DOI: 10.1002/cncr.28592.



12. Eilers J, Harris D, Henry K, Johnson LA. Evidence-based interventions for cancer treatment-related mucositis: Putting evidence into practice. Clinical Journal of Oncology Nursing. 2014; 18(6):80–96. DOI: 10.1188/14.CJON.S3.80-96.


13. Brown CG. A guide to oncology symptom management. 2nd ed. Pittsburgh (PA): Oncology Nursing Society;2015. p. 469–482.
14. Park SJ, Cha GS, Kim HS, Park EY. Effects of oral care protocol on oral mucositis in hematologic malignancy patients receiving chemotherapy. Journal of Korean Clinical Nursing Research. 2016; 22(1):1–9. DOI: 10.22650/JKCNR.2016.22.1.1.
15. Peterson DE, Bensadoun RJ, Roila F. ESMO Guidelines Working Group. Management of oral and gastrointestinal mucositis: ESMO clinical practice guidelines. Annals of Oncology. 2011; 22:Suppl 6. vi78–vi84. DOI: 10.1093/annonc/mdr391.

16. dos Reis PED, Ciol MA, de Melo NS, de Souza Figueiredo PT, Leite AF, de Melo Manzi N. Chamomile infusion cryotherapy to prevent oral mucositis induced by chemotherapy: A pilot study. Supportive Care in Cancer. 2016; 24(10):4393–4398. DOI: 10.1007/s00520-016-3279-y.


17. Svanberg A, Öhrn K, Birgegård G. Caphosol(®) mouthwash gives no additional protection against oral mucositis compared to cryotherapy alone in stem cell transplantation. A pilot study. European Journal of Oncology Nursing. 2015; 19(1):50–53. DOI: 10.1016/j.ejon.2014.07.011.


18. Kakoei S, Ghassemi A, Nakhaee N. Effect of cryotherapy on oral mucositis in patients with head and neck cancers receiving radiotherapy. International Journal of Radiation Research. 2013; 11(2):117–120.
19. Eilers J, Berger AM, Petersen MC. Development, testing, and application of the oral assessment guide. Oncology Nursing Forum. 1988; 15(3):325–330.

20. Beck S. Impact of a systematic oral care protocol on stomatitis after chemotherapy. Cancer Nursing. 1979; 2(3):185–199.


21. Park YJ, Hong MS. The influence of saline and betadine solution for gargle in the leukemic patients receiving chemotherapy. Chonnam Journal of Nursing Science. 1996; 1:41–58.
22. Park MH, Park JS. Difference of oral mucositis in hospitalized cancer patients receiving chemotherapy. Asian Oncology Nursing. 2013; 13(2):76–84. DOI: 10.5388/aon.2013.13.2.76.

23. Son YJ, Shin YJ, Cho MY, Kim SH, Park OS, Han SY, et al. The development of an oral care protocol for cancer patients receiving chemotherapy and its effects. Journal of Korean Clinical Nursing Research. 2011; 17(1):113–122.
24. Salvador P, Azusano C, Wang L, Howell D. A pilot randomized controlled trial of an oral care intervention to reduce mucositis severity in stem cell transplant patients. Journal of Pain and Symptom Management. 2012; 44(1):64–73.


25. Toro JJ, Schneider D, Alonzo R, Hasan A, Lee S, Gushiken F, et al. A prospective, randomized clinical trial of cryotherapy vs. supersaturated calcium phosphate rinses vs. saline rinses for the prevention of oral mucositis in patients with multiple myeloma (MM) receiving high-dose melphalan (HDM) and autotransplantation. Biology of Blood and Marrow Transplantation. 2014; 20(2):S204–S205. DOI: 10.1016/j.bbmt.2013.12.340.

26. Yoshino F, Yoshida A, Nakajima A, Wada-Takahashi S, Takahashi S, Lee MC. Alteration of the redox state with reactive oxygen species for 5-fluorouracil-induced oral mucositis in hamsters. PLoS One. 2013; 8(12):e82834. DOI: 10.1371/journal.pone.0082834.

27. Zorov DB, Juhaszova M, Sollott SJ. Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release. Physiological Reviews. 2014; 94(3):909–950. DOI: 10.1152/physrev.00026.2013.



28. Svanberg A, Öhrn K, Broström H, Birgegård G. The effect of cryotherapy on oral mucosa: A study in healthy volunteers. Medical Oncology. 2012; 29(5):3587–3591. DOI: 10.1007/s12032-012-0230-z.


29. Jastrząbek R, Straburzyńska-Lupa A, Rutkowski R, Romanowski W. Effects of different local cryotherapies on systemic levels of TNF-α, IL-6, and clinical parameters in active rheumatoid arthritis. Rheumatology International. 2013; 33(8):2053–2060. DOI: 10.1007/s00296-013-2692-5.


30. Wilberg P, Hjermstad MJ, Ottesen S, Herlofson BB. Chemotherapy-associated oral sequelae in patients with cancers outside the head and neck region. Journal of Pain and Symptom Management. 2014; 48(6):1060–1069. DOI: 10.1016/j.jpainsymman.2014.02.009.






 PDF
PDF ePub
ePub Citation
Citation Print
Print






 XML Download
XML Download