Abstract
Patients with type 2 diabetes (T2D) have a significantly higher risk of developing cardiovascular diseases such as myocardial infarction, heart failure, and stroke. Current anti-diabetic drugs are highly effective for managing hyperglycemia. However, most T2D patients are still at high risk for cardiovascular disease. Over the past decade, many studies have assessed the efficacy of anti-diabetic drugs in regards to cardiovascular disease outcomes in T2D patients. However, despite the effective glycemic control of these drugs, they failed to show significant benefits that impact the morbidity and mortality of cardiovascular disease (CVD). In recent years, anti-diabetic drugs, developed with other mechanisms, have shown significant results for improving the risk of CVD. In addition, sodium glucose cotransporter 2 inhibitors have shown promising results that impact CVD outcomes in several trials. This article will review the cardiovascular outcomes and possible cardioprotective mechanisms of sodium glucose cotransporter 2 inhibitors.
현대사회에서 평균 수명이 연장됨에 따라 제 2형 당뇨병의 유병률이 증가하고 있으며, 이는 심혈관 질환 등의 심각한 합병증의 위험 증가로 이어지고 있다. 기존에 사용되던 당뇨병 약제들의 심혈관 합병증 예방 효과에 대하여서는 많은 연구가 있었으나, 대부분의 경우 효과적인 혈당 강하 효과에도 불구하고 심근경색이나 뇌졸중과 같은 심혈관 질환에 대한 유의한 위험 개선 효과를 보이지 못하였다.
비교적 최근 개발되어 사용중인 당뇨병 약제들 중 심혈관 질환에 대하여 유의한 위험 개선 효과를 보인 것들이 있었는데, 대표적인 약제로 liraglutide (Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Outcome Results [LEADER] trial),1 semaglutide (Trial to Evaluate Cardiovascular and Other Long-term Outcomes with Semaglutide in Subjects with Type 2 Diabetes [SUSTAIN-6] trial),2 empagliflozin (Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients-Removing Excess Glucose [EMPA-REG OUTCOME] trial),3 canagliflozin (Canagliflozin Cardiovascular Assessment Study [CANVAS] program)4 등이 있다. 이들 중 sodium-glucose cotransporter 2 inhibitors (SGLT 2 억제제)는 경구용 약제로 당뇨병의 미세혈관 합병증인 신장 합병증뿐 아니라 심혈관 질환 발생과 사망률에 긍정적인 결과를 보였다.
SGLT2 억제제는 신장의 근위세뇨관(proximal tubule)에 주로 위치한 낮은 친화도, 높은 수용도의 sodium-glucose cotransporter 2를 억제하여 사구체에서 여과된 포도당이 혈액 내로 다시 재흡수 되는 것을 억제한다.5 환자의 신기능과 혈당 조절 정도에 따라 차이가 있으나, SGLT2에 대한 억제를 통하여 하루에 60–80 g의 포도당을 추가로 몸 밖으로 배출하게 하는 역할을 하여6 소변으로의 당 배출 증가 및 열량 손실로 이어지게 되고 이에 따라 체중 감량도 나타나며,5 삼투성 이뇨 작용에 의해 혈압 강하 효과도 동반되는 것으로 나타났다.7 본 논문에서는 상기 약제의 심혈관 질환 위험에 대한 효과와, 그 가능한 기전에 대하여 고찰해 보고자 한다.
EMPA-REG OUTCOME 연구는 SGLT2 억제제인 empagliflozin의 심혈관 질환 결과를 본 연구로, 당뇨병약제로 심혈관 질환 위험 감소를 증명한 첫번째 연구이다.3 심혈관 질환의 고위험군에 해당하는 7,020명의 제2형 당뇨병 환자를 대상으로, empagliflozin 10 mg/day 또는 25 mg/day을 투여한 군과 대조군을 비교한 무작위 대조군 연구로 3.1년동안 관찰하였을 때 심혈관 질환으로 인한 사망, 심근경색, 뇌졸중을 포함하는 심혈관 질환의 일차결과지표를 통계적으로 유의한 수준에서 개선함을 보였다(hazard ratio [HR], 0.86; 95% confidence interval [CI], 0.74–0.99; p=0.04 for superiority). 비록 심근경색과 뇌졸중 각 질환의 발생률을 통계학적으로 유의하게 줄이지는 못하였으나, 심부전으로 인한 입원을 35%, 심혈관 질환으로 인한 사망률을 38%, 전체 사망률을 32% 개선하는 결과를 보였다.3 하위군 분석(subgroup analysis)에서, 이러한 심부전으로 인한 입원율, 심혈관 질환으로 인한 사망률 개선 효과는 기존 심부전의 동반 여부에 관계 없이 나타나는 것으로 밝혀졌다.8
Canagliflozin은 CANVAS program 연구를 통해 심혈관 질환에 대한 영향을 연구하였다.4 이 연구에서는 심혈관 질환 고위험군인 제 2형 당뇨병 환자 10,142명을 대상으로 치료군, 대조군으로 나누어서 전향적으로 188.2주 동안 canagliflozin과 위약을 비교하였다. 연구결과 canagliflozin은 심혈관 질환으로 인한 사망, 심근경색, 뇌졸중을 합해 본 일차결과지표를 대조군에 비해서 유의하게 예방하는 결과를 보였다(1,000 person-year 당 발생 26.9명 vs. 31.5명; HR, 0.86; 95% CI, 0.75–0.97; p<0.001 for non-inferiority; p=0.02 for superiority). 세부지표에서 심혈관 질환으로 인한 사망을 유의하게 감소시키지는 못하였으나 (1,000 person-year 당 발생 11.6명 vs. 12.8명; HR, 0.87; 95% CI, 0.72–1.06) 심부전으로 인한 입원을 33% 유의하게 개선하는 것으로 나타났다. 상기 연구에서 약제 사용과 관련하여 하지 절단 위험의 증가 가능성이 보고되었으나 (1,000 person-year 당 발생 6.3명 vs. 3.4명, HR, 1.97; 95% CI, 1.41–2.75) 이것이 SGLT2 억제제 전체에서 공통으로 나타날 수 있는 위험인지는 명확하지 않다.
Dapagliflozin의 경우 진행된 IIB/III 상 연구들로 메타 분석 결과가 발표된 바가 있다.9 해당 연구에서는 총 9,339명, 그 중에서 dapagliflzin 치료군 5,936명과 (6,668 person-year) 대조군 3,404명 (3,882 person-year) 결과를 비교 분석하였다. 본 연구에서 dapagliflozin은 주요 심혈관 질환 발생률을 감소(HR, 0.77; 95% CI, 0.54–1.10) 시키는 경향성을 보였으나 통계적으로 유의한 차이를 보이지는 못하였다.9
2017년 발표된 CVD-REAL (Comparative Effectiveness of Cardiovascular Outcomes in New Users of SGLT-2 Inhibitors) Nordiac 연구는 후향적 real-world data 연구로 3종류의 SGLT2 억제제를 모두 포함하여 연구하였다. 이 연구에서는 empagliflozin, canagliflozin 약제도 포함하였지만 대부분 dapagliflozin 사용자를 대상으로 하여 SGLT2 억제제가 실제 임상 환경에서 제2형 당뇨병 환자의 심혈관 질환과 관련한 사망률, 이환율 개선에 도움이 되는가를 확인하였다.10 SGLT2 억제제는 타 당뇨 약제에 비하여 심혈관 질환 관련한 사망률 개선(HR, 0.53; 95% CI, 0.40–0.71), 주요 심혈관 질환 발생률 감소(HR, 0.78, 95% CI, 0.69–0.87), 그리고 심부전으로 인한 입원율 개선(HR, 0.70; 95% CI, 0.61–0.81; p<0.0001 for all)에 효과적인 것으로 나타났다. 2018년 발표된 CVD-REAL 2 연구에서도 마찬가지로, dapagliflozin이 가장 많이 사용되고, 동양인이 다수 포함된 그룹에서의 SGLT2 억제제의 실제 임상 효과를 확인하였다. 본 발표에서 SGLT2 억제제는 기존의 사망률(HR, 0.51; 95% CI, 0.37–0.70), 심부전으로 인한 입원율(HR, 0.64; 95% CI, 0.50–0.82) 뿐만 아니라, 심근경색(HR, 0.81; 95% CI, 0.74–0.88)과 뇌졸중(HR, 0.68; 95% CI 0.55–0.84; p<0.001 for all) 위험 개선에도 효과적임을 밝혔다.11
현재 dapagliflozin이 심혈관 질환에 미치는 영향을 확인하기 위한 IIIB상 무작위대조군 연구인 DECLARE-TIMI 58 (Dapagliflozin Effect on CardiovascuLAR Events)이 2019년경 발표 예정 하에 진행 중에 있다.
국내에서 사용중인 다른 SGLT2 억제제의 경우 장기간, 대규모로 진행, 발표된 연구는 없으나 ipragliflozin과 같은 일부 약제는 대규모 메타분석에 연구 결과가 포함되어 함께 분석된 바가 있다. 2016년 발표된 메타분석에서 SGLT2 억제제는 주요 심혈관 질환 발생(relative risk [RR], 0.84; 95% CI, 0.75–0.95; p=0.006), 심혈관 질환으로 인한 사망(RR 0.63; 95% CI, 0.51–0.77; p<0.0001), 심부전 (RR 0.65; 0.50–0.85; p=0.002), 그리고 전체 사망률(RR 0.71; 0.61–0.83; p<0.0001)에서 유의한 개선 효과를 보였으나, 뇌졸중 발생 위험은 증가(RR, 1.30; 95% CI, 1.00–1.68; p=0.049)하는 것으로 나타났다.12 이 연구에서 약제 간의 심혈관 결과지표, 사망률 상의 차이는 확인되지 않았다(all I2<43%).
2017년에 진행한 메타분석에서는 총 81개의 연구, 37,195명의 환자들을 대상으로 평균 89주 동안 SGLT2 억제제를 사용한 결과를 보고하였다.13 이 분석에서 SGLT2 억제제는 전체 사망률(OR, 0.72; 95% CI, 0.59–0.86; p<0.001), 심혈관 질환으로 인한 사망률(OR, 0.67; 95% CI, 0.53–0.84; p=0.001), 심부전 위험(OR, 0.67; 95% CI, 0.51–0.87; p=0.003) 등에서 유의한 위험 개선 효과를 보였다. 다만 심근경색(OR, 0.89; 95% CI, 0.74–1.09; p=0.29), 뇌졸중 및 일과성 뇌허혈 발작(OR, 1.09; 95% CI, 0.87–1.37; p=0.47) 등에는 유의한 차이를 보이지 않았다. 약제 각각으로 분석해 보았을 때에는 empagliflozin만 전체 사망률 개선에서 유의미한 차이를 보였고, dapagliflozin의 경우 전체 사망률 위험 증가 양상을 보였으나 통계적으로 유의하지는 않았다(OR, 2.15; 95% CI, 0.92–5.04, p=0.08).13
앞서 보았듯 SGLT2 억제제는 그 종류에 상관없이 일관된 심혈관 질환에 대한 보호 효과를 보이고 있다. 초기에는 SGLT2 억제제의 이러한 효과가 혈당 개선을 통한 동맥죽상경화 개선에 의한 것이라 여겨졌다.14 하지만 EMPA-REG OUTCOME 연구에서는 SGLT2 억제제의 사용 초기부터 심혈관 질환 개선 효과가 나타났고, 심근 경색 뿐만 아니라 심부전에 대한 효과도 확인되었다. 이는 SLGT2 억제제의 효과를 동맥죽상경화 개선에 의한 것으로 설명하기에 예외적인 결과들이다.
EMPA-REG OUTCOME 연구와 CANVAS Program은 SGLT2 억제제의 신장 보호 효과 역시 보여주었다. 심장과 신장에 미치는 SGLT2 억제제의 역할에 대한 기전은 아직 명확하게 밝혀져 있지 않고 이를 단순히 혈당 조절에 의한 효과로만 보기도 어렵다. 현재는 SGLT2 억제제를 사용했을 때 확인할 수 있는 사실들, 즉 혈당 개선, 혈압 조절, 체중 감소, 사구체에서의 과여과(hyperfiltration)의 개선 등이 복합적으로 작용하였을 가능성을 고려해 보아야 한다. 따라서 현재 제시되고 있는 SGLT2 억제제를 통한 심장 보호효과의 가능한 기전에 대하여 좀 더 자세히 살펴보도록 하겠다.
무작위 대조군 연구들인 EMPA-REG OUTCOME이나 CANVAS Program의 경우를 보면, 치료군과 대조군 간의 평균 당화혈색소의 차이는 0.6%를 초과하지 않았으며 이는 기존의 타 약제, 예를 들어 dipeptidyl peptidase-4 억제제로 치료를 진행한 연구에서의 경우와151617 크게 차이가 나지 않았다. 이들 타 약제 기반의 연구에서는, 비슷한 혈당조절에도 불구하고 심혈관 질환 효과에 대하여 유의한 차이를 보이지 못하였다. 또한 SGLT2 억제제에 의한 심혈관 질환 개선 효과는 치료 초기부터 나타났으나, 혈당 개선에 의한 심혈관 질환 발생률 개선은 수년이 지난 후에야 나타난다는 점,1819 그리고 고혈당 자체는 심혈관 질환에서의 비교적 약한 위험인자라는 점182021 등으로 미루어 볼 때 단순 혈당 개선에 의한 효과로 보기는 어렵다.
다만 SGLT2 억제제가 다른 당뇨약제인 인슐린, 설폰요소제, 티아졸리딘디온, 인크레틴 기반 약제와 구분되는 점은, 이들 약제가 체내의 포도당을 조직 내로의 이동을 통해 작용한다면, SGLT2 억제제는 포도당을 외부로 배출하는 기전을 보인다는 점이다. 이러한 포도당 흐름의 차이는 당에 의한 독성(glucotoxicity) 차이로 이어질 수 있다. 조직 내에서의 고혈당은 미토콘드리아에서 과산화물(superoxide)의 증가로 이어지며,22 이러한 산화스트레스(oxidative stress)는 심혈관 뿐 아니라 심근 자체에서도 작용하여 동맥의 죽상경화 뿐 아니라 당뇨에서의 심부전 발생과도 연관된다.23 따라서 SGLT2 억제제를 통한 당의 체외 배출은, 당에 의한 독성을 완화하여 심장의 효율 개선과 혈관의 죽상경화 진행의 예방을 기대할 수 있다.
또한 SGLT2 억제제의 사용은 체내에서 포도당 대신 지방산 산화를 통해 생선된 케톤체들의 이용을 증가시킨다.2425 이러한 케톤체는 당뇨병으로 인한 심부전 환자에서, 지방산이나 포도당보다 더 효율적인 에너지원으로 사용될 수 있으며2627 이러한 대사체의 변화로 인한 효과는 현재까지 활발히 연구, 논의되고 있다.
SGLT2 억제제를 사용함으로써, 소변을 통한 포도당의 배출을 유도하고, 이는 열량의 손실 및 체중 감소로 이어진다. 그리고 이러한 체중 감소는 주로 지방조직의 감소에 기인한 것으로 밝혀진 바 있다.282930 이러한 체중, 특히 지방조직의 감소는 심혈관 질환 위험 개선에 기여할 수 있겠으나31 이 역시 체중 감소가 나타나기까지의 시간과 약제의 효과가 나타나기 시작한 시간을 비교해 본다면, 그 연관성을 충분히 설명하기에는 어려운 측면이 있다. 더욱이 EMPA-REG OUTCOME 연구, CANVAS program 등에서는 3.5% 미만의 체중 감소 효과를 보였는데, 기존의 Look AHEAD (Action for Health in Diabetes) 등의 연구에서 생활습관조절을 통해 6% 가량의 체중을 감량했음에도 심혈관 질환 개선 효과를 보이는데 실패했던 점 등을 고려한다면 체중 감량을 통한 효과는 제한적이라고 볼 수 있겠다.32
EMPA-REG OUTCOME 연구를 대상으로, 통계적 분석을 통해 약제 사용 후 변화한 여러 지표 중 어떠한 지표가 심혈관 질환 위험 감소와 가장 밀접한 관련성을 보이는지 보았던 연구에서는 체액의 용적과 관련된 지표들, 즉 적혈구의 용적 백분율(hematocrit)과 혈색소(hemoglobin)의 증가가 가장 밀접한 관련성을 보였다.34 SGLT2 억제제 사용 시 보이는 심혈관 질환에 대한 효과 설명에 있어 주로 제시되는 기전은 이러한 혈역학적인 변화, 즉 삼투압에 의한 이뇨작용과 이를 통한 혈압의 감소, 혈관 내 용적의 감소 등이다.182035 이러한 변화는 심장기능이 저하된 당뇨병 환자에서 전부하(preload)와 후부하(afterload)를 줄여 주고, 동맥경직도를 감소시키며,36 혈액농축을 통해 조직으로의 산소 전달을 용이하게 하여 심장질환 위험을 감소시키고 이러한 작용을 통해 약제에 의한 효과가 빨리 나타날 수 있었음을 짐작할 수 있다.37
물론, SGLT2 억제제 사용에 의한 심혈관 질환 개선 효과는 기존에 심부전이 없던 환자에서도 나타났지만, SGLT2 억제제 치료 연구는 대부분 심혈관 질환 고위험 군에서 이루어졌고, 당뇨병 환자의 상당 수가 진단되지 않은 심부전을 동반할 가능성이 높다는 점을 고려해야 할 것이다.8
여러 임상 연구에서 SGLT2 억제제는 수축기, 이완기 혈압 강하 효과를 함께 보였다. 하지만 이러한 혈압 강하 효과만으로 심혈관 질환 보호 효과를 설명하기는 어렵다. 기존의 타 혈압 강하제를 사용한 연구에서는, 혈압 강하 효과가 심혈관 질환 개선 효과로 이어지는데 SGLT2 억제제보다 더 많은 시간이 필요하였다.3 또한 기존 연구에서 혈압 강하제는 심혈관 질환 개선 보다는 뇌졸중 위험에 대한 개선 효과가 더 큰 것으로 나타났으나, SGLT2 억제제 사용 시에는 뇌졸중 위험 개선에 있어 유의미한 차이를 보여주지 못하였다.1838
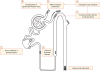
SGLT2 억제제 사용으로 인한 이뇨 효과 또한 심부전으로 인한 입원, 사망률 개선에 직, 간접으로 기여할 수 있을 것으로 보인다.39 다만 이 부분에서도 고려해야 할 사항이 있는데, 기존의 타 이뇨제들의 경우 유사하거나, 더 효과적인 혈관 내 용적 감소 및 염분(net sodium) 조절에도 심혈관 질환으로 인한 사망률을 개선하지 못하였고, 심부전으로 인한 입원율 개선 효과도 더 떨어졌다.40 SGLT2 억제제가 기존의 루프 이뇨제나 티아지드 이뇨제와 구분되는 강점으로 작용할 수 있는 특징은 몇 가지가 있다. 먼저 SGLT2 억제제 사용으로 인한 혈당 강하 효과에도 반사적인 심박동 수 증가, 즉 교감신경계의 활성화로 이어지지 않았다는 점이다. 또한 작용 위치가 근위세뇨관이기 때문에 요세관사구체 되먹임에 영향을 주어 들세동맥(afferent arteriole)의 수축을 유발하여 사구체 여과율을 감소시켜 사구체 내 압력을 감소시킬 수 있고 (Fig. 1), 티아지드 이뇨제에서 볼 수 있는 혈당과 요산 수치 증가가 없고 오히려 감소하였다는 점이다.41
SGLT2 억제제의 사용은 다양한 호르몬 변화를 야기한다. 호르몬의 변화는 심장질환 예방에 있어 중추적 역할을 기대하기는 어려우나, SGLT2 억제제 사용으로 인한 여러 효과와 연관되어 작용할 수 있다. SGLT2 억제제는 혈관 내 용적 감소, 혈압 감소, 염분 배출 등의 효과로 인해 renin-angiotensin-aldosterone system (RAAS)를 오히려 활성화시키는 것으로 나타났다.44 다만 당뇨병에서 심혈관 질환 고위험군인 환자들의 다수는 기존에 angiotensin-converting enzyme 억제제 또는 type 1 안지오텐신2 수용체 차단제를 사용하고 있는 경우가 많으므로, SGLT2 억제제가 type 2 안지오텐신2 수용체와 안지오텐신1-7의 활성화에만 작용하여 항염증효과, 강심 효과를 보였을 가능성이 있다.45
SGLT2 억제제가 심근에 직접 작용할 수 있는지 여부는 명확하지 않다. SGLT2는 인간의 심근에서는 거의 발현되지 않으므로49 그 역할 또한 제한될 수 있다. 하지만 최근 동물 모델의 연구에서, SGLT2 억제제가 심근 내에서의 나트륨,50 칼슘51 농도에 영향을 주고, 이를 통해 심근세포에 직접 작용할 수 있다는 가능성에 대하여 발표한 바가 있다. 아울러 직접 작용 여부는 명확하지 않으나 심근에서의 항산화작용 및 염증반응 감소5253 작용에 관여하여 심혈관 질환에 대한 보호효과를 보였을 것이라 보는 시각도 있다. 하지만 이들은 전임상 단계에서 이루어진 연구들로 상기 역할에 대해서는 보다 많은 연구가 필요할 것이다.
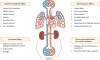
SGLT2 억제제는 기존의 타 당뇨약제에 비하여 우수한 심혈관 질환 개선 효과를 보였고, 이러한 효과는 약제의 계열 전반에 걸쳐 확인할 수 있었다. 이러한 효과에 대한 기전은 앞서 살펴본 혈역학적인 차이, 대사 과정의 차이, 호르몬에서의 차이 등이 복합적으로 작용하여 기능을 할 것으로 보인다(Fig. 2). 하지만 현재까지 어떠한 기전이 주로 작용하여 심혈관 질환 결과에 유의한 차이를 보이는가에 대해서는 명확하게 밝혀져 있지 않다.
앞으로, 심혈관 질환 위험 개선에 주로 작용하는 정확한 기전에 대한 연구를 더 진행한다면, 그 기전과 관련하여 어떠한 환자군에서 SGLT2 억제제 사용으로 가장 큰 효과를 기대할 수 있을지, 그리고 심혈관 질환 저위험군에 해당하는 제2형 당뇨병 환자에서도 유사한 효과를 기대할 수 있을지 등에 대해 밝히는 주요 근거가 될 수 있을 것이다.
ACKNOWLEDGEMENTS
The authors would like to thank Dong-Su Jang, MFA, (Medical Illustrator) for his help with the illustrations.
References
1. Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JF, Nauck MA, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2016; 375:311–322.

2. Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA, et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med. 2016; 375:1834–1844.

3. Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med. 2015; 373:2117–2128.

4. Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N, et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med. 2017; 377:644–657.

5. Madaan T, Akhtar M, Najmi AK. Sodium glucose CoTransporter 2 (SGLT2) inhibitors: current status and future perspective. Eur J Pharm Sci. 2016; 93:244–252.

6. Abdul-Ghani MA, Norton L, Defronzo RA. Role of sodium-glucose cotransporter 2 (SGLT 2) inhibitors in the treatment of type 2 diabetes. Endocr Rev. 2011; 32:515–531.

7. Sanchez RA, Sanabria H, de Los Santos C, Ramirez AJ. Incretins and selective renal sodium-glucose co-transporter 2 inhibitors in hypertension and coronary heart disease. World J Diabetes. 2015; 6:1186–1197.

8. Fitchett D, Zinman B, Wanner C, Lachin JM, Hantel S, Salsali A, et al. Heart failure outcomes with empagliflozin in patients with type 2 diabetes at high cardiovascular risk: results of the EMPA-REG OUTCOME® trial. Eur Heart J. 2016; 37:1526–1534.
9. Sonesson C, Johansson PA, Johnsson E, Gause-Nilsson I. Cardiovascular effects of dapagliflozin in patients with type 2 diabetes and different risk categories: a meta-analysis. Cardiovasc Diabetol. 2016; 15:37.

10. Birkeland KI, Jørgensen ME, Carstensen B, Persson F, Gulseth HL, Thuresson M, et al. Cardiovascular mortality and morbidity in patients with type 2 diabetes following initiation of sodium-glucose co-transporter-2 inhibitors versus other glucose-lowering drugs (CVD-REAL Nordic): a multinational observational analysis. Lancet Diabetes Endocrinol. 2017; 5:709–717.

11. Kosiborod M, Lam CS, Kohsaka S, Kim DJ, Karasik A, Shaw J, et al. Cardiovascular events associated with SGLT-2 inhibitors versus other glucose-lowering drugs: the CVD-REAL 2 study. J Am Coll Cardiol. 2018; 71:2628–2639.
12. Wu JH, Foote C, Blomster J, Toyama T, Perkovic V, Sundström J, et al. Effects of sodium-glucose cotransporter-2 inhibitors on cardiovascular events, death, and major safety outcomes in adults with type 2 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol. 2016; 4:411–419.

13. Saad M, Mahmoud AN, Elgendy IY, Abuzaid A, Barakat AF, Elgendy AY, et al. Cardiovascular outcomes with sodium-glucose cotransporter-2 inhibitors in patients with type II diabetes mellitus: a meta-analysis of placebo-controlled randomized trials. Int J Cardiol. 2017; 228:352–358.

14. Inzucchi SE, Zinman B, Wanner C, Ferrari R, Fitchett D, Hantel S, et al. SGLT-2 inhibitors and cardiovascular risk: proposed pathways and review of ongoing outcome trials. Diab Vasc Dis Res. 2015; 12:90–100.

15. Scirica BM, Bhatt DL, Braunwald E, Steg PG, Davidson J, Hirshberg B, et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med. 2013; 369:1317–1326.

16. White WB, Cannon CP, Heller SR, Nissen SE, Bergenstal RM, Bakris GL, et al. Alogliptin after acute coronary syndrome in patients with type 2 diabetes. N Engl J Med. 2013; 369:1327–1335.

17. Green JB, Bethel MA, Armstrong PW, Buse JB, Engel SS, Garg J, et al. Effect of sitagliptin on cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2015; 373:232–242.

18. Abdul-Ghani M, Del Prato S, Chilton R, DeFronzo RA. SGLT2 inhibitors and cardiovascular risk: lessons learned from the EMPA-REG OUTCOME study. Diabetes Care. 2016; 39:717–725.

19. Hayward RA, Reaven PD, Wiitala WL, Bahn GD, Reda DJ, Ge L, et al. Follow-up of glycemic control and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2015; 372:2197–2206.

20. DeFronzo RA. The EMPA-REG study: what has it told us? A diabetologist's perspective. J Diabetes Complications. 2016; 30:1–2.

21. Sattar N. Revisiting the links between glycaemia, diabetes and cardiovascular disease. Diabetologia. 2013; 56:686–695.

22. Giacco F, Brownlee M. Oxidative stress and diabetic complications. Circ Res. 2010; 107:1058–1070.

23. Dassanayaka S, Jones SP. O-GlcNAc and the cardiovascular system. Pharmacol Ther. 2014; 142:62–71.

24. Ferrannini E, Muscelli E, Frascerra S, Baldi S, Mari A, Heise T, et al. Metabolic response to sodium-glucose cotransporter 2 inhibition in type 2 diabetic patients. J Clin Invest. 2014; 124:499–508.

25. Daniele G, Xiong J, Solis-Herrera C, Merovci A, Eldor R, Tripathy D, et al. Dapagliflozin enhances fat oxidation and ketone production in patients with type 2 diabetes. Diabetes Care. 2016; 39:2036–2041.

26. Mudaliar S, Alloju S, Henry RR. Can a shift in fuel energetics explain the beneficial cardiorenal outcomes in the EMPA-REG OUTCOME study? A unifying hypothesis. Diabetes Care. 2016; 39:1115–1122.

27. Ferrannini E, Mark M, Mayoux E. CV protection in the EMPA-REG OUTCOME trial: a “thrifty substrate” hypothesis. Diabetes Care. 2016; 39:1108–1114.

28. Stenlöf K, Cefalu WT, Kim KA, Alba M, Usiskin K, Tong C, et al. Efficacy and safety of canagliflozin monotherapy in subjects with type 2 diabetes mellitus inadequately controlled with diet and exercise. Diabetes Obes Metab. 2013; 15:372–382.

29. Bolinder J, Ljunggren Ö, Johansson L, Wilding J, Langkilde AM, Sjöström CD, et al. Dapagliflozin maintains glycaemic control while reducing weight and body fat mass over 2 years in patients with type 2 diabetes mellitus inadequately controlled on metformin. Diabetes Obes Metab. 2014; 16:159–169.

30. Ridderstråle M, Andersen KR, Zeller C, Kim G, Woerle HJ, Broedl UC, et al. Comparison of empagliflozin and glimepiride as add-on to metformin in patients with type 2 diabetes: a 104-week randomised, active-controlled, double-blind, phase 3 trial. Lancet Diabetes Endocrinol. 2014; 2:691–700.

31. Fox CS, Pencina MJ, Wilson PW, Paynter NP, Vasan RS, D'Agostino RB Sr. Lifetime risk of cardiovascular disease among individuals with and without diabetes stratified by obesity status in the Framingham heart study. Diabetes Care. 2008; 31:1582–1584.

32. Wing RR, Bolin P, Brancati FL, Bray GA, Clark JM, Coday M, et al. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med. 2013; 369:145–154.

33. Odden MC, Amadu AR, Smit E, Lo L, Peralta CA. Uric acid levels, kidney function, and cardiovascular mortality in US adults: National Health and Nutrition Examination Survey (NHANES) 1988–1994 and 1999–2002. Am J Kidney Dis. 2014; 64:550–557.

34. Inzucchi SE, Zinman B, Fitchett D, Wanner C, Ferrannini E, Schumacher M, et al. How does empagliflozin reduce cardiovascular mortality? Insights from a mediation analysis of the EMPA-REG OUTCOME trial. Diabetes Care. 2018; 41:356–363.

36. Chilton R, Tikkanen I, Cannon CP, Crowe S, Woerle HJ, Broedl UC, et al. Effects of empagliflozin on blood pressure and markers of arterial stiffness and vascular resistance in patients with type 2 diabetes. Diabetes Obes Metab. 2015; 17:1180–1193.

37. Marx N, McGuire DK. Sodium-glucose cotransporter-2 inhibition for the reduction of cardiovascular events in high-risk patients with diabetes mellitus. Eur Heart J. 2016; 37:3192–3200.

38. Xie X, Atkins E, Lv J, Bennett A, Neal B, Ninomiya T, et al. Effects of intensive blood pressure lowering on cardiovascular and renal outcomes: updated systematic review and meta-analysis. Lancet. 2016; 387:435–443.

39. Scheen AJ. Reappraisal of the diuretic effect of empagliflozin in the EMPA-REG OUTCOME trial: comparison with classic diuretics. Diabetes Metab. 2016; 42:224–233.

40. Emdin CA, Rahimi K, Neal B, Callender T, Perkovic V, Patel A. Blood pressure lowering in type 2 diabetes: a systematic review and meta-analysis. JAMA. 2015; 313:603–615.
41. Cherney DZ, Perkins BA, Soleymanlou N, Maione M, Lai V, Lee A, et al. Renal hemodynamic effect of sodium-glucose cotransporter 2 inhibition in patients with type 1 diabetes mellitus. Circulation. 2014; 129:587–597.

43. Schmieder R, Ott C, Linz P, Jumar A, Friedrich S, Titze J, et al. OS 12-03 SGLT-2-inhibition with dapagliflozin reduces tissue sodium content. J Hypertens. 2016; 34:e76.

44. Tikkanen I, Chilton R, Johansen OE. Potential role of sodium glucose cotransporter 2 inhibitors in the treatment of hypertension. Curr Opin Nephrol Hypertens. 2016; 25:81–86.

45. Muskiet MH, van Raalte DH, van Bommel EJ, Smits MM, Tonneijck L. Understanding EMPA-REG OUTCOME. Lancet Diabetes Endocrinol. 2015; 3:928–929.

46. Lambers Heerspink HJ, de Zeeuw D, Wie L, Leslie B, List J. Dapagliflozin a glucose-regulating drug with diuretic properties in subjects with type 2 diabetes. Diabetes Obes Metab. 2013; 15:853–862.

47. Sano M, Takei M, Shiraishi Y, Suzuki Y. Increased hematocrit during sodium-glucose cotransporter 2 inhibitor therapy indicates recovery of tubulointerstitial function in diabetic kidneys. J Clin Med Res. 2016; 8:844–847.

48. Jones BJ, Tan T, Bloom SR. Minireview: glucagon in stress and energy homeostasis. Endocrinology. 2012; 153:1049–1054.

49. Zhou L, Cryan EV, D'Andrea MR, Belkowski S, Conway BR, Demarest KT. Human cardiomyocytes express high level of Na+/glucose cotransporter 1 (SGLT1). J Cell Biochem. 2003; 90:339–346.

50. Baartscheer A, Schumacher CA, Wüst RC, Fiolet JW, Stienen GJ, Coronel R, et al. Empagliflozin decreases myocardial cytoplasmic Na+ through inhibition of the cardiac Na+/H+ exchanger in rats and rabbits. Diabetologia. 2017; 60:568–573.

51. Hamouda NN, Sydorenko V, Qureshi MA, Alkaabi JM, Oz M, Howarth FC. Dapagliflozin reduces the amplitude of shortening and Ca(2+) transient in ventricular myocytes from streptozotocin-induced diabetic rats. Mol Cell Biochem. 2015; 400:57–68.





 PDF
PDF ePub
ePub Citation
Citation Print
Print


 XML Download
XML Download