Abstract
배경
저자들은 Cobas h 232 POC system을 사용하여 Roche Cardiac POC Troponin T (Roche Diagnostics, Switzerland) 검사의 분석적 수행능을 평가하고자 하였다.
방법
Roche Cardiac POC Troponin T 정도관리물질을 사용하여 반복정밀도와 검사실내 비정밀도를 평가하였다. 또한 환자 검체를 사용하여 반복정밀도를 추가로 평가하였다. 다섯 가지 농도의 환자 검체를 사용하여 직선성을 평가하였다. 40명의 환자 검체를 사용하여 중앙검사실의 Elecsys Troponin T high sensitiveity 검사와 Roche Cardiac POC Troponin T 검사의 상관성을 평가하였다.
초록
Background
The point-of-care (POC) troponin T assay has been used in various clinical settings. Recently, a POC troponin T assay with an extended measurable range (40 ng/L-2,000 ng/L) was introduced. We aimed to evaluate the analytical performance of the Roche Cardiac POC Troponin T assay (POC TnT, Roche Diagnostics, Switzerland) using the cobas h 232 POC system.
Methods
The repeatability and within-laboratory imprecision of the POC TnT assay were evaluated using the Roche Cardiac POC Troponin T level 2 control. Repeatability was also assessed using patient samples. Linearity of the POC TnT assay was evaluated using patient samples containing five different concentrations of troponin T. Performance of the Elecsys Troponin T high sensitivity assay (hs-TnT) was compared with that of the POC TnT assay using 40 patient samples.
Results
The repeatability (%CV), and within-laboratory imprecision (%CV) using the level 2 control solution (mean troponin T, 441.6 ng/L) were 8.5% and 8.6%, respectively. The repeatability of patient samples containing 88.7 ng/L and 454.6 ng/L TnT was 7.5% and 7.2%, respectively. The POC TnT assay was confirmed to produce linear data between 54.0 ng/L and 1,347.7 ng/L. Relative to the hs-TnT assay, the Passing-Bablok linear regression equation (correlation coefficient) was y=0.8933x+6.24 (r=0.988). At a troponin T concentration of 40 ng/L, the estimated bias of the POC TnT assay was 1.972 ng/L (4.93%).
심장성 troponin은 심근 괴사에 민감하고 심근 조직에 매우 특이적으로 급성심근경색 등 심근허혈의 진단에 사용되는 표지자이다[1]. 또한 허혈성 심질환의 재발이나 급성관상동맥증후군 환자의 사망을 예측하는 데도 유용하게 사용되고 있다[2]. 최근에는 검출 한계가 낮아진 고 민감도 심장성 troponin 검사가 소개되어 임상에서 널리 사용되고 있다[34].
급성심근경색 진단을 위해서 신속한 심장성 troponin 검사 및 결과 보고가 필수적이다. 응급 상황에서 중앙검사실의 심장성 troponin 검사소요시간(turnaround time, TAT)보다 짧은 시간 내에 troponin 결과 확인이 필요한 경우가 있는데, 이러한 경우 현장검사 형태로 심장성 troponin을 검사할 수 있다. 현장검사는 환자 주변에서 사용자가 직접 검사하여 결과를 확인할 수 있는 장점이 있어 중앙검사실 결과에 비해 의학적 의사결정에 필요한 시간을 단축시킬 수 있다.
Roche CARDIAC T Quantitative (Roche Diagnostics, Basel, Switzerland) 카트리지는 현장검사 형태로 시행되는 심장성 troponin 검사의 일종으로, 일회용 카트리지를 사용하여 cobas h 232 (Roche Diagnostics) 검사 장비에서 8–12분 이내에 심장성 troponin T 결과를 확인할 수 있다. Roche CARDIAC T Quantitative 카트리지는 50–2,000 ng/L 구간의 심장성 troponin T를 정성 및 정량적으로 측정할 수 있으며, 이에 대한 수행능 평가 결과가 보고된 바 있다[5]. 이 카트리지는 100–2,000 ng/L의 troponin T는 정량적으로 측정하여 보고하며, 50–100 ng/L 구간의 측정값은 검사 장비에서 ‘50–100 ng/L’로 표기되어 측정 결과를 반정량적으로 보고한다. 최근 Roche CARDIAC T Quantitative 카트리지보다 측정가능범위가 40–2,000 ng/L로 확장된 Roche Cardiac POC Troponin T (Roche Diagnostics) 카트리지가 소개되었다. 현재까지 Roche Cardiac POC Troponin T 카트리지에 대한 수행능 평가가 거의 되어 있지 않다.
저자들은 Roche cobas h 232 POC system을 사용하여 Roche Cardiac POC Troponin T 검사의 분석적 수행능을 평가하고자 하였다.
본 연구는 이대목동병원 연구윤리 심의위원회의 승인을 받았다(승인번호: EUMC 2016-10-035).
정밀도 평가를 위해 Roche Cardiac POC Troponin T 검사의 전용 정도관리물질인 Roche Cardiac POC Troponin T 2-level 2 Control (Roche Diagnostics)과 환자 검체를 각각 사용하였다. Level 1 정도관리물질의 농도는 Cobas h 232 검사 장비에서 측정 가능한 정량 한계(40 ng/L) 미만이었기 때문에 본 연구에서는 Level 2 정도관리물질의 정밀도만 평가하였다. 정도관리물질의 정밀도 평가를 위해 Clinical and Laboratory Standards Institute (CLSI) EP15-A3 지침에 따라 총 5일 동안 하루에 5회 반복측정하였고, 측정 결과로 반복정밀도(repeatability) 및 검사실 내 비정밀도(within-laboratory imprecision)를 각각 계산하였다[6]. Roche Cardiac POC Troponin T 카트리지 설명서에는 반복정밀도의 95% 단측 상한 신뢰구간이 전체 측정 범위에서 20% 이하로 표기되어 있었으나, 검사실내 비정밀도에 대한 별도의 기준은 없었다. 실제 환자 검체의 반복정밀도를 평가하기 위해 정도관리물질 이외에 두 가지 농도의 환자 검체를 각각 10회 반복측정하여 반복정밀도를 추가로 평가하였다. 환자 검체는 혈장분리관(plasma separation tube, PST) 용기를 사용하여 채혈한 전혈을 사용하였다. 저자들은 정도관리물질 및 환자 검체의 반복정밀도가 제조사가 제시한 troponin T 현장검사의 반복정밀도 20%를 만족하는지 검정하였다.
직선성은 CLSI EP6-A 지침에 따라 다섯 가지 농도의 환자 검체를 3회 반복측정하여 평가하였다[7]. 환자 검체는 혈장분리관 용기를 사용하여 채혈한 전혈을 사용하였다. 직선성 평가를 위한 검체는 혼합이나 분주 없이 서로 다른 troponin T 농도를 보이는 다섯 환자의 원검체를 그대로 사용하였다. 직선성 평가 결과 분석을 위한 목적값(target value)은 cobas e 411 (Roche Diagnostics) 장비와 Elecsys Troponin T high sensitive assay (Roche Diagnostics) 검사 시약을 사용하여 설정하였다. 다항회귀분석을 사용하여 측정 결과의 직선성 여부를 평가하였다.
장비 간 상관성은 CLSI EP9-A3 지침에 준하여 평가하였다[8]. 기준 방법(comparative method)은 중앙검사실에서 사용하고 있는 cobas e 411 장비와 Elecsys Troponin T high sensitive assay 검사 시약으로 측정한 값을 사용하였다. 비교 방법(candidate method) 은 cobas h 232 장비와 Roche Cardiac POC Troponin T 카트리지를 사용하여 측정한 값으로 하였다. 두 검사장비의 측정가능범위에 포함된 40명의 환자 검체를 사용하였다. 혈장분리관 용기에 채혈한 전혈 검체로 cobas h 232 장비에서 troponin T를 검사하였고, 즉시 혈장을 분리하여 Roche e 411장비로 troponin T를 측정하였다. 두 검사 장비에서 troponin T 농도는 각각 1회씩 측정하였다.
상관성 평가 결과 분석을 위해 Passing-Bablok 회귀분석을 사용하였다. 회귀방정식의 기울기(95% 신뢰구간), y절편(95% 신뢰구간) 및 상관계수(coefficient of correlation, R)를 각각 구하였다. 본 연구에서 Roche Cardiac POC Troponin T 카트리지의 측정가능범위 하한인 40 ng/L를 임의로 의학적 의사결정(medical decision point) 농도로 정하였고, 회귀방정식을 사용하여 40 ng/L 농도에서 현장검사의 바이어스 추정값을 계산하였다. Troponin T 현장검사의 바이어스 허용 기준은 생물학적 변이(biological variation)를 고려하여 23.7%로 정하였다[9].
Level 2 정도관리물질의 평균 troponin T 값은 441.6 ng/L, 표준편차는 37.9 ng/L로 반복정밀도 8.5%, 검사실 내 비정밀도는 8.6% 였다. 환자 검체를 이용한 정밀도 평가에서 88.7 ng/L (표준편차 6.7 ng/L) 농도 검체의 반복정밀도는 7.5%였고, 454.6 ng/L (표준편차 32.9 ng/L) 농도 검체의 반복정밀도는 7.2%였다(Table 1). 정도관리물질과 환자 검체의 반복정밀도는 모두 제조사의 반복정밀도 기준인 20%보다 낮았다.
40개 환자 검체로 cobas e 411 장비와 cobas h 232 장비 간 상관성을 평가한 결과, 선형 회귀방정식은 h232=0.8933e411+6.24였고, 두 장비 간 상관계수는 0.988이었다(Fig. 2). 기울기 및 y 절편의 95% 신뢰구간은 각각 0.8062−1.027, −5.367−12.75였다. Troponin T 40 ng/L 농도에서 cobas h 232 장비의 추정값은 41.972 ng/L로 바이어스는 1.972 ng/L (4.93%, 1.972/40)였다.
Roche Cardiac POC Troponin T 카트리지의 수행능 평가에 대한 이전 연구에서 정도관리물질의 일간 비정밀도(between-day imprecision) 변이계수는 11.3%였고, 환자검체의 반복정밀도는 40–200 ng/L 농도에서 9.3%, 200–600 ng/L 농도에서 11.8%, 그리고 600–2,000 ng/L 농도에서는 12.9%였다[10]. 본 연구 결과 Roche Cardiac POC Troponin T 카트리지의 반복정밀도는 441.6 ng/L 농도의 정도관리물질이 8.5%였고, 환자 검체 평가 결과 88.7 ng/L 농도에서 7.5%, 그리고 454.6 ng/L 농도에서 7.2%로 이전 연구의 비정밀도보다 소폭 낮았다. 또한 저자들의 정밀도 평가 결과 정도관리물질과 환자 검체 모두 시약설명서에 제시된 반복정밀도 기준을 만족하였다.
기존에 사용하던 Roche CARDIAC T Quantitative 카트리지의 비정밀도는 정량 측정 구간(100–2,000 ng/L)에서 <9%로 보고되었다[5]. 본 연구에서 정도관리물질의 검사실 내 비정밀도는 8.6%로, 측정가능범위가 40–2,000 ng/L로 확장된 Roche Cardiac POC Troponin T 카트리지의 비정밀도가 이전 카트리지와 유사하거나 소폭 개선되었다고 판단하였다. 본 연구에서 수행능 평가 기간 동안 troponin T 1,500–2,000 ng/L 구간의 잔여 검체 확보가 어려워 시약설명서에 표시된 측정가능범위보다 좁은 54 ng/L부터 1,347.7 ng/L 구간의 직선성만을 확인하였다.
중앙검사실 장비인 cobas e 411 장비와 현장검사 장비인 cobas h 232 장비의 장비 간 상관성 평가에서 회귀방정식 기울기의 95% 신뢰구간(0.8062 to 1.027)은 1.0을 포함하고 있었고, y절편의 95% 신뢰구간(−5.367 to 12.75)은 0을 포함하고 있었기 때문에 두 장비의 troponin T 결과가 통계적으로 유의한 차이가 없다고 판단하였다. 또한 상관계수가 0.988로 현장검사 장비와 중앙검사실 장비가 우수한 상관성을 보였다.
본 연구에서 저자들이 임의로 설정한 의학적 의사결정 농도인 40 ng/L에서 Roche Cardiac POC Troponin T 검사의 추정값은 41.972 ng/L (0.8933×40+6.24)로, 현장검사 결과가 중앙검사실 결과와 비교하여 약 5%가량 높았으나 생물학적 변이를 고려한 허용 바이어스(23.7%) 이내였다. 저자들의 연구 결과는 troponin T 현장검사와 중앙검사실의 고 민감도 troponin T 검사의 상관성을 평가한 이전 연구 결과(장비 간 결과 차이, −4.1% to에서 +6.8%)와 유사하였다 [9].
Roche Cardiac POC Troponin T 카트리지의 측정가능범위 하한은 40 ng/L이기 때문에 고 민감도 troponin T 검사가 아니다. 즉, Roche Cardiac POC Troponin T 카트리지를 사용하여 정상인 50% 이상에서 troponin T를 정량적으로 측정할 수 없다. 반면, 중앙검사실에서 시행하는 troponin T 검사는 고 민감도 troponin T 검사로 검출 한계 5 ng/L, 변이계수 10% 미만의 정량 한계 13 ng/L, 그리고 정상인의 99 백분위수 컷오프는 14 ng/L이다[1112]. 비록 Roche Cardiac POC Troponin T 카트리지의 측정가능범위가 이전에 사용하던 Roche CARDIAC T Quantitative 카트리지보다 확장되었지만, 여전히 정량적으로 측정할 수 있는 troponin T 하한 값이 40 ng/L로 정상인의 99 백분위수 컷오프 14 ng/L보다 높기 때문에 급성심근경색을 배제하기 위한 검사로는 다소 제한점이 있다. 이는 현재 사용되고 있는 현장검사 형태의 troponin 검사의 공통적인 한계점이다.
Roche Cardiac POC Troponin T 카트리지보다 정량 한계가 더 낮은 AQT90-flex cTnT assay (Radiometer Medical, Copenhagen, Denmark)의 경우 검출 한계는 10 ng/L이고, 변이계수 10% 이하의 정량 한계는 26 ng/L (CV≤10%)이다[12]. 하지만 AQT90-flex cTnT 검사 역시 고 민감도 troponin T 검사와 비교하여 민감도가 낮아 (68% vs. 91%) 현장검사 결과만으로 급성심근경색 환자를 진단하는 데 다소 제한점이 있었다[12]. 이와 유사하게 현장검사 형태의 troponin I에 관한 연구에서도 현장검사 결과의 위음성이 보고되었다[13]. 추후 현장검사로 시행하는 troponin 검사의 검출 한계가 점차 낮아져 고 민감도 troponin 검사와 대등해지면 현장검사의 임상적인 활용도가 더욱 증가할 것으로 예상된다.
본 연구에는 몇 가지 제한점이 있었다. 첫째, 정밀도 평가에서 Roche Cardiac POC Troponin T 검사의 측정 하한인 40 ng/L 농도 주변이나 또는 1,000 ng/L 이상의 고농도 등 다양한 troponin T 농도의 환자 검체를 사용하지 못했다. 둘째, 직선성 평가에서 검사 시약의 측정가능범위를 충분히 반영하지 못했다. 셋째, 진단민감도 및 진단특이도 등의 임상적 유용성 평가를 시행하지 못했다.
결론적으로 Roche Cardiac POC Troponin T 검사는 현장검사로 사용할 수 있는 정밀도와 직선성을 보였고, 중앙검사실의 고 민감도 troponin T 검사와 우수한 상관성을 보였다. 급성심근경색이 의심되는 환자에서 신속한 의학적 의사결정이 필요한 경우 Roche Cardiac POC Troponin T 현장검사가 유용하게 사용될 수 있을 것으로 판단된다. 다만 Roche Cardiac POC Troponin T 검사의 측정가능범위 하한이 40 ng/L이므로 급성심근경색이 강력히 의심되는 환자에서 현장검사 troponin T가 <40 ng/L인 경우 반드시 중앙검사실의 고 민감도 troponin T 결과를 확인해야 한다.
Figures and Tables
 | Figure 1Linearity of the Roche Cardiac POC Troponin T assay. The blue line represents linear regression of the data. The gray line depicts a theoretical line with a slope of 1.0 and a y-intercept of 0. |
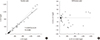 | Figure 2Comparison of troponin T assays using cobas e 411 and cobas h 232 analyzers. In the scatter plot, the light gray line depicts a theoretical line with a slope of 1.0 and a y-intercept of 0, and the dark gray line represents Passing-Bablok linear regression. |
감사의 글
본 연구는 Roche에서 제공한 Cardiac POC Troponin T 카트리지를 사용하였습니다. Roche는 연구설계, 수행능평가, 자료 취합 및 분석, 논문 작성 등 본 연구에 일체 관여하지 않았습니다.
References
1. Apple FS, Sandoval Y, Jaffe AS, Ordonez-Llanos J. IFCC Task Force on Clinical Applications of Cardiac Bio-Markers. Cardiac troponin assays: guide to understanding analytical characteristics and their impact on clinical care. Clin Chem. 2017; 63:73–81.

2. Reichlin T, Hochholzer W, Bassetti S, Steuer S, Stelzig C, Hartwiger S, et al. Early diagnosis of myocardial infarction with sensitive cardiac troponin assays. N Engl J Med. 2009; 361:858–867.

3. Amsterdam EA, Wenger NK, Brindis RG, Casey DE, Ganiats TG, Jaffe AS, et al. 2014 AHA/ACC Guideline for the Management of Patients with Non-ST-Elevation Acute Coronary Syndromes: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2014; 64:e139–e228.
4. Ibanez B, James S, Agewall S, Antunes MJ, Bucciarelli-Ducci C, Bueno H, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2018; 39:119–177.
5. Amundson BE, Apple FS. Cardiac troponin assays: a review of quantitative point of care devices and their efficacy in the diagnosis of myocardial infarction. Clin Chem Lab Med. 2015; 53:665–676.

6. CLSI Clinical and Laboratory Standards Institute. User Verification of Precision and Estimation of Bias; Approved Guideline-Third Edition. CLSI document EP15-A3. Wayne, PA: Clinical and Laboratory Standards Institute;2014. www.clsi.org.
7. CLSI Clinical and Laboratory Standards Institute. Evaluation of the Linearity of Quantitative Measurement Procedures: A Statistical Approach; Approved Guideline. CLSI document EP06-A. Wayne, PA: Clinical and Laboratory Standards Institute;2003. www.clsi.org.
8. CLSI Clinical and Laboratory Standards Institute. Measurement Procedure Comparison and Bias Estimation Using Patient Samples; Approved Guideline-Third Edition. CLSI document EP09-A3. Wayne, PA: Clinical and Laboratory Standards Institute;2013. www.clsi.org.
9. Ricós C, Alvarez V, Cava F, García-Lario JV, Hernández A, Jiménez CV, et al. Current databases on biologic variation: pros, cons and progress. Scand J Clin Lab Invest. 1999; 59:491–500.
10. Jungbauer C, Hupf J, Giannitsis E, Frick J, Slagman A, Ehret C, et al. Analytical and clinical validation of a point-of-care cardiac troponin T test with an improved detection limit. Clin Lab. 2017; 63:633–645.

11. Xu RY, Zhu XF, Yang Y, Ye P. High sensitive cardiac troponin T. J Geriatr Cardiol. 2013; 10:102–109.
12. Ter Avest E, Visser A, Reitsma B, Breedveld R, Wolthuis A. Point-of-care troponin T is inferior to high-sensitivity troponin T for ruling out acute myocardial infarction in the emergency department. Eur J Emerg Med. 2016; 23:95–101.

13. Alan HB. Recent advances in point-of-care diagnostics for cardiac markers. EJIFCC. 2014; 25:170–177.




 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download