Abstract
The cutaneous melanoma has been regarded as rare disease entity in Korea for long time but it shows a silent growth recently. Furthermore the management of cutaneous melanoma including staging system, surgical principle, sentinel lymph node biopsy and subsequent complete node dissection and, most importantly, immunotherapy and target therapy against cutaneous melanoma recently. The incidence of cutaneous melanoma is steadily increasing in Korea but its increase is rapid recent 2 decades to 4.3 times and should be greater soon according to the steeper increase of life expectancy. New staging system proposed by American Joint Committee on Cancer (2017) includes changes in individual TNM category and stage groups, particularly from a prognostic viewpoint. Dermoscopy has been successfully introduced in the differential diagnosis of pigmented skin lesion focusing on cutaneous melanoma by non-invasive simple diagnostic tool. Sentinel lymph node biopsy was a issue of long debate whether survival benefit is real or not. Temporary conclusion about this question is reached after two large scale studies and immediate complete node dissection should be performed in a certain situations. Most important change is drug therapy focusing on immunotherapy and target therapy. Braf- and MEK-inhibitor, immune checkpoint inhibitor and PD-1 blocker has been proved to be effective as a sole or combination regimen against advanced and/or high-risk adjuvant setting of cutaneous melanoma. In conclusion, these remarkable changes will be reviewed shortly here.
흑색종은 멜라닌세포(melanocyte) 또는 모반세포(nevus cell)의 악성 변화로 인한 악성종양으로 비록 발생률은 낮지만 치명적인 결과로 인해 많은 관심을 가진 질환이다. 발생원인은 인종과 같은 유전적 요인과 자외선 노출과 같은 환경적 요인으로 나눌 수 있다. 그러나 이와 같은 인자가 큰 영향을 미치지 않는 한국인에서의 흑색종은 아직 발생원인이 외상, 피부착색, 땀샘, 감염 등이 복합적으로 작용하리라 추정될 뿐 정확히 알려진 바가 없다.
흑색종 환자가 많은 서양에서의 높은 관심에 비해 한국을 포함한 동양권에서는 피부흑색종의 발생이 적어 이에 대한 관심이 적었던 것이 사실이고 의사들조차 이 질환에 대해 무심하였다. 그러나 최근 신환자 발생 건수(통계청 자료)를 보면 1992년 121명, 2002년 266명, 2012년 520명(인구 10만 명당 1명 환자 발생)으로 20년 만에 4.3배의 증가를 보이며 2015년 570명의 신환자가 발생하였으며 흑색종의 호발연령인 국내 노인인구의 급속한 증가에 발맞춰 지속적으로 증가하리라 예상된다(Figure 1). 신환자 수의 중요한 증가 원인으로 흑색종의 호발연령이 60세 이상의 고령인 점을 감안할 때 1990년 한국에서 60세 이상의 고령 인구가 7.65%, 2000년 11.22%이다가 2010년 15.85%, 2015년 18.62%로 급격히 증가하는 현실을 반영한다면 흑색종 신환자도 빠른 속도로 증가함을 추론해 볼 수 있다. 그 외에 피부 흑색종의 병리조직학적 진단율의 증가와 신체에 의심되는 피부병변이 있을 경우 과거보다 더 흔히 피부 조직검사를 시행하는 것으로도 설명할 수 있다.
한국인의 흑색종은 서양인과는 다른 임상적인 특징, 특히 흑색종의 아형의 빈도 차이를 보인다[1]. 한국인에서 가장 흔한 말단흑자흑색종은 팔다리 말단부인 손발, 특히 손발바닥과 손발톱에 많이 발생하는 형태로 국내 보고들에 따르면 전체 환자의 52-80%를 차지한다. 손발바닥에 수년 또는 수십 년에 걸쳐 서서히 커지는 갈색 반점의 형태를 보이다가 수직성장(침윤)을 하면서 결절과 궤양이 형성된다(Figure 2A). 한국을 포함한 동북 아시아인에서 가장 흔한 유형으로 한국인 흑색종의 평균 60%, 일본 45-50%, 홍콩중국인 75%을 차지한다. 그 중 특이한 형태로 손발톱 부위에 발생하는 조갑흑색종은 손발톱에 다양한 형태의 변색 또는 종축의 띠 모양의 흑색선조가 발생하며(Figure 2B) 진행할 경우 손발톱의 파괴를 보이거나 손발톱의 주위 피부로 착색이 번져가는 징후(Hutchinson sign)을 보인다(Figure 2C). 아시아인에서 특히 흔하여 10-31%까지 보고되며 상당한 빈도에서 흑색종의 임상적 특징인 흑갈색의 색소침착을 보이지 않아 진단에 혼란을 초래하기 쉽다.
결절흑색종은 흑색종의 특징인 수평성장(서서히 커지는 갈색 반점)을 보이지 않고 바로 결절이 발생하는 경우로 흔히 점이나 검버섯으로 오인되기 쉬워 발견이 늦어져 진행된 상태로 병원을 찾기 쉽다(Figure 2D).
표재확산흑색종은 몸통과 손발을 제외한 사지에 발생하는 형태로 서서히 커지면서 중심부는 흔히 퇴화하여 갈색 외에 적색, 청색과 백색 등 다양한 색상을 동시에 보이기도 한다(Figure 2E).
마지막으로 악성흑색점흑색종은 노인의 특히 코와 뺨에서 자주 발견되며 노인에게 흔한 노인성흑자와 감별이 매우 어렵다(Figure 2F).
흑색종의 병기 설정은 종양의 침윤 수준(Clark level)과 종양의 두께(Breslow thickness)의 개념이 도입되면서 TNM 병기로 개발되었다. TNM 병기는 기본적으로 T(종양의 두께), N(림프절 전이), M(원격전이)의 상태에 따라 정의되어진다. 2017년 새로 변경되어 2018년부터 적용되고 있는 흑색종 병기 설정(American Joint Committee on Cancer TNM 병기 8판)은 상당한 변화를 보였다[12]. 중요한 변화로는 T 병기에는 우선 Breslow 두께에 따라 1, 2, 4 mm의 cut-off value로 구분되던 것을 1 mm 이하를 <0.8 mm와 0.8-1 mm로 세분하여 전자를 다시 궤양의 유무에 따라 T1a와 T1b로 구분하였다. 그 외에 Breslow 두께를 소수점 2자리까지 측정하던 것을 정확한 측정의 어려움을 근거로 소수점 1자리로 변경하였으며 미세침윤지에 적용되던 세포분열의 기준은 삭제하였다[3]. N 병기의 변화로는 전이가 확인된 림프절 개수에 따라 1, 2-3, 4개 이상으로 하여 N1, N2, N3로 분류를 기본으로 한 것은 변화가 없으나 전이된 림프절 내의 종양세포의 침윤정도는 삭제하였다[3]. 반면 과거와 달리 미세위성병변, 위성병변과 intransit metastasis의 의미를 강조하여 전이된 림프절 개수의 기준보다 한 단계씩 상향조정되도록 하였다. 예를 들자면 N1의 기준을 만족하는 1개의 림프절 전이를 보이더라고 앞선 변화들을 보일 경우 한 단계 올려 N2c로 결정토록 하였다. M 병기의 변화로 M1은 원위부의 피부, 피하지방층 그리고 비국소부위 림프절의 침범, M2은 폐 전이, M3는 중추신경계를 제외한 기타 원격 전이, M4는 중추신경계 전이로 구분한 다음 각각에서 lactic dehydrogenase의 상승 유무에 따라 Mxa 또는 Mxb로 구분하였다[3]. 이들 변화에 맞춰 새로운 병기는 각각의 TNM 병기를 바탕으로 0, IA, IB, IIA, IIB, IIC, IIIA, IIIB, IIIC, IIID(새로 추가)와 IV기로 최종 병기가 설정되게 되었다(Table 1) [3]. 이런 변화의 근거에는 과거 병기설정법(7판, 2009년)에서 일부 병기 구간에서 제기되었던 병기와 생존율이 비례하지 않은 점을 다소나마 개선하고자 하는 노력의 일환으로 알려져 있다.
최근 흑색종을 비롯한 색소성 병변의 진단에 피부확대경의 이용이 매우 활발해지고 있으며 그 가치를 인정받아 국내에서도 조만간 법정비급여로 인정될 예정이다. 피부확대경은 일반적인 확대경과는 달리 일반 인공조명 또는 LED조명 대신 편광을 이용하여 비침습적으로 확대경으로는 도달할 수 없는 깊이의 피부 내 구조물들을 관찰하여 질병의 진단을 도우며 가끔 표면을 더 잘 관찰하기 위해서는 비편광을 이용하기도 한다.
피부확대경의 가장 중요한 적응증은 피부병변 중에서 색소성 병변을 선별하고 이 중에서 악성변화, 즉, 흑색종을 진단함을 주된 목적으로 하지만 최근에는 거의 모든 피부과 질환의 진단에 이용되고 있다. 색소성 병변을 위한 일반적인 검사방법으로 우선 색소성 또는 비색소성 병변 여부를 결정하는 단계를 거치게 되는데[4] pigment network, aggregated globule, branched streak, homogeneous blue pigmentation과 parallel pattern 등을 이용하여 구분한다. 다음 단계로 색소성 병변에 대입되는 진단 기준으로 pattern analysis, ABCD rule, Menzies method와 7-point check list 등이 있으며 이중에서는 엄격한 개개 진단 기준 대신 여러 소견의 종합적인 양상을 바탕으로 판단하는 pattern analysis의 global feature와 local feature의 분석에 근거한다. 전자의 소견으로 reticular pattern, starburst pattern과 parallel pattern 등이 있으며 후자의 소견으로는 blue-white veil, regression structure, structureless/homogeneous hypopigmented area, blotches와 여러 vascular structure 특히 dotted vessel, linear-irregular vessels과 vessels within regression structure 등 소견이 흑색종 진단에 유용하게 채택된다. 특히 한국인의 손발바닥에 흔한 말단 흑색종을 진단하고자 할 경우 parallel furrow pattern, lattice pattern이나 fibrillar pattern보다 parallel ridge pattern이 흑색종을 강하게 시사하여 조직검사 전 진단에 매우 유용하다[5]. 또한 한국인에서 흔한 조갑흑색종을 시사하는 중요한 소견으로 갈색의 바탕색조 위에 존재하는 불규칙한 띠를 제시하였으며 이 외에 micro-Hutchinson 징후, 폭이 넓은 경우와 삼각형모양의 색소침착 등을 들고 있다[6].
흑색종을 진단하기 위해서는 병변의 조직검사가 가장 기본적인 확진법이다. 가능한 경우 절제생검이 이상적이지만 병변이 크거나 손발바닥과 얼굴과 같은 부위는 절개생검이나 펀치생검이 주로 이용된다. 생검의 깊이는 환자의 예후와 향후 치료 방침 결정에 절대적 영향을 미치는 Breslow 두께를 알아야 하므로 최소 모든 피부 부속기가 침범될 수 있도록 충분한 양의 피하지방층이 포함되어야 한다. 이와 같은 이유로 표면만을 제거하는 면도생검은 검사법으로 매우 부적당하다. 병변 부위의 선택은 가장 색이 짙고 두꺼운 부위에서 시행하기가 권유되지만 이런 부위가 반드시 Breslow 두께가 가장 두꺼운 부위를 그대로 반영하지 못 하는 경우도 있다. 즉 괜찮은 사과로 보여 껍질을 깎고 난 다음 일부 표면 부위가 상해있는 것을 발견한다든지 또는 심지어 표면은 괜찮은데 사과의 내부가 상해있는 경우와 마찬가지의 예이다. 따라서 현실적으로 큰 병변이거나 조직검사에 적당한 부위를 발견하기 어려운 경우에는 여러 부위를 생검하거나 일반적인 생검보다 깊게 의심되는 병변부위가 많이 포함되게 조직검사를 시행하기도 한다. 최근 들어 흑색종의 임상진단에 많이 이용되는 피부확대경을 이용할 경우 가장 먼저 불필요한 피부 생검을 줄이는 장점이 있는 외에도 병변이 다수이거나 병변이 커서 여러 병변 중 어느 병변 또는 한 병변 내에서 어느 부위를 검사할지 혼란스러운 경우에 검사 부위를 선택하는데 큰 도움을 줄 수 있다.
조직검사 후 흑색종 병변의 절제 수술의 시기에 대해서는 이견이 많다. 이전에는 검사 후 수술의 시기와는 생존율에 영향이 없다는 의견이 많았으나 최근 15만여 명의 환자를 포함한 연구에 따르면 조직검사 후 30일 이상 수술이 연기되는 상황은 stage 1의 흑색종에서 사망률에 나쁜 영향을 미친다는 보고가 있으니 이 경우에는 조직검사 후 가능한 빨리 절제 수술을 시행하는 것이 안전하다고 하겠다[7].
피부병변의 절제 범위에는 과거로부터 큰 논란이 있었던 주제이다. 1900년대 초반 흑색종은 매우 광범위한 절제가 필요하다는 의견이 대두되어 심지어 ‘dinner plate excision’이 필요하다는 의견까지 제시되었다. 20세기 초중반까지 이 기조는 유지되었으며 국내에서도 이 영향으로 개개 흑색종의 병기와 무관하게 지나치게 광범위한 절제, 특히 손발의 작은 흑색종의 경우에도 사지 절단과 같은 극단적인 치료법이 권유되기도 했다. 그러나 이후 연구들을 거쳐 최근에는 과거보다 비교적 제한적인 절제(수술 여백 0.5-2 cm)가 권장되고 있으며 국내에서도 이에 보조를 맞추어 해당 환자의 TNM 병기에 적합한 수술적 절제가 시행되고 있다[8]. 피부 병변 절제 시 깊이에 대해서는 아직 이견이 많은 편이지만 대개 근육막 직전까지 전체 피하지방층을 제거하자는 의견이 대세이며 상피내암과 같이 얕은 병변의 경우는 일부 지방층만을 제거하는 것도 인정된다.
기저세포암 등의 피부암 치료에 매우 유용한 모즈수술(Mohs micrographic surgery)은 흑색종의 수술에서는 제한적으로 이용된다. 적응증으로는 안면이나 손발가락과 성기와 같이 절제 후 심각한 미용적 기능적 장애가 예상되는 경우와 악성흑색점흑색종과 같이 병변의 경계가 불분명한 경우에 주로 적용되고 있다.
감시림프절생검(sentinel lymph node biopsy, SLNB)이 이용되기 전에는 림프절 전이를 검사하기 위한 방법으로는 신체검사와 영상의학적 검사가 이용되었으며 이를 통해 전이가 의심되는 경우에만 또는 병원에 따라서는 모든 예에서 해당 국소림프절의 전절제술이 시행되었다. 그러나 이후 연구를 통해 이러한 전절제술은 생존율의 현저한 이점이 없는 외에도 림프절 순환이 항상 예측 가능한 것이 아니며 수술로 너무 많은 림프절이 채취되어 도리어 자세한 병리학적 검사가 어려울 수도 있고 림프관 전이와는 별개로 약 10%의 환자에서 혈행 전이가 먼저 발생하므로 수술의 이론적 배경이 취약하여 현재 무조건으로 시행하고 있지는 않는 실정이다.
반면 SLNB는 말 그대로 암세포가 넘어오는지를 감시하는 검사법으로 환자의 해당 감시림프절만을 선택적으로 채취한 후 조직검사를 하여 진단의 정확성을 높이는 방법이다. 원리는 피부 흑색종 병변 주위에 방사성 동위원소를 주입할 경우 동위원소가 림프관을 따라가다가 처음으로 축척되는 림프절을 감시림프절라고 하는데 이 림프절만을 채취하여 병리조직검사를 하는 방법을 의미한다. 이 방법은 암세포가 주사한 방사성 동위원소와 같은 방식으로 순환하여 림프절에 축적되는 것과 같은 암세포의 전이를 보인다는 데 착안하여 1990년 이후로 Morton 등[9]에 의해 확립되었다.
이후 SLNB의 유용성은 많은 연구들에 의해 검증되었다. 그러나 SLNB에서 전이 양성을 보이는 경우 즉시 치료적림프절절제술을 시행할지 여부에 대해 장기 연구를 통해 검증되었는데 즉각적인 절제술이 림프절 재발이 발생할 때까지 경과관찰하는 경우보다 국소 전이를 치료하는 데는 도움이 되지만 흑색종과 직접 관련된 생존율을 증가시키지는 못 한다는 결과가 도출되었다[10]. 따라서 SLNB 전이 양성을 보이는 경우 모든 환자에서 치료적림프절절제술을 시행하기 보다는 선택적으로 시행하는 것이 맞다는 의견이 대두되고 있으나 아직 그 시행기준은 없는 상태이다.
악성흑색종이 수술적 절제가 불가능한 경우에는 고식적인 치료목적으로 dacarbazine과 cisplatin 등의 항암화학요법이 단독 또는 복합요법으로 사용되나 기대 여명이 약 9개월 정도로 예후가 불량하다. 그 이외에도 interleukin-2 등의 cytokine을 이용한 면역치료요법이 가능하나 치료 반응률이 낮고 심각한 독성으로 인해 한계를 보여 왔다. 이후 기초의학의 발달로 흑색종의 발생과 진행에 관여하는 BRAF, NRAS 및 CKIT와 관계된 주요한 분자생물학적 기전이 밝혀졌다. 이들은 주로 MAPK 신호전달기전을 활성화시키며 NRAS 및 CKIT는 PI3K/AKT/mTOR도 활성화시킨다[11]. 또한 면역세포의 종양세포에 대한 면역회피에 관여하는 CTLA4, PD1, PD-L1과 같은 중요한 분자물질의 발견으로 최근 이들을 표적으로 하는 표적치료제가 다양한 임상시험을 통하여 그 효능을 입증함으로써 악성 흑색종의 치료에 새로운 역사를 이루게 되었다.
BRAF V600E 변이가 확인된, 수술이 불가능하거나 전이성인 흑색종 환자의 경우 BRAF 억제제인 vemurafenib과 dabrafenib, 그리고 MEK 억제제인 trametinib을 사용할 수 있다. Vemurafenib과 dabrafenib은 BRAF specific inhibitor로 기존의 dacarbazine과 비교하여 반응률과 전체 생존율의 향상을 보여주었다[12]. 가장 흔하게 관찰된 3등급 이상반응들은 피부부작용과 관련이 있었으며 그중에는 피부 편평상피세포암도 포함되어 있었다. Trametinib은 강력한 MEK1와 MEK2 inhibitor이다. 대규모 3상 임상연구에서 BRAF V600E/K 변이가 있는 진행성 혹은 전이성 흑색종 환자에서 dacarbazine 혹은 paclitaxel 3주요법과 비교하여 생존율을 유의하게 향상시킴을 보여주었다(위험률 0.47, 95% 신뢰구간 0.34-0.65, P<0.0001). 가장 많이 보고된 trametinib의 이상반응으로는 발진, 설사, 부종 등이 있었다. 그러나 BRAF inhibitor에서 관찰될 수 있는 심각한 부작용중의 하나인 피부 편평상피세포암은 보고되지 않았다. 또한 BRAF inhibitor의 약제 내성 기전의 하나로 MAPK pathway의 reactivation이 있어, BRAF의 downstream pathway인 MEK을 같이 차단함으로써 약제 저항성의 지연을 기대해 볼 수 있다. 이에 근거하여 BRAF inhibitor인 dabrafenib과 MEK inhibitor인 trametinib을 병용 투여하는 임상연구가 시행되었다. Dabrafenib과 trametinib의 병용 요법은 무진행 생존기간이 dabrafenib 단독요법에 비해 4개월 이상 증가되고[13], 발열 이외에 부작용의 증가는 관찰되지 않아 효과를 입증하였다.
암의 발생과 진행 과정에 다양한 면역 기전이 작용하는 것은 오래 전부터 알려져 왔으나, 최근 면역관문차단 기전에 대한 이해도가 높아지고, 이를 이용한 면역항암치료제의 임상연구에서 좋은 성적이 발표되면서 다시 주목받기 시작하였다. 면역체계는 인체의 정상 방어기전으로 신체 내 이상 세포가 발생할 경우 이를 파괴하고 제거하는 역할을 한다. 종양세포는 정상적인 면역기능을 통하여 제거되어야 하므로, 암의 발생과 전이는 면역체계의 면역감시를 회피할 수 있을 때 일어나게 된다. 이러한 회피 기전의 하나로서 종양세포는 면역관문을 활성화시킴으로서 종양특이 T 림프구 세포의 공격을 회피한다. 종양면역치료는 이러한 종양세포가 획득한 면역회피 기전을 극복하기 위해 면역체계를 회복 또는 강화하는 치료라 할 수 있다. 면역치료는 기존의 세포 독성 항암제와는 달리, 암세포에 특이적으로 내성 없이 오랫동안 반응을 나타내며 독성이 대단히 적은 것이 특징이다. 최근 가장 활발한 연구가 이루어지고 있는 것이 면역관문조절제들이다. 최초의 면역관문억제제는 cytotoxic T-lymphocyte associated antigen-4의 억제 단클론항체인 ipilimumab이다. 2010년 ipilimumab이 전이성 악성흑색종의 일차 치료제로 dacarbazine 단독요법에 비해 중앙생존기간을 9.1개월 대 11.2개월로 유의하게 증가시켜 미식품의약품안전청의 승인을 받아 새로운 암치료 전략으로서 종양면역치료의 시대가 열렸다[14]. 이후 PD-1 및 PD-L1에 대한 단클론항체가 악성흑색종에서 보다 강력한 효과를 보여주었다. 대표적인 약제인 pembrolizumab과 nivolumab은 T cell의 inhibitory receptor인 PD-1을 억제해 T-cell을 재활성하여 암세포를 공격하게 하는 기전을 가지고 있다. Pembrolizumab과 nivolumab은 기존의 표준치료인 dacarbazine에 대비해 생존율 향상을 입증했을 뿐 아니라, ipilimumab을 대조군으로 한 임상연구에서도 일차 치료제로서의 무질병 생존율과 전체 생존율의 향상을 입증하였다[1516]. 면역항암제는 치료반응이 좋은 환자에 대해 장기간 치료를 유지·사용할 수 있다. 주목할 만한 점은 반응이 나타나는 환자들의 경우에는 장기 생존이 가능하다는 점이다[17]. 또한 기존 화학항암제와는 달리 구토·탈모 등 부작용이 적기 때문에 항암제의 부작용으로 인해 환자들이 겪는 고통을 낮출 수 있다.
항암치료의 흐름은 면역항암제로 넘어왔지만 아직 해결해야 할 문제가 많이 있다. 면역체계 활성화에 따른 자가면역질환 등의 부작용이 있을 수 있고, 어떤 환자들이 효과를 볼 수 있을지를 판별할 수 있는 바이오마커가 부족하다. 하지만, 현재까지의 임상 결과로 볼 때 4기 암을 완치에 가까운 장기생존율을 보이는 몇 가지 되지 않은 치료방법으로 현재 진행 중인 많은 전향적 임상연구의 결과를 주의 깊게 지켜볼 필요가 있다.
과거에 비해 국내에 피부암이 많이 알려짐으로 인해 흑색종 환자의 조기 병원 방문이 늘어나고 있으며 더모스코피의 활발한 국내 도입으로 인해 피부 흑색종의 조기 발견이 더욱 용이하게 되고 있다. 또한 감시림프절생검과 같은 전이 검사법이 국내에도 널리 보급되고 흑색종의 수술적 치료에 있어서도 무조건 절단만을 강조하던 과거보다 좀더 근거에 바탕을 둔 과학적인 접근이 이루어지는 양상을 보이고 있다. 특히 과거에는 수술의 실패가 곧 모든 치료의 실패이던 흑색종 분야에서 최근 수년간의 눈부신 약물치료제(표적치료제, 면역치료제 등)의 발달로 인해 새로운 희망을 보여주고 있다는 점이 고무적이다.
이 논문은 최근 늘어나고 있는 피부암, 특히 예후가 좋지 않아 조기발견과 조기치료가 매우 중요한 피부흑색종에 대해서 소개하고 있다. 서양과는 달리 한국인에서 가장 흔한 흑색종의 아형인 말단흑색종에 대한 임상적 특징을 소개하고 있고, 새로운 비침습적 진단보조기구인 더모스코피의 유용성을 소개해 주고 있다. 또한 조직검사에서 주의할 점과 감시 림프절 생검의 의의 및 새로운 병기설정까지 잘 설명해 주고 있다. 최근 흑색종 치료에서 사용되는 유전자 돌연변이 억제제와 면역관문 억제제의 새로운 치료제들에 대해서도 설명해 주고 있다. 이 논문은 의사들이 오진할 경우 환자에게는 치명적인 결과를 초래하는 매우 중요한 피부암인 피부흑색종을 한국인 특성에 맞게 잘 설명해 주고 있는 유용한 논문이라 판단된다.
[정리: 편집위원회]
Figures and Tables
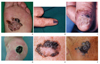 | Figure 2(A) Acral lentiginous melanoma in the sole, (B) longitudinal melanonychia due to subungual melanoma, (C) Hutchinson sign, (D) nodular melanoma of lat buttock, (E) superficial spreading melanoma on the trunk, and (F) lentigo maligna melanoma of the face. |
Table 1
American Joint Committee on Cancer prognostic stage groups

Reproduced from Gershenwald JE et al. CA Cancer J Clin 2017;67:472-492, according to the Creative Commons license [3].
References
1. Knackstedt T, Knackstedt RW, Couto R, Gastman B. Malignant melanoma: diagnostic and management update. Plast Reconstr Surg. 2018; 142:202e–216e.
2. Gershenwald JE, Scolyer RA, Hess KR, Thompson JF, Long GV, Ross MI. Melanoma of the skin. In : Amin MB, Edge S, Greene F, Byrd DR, Brookland RK, Washington MK, Gershenwald JE, Compton CC, Hess KR, Sullivan DC, Jessup JM, Brierley JD, Gaspar LE, Schilsky RL, Balch CM, Winchester DP, Asare EA, Madera M, Gress DM, Meyer LR, editors. AJCC cancer staging manual. 8th ed. New York: Springer;2017. p. 563–585.
3. Gershenwald JE, Scolyer RA, Hess KR, Sondak VK, Long GV, Ross MI, Lazar AJ, Faries MB, Kirkwood JM, McArthur GA, Haydu LE, Eggermont AMM, Flaherty KT, Balch CM, Thompson JF. for members of the American Joint Committee on Cancer Melanoma Expert Panel and the International Melanoma Database and Discovery Platform. Melanoma staging: evidence-based changes in the American Joint Committee on Cancer eighth edition cancer staging manual. CA Cancer J Clin. 2017; 67:472–492.

4. Malvehy J, Puig S, Argenziano G, Marghoob AA, Soyer HP;. Dermoscopy report: proposal for standardization: results of a consensus meeting of the International Dermoscopy Society. J Am Acad Dermatol. 2007; 57:84–95.
5. Saida T, Miyazaki A, Oguchi S, Ishihara Y, Yamazaki Y, Murase S, Yoshikawa S, Tsuchida T, Kawabata Y, Tamaki K. Significance of dermoscopic patterns in detecting malignant melanoma on acral volar skin: results of a multicenter study in Japan. Arch Dermatol. 2004; 140:1233–1238.

6. Koga H, Saida T, Uhara H. Key point in dermoscopic differentiation between early nail apparatus melanoma and benign longitudinal melanonychia. J Dermatol. 2011; 38:45–52.

7. Conic RZ, Cabrera CI, Khorana AA, Gastman BR. Determination of the impact of melanoma surgical timing on survival using the National Cancer Database. J Am Acad Dermatol. 2018; 78:40–46.

8. Bichakjian CK, Halpern AC, Johnson TM, Foote Hood A, Grichnik JM, Swetter SM, Tsao H, Barbosa VH, Chuang TY, Duvic M, Ho VC, Sober AJ, Beutner KR, Bhushan R, Smith Begolka. American Academy of Dermatology. Guidelines of care for the management of primary cutaneous melanoma. American Academy of Dermatology. J Am Acad Dermatol. 2011; 65:1032–1047.
9. Morton DL, Wen DR, Wong JH, Economou JS, Cagle LA, Storm FK, Foshag LJ, Cochran AJ. Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg. 1992; 127:392–399.

10. Faries MB, Thompson JF, Cochran AJ, Andtbacka RH, Mozzillo N, Zager JS, Jahkola T, Bowles TL, Testori A, Beitsch PD, Hoekstra HJ, Moncrieff M, Ingvar C, Wouters MWJM, Sabel MS, Levine EA, Agnese D, Henderson M, Dummer R, Rossi CR, Neves RI, Trocha SD, Wright F, Byrd DR, Matter M, Hsueh E, MacKenzie-Ross A, Johnson DB, Terheyden P, Berger AC, Huston TL, Wayne JD, Smithers BM, Neuman HB, Schneebaum S, Gershenwald JE, Ariyan CE, Desai DC, Jacobs L, McMasters KM, Gesierich A, Hersey P, Bines SD, Kane JM, Barth RJ, McKinnon G, Farma JM, Schultz E, Vidal-Sicart S, Hoefer RA, Lewis JM, Scheri R, Kelley MC, Nieweg OE, Noyes RD, Hoon DSB, Wang HJ, Elashoff DA, Elashoff RM. Completion dissection or observation for sentinel-node metastasis in melanoma. N Engl J Med. 2017; 376:2211–2222.

12. Chapman PB, Hauschild A, Robert C, Haanen JB, Ascierto P, Larkin J, Dummer R, Garbe C, Testori A, Maio M, Hogg D, Lorigan P, Lebbe C, Jouary T, Schadendorf D, Ribas A, O'Day SJ, Sosman JA, Kirkwood JM, Eggermont AM, Dreno B, Nolop K, Li J, Nelson B, Hou J, Lee RJ, Flaherty KT, McArthur GA. BRIM-3 Study Group. Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med. 2011; 364:2507–2516.

13. Flaherty KT, Infante JR, Daud A, Gonzalez R, Kefford RF, Sosman J, Hamid O, Schuchter L, Cebon J, Ibrahim N, Kudchadkar R, Burris HA 3rd, Falchook G, Algazi A, Lewis K, Long GV, Puzanov I, Lebowitz P, Singh A, Little S, Sun P, Allred A, Ouellet D, Kim KB, Patel K, Weber J. Combined BRAF and MEK inhibition in melanoma with BRAF V600 mutations. N Engl J Med. 2012; 367:1694–1703.

14. Hodi FS, O'Day SJ, McDermott DF, Weber RW, Sosman JA, Haanen JB, Gonzalez R, Robert C, Schadendorf D, Hassel JC, Akerley W, van den, Lutzky J, Lorigan P, Vaubel JM, Linette GP, Hogg D, Ottensmeier CH, Lebbe C, Peschel C, Quirt I, Clark JI, Wolchok JD, Weber JS, Tian J, Yellin MJ, Nichol GM, Hoos A, Urba WJ. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med. 2010; 363:711–723.

15. Schachter J, Ribas A, Long GV, Arance A, Grob JJ, Mortier L, Daud A, Carlino MS, McNeil C, Lotem M, Larkin J, Lorigan P, Neyns B, Blank C, Petrella TM, Hamid O, Zhou H, Ebbinghaus S, Ibrahim N, Robert C. Pembrolizumab versus ipilimumab for advanced melanoma: final overall survival results of a multicentre, randomised, open-label phase 3 study (KEYNOTE-006). Lancet. 2017; 390:1853–1862.





 PDF
PDF ePub
ePub Citation
Citation Print
Print




 XML Download
XML Download