This article has been corrected. See "Corrigendum: Pharmacological treatment of osteoarthritis" in Volume 61 on page 699.
Abstract
Osteoarthritis (OA) is a common chronic degenerative disease, and its prevalence increases with age. For patients with symptomatic OA, pharmacological treatment is suggested if symptoms and function do not improve with nonpharmacological modalities, including exercise, devices, manual therapy, or self-management programs. Attempts have been made to develop medications that prevent the structural progression of OA; however, the pharmacological treatment of OA has focused on the management of pain to improve the functional ability of joints. Clinicians try to prescribe adequate classes and doses of medications for pain relief, considering the affected parts of joints, each patient's comorbidities, and the clinical response to medical treatment, including tolerability and side effects. It is important to titrate the dose of medications as patients' symptoms change over time, maintaining the lowest effective dose for each individual.
골관절염은 관절의 과도한 사용이나 외상으로 인한 물리적인 손상에 의하여, 혹은 연골세포에서 증가된 이화작용이 원인이 되어 연골이 파괴되면서 활막, 연골하 골 등 관절 전반에 병적인 변화가 초래되는 질환이다[1]. 골관절염은 가장 흔한 만성질환으로서 국내 유병률은 연구방법에 따라 5–30%로 알려져 있으며, 연령에 비례하여 증가하는 경향이 있다[23]. 사회의 고령화와 비만의 증가로 인해 질병의 유병률은 점차 높아지고 있으며, 만성통증과 기능장애를 유발하는 질환의 특징으로 말미암아 신체활동을 제한하고 삶의 질에 크게 영향을 주어 사회 보건학적으로도 큰 질병부담을 유발하는 질환이다[45]. 따라서 골관절염에 동반되는 증상을 적극적으로 조절하고, 관절기능을 개선하여 환자들의 삶의 질을 향상시키기 위한 다양한 치료가 적용되고 있다. 골관절염의 치료는 비약물적 보존적 치료를 기반으로 질환의 진행 정도에 따라 약물치료를 병합하게 되며, 약물적 치료로 통증 조절이 잘 되지 않고 관절의 구조적 손상이 심한 경우에는 수술적 치료를 고려하게 된다.
본문에서는 골관절염의 치료를 위해 사용되는 약물들의 종류를 살펴보고, 국내 골관절염 환자 중 가장 흔한 무릎골관절염 환자를 중심으로 한 치료현황과 최근 발표된 국내 근거자료들을 바탕으로 약물치료의 적절한 방향을 제시하고자 한다.
골관절염에서 약물치료의 일차목표는 통증을 완화시키는 것으로, 이를 통해 관절의 운동성을 개선하고, 장기적으로 관절기능장애를 방지한다. 골관절염으로 인한 통증에 대해 우선적으로 체중관리, 유산소운동, 보조기 사용 및 적절한 교육 등 비약물적 보존적 치료를 기본적으로 시행하며, 질환의 진행 정도, 관절의 통증 정도를 고려하여 약물치료를 병행하게 된다. 약물치료로는 진통제, 비스테로이드소염제(nonsteoroidal anti-inflammtory drugs, NSAIDs), symptomatic slow acting drugs for osteoarthritis (SYSADOA)와 같은 경구용 약제와 관절강 내 글루코코르티코이드 및 히알루론산 주사 치료가 있다. 약물 종류와 제형을 결정하기 위해서는 골관절염이 침범한 관절의 수, 주로 증상을 동반하는 부위뿐만 아니라 환자의 기저질환과 연령을 우선 고려하여야 한다.
최근 국내 청구자료를 이용하여 발표된 대규모연구 결과에서는 국내 무릎골관절염 환자 중 82.5%에서 NSAIDs를 사용하고, 43.4% 환자에서 SYSADOA를 사용함을 보고하였다[6]. SYSADOA 중에서도 국내에서만 승인된 생약제제가 29.7%로 사용률이 높은 경향을 보여 이에 대한 효과와 안전성에 대한 체계적 근거의 확보가 필요함을 제안하였다. 반면, 상당히 많은 환자(8.6%)에서 경구 스테로이드제를 사용하고 있어 골관절염의 치료를 위하여 반드시 필요한 상태인지를 개별 환자에서 면밀하게 검토하여 사용을 지양할 필요가 있겠다.
아세트아미노펜(acetaminophen)은 경도 및 중등도의 관절통을 조절하기 위해 초기에 선택할 수 있는 약제이다[7]. 다른 진통제와 NSAIDs에 비해 비교적 유해반응이 적으므로 아세트아미노펜으로 관절 통증이 잘 조절될 경우에는 하루 최대 4 g까지 사용할 수 있다[8]. 하지만 최근 문헌고찰에서 용량에 비례하여 소화기계, 심혈관계, 신장관련 유해반응이 증가할 수 있는 위험성이 확인되면서[9], 통증을 효과적으로 조절하면서 유해반응을 최소화할 수 있는 용량으로 아세트아미노펜을 투약하도록 권고한다[7]. 골관절염 환자 중에는 특히 고령환자가 많기 때문에 하루 2 g이하로 조절하는 것이 바람직하다. 특히 감기약 등에도 흔히 사용되므로 중복처방에 따른 용량과다의 가능성, 알코올 섭취 시 유해반응이 증가할 가능성에 대해서는 충분히 설명할 필요가 있다.
국소NSAIDs나 최대 용량의 경구 아세트아미노펜으로도 조절되지 않는 중등도 이상의 관절통에 경구용 NSAIDs를 처방한다[10]. NSAIDs는 종류가 다양하고 환자에 따라 약효뿐만 아니라 유해반응이 다양하게 나타나므로 약제의 특성에 대한 충분한 이해를 바탕으로 투약하여야 한다. NSAIDs는 아라키돈산(arachidonic acid)과 시클로옥시나제(cyclooxygenase, COX)의 결합을 방해하여 프로스타글란딘(prostaglandin)의 합성을 억제함으로써 진통 및 소염 작용을 한다. COX-1은 위장관 점막을 포함하여 다양한 정상 세포에 존재하는데, 혈소판에 존재하는 COX-1은 트롬복산 A2 (thromboxane A2)의 합성에 관여한다. COX-2는 유해한 자극이 발생하면 염증반응에 의해 유도되며 증가하는데, 일반적으로 NSAIDs는 COX-1과 COX-2를 비선택적으로 모두 억제하는 작용을 하므로 진통소염효과와 함께 출혈 경향 및 위장관 자극과 같은 유해반응을 동반하기도 한다. 따라서 COX-2만 선택적으로 억제하는 약제를 개발하는 계기가 되었고, COX-2 선택적 억제제의 도입으로 약물 유해반응이 상대적으로 감소하게 되면서 사용량은 증가하였다. 또한 최근 COX-2 선택적 억제제의 보험급여 기준이 확대되어 골관절염의 증상과 징후를 개선하는 목적의 1차 약제로도 처방이 가능해져서 위장관계 유해반응을 적극적으로 감소시킬 수 있을 것으로 기대된다. 그러나 COX-2 선택적 억제제의 심혈관계 안전성에 대해서는 그 의문이 꾸준히 제기되고 있다. 특히 2015년도부터 COX-2 선택적 억제제의 특허가 만료되면서 제네릭 약제 개발이 급격히 늘어났고, 이에 대한 관심과 사용량은 훨씬 더 가파른 속도로 증가하고 있다. 이에 COX-2 선택적 억제제의 안전하고 적절한 사용을 위하여 심혈관계 및 위장관계 안전성에 대한 정보가 지속적으로 필요한 시점이다. 국내에서는 2015년에 에토리콕시브(etoricoxib)가 무릎골관절염 환자에게 1회 30 mg의 용량으로 승인되었고, 현재 사용 가능한 COX-2 선택적 억제제는 세레콕시브(celecoxib)와 더불어 두 가지로 선택지가 늘어났다. 에토리콕시브는 장기간의 안전성 근거가 부족하기는 하지만, 단기간의 위장관계 심혈관계 안전성은 다른 NSAIDs와 유사한 결과를 보였다[11]. 폴마콕시브(polmacoxib)는 국내에서만 승인된 COX-2 선택적 억제제로 골관절염 환자에서 세레콕시브와 유사한 효과와 심혈관계 안전성을 갖는 것으로 알려져 있으나, 안전성에 대한 대규모연구는 수행되지 못한 상태이다.
출혈의 위험도가 높은 환자들에게는 가급적 NSAIDs를 처방하지 않는 것이 좋겠지만, 이전 상부위장관 병력이 있는 환자에게 NSAIDs를 투약해야 한다면 COX-2 선택적 억제제와 프로톤펌프억제제(proton pump inhibitor, PPI)를 함께 처방한다. 위장관 유해반응을 예방하기 위해 NSAIDs와 프로스타글란딘 유사체인 미소프로스톨(misoprostol) 혹은 PPI를 병용 투약한다[12]. 하지만 일반적으로 처방하는 용량의 H2 수용체 길항제는 상부위장관 유해반응을 예방하는 효과가 없다. 아울러 흔히 처방하고 있는 점막보호제 등이 위염 혹은 위궤양의 치료효과로 승인되었기 때문에, 과연 NSAIDs와 병용하였을 때 위장관질환의 예방에 적절한지에 대해서는 추가적 검토가 필요하다.
심혈관계질환을 가진 환자에서 NSAIDs의 사용이 필요한 경우 주로 나프록센(naproxen)이 선호되고 있다[13]. 한편, 디클로페낙(diclofenac)은 여러 연구에서 심혈관질환의 위험을 증가시키는 것이 확인되었으며, 세레콕시브는 연구에 따라 다른 NSAIDs와 비슷하거나 다소 높은 심혈관계 위험성을 동반한 것으로 보고되었다[1415]. 하지만 최근 대규모연구에서 세레콕시브 200 mg/day은 나프록센이나 이부프로펜(ibuprofen)보다 심혈관계질환의 위험성이 크지 않은 것으로 나타났다[16]. 나프록센은 위장관 장애로 인해 잘 처방되지 않았는데, 최근 PPI와 결합된 새로운 형태의 약제 사용으로 저변이 확대되고 있는 경향이 있다. 이렇듯 골관절염 치료에 있어 NSAIDs 계열의 약물치료는 위장관 및 심혈관계 위험도를 염두에 둔 주치의의 현명한 판단이 필수적이다.
한편, 기존에 존재하는 심혈관계질환으로 저용량 아스피린(aspirin, 325 mg/day 이하)을 복용 중인 환자에게 경구 NSAIDs를 처방해야 한다면 이부프로펜을 제외한 비선택적 NSAIDs를 PPI와 병용하여 투약할 것을 권고한다[13]. 이는 이부프로펜이 아스피린의 항혈전효과를 상쇄하여 심혈관계질환을 예방하는 효과를 감소시키기 때문이다.
또한 프로스타글란딘은 신장 혈류를 유지하는 기전에 관여하므로, NSAIDs를 투약할 때 고혈압이나 말초 부종이 동반될 수 있다. 이외에도 간질신장염, 콩팥유두괴사 등을 유발하여 급성신부전을 유발하거나 만성신부전을 악화시킬 수 있다. NSAIDs는 사구체여과율이 30 mL/min/1.73 m2 미만인 4기 이상의 만성콩팥병 환자에게 투약되어서는 안되며, 3기 만성콩팥병 환자에서는 의사의 임상적 판단에 따라 주의 깊게 모니터링하면서 제한적으로 투약할 수 있다[10]. 특히 NSAIDs에 의한 신기능저하는 조기에 발견될 경우 약제를 중단하면 가역적이므로, NSAIDs를 처방하는 주치의는 정기적으로 신기능을 평가하여야 한다. 신혈관과 사구체에서 COX-1과 COX-2가 모두 발현되지만, 이부프로펜보다는 COX-2 선택적 억제제에서 신장 유해반응의 빈도가 유의하게 낮았다[16].
위와 같은 소화기계, 심혈관계, 신장 관련 합병증은 용량에 따라서 유해반응의 위험을 높일 수 있으므로 통증을 조절할 수 있는 최소 용량의 NSAIDs를 처방하는 것이 중요하다. 아울러 두가지 NSAIDs를 병용하는 것은 효과 측면에서 이득이 없으나, 유해반응이 증가할 수 있으므로 이를 지양해야 한다. 현재 의약품안전사용서비스(Drug Utilization Review)을 통해 병용 사용을 제한하고 있고, 이를 통해 사용량이 감소하고 있다[17].
아편유사제(opioid)는 NSAIDs에 효과가 없거나 이를 투약하지 못하는 금기증에 해당하는 환자에게 대체약으로 투약할 수 있다[8]. 손골관절염보다는 약물치료와 비약물적 치료에 모두 반응하지 않지만 수술을 할 수 없는 무릎 및 고관절의 골관절염에 대해 아편유사제를 처방할 수 있다[10]. 하지만 아편유사제는 유해반응으로써 중추신경작용과 관련하여 구역, 구토, 변비, 소변 저류, 기면, 혼동, 호흡억제 등이 있으며, 특히 노인환자에서 낙상을 유발하여 골절의 원인이 될 수 있으므로 사용에 주의해야 한다. 최근에 수술 등 급성통증 상황에서 적응증을 받은 아편유사제를 통증 조절이 안되는 골관절염 환자에게 사용하는 사례가 많이 발생하는데, 환자의 의존과 내성 가능성이 증가하므로 각별히 조심하는 것이 바람직하다.
항우울제 중에서 duloxetine이 세로토닌과 노르에피네프린의 재흡수를 억제하여 통증중추를 조절하여 골관절염으로 인한 만성통증을 효과적으로 감소시키는 것이 무작위임상시험연구에서 확인되었으나[21], 통증조절을 위해 일차적으로 투약하는 NSAIDs보다 효과가 우세하지는 않았다[22]. 따라서 통상적인 진통제와 NSAIDs에 적절히 반응하지 않는 경우에 다른 약제와 병용할 수 있다. 그러나 구강건조, 주간 졸림, 피곤, 오심, 변비, 식욕감소, 다한과 같은 유해반응으로 duloxetine을 중단하는 경우가 위약군보다 유의하게 많았다. 이의 사용에 대한 권고 여부는 가이드라인에 따라 매우 다양한데, 현재 우리나라에서 승인되어 있는 사실에 비해 임상적 근거는 매우 부족한 것이 현실이다.
SYSAODA는 비교적 적은 유해반응으로 골관절염으로 인한 통증을 조절할 수 있으나, 즉각적인 증상의 개선을 기대하기는 어려우며 사용에 따른 진통효과의 차이가 크지 않다. 당초 연골 손상의 방지효과를 기대하였던 약제들이 결국에는 다소의 증상개선의 효과만 있어, 이에 포함된 상황이라 볼 수 있다. 체계적인 임상시험을 통해서는 무릎과 고관절의 골관절염에 대해 글루코사민(glucosamine)과 콘드로이틴황산염(chondroitin sulphate)의 효과에 대해 일부 입증되었지만, 손골관절염에 대한 SYSADOA 효과에 대한 근거는 부족하다[23]. 한편, NSAIDs와 함께 사용할 경우, NSAIDs의 요구량을 감량할 수 있다는 후향적 연구가 발표되기도 하였다[24].
Diacerein은 다양한 골관절염에서 통증감소효과에 대해 연구가 수행되었다. 그 결과, 통증조절효과와 관절기능개선효과가 확인되었으나 연구에 참여한 환자의 수가 적어 신뢰도가 크지 않았다. 일부 연구에서 고관절의 골관절염에 대해 구조개선 효과가 있다고 보고되었으나 통증을 조절하지는 못하였고, 관찰기간이 다른 관절염에 비해 길었기 때문에 추가 연구가 필요하다. 대표적인 유해반응으로 설사가 있으며, 대부분의 연구에서 보고되었다[23].
Avocado/soybin saponifiables는 고관절골관절염보다 무릎골관절염의 통증조절에 효과가 있었으나 통증조절의 정도가 크지는 않았으며, 다른 약제들보다 골관절염의 통증을 조절하는 효과가 우월하지는 않았다[31].
무릎과 고관절골관절염의 통증을 조절하기 위해 관절강내 스테로이드주사가 처방될 수 있다[10]. 만성통증보다는 4주 이내에 발생한 통증을 조절하는데 보다 효과적이며[32], 진통효과는 즉각적으로 나타나서 최대 효과는 1주일 내에 나타나서 4주정도 지속되는 지속되나 환자에 따라 편차가 있을 수 있다. 하지만 관절강내 스테로이드 주사를 반복적으로 시행하는 경우 연골부피가 감소될 수 있으므로 잦은 처방은 지양한다[33]. 관절강내 히알루론산 주사는 경구약제로 통증조절에 실패한 경우 시도해볼 수 있으며, 관절통증 조절 및 관절기능개선에 대해 효과가 수개월간 지속된다는 것이 밝혀져 있으므로[34], 국내에서는 Kellgren-Lawrence grade 1–3 (Figure 1)에 해당하는 증상이 있는 무릎골관절염 환자에게 1주 간격으로 3회 주사하는 용법으로 처방할 수 있다. 최근에는 6개월 이상 간격으로 1회 투약이 가능한 제제가 도입되었으며, 관절강내 히알루론산 주사에 무릎골관절염의 증상이 조절되는 효과가 있을 경우에 한해 6개월이 경과한 시점에서 재투약이 가능하다. 하지만 관절강내 주사는 일부에서 투약 이후에 통증이 오히려 악화되는 경우가 있고, 반복적인 투약으로 인해 세균성 관절염이 동반될 수 있으므로 투약에 주의하여야 한다. 국내에서 2017년에는 기존의 치료에 반응하지 않는 Kellgren-Lawrence grade 3 이상의 무릎골관절염 환자에게 유전자 치료제인 tonogenconcel이 승인되었는데, 1회의 관절강내 주사로 1년 후의 통증 및 기능 개선의 효과가 임상시험에서 확인되었기 때문이다[35]. 유전자 치료인 만큼 연골구조의 개선효과에 대한 기대가 높았는데, 짧은 관찰기간 때문에 이에 대한 근거는 아직 부족한 실정이다. 향후 연골재생효과와 관련한 임상적 효과에 대해 장기적인 경과관찰과 재평가가 필요할 것이다.
증상을 동반하는 골관절염에 대해 비약물적 치료로 증상이 개선되지 않을 경우에 통증을 경감시키기 위한 약제를 투약할 수 있다. 아세트아미노펜을 투약하여 관절통이 조절되지 않는다면 경구 NSAIDs를 처방하고, 심한 통증에 대해서는 트라마돌을 병용한다. 국소증상을 조절하기 위해서 관절강내 주사, 국소 NSAIDs 혹은 캡사이신 패치나 연고를 함께 처방하여 경과를 관찰한다. SYSADOA는 골관절염 증상을 조절하고 관절의 구조적인 손상을 억제하기 위해 투약할 수 있는데, 이와 관련한 효능에 대해서는 향후 추가 연구가 필요하다.
골관절염의 통증을 조절하는 약제를 처방하는데 반드시 기억해야 할 사항은 증상을 효과적으로 조절할 수 있는 최소한의 용량으로 약제를 처방하며, 가능한 단기간 사용하도록 하는 것이다. 만성적인 통증을 호소하는 환자들에게 장기간 약물처방을 할 때에는 환자들의 기저질환을 고려하여 유해반응을 최소화할 수 있는 약제를 선택하여야 하며, 동일계열의 약제가 중복되어 처방되지 않도록 주의하여야 한다.
골관절염은 가장 흔한 근골격계 질환이다. 인구의 고령화에 따라 골관절염으로 인한 경제적, 사회적 손실은 계속 증가되고 있다. 그러나 골관절염의 발병에 기여하는 구조적, 생화학적 이상을 교정하여 연골을 재생하는 효과가 입증된 치료제는 아직 없는 상태이다. 증상 조절과 연골 보호를 위해 다양한 약물 및 비약물 치료가 개발되어 적용되고 있으나 이들에 대한 근거 또한 부족한 상황이다. 이 논문은 골관절염 치료제의 종류, 작용 기전, 효과에 관한 임상적 근거 및 주의 사항을 설명하고, 국내의 현황과 문제점을 보여 주고 있으며, 이를 토대로 바람직한 치료 전략을 제시하고 있어 골관절염을 이해하고 바른 치료법을 선택하는데 유용한 정보를 제공할 것으로 기대된다.
[정리: 편집위원회]
Figures and Tables
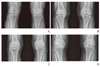 | Figure 1Radiologic evaluation of knee osteoarthritis according to the Kellgren-Lawrence (KL) classification. The figure contains representative radiographic images of each KL classification grade of knee osteoarthritis that were taken in the anteroposterior standing position. (A) KL grade 1 demonstrates doubtful narrowing of the joint space with a possible osteophyte. (B) KL grade 2 demonstrates definite narrowing of the joint space with a definite osteophyte. (C) KL grade 3 demonstrates definite narrowing of the joint space with moderate osteophyte formation, sclerosis, and possible deformity of the bony ends. (D) KL grade 4 demonstrates severe narrowing of the joint space with large osteophyte formation, marked sclerosis, and definite deformity of the bone ends. |
References
1. Loeser RF, Goldring SR, Scanzello CR, Goldring MB. Osteoarthritis: a disease of the joint as an organ. Arthritis Rheum. 2012; 64:1697–1707.

2. Cho NH, Kim S, Kim HA, Seo YI. The prevalence and risk factors of knee and hand osteoarthritis in Korea. J Korean Rheum Assoc. 2007; 14:354–362.

3. Park JH, Hong JY, Han K, Suh SW, Park SY, Yang JH, Han SW. Prevalence of symptomatic hip, knee, and spine osteoarthritis nationwide health survey analysis of an elderly Korean population. Medicine (Baltimore). 2017; 96:e6372.

4. Bijlsma JW, Berenbaum F, Lafeber FP. Osteoarthritis: an update with relevance for clinical practice. Lancet. 2011; 377:2115–2126.

5. Kim H, Cho SK, Kim D, Kim D, Jung SY, Jang EJ, Sung YK. Impact of osteoarthritis on household catastrophic health expenditures in Korea. J Korean Med Sci. 2018; 33:e161.

6. Park HR, Cho SK, Im SG, Jung SY, Kim D, Jang EJ, Sung YK. Treatment patterns of knee osteoarthritis patients in Korea. Korean J Intern Med. 2018; 03. 21. [Epub]. DOI: 10.3904/kjim.2017.304.

7. Machado GC, Maher CG, Ferreira PH, Pinheiro MB, Lin CW, Day RO, McLachlan AJ, Ferreira ML. Efficacy and safety of paracetamol for spinal pain and osteoarthritis: systematic review and meta-analysis of randomised placebo controlled trials. BMJ. 2015; 350:h1225.

8. Jordan KM, Arden NK, Doherty M, Bannwarth B, Bijlsma JW, Dieppe P, Gunther K, Hauselmann H, Herrero-Beaumont G, Kaklamanis P, Lohmander S, Leeb B, Lequesne M, Mazieres B, Martin-Mola E, Pavelka K, Pendleton A, Punzi L, Serni U, Swoboda B, Verbruggen G, Zimmerman-Gorska I, Dougados M. Standing Committee for International Clinical Studies Including Therapeutic Trials ESCISIT. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann Rheum Dis. 2003; 62:1145–1155.
9. Roberts E, Delgado Nunes V, Buckner S, Latchem S, Constanti M, Miller P, Doherty M, Zhang W, Birrell F, Porcheret M, Dziedzic K, Bernstein I, Wise E, Conaghan PG. Paracetamol: not as safe as we thought? A systematic literature review of observational studies. Ann Rheum Dis. 2016; 75:552–559.

10. Hochberg MC, Altman RD, April KT, Benkhalti M, Guyatt G, McGowan J, Towheed T, Welch V, Wells G, Tugwell P. American College of Rheumatology. American College of Rheumatology 2012 recommendations for the use of non-pharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee. Arthritis Care Res (Hoboken). 2012; 64:465–474.

11. Kim D, Cho SK, Nam SW, Kwon HH, Jung SY, Jeon CH, Im SG, Kim D, Jang EJ, Sung YK. Cardiovascular and gastrointestinal effects of etoricoxib in the treatment of osteo-arthritis: a systematic review and network meta-analysis. J Rheum Dis. 2017; 24:293–302.

12. Freedberg DE, Kim LS, Yang YX. The risks and benefits of long-term use of proton pump inhibitors: expert review and best practice advice from the American Gastroenterological Association. Gastroenterology. 2017; 152:706–715.

13. Patrono C, Baigent C. Nonsteroidal anti-inflammatory drugs and the heart. Circulation. 2014; 129:907–916.

14. White WB, West CR, Borer JS, Gorelick PB, Lavange L, Pan SX, Weiner E, Verburg KM. Risk of cardiovascular events in patients receiving celecoxib: a meta-analysis of randomized clinical trials. Am J Cardiol. 2007; 99:91–98.

15. Xu C, Gu K, Yasen Y, Hou Y. Efficacy and safety of celecoxib therapy in osteoarthritis: a meta-analysis of randomized controlled trials. Medicine (Baltimore). 2016; 95:e3585.
16. Nissen SE, Yeomans ND, Solomon DH, Luscher TF, Libby P, Husni ME, Graham DY, Borer JS, Wisniewski LM, Wolski KE, Wang Q, Menon V, Ruschitzka F, Gaffney M, Beckerman B, Berger MF, Bao W, Lincoff AM. PRECISION Trial Investigators. Cardiovascular safety of celecoxib, naproxen, or ibuprofen for arthritis. N Engl J Med. 2016; 375:2519–2529.

17. Jung SY, Jang EJ, Choi S, Im SG, Cho SK, Kim H, Sung YK. The effect of national drug utilization review system on non-steroid anti-inflammatory drug therapeutic duplication among knee osteoarthritis patients in the Korea. J Rheum Dis. 2018; 25:Suppl 1. S207.
18. Smith SR, Deshpande BR, Collins JE, Katz JN, Losina E. Comparative pain reduction of oral non-steroidal anti-inflammatory drugs and opioids for knee osteoarthritis: systematic analytic review. Osteoarthritis Cartilage. 2016; 24:962–972.

19. Jung SY, Jang EJ, Nam SW, Kwon HH, Im SG, Kim D, Cho SK, Kim D, Sung YK. Comparative effectiveness of oral pharmacologic interventions for knee osteoarthritis: a network meta-analysis. Mod Rheumatol. 2018; 03. 01. [Epub]. DOI: 10.1080/14397595.2018.1439694.

20. Zhang W, Nuki G, Moskowitz RW, Abramson S, Altman RD, Arden NK, Bierma-Zeinstra S, Brandt KD, Croft P, Doherty M, Dougados M, Hochberg M, Hunter DJ, Kwoh K, Lohmander LS, Tugwell P. OARSI recommendations for the management of hip and knee osteoarthritis: part III: changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis Cartilage. 2010; 18:476–499.

21. Wang G, Bi L, Li X, Li Z, Zhao D, Chen J, He D, Wang CN, Duenas H, Skljarevski V, Yue L. Efficacy and safety of duloxetine in Chinese patients with chronic pain due to osteoarthritis: a randomized, double-blind, placebo-controlled study. Osteoarthritis Cartilage. 2017; 25:832–838.

22. Myers J, Wielage RC, Han B, Price K, Gahn J, Paget MA, Happich M. The efficacy of duloxetine, non-steroidal anti-inflammatory drugs, and opioids in osteoarthritis: a systema-tic literature review and meta-analysis. BMC Musculoskelet Disord. 2014; 15:76.

23. Zhang W, Doherty M, Leeb BF, Alekseeva L, Arden NK, Bijlsma JW, Dincer F, Dziedzic K, Hauselmann HJ, Herrero-Beaumont G, Kaklamanis P, Lohmander S, Maheu E, Martín-Mola E, Pavelka K, Punzi L, Reiter S, Sautner J, Smolen J, Verbruggen G, Zimmermann-Gorska I. EULAR evidence based recommendations for the management of hand osteoarthritis: report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis. 2007; 66:377–388.

24. Cho SK, Kim H, Park HR, Choi W, Choi S, Jung S, Jang EJ, Sung YK. NSAID sparing effect of symptomatic slow acting drugs for osteoarthritis (SYSADOA) in knee osteoarthritis patients. J Rheum Dis. 2018; 25:Suppl 1. S266.
25. Reginster JY, Deroisy R, Rovati LC, Lee RL, Lejeune E, Bruyere O, Giacovelli G, Henrotin Y, Dacre JE, Gossett C. Long-term effects of glucosamine sulphate on osteoarthritis progression: a randomised, placebo-controlled clinical trial. Lancet. 2001; 357:251–256.

26. Clegg DO, Reda DJ, Harris CL, Klein MA, O'Dell JR, Hooper MM, Bradley JD, Bingham CO 3rd, Weisman MH, Jackson CG, Lane NE, Cush JJ, Moreland LW, Schumacher HR Jr, Oddis CV, Wolfe F, Molitor JA, Yocum DE, Schnitzer TJ, Furst DE, Sawitzke AD, Shi H, Brandt KD, Moskowitz RW, Williams HJ. Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis. N Engl J Med. 2006; 354:795–808.

27. Kongtharvonskul J, Anothaisintawee T, McEvoy M, Attia J, Woratanarat P, Thakkinstian A. Efficacy and safety of glucosamine, diacerein, and NSAIDs in osteoarthritis knee: a systematic review and network meta-analysis. Eur J Med Res. 2015; 20:24.

28. Zeng C, Wei J, Li H, Wang YL, Xie DX, Yang T, Gao SG, Li YS, Luo W, Lei GH. Effectiveness and safety of Glucosamine, chondroitin, the two in combination, or celecoxib in the treatment of osteoarthritis of the knee. Sci Rep. 2015; 5:16827.

29. Mazieres B, Combe B, Phan Van A, Tondut J, Grynfeltt M. Chondroitin sulfate in osteoarthritis of the knee: a prospective, double blind, placebo controlled multicenter clinical study. J Rheumatol. 2001; 28:173–181.
30. Hochberg MC, Zhan M, Langenberg P. The rate of decline of joint space width in patients with osteoarthritis of the knee: a systematic review and meta-analysis of randomized placebo-controlled trials of chondroitin sulfate. Curr Med Res Opin. 2008; 24:3029–3035.

31. Christensen R, Bartels EM, Astrup A, Bliddal H. Symptomatic efficacy of avocado-soybean unsaponifiables (ASU) in osteoarthritis (OA) patients: a meta-analysis of randomized controlled trials. Osteoarthritis Cartilage. 2008; 16:399–408.

32. van Middelkoop M, Arden NK, Atchia I, Birrell F, Chao J, Rezende MU, Lambert RG, Ravaud P, Bijlsma JW, Doherty M, Dziedzic KS, Lohmander LS, McAlindon TE, Zhang W, Bierma-Zeinstra SM. The OA Trial Bank: meta-analysis of individual patient data from knee and hip osteoarthritis trials show that patients with severe pain exhibit greater benefit from intra-articular glucocorticoids. Osteoarthritis Cartilage. 2016; 24:1143–1152.

33. McAlindon TE, LaValley MP, Harvey WF, Price LL, Driban JB, Zhang M, Ward RJ. Effect of intra-articular triamcinolone vs saline on knee cartilage volume and pain in patients with knee osteoarthritis: a randomized clinical trial. JAMA. 2017; 317:1967–1975.

34. Cooper C, Rannou F, Richette P, Bruyere O, Al-Daghri N, Altman RD, Brandi ML, Collaud Basset S, Herrero-Beaumont G, Migliore A, Pavelka K, Uebelhart D, Reginster JY. Use of intraarticular hyaluronic acid in the management of knee osteoarthritis in clinical practice. Arthritis Care Res (Hobo-ken). 2017; 69:1287–1296.

35. Cho J, Kim T, Park Y, Shin J, Kang S, Lee B. Invossa (Tissue-gene-C) in patients with osteoarthritis: a phase III trial. Osteo-arthritis Cartilage. 2016; 24(Supp 1):S190.




 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download