Abstract
Age-related macular degeneration (AMD) is a major cause of central vision loss in developed countries. The incidence of AMD has increased rapidly in Korea. The objective of this article is to introduce the latest knowledge about the pathophysiology, diagnostic tools and therapeutic modalities of AMD. The risk factors for AMD are age, smoking, familial history, genetic factors related to the complement system, diet, and cholesterol levels. Inflammation plays an important role in the pathophysiology of AMD and is associated with the complement system. Genes associated with the complement system affect the pathophysiology, expression, progression and therapeutic response of AMD. The use of antioxidants, zinc, and omega-3 fatty acids inhibits progression from moderate AMD to advanced AMD. Although there is no established treatment for dry AMD, treatment with agents that inhibit the complement system or through other mechanisms is under study. A number of anti-vascular endothelial growth factor agents have been developed for the prevention of choroidal neovascularization in the treatment of wet AMD and are being used clinically. Therapeutic alternatives to anti-vascular endothelial growth factor agents are under study.
나이관련황반변성은 50세 이상 고령에서 중심시력을 이루는 황반 부위에 변성이 나타나는 질환이다. 나이관련황반변성은 크게 드루젠(drusen)과 색소이상, 지도모양위축이 나타나는 건성, 맥락막 신생혈관이 동반되는 습성으로 나뉜다. 습성 나이관련황반변성은 맥락막 신생혈관에 의한 삼출물, 부종, 출혈 등으로 인해 건성 나이관련황반변성보다 망막의 시세포의 위축과 퇴행이 급격하다.
나이관련황반변성은 서구에서 65세 이상 인구에 실명을 유발하는 대표적인 원인으로, 아시아에서도 노령인구의 시력저하와 실명에 중요한 원인 질환으로 보고되었다. 우리나라에서도 수명의 증가 및 식습관 등의 서구화가 진행되면서 과거에 비해 유병률이 크게 증가하고 있다.
망막 조직의 노화 징후들은 75세 이후 두드러진다. 망막에는 추체와 간체라는 시세포가 존재하여 자극을 수용한다. 자극을 받아들인 시세포에서 전기적인 변화가 발생하고, 전기적인 변화가 발생한 시세포 말단은 기능을 소실한다. 기능이 소실된 시세포 말단을 망막색소상피가 제거한다. 망막색소상피가 기능이 소실된 시세포의 말단을 제거하는 과정에서 지방갈색소(lipofuscin)가 발생한다. 노화가 진행되면 망막색소상피 기능이상으로 망막색소상피세포에 지방갈색소 및 세포 내 잔류체가 축적된다. 망막색소상피의 기능이상이 진행되면 브루크막의 투과성이 변하고, 세포외 물질이 망막색소상피의 바닥막과 브루크막의 내측 아교질층 사이에 축적되어 드루젠을 형성한다. 드루젠의 형성은 망막색소상피 기능이상에 중요한 신호다. 드루젠 형성은 망막색소상피 소실을 촉진하고, 망막색소상피 소실은 광수용체 소실을 촉진한다. 건성 나이관련황반변성 환자의 망막색소상피에서 DICER1 (ribonucleic acid cleaving enzyme)의 수치가 낮은데, DICER1의 수치가 낮을 경우 염증 단백질들이 활성화되어 망막색소상피 소실을 초래한다[1].
드루젠은 맥락막 혈관으로부터 망막으로 산소나 영양공급을 저해하고 맥락막으로부터 대식세포를 유인하는 간접적인 혈관형성인자로 작용한다. 산소 부족 상태가 되면 망막은 혈관내피성장인자 (vascular endothelial growth factor, VEGF)를 분비하여 맥락막에 비정상적인 새로운 혈관을 생성하게 한다. 망막색소상피의 기능이상과 노화에 따른 변화로 인한 브루크막의 기능이상으로 브루크막의 파열된 부위를 통해 맥락막 신생혈관이 유입되어 망막색소상피와 브루크막 사이에서 증식한다. 맥락막 신생혈관의 내피세포는 장벽기능이 없으므로 감각신경망막과 망막색소상피층에 단백질 및 지방 삼출물이 누출되고 섬유혈관상처가 발생하여 시력손상을 유발한다.
염증은 드루젠과 나이관련황반변성 병인에 중요한 역할을 한다. C 반응성 단백질 수치가 나이관련황반변성 환자에서 유의하게 증가되어 있으며, C 반응성 단백질 수치가 유의하게 높은 사람에서 나이관련황반변성의 유병률이 높았다. 드루젠의 형성은 나이관련황반변성 진행에 관여하는 염증연쇄반응을 촉진시킨다[2]. 보체체계는 면역반응의 일부로 외부물질을 제거하고 세포나 조직의 잔재를 제거하는 시스템이다. 보체체계와 관련된 신호전달 시스템은 건성 나이관련황반변성을 유발하는 유전적인 요인과 관련이 있고, 신호전달이 활성 또는 억제되는 것이 건성 나이관련황반변성의 진행과 진행과 관련이 있다. 여러 연구에서 보체인자와 관련된 유전자들의 다형성에 관해 보고하였으며, 보체 연쇄반응경로에 관련된 염증인자들이 드루젠 내에서 확인되었다.
미토콘드리아의 기능이상이 건성 나이관련황반변성과 관련이 있다. 건성 나이관련황반변성 환자에서 미토콘드리아의 이상형태가 관찰되었고, 기능이상을 동반하였다[3].
많은 연구에서 모든 형태의 나이관련황반변성이 연령이 증가함에 따라 유병률, 발생률, 진행이 증가하였다. 나이관련황반변성은 50세 이하에서 드물지만, 65–74세 연령대에 비해 75세 이상에서 나이관련황반변성이 유발될 위험이 3배 이상이었다.
흡연은 건성과 습성 나이관련황반변성의 위험인자다. 나이관련황반변성과 흡연은 용량 반응 관계에 있고, 금연 후에도 위험도가 증가된 상태로 남아있다. 흡연은 complement factor H (CFH)를 감소시켜, 흡연자가 비흡연자에 비해 나이관련황반변성이 진행하는데 위험도를 증가시킨다[4].
과거 연구에서 환자군 가족의 경우 대조군 가족과 비교해 2–3배 나이관련황반변성의 위험이 높았고, 형제자매나 쌍생아 연구에서도 연관성을 보였다. 현재까지 나이관련황반변성과 관련된 34개의 유전자자리에서 52개의 유전자변이체가 확인되었다. 질병이 없는 사람과 있는 사람의 유전체를 비교하는 genome-wide association study 기법을 이용하여, 다른 염색체에서 몇 종류의 유전자변이체를 확인하였다. 1번 염색체에 CFH의 경우 정상적으로는 보체 경로를 억제하는데, 유전자 다형성에 기인한 비정상적인 CFH의 활성으로 보체 연쇄반응이 활성화되고, 망막하 조직에 염증반응을 유발하여 나이관련황반변성의 위험을 증가시키는 상관관계를 가진다. 6번 염색체에 complement factor B, complement component 2의 유전자 다형성은 보체경로 활성화를 억제하고, 만성염증을 억제하여 나이관련황반변성 위험에 보호효과를 가진다. Age-related maculopathy susceptibility 2 (ARMS2)/High-temperature requirement serine peptidase 1 (HTRA1) 유전자는 10번 염색체에 존재하며, ARMS2/HTRA1 유전자의 특정 단일염기과형성은 망막하출혈과 관련이 있다[5]. Complement component 3 (C3) 유전자는 나이관련황반변성의 위험도를 높이는 것으로 알려져 있으며, 고밀도지단백 콜레스테롤 대사와 관련된 lipase C hepatic type, toll like receptor 3 등의 유전자변이체들이 나이관련황반변성과 관련이 있는 것으로 알려져 있다.
항산화제와 아연 섭취는 나이관련황반변성의 진행 위험을 낮추고 시력 소실을 감소시킨다. 항산화제가 풍부한 과일, 야채를 섭취할 경우 삼출성 나이관련황반변성의 위험도가 감소하였고, 65세 이상의 한국인을 대상으로 시행한 연구에서도 비슷한 결과를 보였다[89]. 카로티노이드는 활성산소로 인한 손상을 막는 항산화제로 황반에 고농도로 존재하는데, 카로티노이드인 루테인(lutein)과 제아잔틴(xeazanthin)은 삼출성 나이관련황반변성의 위험을 줄인다. 비타민D의 결핍은 염증, 신생혈관생성, 섬유화와 관련이 있으며, 나이관련황반변성의 위험을 높인다는 연구들이 있지만 아직 논쟁 중이다.
체질량지수가 높거나, 허리둘레가 큰 사람에서 나이관련황반변성의 진행 비교위험도가 높았다. 음주는 현재까지 나이관련황반변성 발생에 큰 영향을 미치지 않는 것으로 알려져 있다. 햇빛 노출과 나이관련황반변성의 상관관계는 논란이 진행 중이다. 여러 연구에서 여성은 같은 연령대 남성과 비교해 나이관련황반변성 유병률이 높았다. 17만 명 이상의 환자를 포함한 메타분석에서 아스피린이 나이관련황반변성의 위험인자가 아닌 것으로 밝혀졌다[12].
나이관련황반변성은 크게 건성과 습성으로 나뉜다. 나이관련황반변성 환자의 90%는 비습성인 건성이다. 건성 나이관련황반변성은 망막색소상피 소실을 특징으로 하며, 하나 이상 패치 모양의 위축이 생기면서 커지거나 융합되고, 망막색소상피가 소실된 부위는 시세포 소실과 관련이 있다. 망막색소상피의 지도모양 위축은 건성 나이관련황반변성의 말기형이다. 건성 나이관련황반변성은 드루젠의 크기와 개수, 색소변화 정도에 따라 초기, 중기, 후기로 나뉜다. 습성 나이관련황반변성은 맥락막 신생혈관과 망막색소상피박리를 특징으로 한다. 진행된 나이관련황반변성의 경우 동양인은 삼출형이, 서양인은 위축형이 많은 것으로 알려져 있다. 비삼출성 나이관련황반변성의 10–20%는 습성 나이관련황반변성으로 발전한다.
Age-Related Eye Disease Study (AREDS)에서 나이관련황반변성을 드루젠, 위축, 신생혈관에 따라 황반변성이 없거나, 초기, 중기, 후기 나이관련황반변성으로 분류하였으며, 후기 나이관련황반변성의 발생위험도를 계산할 수 있는 방법을 제시하였다.
드루젠은 황반에서 망막, 맥락막 변성이 시작되었다는 징후이며, 위치에 따라 그 자체로 시력감소의 원인이 되기도 한다. 건성 나이관련황반변성 환자에서 후극부의 드루젠의 종류, 크기, 분포가 대칭성을 보인다. 모양에 따라 경성 드루젠과 연성 드루젠으로 구분되며, 연성 드루젠은 경성 드루젠보다 크고, 부드럽고, 비정형의 모양을 보인다. 빛간섭단층촬영에서 망막색소상피 수준에서 융기된 병변으로 관찰된다(Figure 1A,1B). 드루젠과 더불어 색소변화 및 색소이상도 나이관련황반변성의 진행을 나타내는 소견으로 색소의 감소(저색소)와 색소의 증가(과색소)로 나타난다.
지도모양위축은 망막색소상피의 저색소 침착 또는 탈색소 또는 망막색소상피가 없는 부위가 원형 또는 타원형의 분명한 경계를 가지고 맥락막 혈관이 잘 보이며, 직경이 175 µm 이상인 병변으로 정의하며, 빛간섭단층촬영에서 외경계막, 내절-외절경계, 망막색소상피 및 브루크막 복합체 등이 관찰되지 않는다(Figure 1C,1D). 형광안저조영술상 소실되거나 위축된 망막색소상피를 통해 배경 맥락막 형광이 쉽게 투과돼 초기부터 밝은 과형광이 나타나고, 이 부분을 지나는 맥락막 혈관이 같이 관찰된다.
자가형광안저촬영은 망막색소상피 내에 분자들 중 주로 지방갈색소에 의해 나타난다. 지도모양위축은 망막색소상피 소실과 함께 지방갈색소 축적이 없으므로 경계가 명확한 저형광을 보인다. 위축이 있는 부위와 없는 부위의 경계에 다양한 패턴의 고형광의 자가형광이 나타나는데, 새로운 위축이 생기는 부분은 자가형광이 증가된 부분에서 이루어지며, 증가된 자가형광의 존재와 패턴은 지도모양위축의 진행에 대한 예후를 알려준다. FAM (multicenter Fundus Autofluorescence in Age-related Macular Degneration)연구에서 지도모양위축 경계부위의 비정상적인 자가형광 패턴을 없거나, 국소적으로 증가하였거나, 밴드형, 패치형, 미만형의 5가지로 분류하였는데, 지도모양위축의 진행이 미만형의 trickling 패턴에서 가장 높게 나타났다[13].
습성 나이관련황반변성은 망막색소상피박리와 맥락막 신생혈관을 특징으로 하며, 망막색소상피박리는 섬유혈관성, 장액성, 출혈성, 드루젠과 연관된 망막색소상피박리로 구분한다. 맥락막 신생혈관을 의심할 수 있는 안저소견으로는 망막하막과 출혈, 망막하 지방삼출물 등이 있다(Figure 2A). 습성 나이관련황반변성에서 망막내액 혹은 망막하액, 출혈, 망막하막, 망막내수포 등이 빛간섭단층촬영에서 관찰된다(Figure 2B). 맥락막 신생혈관은 형광안저조영술에 의해 전형 맥락막 신생혈관, 잠복 맥락막 신생혈관으로 나뉜다. 형광안저조영술에서 초기부터 경계가 명확한 과형광이 관찰되고, 후기로 가면서 누출이 심해지고 경계가 불분명해지는 경우 전형 맥락막 신생혈관으로 진단하며(Figure 2C,2D), 잠복 맥락막 신생혈관의 경우 형광안저조영술 수 분 후에 점상의 다수의 과형광과 후기에 형광 누출, 고임으로 과형광이 진해지는 경우 제1형 잠복 맥락막 신생혈관, 초기에 별다른 변화가 없다가 후기에 경계가 명확하지 않은 과형광이 보이는 경우 제2형 잠복 맥락막 신생혈관으로 진단한다. 치료받지 않은 맥락막 신생혈관은 섬유혈관성반흔 (원반반흔)으로 진행한다.
빛간섭단층촬영은 형광안저조영술상 병변이 명확하지 않을 때, 치료 반응을 추적관찰 할 때 유용하다. Spectral-domain optical coherence tomography (OCT)는 지도모양위축의 위축 병변에서 망막색소상피와 광수용체의 소실 등 나이관련황반변성의 미세구조 변화를 이해하는데 도움을 준다. OCT angiography는 신생혈관 나이관련황반변성에서 치료반응을 추적관찰 하거나, 비신생혈관성 나이관련황반변성의 병인에 중요한 맥락막 모세혈관과 혈관구조를 관찰하는데 유용하다.
형광안저조영술에서 드루젠은 플루오레신과 결합해 후기에 과형광으로 나타나지만 드루젠을 구성하는 요소에 따라 다르게 나타난다. 임상적으로 확인 가능한 드루젠의 50% 정도에서만 플루오레신으로 염색된다.
인도시아닌그린 색소는 높은 투과력과 적은 누출로 인해 플루오레신 색소에 비해 병변의 경계를 상대적으로 명확히 조영 할 수 있다. 인도시아닌그린혈관조영술은 큰 망막색소상피박리가 동반되는 경우, 잠복 맥락막 신생혈관, 망막혈관종성증식, 결절맥락망막병증 진단에 유용하다.
AREDS1은 비타민C(500 mg), 비타민E(400 IU), 베타카로틴(15 mg), 아연(80 mg), 구리(2 mg, 아연에 의한 빈혈 예방)로 구성된 보충제가 나이관련황반변성의 진행에 미치는 영향을 조사했다. 비타민C와 E는 항산화제, 베타카로틴은 카로티노이드로 황반 색소를 구성하고, 아연은 면역기능과 세포분열에 관여한다. 나이관련황반변성이 없거나, 초기 나이관련황반변성 환자의 경우 이득이 없었다. 중기 나이관련황반변성 또는 반대안에 진행된 나이관련황반변성이 있을 때 AREDS1 유형 식이보충을 한 경우 5년 후 진행된 나이관련황반변성으로 진행할 위험이 25% 감소하였다. 하지만 AREDS1 유형 식이보충에서 베타카로틴은 흡연을 하는 사람에서 폐암을 유발하며, 80 mg 고용량 아연은 위장장애와 전립선 비대증과 관련이 있었다. 황반에 존재하는 카로티노이드 화합물인 루테인과 제아잔틴이 나이관련황반변성의 발생을 줄이고, 오메가 3 지방산(docosahexaenoic acid, eicosapentaenoic acid)이 진행된 나이관련황반변성으로 진행을 억제한다는 연구가 있었다. Docosahexaenoic acid는 망막조직을 구성하는 성분이며, eicosapentaenoic acid는 염증억제 물질이다. 루테인, 제아잔틴, 오메가3 지방산을 복용하는 것이 진행된 나이관련황반변성을 줄일 수 있는지 2006년 AREDS2가 진행되어 2013년 중간결과가 발표되었다. AREDS2에서는 베타카로틴을 없애거나 아연 용량을 낮추는 것이 진행된 나이관련황반변성으로 진행에 영향을 주지 않았고, 흡연자에서 루테인과 제아잔틴이 베타카로틴 대체 섭취물로 적절하다고 보고했다.
건성 나이관련황반변성에서 아직 확립된 치료법은 없다. 염증과 보체체계와 관련된 유전자들의 다형성이 나이관련황반변성의 병태생리와 연관되어 있다는 연구들이 보고되면서, 건성 나이관련황반변성의 치료를 위해 다양한 보체 억제제들이 연구되고 있다. Lampalizumab은 C3단백질 전환효소인 complement factor D를 타겟으로, 항원-항체 결합반응을 통해 complement factor D를 억제하는 단일클론 항체이다. Lampalizumab 2상 임상시험(MAHALO study)에서 lampalizumab을 매달 주사한 군에서 지도모양위축 진행이 sham 치료군과 비교하여 감소하였다고 발표했다[16]. 하지만 lampalizumab 3상 임상시험(SPECTRI, CHROMA)에서 sham 대조군과 lampalizumab 치료군에서 지도모양위축 병소 크기를 비교하였을 때 유의미한 차이를 보이지 못했다. 보체체계를 활성화하는 complement factor 5 단백질을 억제하는 지도모양위축 치료제는 현재 임상 2, 3상을 진행 중이다. APL-2는 C3단백질 억제제로, C3단백질과 결합하여 보체 연쇄반응을 차단한다. 지도모양위축을 가지는 환자의 APL-2 2상 임상시험(FILLY trial)에서 12개월 동안 매달 APL-2를 유리체강 내 주사한 치료군에서 sham 치료군과 비교하여 지도모양위축 진행속도가 감소하였다.
Doxycycline은 저용량에서 항염작용을 가지는데, 저용량의 doxycycline이 지도모양위축 진행 속도를 줄이는지에 대해 연구가 진행 중이다. MTP-131은 미토콘드리아를 보호하는 화합물로 건성 나이관련황반변성 치료에 미치는 영향을 연구 중이다. Brimonidine tartrate는 신경보호 효과가 있어, 지도모양위축을 가진 환자에서 광수용체의 세포 자멸사를 막아 황반기능을 보전할 것이라고 생각하여 연구가 진행 중이다[1718]. 줄기세포치료는 지도모양위축 병변 내에 소실된 광수용체나 망막색소상피를 대체하는 방법으로, 배아줄기세포에서 획득한 망막색소상피를 위축성 나이관련황반변성 환자에서 망막하 삽입 후 12개월째에 치료받지 않은 눈에 비해서 시력이 개선되었다는 연구가 있다[19].
레이저 광응고술은 맥락막 신생혈관 막을 파괴하여 신생혈관 진행을 늦추기 위해 고안되었으나, 치료받은 환자의 82%에서 시력저하가 발생하였고, 광역학치료와 anti-VEGF 치료가 보편화 되면서 중심와 밑 맥락막 신생혈관 치료에 거의 사용되지 않고, 중심와 밖 맥락막 신생혈관 치료에 사용되고 있다.
광역학치료는 광감작물질을 혈관 내에 주사하면, 증식하는 조직에 광감작물질이 축적되고 689 nm 파장의 레이저를 조사하여 활성화시키면, 활성산소 및 자유유리기가 생성되 광화학반응을 일으키고 선택적으로 맥락막 신생혈관을 폐쇄시킨다. 망막에 영향을 주지 않고 병변이 있는 맥락막 신생혈관을 치료하는 개념으로 시도되었으나, 정상적인 맥락막 모세혈관에서 혈전형성을 동반한 혈관폐쇄로 인한 조직 허혈로 국소적으로 VEGF를 증가시킨다. Anti-VEGF 치료에 반응을 하지 않는 경우, anti-VEGF 치료와 병합하여 이차치료로 사용될 수 있으며, 스테로이드와의 병합치료도 고려해 볼 수 있다.
Bevacizumab (Avastin; Genentech, South San Francisco, CA, USA)은 VEGF-A의 모든 아형에 결합하는 재조합 인간화 단일클론항체로 신생혈관형성과 혈관투과성을 감소시킨다. 2004년 미국 식품의약국의 승인을 받아 전이성 대장암과 직장암치료에 사용되었다. CATT (Comparison of ARDM Treatment Trial) 연구와 IVAN (Inhibition of VEGF in Age-related Choroidal Neovascularization) 연구에서 삼출성 나이관련황반변성으로 인한 중심와밑 맥락막 신생혈관 치료에 bevacizumab과 ranibizumab은 동등한 효과를 보였다.
Pegaptanib (Macugen; Eyetech, Palm Beach Gardens, FL, USA)은 혈류망막장벽파괴와 안내신생혈관에 관여하는 VEGF165를 차단하는 aptamer로 선택적으로 혈관형성을 억제한다. 2004년 미국 식품의약국에 의해 첫번째 anti-VEGF 약물로 승인을 받았으나, 효과가 시력안정화에 국한되어 있고 시력호전은 크지 않았다.
Ranibizumab (Lucentis, Genentech)은 VEGF에 대한 인간화 단일클론항체로, 모든 VEGF-A 아형들과 결합해 활성을 억제하고, 항원결합분절만으로 구성되어 있다. 2006년 미국 식품의약국의 승인을 받아 나이관련황반변성에서 발생한 맥락막 신생혈관 치료에 사용되고 있다. ANCHOR (Anti-VEGF Antibody for the Treatment of Predominantly Classic CNV in AMD), MARINA (Minimally Classic/occult Trial of the Anti-VEGF Antibody Ranibizumab in the Treatment of Neovascular AMD) 연구에서 매달 ranibizumab 주사 치료를 하는 것이 삼출성 나이관련황반변성에서 효과적이고 안전한 치료임을 증명하였고, 통계적으로 유의한 시력호전을 보였다. PIER 연구에서는 첫 3개월은 매달 ranibizumab 주사치료를 시행한 후 3개월마다 주사치료를 시행한 결과를 분석하였는데, 치료군에서 대조군에 비해 시력을 보전하는 효과는 있었으나, 시력 호전은 미미하였다. 하지만 매달 주사치료를 시행하는 것은 임상적인 한계가 있으므로, 주사치료의 효과를 유지하면서 치료 횟수를 줄이는 방법이 연구되었다. PrONTO (Prospective Optical Coherence Tomography Imaging of Patients with Neovascular Age-related Macular Degeneration)연구에서 빛간섭단층촬영을 이용해 황반병변의 변화양상에 따라 치료를 추가하고 분석하였는데, ranibizumab 안내 주입술의 횟수를 유의미하게 줄일 수 있었다. 장기간 ranibizumab 치료의 안정성 및 효과를 알아보기 위해 HORIZON 연구, SECURE 연구가 진행되었고 전신적, 안과적 유해사례는 기존 연구와 차이가 없었다.
Aflibercept (Eylea; Regeneron, Tarrytown, NY, USA)는 bevacizumab이나 ranibizumab과는 달리 VEGF-B와 platelet-derived growth factor에도 결합한다. 임상 3상 VIEW1 and VIEW2 (VEGF Trap-Eye: Investigation of Efficacy and Safety in Wet AMD)연구에서 첫 3회 매달 주사 후 2달마다 aflibercept를 주사한 군에서, 매달 ranibizumab을 주사한 군과 효과와 안정성에서 유사한 결과를 보여주었다. 2014년 발표된 2년째 VIEW연구에서 96주째 모든 aflibercept군과 ranibizumab군이 시력소실 방지와 시력호전에 유사한 결과를 보여주었고, 2 mg aflibercept를 첫 3개월 매달 주사 후 2달마다 주사한 군은 매달 ranibizumab을 주사한 군과 유사한 효과를 보였고 평균 주사횟수는 5회 적었다. 여러 연구들에서 bevacizumab이나 ranibizumab 치료에 반응하지 않는 신생혈관 나이관련황반변성 환자에서 aflibercept를 주입하였을 때 망막색소상피박리 높이나 중심와 두께의 유의한 감소를 보고하였는데[2021222324], 한국인 환자를 대상으로 시행한 연구에서도 비슷한 결과를 보였다[252627].
신생혈관 나이관련황반변성에서 anti-VEGF 치료를 할 때 fixed 방법, pro re nata 방법, treat and extended 방법, observe and plan 방법과 같이 크게 4가지 방법이 있다. 매달 내원하여야 하는 pro re nata 방법보다는, 치료반응에 따라서 기간을 조절하는 treat and extended 방법이나 observe and plan 방법이 대두되고 있다.
기존의 치료법은 치료 단백질을 눈에 직접 주사하여 VEGF와 결합해 비활성화시켰고, 치료 단백질은 눈에서 입으로 통하는 통로를 통해 소실되므로 6–8주마다 재치료를 받아야 했다. 현재 치료물질의 잔존 기간을 늘리거나, 안구 내에 약물을 삽입하는 장치 등 치료효과 지속기간을 연장하기 위해 다양한 연구가 진행되고 있다. 한 연구에서는 AAV2 바이러스를 매개체로 사용해, 바이러스가 망막세포를 관통하여 세포가 VEGF와 결합하는 sLFT01이라는 치료단백질을 생산하도록 전환시키는 유전자를 삽입하여, anti-VEGF 치료 없이 시력 호전을 보고하였다[28].
Pegpleranib은 platelet-derived growth factor에 결합해 신생혈관막에 혈관주위세포 밀도를 감소시켜, anti-VEGF 치료제의 침투를 돕는다. 하지만 임상 3상에서 ranibizumab과 pegpleranib의 병합치료가 ranibizumab 단독치료보다 더 효과적이지 않았다.
Transpupillary thermotherapy는 anti-VEGF 치료에 보조치료로, 동공을 통해 적외선 파장의 파형을 주변 망막에 손상을 주지 않는 저용량(136 mW/mm)으로 조사하는데, 습성 나이관련황반변성 환자에서 sham 치료군과 비교하여 ranibizumab 주입술의 횟수를 줄일 수 있었다[29]. Stereotatic radiotherapy도 시력을 유지하는데 필요한 유리체강 내 anti-VEGF 주입술 횟수를 줄일 수 있다는 연구가 있다[30].
수술적인 요법으로는 맥락막 신생혈관 제거술과 황반변위술이 있다. 하지만, Submacular Surgery Trial에서 경과관찰한 군과 중심와 밑 맥락막 신생혈관을 제거한 군을 비교했을 때 수술적 방법이 시력을 호전시키지 못했다고 보고 하였으며, 황반변위술의 경우 50% 이상의 재발율과 수술 후 높은 비율의 증식성 유리체 망막병증이 발생하였다.
나이관련황반변성에서 손상된 망막색소상피를 대체하기 위해 여러 연구가 진행되었는데, 자가 망막색소상피이식술의 경우 손상이 많이 가고 증식성 유리체 망막병증의 발생 비율이 높았다. 하지만 배아줄기세포를 이용하여 여러 연구들이 진행되었고, 한 연구에서는 삼출성 나이관련황반변성으로 시력을 거의 잃은 환자에서, 배아줄기세포에서 획득한 망막색소상피 패치를 망막의 손상된 부분 밑에 이식하여 시력이 호전되었다고 보고했다[31].
현재까지 밝혀진 나이관련황반변성의 위험인자는 나이, 흡연, 가족력 및 보체체계와 관련된 유전자, 식이습관, 고지혈증이 있다. 나이관련황반변성의 병태생리에 염증이 중요한 역할을 하며, 보체체계와 관련이 있다. 보체체계와 관련된 유전자는 나이관련황반변성의 병태생리, 발현, 진행, 치료반응에 영향을 준다. 항산화제, 아연, 오메가3 지방산의 복용은 중등도의 나이관련황반변성에서 진행된 나이관련황반변성으로 진행을 억제한다. 건성 나이관련황반변성의 확립된 치료는 없지만, 보체체계를 억제하거나 다른 기전을 통한 통한 치료제가 연구 중이다. 습성 나이관련황반변성에서 맥락막 신생혈관을 억제하기 위해 다양한 anti-VEGF 치료제가 개발되어 임상에서 사용 중이며, anti-VEGF 치료횟수를 줄이기 위한 보조적인 치료나 anti-VEGF 치료제를 대체할 수 있는 치료법이 연구 중이다. 나이관련황반변성은 다인자 질환으로 환자를 진료할 때 여러 측면을 고려해야 하며, 중심시력 소실이 되므로 환자를 진료할 때 중심시력 소실에 따른 삶의 질 감소도 반드시 같이 고려해야 한다.
이 논문은 최근 노인 인구의 중요한 실명 원인으로 대두되는 나이관련 황반변성의 임상양상 및 분류, 병태생리, 위험인자, 진단 및 치료 등을 체계적으로 정리하고 있다. 식생활의 서구화 및 노인 인구의 증가 등으로 인해 나이관련 황반변성은 국민보건, 특히 노인 인구의 삶의 질에 중요한 영향을 미치는 질환이다. 나이관련 황반변성의 역학, 원인 및 병태 생리, 진단 및 치료에 관해 자세하게 설명하고 있으며, 최근 논문에 대한 정보를 잘 제시해 주고 있다. 특히 이 질환의 예방법으로 알려진 금연과 AREDS fromula에 대해 자세히 설명하고 있으며, 황반변성 발생의 병태생리로서 산화스트레스에 의한 염증의 중요성을 강조하고 있다. 이 논문은 다소 생소한 나이관련 황반변성을 이해하는데 많은 정보를 제공할 것으로 판단된다.
[정리: 편집위원회]
Figures and Tables
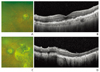 | Figure 1Clinical finding of dry age-related macular degeneration. (A) Fundus photograph image of soft drusen. (B) Optical coherence tomography image of soft drusen. (C) Fundus photograph image of geographic atrophy. (D) Optical coherence tomography image of geographic atrophy |
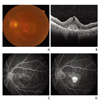 | Figure 2Clinical findings of wet age-related macular degeneration. (A) Fundus photograph image of classic choroidal neovascularization. (B) Optical coherence tomography image of classic choroidal neovascularization. (C) Early phase fluorescence angiography image of classic choroidal neovascularization. (D) Late phase fluorescence angiography image of classic choroidal neovascularization. |
References
1. Tarallo V, Hirano Y, Gelfand BD, Dridi S, Kerur N, Kim Y, Cho WG, Kaneko H, Fowler BJ, Bogdanovich S, Albuquerque RJ, Hauswirth WW, Chiodo VA, Kugel JF, Goodrich JA, Ponicsan SL, Chaudhuri G, Murphy MP, Dunaief JL, Ambati BK, Ogura Y, Yoo JW, Lee DK, Provost P, Hinton DR, Nunez G, Baffi JZ, Kleinman ME, Ambati J. DICER1 loss and Alu RNA induce age-related macular degeneration via the NLRP3 inflammasome and MyD88. Cell. 2012; 149:847–859.

2. Johnson LV, Leitner WP, Staples MK, Anderson DH. Complement activation and inflammatory processes in Drusen formation and age related macular degeneration. Exp Eye Res. 2001; 73:887–896.

3. Nordgaard CL, Karunadharma PP, Feng X, Olsen TW, Ferrington DA. Mitochondrial proteomics of the retinal pigment epithelium at progressive stages of age-related macular degeneration. Invest Ophthalmol Vis Sci. 2008; 49:2848–2855.

4. Esparza-Gordillo J, Soria JM, Buil A, Almasy L, Blangero J, Fontcuberta J, Rodriguez de Córdoba S. Genetic and environmental factors influencing the human factor H plasma levels. Immunogenetics. 2004; 56:77–82.

5. van Asten F, Simmons M, Singhal A, Keenan TD, Ratnapriya R, Agron E, Clemons TE, Swaroop A, Lu Z, Chew EY; Age-Related Eye Disease Study 2 Research Group. A deep phenotype association study reveals specific phenotype associations with genetic variants in age-related macular degeneration: age-related eye disease study 2 (AREDS2) report no. 14. Ophthalmology. 2018; 125:559–568.

6. Smailhodzic D, Muether PS, Chen J, Kwestro A, Zhang AY, Omar A, Van de Ven JP, Keunen JE, Kirchhof B, Hoyng CB, Klevering BJ, Koenekoop RK, Fauser S, den Hollander AI. Cumulative effect of risk alleles in CFH, ARMS2, and VEGFA on the response to ranibizumab treatment in age-related macular degeneration. Ophthalmology. 2012; 119:2304–2311.

7. Medina FM, Alves Lopes da Motta A, Takahashi WY, Carricondo PC, Dos Santos Motta MM, Melo MB, Vasconcellos JP. Pharmacogenetic Effect of complement factor H gene polymorphism in response to the initial intravitreal injection of bevacizumab for wet age-related macular degeneration. Ophthalmic Res. 2015; 54:169–174.

8. Kim EK, Kim H, Vijayakumar A, Kwon O, Chang N. Associations between fruit and vegetable, and antioxidant nutrient intake and age-related macular degeneration by smoking status in elderly Korean men. Nutr J. 2017; 16:77.

9. Kim EK, Kim H, Kwon O, Chang N. Associations between fruits, vegetables, vitamin A, β-carotene and flavonol dietary intake, and age-related macular degeneration in elderly women in Korea: the Fifth Korea National Health and Nutrition Examination Survey. Eur J Clin Nutr. 2018; 72:161–167.

10. Saunier V, Merle BMJ, Delyfer MN, Cougnard-Gregoire A, Rougier MB, Amouyel P, Lambert JC, Dartigues JF, Korobelnik JF, Delcourt C. Incidence of and risk factors associated with age-related macular degeneration: four-year follow-up from the ALIENOR study. JAMA Ophthalmol. 2018; 136:473–481.

11. Cougnard-Gregoire A, Delyfer MN, Korobelnik JF, Rougier MB, Malet F, Le Goff M, Dartigues JF, Colin J, Barberger-Gateau P, Delcourt C. Long-term blood pressure and age-related macular degeneration: the ALIENOR study. Invest Ophthalmol Vis Sci. 2013; 54:1905–1912.

12. Zhu W, Wu Y, Xu D, Li YH, Jun B, Zhang XL, Wang F, Yu J. Aspirin use and risk of age-related macular degeneration: a meta-analysis. PLoS One. 2013; 8:e58821.

13. Batioglu F, Gedik Oguz Y, Demirel S, Ozmert E. Geographic atrophy progression in eyes with age-related macular degeneration: role of fundus autofluorescence patterns, fellow eye and baseline atrophy area. Ophthalmic Res. 2014; 52:53–59.

14. Goldstein M, Loewenstein A, Barak A, Pollack A, Bukelman A, Katz H, Springer A, Schachat AP, Bressler NM, Bressler SB, Cooney MJ, Alster Y, Rafaeli O, Malach R; Preferential Hyperacuity Perimeter Research Group. Results of a multicenter clinical trial to evaluate the preferential hyperacuity perimeter for detection of age-related macular degeneration. Retina. 2005; 25:296–303.

15. Jackson GR, Scott IU, Kim IK, Quillen DA, Iannaccone A, Edwards JG. Diagnostic sensitivity and specificity of dark adaptometry for detection of age-related macular degeneration. Invest Ophthalmol Vis Sci. 2014; 55:1427–1431.

16. Rhoades W, Dickson D, Do DV. Potential role of lampalizumab for treatment of geographic atrophy. Clin Ophthalmol. 2015; 9:1049–1056.
17. Tsai JC. Canadian Journal of Ophthalmology Lecture: translational research advances in glaucoma neuroprotection. Can J Ophthalmol. 2013; 48:141–145.

18. Wong WT, Kam W, Cunningham D, Harrington M, Hammel K, Meyerle CB, Cukras C, Chew EY, Sadda SR, Ferris FL. Treatment of geographic atrophy by the topical administration of OT-551: results of a phase II clinical trial. Invest Ophthalmol Vis Sci. 2010; 51:6131–6139.

19. Schwartz SD, Regillo CD, Lam BL, Eliott D, Rosenfeld PJ, Gregori NZ, Hubschman JP, Davis JL, Heilwell G, Spirn M, Maguire J, Gay R, Bateman J, Ostrick RM, Morris D, Vincent M, Anglade E, Del Priore LV, Lanza R. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. Lancet. 2015; 385:509–516.

20. Kumar N, Marsiglia M, Mrejen S, Fung AT, Slakter J, Soren-son J, Freund KB. Visual and anatomical outcomes of intra-vitreal aflibercept in eyes with persistent subfoveal fluid despite previous treatments with ranibizumab in patients with neovascular age-related macular degeneration. Retina. 2013; 33:1605–1612.

21. Bakall B, Folk JC, Boldt HC, Sohn EH, Stone EM, Russell SR, Mahajan VB. Aflibercept therapy for exudative age-related macular degeneration resistant to bevacizumab and ranibizumab. Am J Ophthalmol. 2013; 156:15–22.

22. Cho H, Shah CP, Weber M, Heier JS. Aflibercept for exudative AMD with persistent fluid on ranibizumab and/or bevacizumab. Br J Ophthalmol. 2013; 97:1032–1035.

23. Ho VY, Yeh S, Olsen TW, Bergstrom CS, Yan J, Cribbs BE, Hubbard GB 3rd. Short-term outcomes of aflibercept for neovascular age-related macular degeneration in eyes previously treated with other vascular endothelial growth factor inhibi-tors. Am J Ophthalmol. 2013; 156:23–28.

24. Blanco-Garavito R, Jung C, Uzzan J, Quaranta-ElMaftouhi M, Coscas F, Sahel J, Korobelnik JF, Bechet S, Querques G, Souied EH. Aflibercept after ranibizumab intravitreal injections in exudative age-related macular degeneration: the ARI2 study. Retina. 2017; 12. 21. [Epub]. DOI: 10.1097/IAE.0000000000001928.
25. Kim JH, Cho NC, Kim WJ. Intravitreal aflibercept for neovascular age-related macular degeneration resistant to bevacizumab and ranibizumab. J Korean Ophthalmol Soc. 2015; 56:1359–1364.

26. Kim KM, Kim JH, Chang YS, Kim JW, Kim CG, Lee DW. Efficacy of three aflibercept injections for neovascular age-related macular degeneration showing limited response to ranibizumab. J Korean Ophthalmol Soc. 2017; 58:62–68.

27. Moon DR, Lee DK, Kim SH, You YS, Kwon OW. Aflibercept treatment for neovascular age-related macular degeneration and polypoidal choroidal vasculopathy refractory to anti-vascular endothelial growth factor. Korean J Ophthalmol. 2015; 29:226–232.

28. Heier JS, Kherani S, Desai S, Dugel P, Kaushal S, Cheng SH, Delacono C, Purvis A, Richards S, Le-Halpere A, Connelly J, Wadsworth SC, Varona R, Buggage R, Scaria A, Campochiaro PA. Intravitreous injection of AAV2-sFLT01 in patients with advanced neovascular age-related macular degeneration: a phase 1, open-label trial. Lancet. 2017; 390:50–61.

29. Soderberg AC, Algvere PV, Hengstler JC, Soderberg P, Seregard S, Kvanta A. Combination therapy with low-dose transpupillary thermotherapy and intravitreal ranibizumab for neovascular age-related macular degeneration: a 24-month prospective randomised clinical study. Br J Ophthalmol. 2012; 96:714–718.

30. Ranjbar M, Kurz M, Holzhey A, Melchert C, Rades D, Grisanti S. Stereotactic radiotherapy in neovascular age-related macular degeneration: real-life efficacy and morphological evaluation of the outer retina-choroid complex. Medicine (Baltimore). 2016; 95:e5729.
31. da Cruz L, Fynes K, Georgiadis O, Kerby J, Luo YH, Ahmado A, Vernon A, Daniels JT, Nommiste B, Hasan SM, Gooljar SB, Carr AF, Vugler A, Ramsden CM, Bictash M, Fenster M, Steer J, Harbinson T, Wilbrey A, Tufail A, Feng G, Whitlock M, Robson AG, Holder GE, Sagoo MS, Loudon PT, Whiting P, Coffey PJ. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nat Biotechnol. 2018; 36:328–337.





 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download