Abstract
대상 및 방법
7예의 환자를 대상으로 하였다. 평균 나이는 44세였으며 남자 4예, 여자 3예였다. 평균 추시 기간은 38개월이었다. 기능적 평가는 Musculoskeletal Tumor Society (MSTS) 점수를 측정하였으며, 주기적 방사선 촬영을 통해 합병증을 분석하였다. 최종 추시 시 종양학적 결과를 분석하였다.
결과
이환 부위는 대퇴골 5예, 상완골 1예, 경골 1예였다. 최종 진단은 악성 골육종 4예, 다발성 골수종 2예, 법랑종 1예였다. 이식된 동종골의 평균 길이는 165 mm였다. 동종골 내고정은 금속정과 금속판 고정 4예, 골수강 내 금속정 고정 2예, 나사못 고정 1예였다. 평균 유합 기간은 14.5주였다. 최종 추시 시 평균 MSTS 점수는 20점(67%)이었다. 수술 후 합병증으로는 불유합 3예, 내고정물 파손 1예, 감염 1예였다. 최종 추시 시 지속적 무병 상태 5예, 유병 상태의 생존 2예였다. 3예의 불유합 중 2예의 환자에서 자가골 이식술과 반 피질 동종골 보강술을 시행하였다.
초록
Purpose
We evaluated the results of allograft reconstruction following wide resection of malignant bone tumors in long bone, retrospectively.
Materials and Methods
Seven patients were included. The mean age was 44 years old. Male was 4 cases, and female was 3 cases. Mean follow-up period was 38 months. The mean Musculoskeletal Tumor Society (MSTS) score at final follow-up was evaluated. Postoperative complications were evaluated via periodic radiologic follow-up. Oncologic results were analyzed at final follow-up.
Results
The primary malignancies occurred at femur in 5 cases, humerus in 1 case and tibia in 1 case. Pathologic diagnoses were osteosarcoma in 4 cases, multiple myeloma in 2 cases and adamantinoma in 1 case. Mean length of allograft was 165 mm. Fixations of allograft were intramedullary nailing with additional plate in 4 cases, intramedullary nailing in 2 cases, and screw fixation in 1 case. Mean time to union was 14.5 weeks. Mean MSTS score at final follow-up was 20 (67%). Postoperative complications were nonunion in 3 cases, implant failure in 1 case, and infection in 1 case. Oncologic outcomes were continuous disease free in 5 cases and alive with disease in 2 cases at final follow-up. Autologous bone graft and hemi-cortical onlay graft were performed in 2 cases of nonunion.
진단 기법과 항암 화학 요법 및 수술 방법의 비약적 발전으로 인하여 원발성 악성 골종양의 치료 방법이 과거에는 절단술이 주된 수술 방법이었다면, 최근에는 사지 구제술로 전환을 가져왔다.123) 악성 골종양의 광범위 절제술 후 결손 부위의 사지 구제술을 위한 재건술의 방법은 종양 대치물,45) 동종골 및 종양 대치물 복합체,1) 신연 골 연장술,6) 절제술 후 종양 세포를 처리한 후 재사용하는 자가골 이식술,78) 비골 등의 자가골 이식술,9) 동종골 이식술101112) 등의 방법이 있다. 이 중 종양 대치물을 이용한 재건술은 수술 후 신속한 재활을 할 수 있어 많이 사용하고 있지만, 종양이 침범되지 않은 부분도 희생시켜야 한다는 점과 기계적 수명에 한계가 있다는 단점이 있다. 신연 골 연장술은 주로 장관골에서 적응이 가능하며 종양 절제 후 결손을 채우기까지 매우 오랜 시간이 걸린다. 종양 절제술 후 종양 세포를 처리한 뒤에 재사용하는 자가골 이식술은 자가골을 사용하기 때문에 면역학적 거부 반응이 없지만 재사용하는 자가골이 약해져 이식 후 골절 및 불유합 등의 합병증이 보고되고 있다.131415) 동종골 이식술은 악성 골종양의 광범위 절제술 후 결손 부위의 재건술에 만족스러운 결과를 보고하고 있다.1617) 그러나 동종골 이식술은 면역학적 거부 반응, 공여자의 질병 전파, 수술 후 감염, 이식된 동종골 골절, 숙주골과 동종골 경계부위의 불유합 등과 같은 다양한 합병증이 보고되고 있다.101112171819)
이에 저자들은 장관골에 발생한 악성 골종양의 광범위 절제술 후 동종골을 이용한 재건술의 임상적 및 종양학적 결과, 수술 합병증 등에 대해 후향적으로 분석하고자 하였다.
장관골에서 발생한 악성 골종양의 광범위 절제술 후 동종골 이식을 시행받은 7예의 환자를 대상으로 하였다. 환자의 평균 나이는 44세(19–62세)였으며 남자 4예, 여자가 3예였다. 평균 추시 기간은 38개월(13–96개월)이었다. 이환 부위는 대퇴골 5예, 상완골 1예, 경골 1예였다(Table 1).
조직 검사를 통한 최종 진단은 악성 골육종 4예, 다발성 골수종 2예, 법랑종 1예였다. 수술 전 촬영한 자기공명영상을 기초로 하여 종양 부위에서 최소한 2 cm 이상의 광범위 절제연을 확보하였으며 조직 검사 경로 및 근육 등의 주변 연부조직을 포함하여 종양세포의 노출 없이 광범위 절제술을 시행하였다. 6예의 환자에서 동일한 길이의 전 피질골 동종골, 1예의 환자에서 반 피질골 동종골을 이용하여 재건하였으며, 동종골 이식 후 고정은 4예의 환자에서 골수강 내 금속정과 금속판 고정, 2예의 환자에서 골수강 내 금속정 고정, 1예의 환자에서 나사못 고정을 시행하였다. 이식된 동종골의 평균 길이는 165 mm (110–195 mm)였다(Table 1).
수술 후 주기적인 방사선 촬영을 통해 숙주골과 동종골 사이의 골유합 유·무 및 합병증을 분석하였다. 단순 방사선 사진에서 숙주골과 동종골 경계면에서 수술 후 12개월 동안 가골 형성 또는 골유합 소견이 보이지 않을 경우 불유합으로 판단하였다.
기능적 평가는 최종 추시 시 Enneking 등20)이 1993년에 Musculoskeletal Tumor Society (MSTS)에서 제창한 기능적 분류 척도를 이용하였다. 이 평가 방법에 따라 동통(pain), 기능(function), 정서적 순응도(emotional acceptance)에 0–5점씩 부과하였으며 하지에 병소가 있는 경우 보조기 사용(supports), 보행(walking), 걷는 모양(gait)을, 상지에 골 병소가 있는 경우에는 손 운동(hand positioning), 기능 숙달도(manual dexterity), 거상 능력(lifting ability)에 대해서도 같은 방법으로 0–5점씩 부과하여 총 30점 만점으로 계산하였다.
수술 후 숙주골과 동종골 사이의 평균 유합 기간은 14.5주(10–18주)였다. 수술 후 10주 만에 제일 먼저 유합을 얻은 증례는 경골간부의 법랑종으로 진단받고 반 피질골 동종골을 이용하여 재건술을 시행한 환자로 이는 다른 전 피질골 동종골 이식술을 시행한 환자들보다 훨씬 빠른 시간에 유합을 얻을 수 있었다. 3예의 불유합 환자 중 2예에서 재수술을 시행하였다.
최종 추시 시 지속적 무병 상태 5예, 유병 상태의 생존 2예였으며 폐 전이나 국소 재발 등의 소견은 없었다. MSTS의 기능적 평가방법에 따른 최종 추시 시 평균 지수는 20점(67%)이었다(Table 1). 이 중 동통 지수는 평균 3.5, 기능 지수는 평균 3.5, 정서적 만족도는 평균 3.0으로 동통 지수와 기능 지수가 비교적 높은 점수를 보인 반면, 정서적 만족도는 낮은 점수를 보였다.
수술 후 합병증으로는 동종골 이식 부위와 숙주골 사이의 불유합 3예, 금속 내고정물 파손 1예, 감염 1예가 있었다(Table 1). 이 중불유합 1예와 내고정물 파손 1예는 동일 환자에서 발생하였다.
총 3예의 불유합 환자 중 2예의 환자에서 재수술을 시행하였으며, 1예의 불유합 환자는 전신 상태 저하로 추가적인 수술을 시행하지 않았다. 내고정물 파손과 불유합이 동시에 발생한 1예의 환자에서 골수강 내 금속정 파손 후 내고정물을 교체하였으며, 이후 동종골과 숙주골의 불유합 부위에 자가골 이식술과 반 피질골 동종골 이식편을 얹는 방식(hemi-cortical onlay allograft)의 보강술을 시행하였다(Fig. 1). 재수술 8개월에 유합을 얻었다. 골수강 내 금속정 단독으로 내고정술을 시행한 1예의 불유합 환자에서도 동종골과 숙주골 경계 부위에 반 피질골 동종골 이식편으로 보강술을 시행하였으나, 재수술 10개월 경과한 시점으로 아직 유합은 얻지 못하고 있다. 1예의 감염은 적절한 감염 부위의 변연절제술로 치료하였다.
악성 골종양 수술 방법이 과거에는 종양 발생부 근위부에서 시행한 절단 수술이 대부분의 치료였으나 최근에는 광범위 절제술 후 사지 구제술을 통해 이환지의 기능을 최대한 회복하는 데 중점을 두고 있다. 사지 구제술의 여러 수술 방법 중 광범위 절제술 후 동종골을 이용한 재건술은 최근 들어 그 빈도가 점점 늘어나는 추세이다. 그 대표적 이유로는 국내 3차 의료 기관 대부분이 자체의 골 은행을 운영하고 있다는 점, 민간 조직 처리 업체 수의 증가로 동종 이식골 공급이 이전보다는 원활하다는 점 등이 광범위 절제술 후 동종골 이식술의 빈도를 높이는 요인 중 하나일 것이다. 동종골 이식술의 장점으로는 종양 대치물보다 생리학적으로 우월한 관절 기능을 회복시킬 수 있다는 점, 절제연의 주변 연부조직 부착이 종양 대치물보다 용이하다는 점 등이 있으며, 그 외 장점으로는 수술 후 수일 내 체중 부하가 가능하다는 점 등을 들 수 있다.
그러나 이러한 동종골 이식술은 여러 장점 못지 않게 많은 합병증도 보고되고 있다.11011121819) 동종골 이식술 후 합병증으로는 감염, 이식 동종골의 골절, 공여자의 질병 전파, 불유합 등이 있다. 그 중 대표적인 합병증은 숙주골과 동종골 경계 부위의 불유합이다.10111921222324) Hornicek 등18)은 동종골 불유합의 빈도를 17.2%로 보고하였다. 동종골은 혈관 분포가 없는 구조물이므로 동종골 이식술 후 치유 과정이 전적으로 동종골과 경계를 이루고 있는 숙주골의 주변 환경과 숙주의 전신 상태에 의존하고 있다. 악성 골종양의 광범위 절제술과 동시에 주변 연부조직의 광범위 손상으로 인한 연부조직 주변의 혈관 손상은 정상적인 치유 과정(reparative process)을 방해한다. 예를 들어, 동종골에 대한 골유도(osteoinduction)능력의 저하, 숙주의 정상 면역 과정이 억제된다는 점 등을 들 수 있다. 악성 골종양의 광범위 절제술 후 동종골 이식술을 시행 받은 대부분의 환자들은 수술 후 항암 화학 요법 또는 방사선 치료 등의 보조 치료(adjuvant therapy)를 받게 된다. 수술 후 보조 치료를 받는 환자군에서 그렇지 않은 환자군보다 수술 후 불유합의 빈도가 더 높은 것으로 알려져 있다.18) 이는 수술 후 보조 치료 목적으로 투여하는 다수의 항암제가 매우 독성이 강해 세포의 분화, 신생골 형성을 방해하기 때문에 불유합의 빈도가 높다고 해석할 수 있다. 또한 수술 후 항암 요법이 끝난 후에도 항암 화학 약제가 체내에서 대사되지 않고 장시간 체류하면서 지속적인 영향을 미치고 있다. 이러한 항암 화학 요법의 문제점은 수술 후 감염과도 연관이 있을 것이다.
동종골 불유합에 영향을 미치는 그 외 요인으로는 숙주골의 절제연과 이식된 동종골의 견고하고 넓은 접촉이 있다. 저자들이 경험한 좌측 대퇴골의 악성 골육종으로 진단받은 24세 남자 환자의 경우 동종골 불유합과 금속 내고정물 파손이 동시에 발생하였다(Fig. 1). 이 환자의 일차 수술 후 단순 방사선 사진을 보면 숙주골-동종골의 근위 경계 부위에 완전히 접촉되지 않은 간격(gap)을 볼 수 있으며, 이 후 추시 기간 중 이 부위에서 불유합과 금속 내고정물 파손이 발생하였다. 반면, 숙주골과 이식된 동종골 사이에 간격 없이 견고하고 넓은 접촉을 보인 원위 경계 부위는 추시 기간 중 양호한 유합을 얻을 수 있었다. 동종골 불유합은 금속 내고정물 파손과도 밀접한 관계가 있다. 이는 불유합 부위에 과도한 스트레스가 집중되면서 동시에 금속 내고정물을 약화시켰기 때문에 금속 내고정물 파손이 발생한 것으로 이해할 수 있다.
숙주골-동종골 사이의 유합률을 높이기 위해서 저자들이 경험한 또 다른 증례를 들어 보겠다. 우측 경골 간부에 발생한 1예의 법랑종 환자의 경우 경골 간부 전방 피질골 내에 국한된 병변으로 반 피질골 절제술(hemicortical resection) 후 같은 크기의 반 피질 동종골 이식편을 이용하여 재건술을 시행하였다. 숙주골의 반 피질골 절제술한 크기와 반 피질 동종골 이식편의 크기가 거의 일치하여 동종골 이식술 후 숙주골-동종골의 경계 부위 간격이 없이 재건술을 시행하였다. 이 증례의 경우 매우 견고한 숙주골-동종골 유합을 얻을 수 있었다(Fig. 2).
Jeon 등25)의 연구에 의하면 동종골과 숙주골 사이의 접촉면을 최대화 하기 위해 동종골의 단면 지름이 숙주골의 단면 지름보다 넓은 것을 사용하여 이식하는 circumferential overlapping법 또는 이식할 동종골에 tong-like sleeve를 만들어 이식하는 partial overlapping 법으로 동종골 이식률을 획기적으로 높였다.
일반적으로 다발성 골수종은 항암 치료 및 방사선 치료에 반응을 잘하는 종양으로 알려져 있으나 저자들이 경험한 2예의 다발성 골수종 환자의 수술 전 평가에서 2예 모두 우측 상완골 및 좌측 대퇴골 단일 골에만 다발성 골수종이 발생한 경우로 수술 시 광범위 절제술을 결정하고, 이 중 우측 상완골의 다발성 골수종으로 진단 받은 62세 여자 환자는 Jeon 등25)의 연구에서 소개한 수술 방법으로 숙주골-동종골 사이의 견고한 유합을 얻은 바 있다(Fig. 3).
저자들이 경험한 3예의 불유합 환자 중 2예에서 동종골 불유합 부위에 자가골 이식술 및 반 피질골 동종골 이식편을 불유합 부위에 얹고 금속 케이블로 고정하는 방법으로 불유합 부위의 보강술을 시행하였다. 이 수술 방법은 Judas 등26)이 인공 고관절 치환술 환자의 대퇴 스템 주위 골절 또는 대퇴 스템의 무균성 해리 등으로 인해 재수술이 필요한 경우 시행한 방법으로 동종골 이식편이 매우 유용한 생물학적, 역학적 지지를 해준다고 보고한 바 있다. 저자들이 재수술을 시행한 2예의 동종골 불유합 환자에서도 재수술 후 동종골 유합으로 불안정성을 극복할 수 있었다.
악성 골종양의 수술적 치료에서 종양 부위의 광범위 절제술 후 시행한 동종골 이식술은 매우 유용한 수술 방법 중 하나이다. 그러나 숙주골-동종골 불유합 발생 가능성이 높다는 것을 반드시 염두에 두어야 한다. 숙주골-동종골 사이의 유합률을 높이기 위해서는 이식된 동종골과 숙주골 사이의 간격이 없는 견고한 접촉이 매우 중요할 것으로 판단되었다. 동종골 불유합 발생 시 불유합 부위에 반 피질골 동종골 이식편을 이용한 불유합 부위 보강술은 이를 극복할 수 있는 유용한 수술 방법으로 생각된다. 본 연구의 결정적인 단점으로는 증례 수가 적어 통계학적 설득력이 매우 약하다는 것이다. 추후 더 많은 증례 수집이 필요할 것으로 생각된다.
Figures and Tables
 | Figure 1(A) A 24-year-old male with ovoid to round osteolytic lesion at distal one third of left femur. Osteoblastic osteosarcoma was confirmed by incisional biopsy. (B) Radiograph showing allograft reconstruction following wide resection of malignant bone tumor, then internal fixation was done with retrograde intramedullary nail. (C) Radiograph showing nonunion (arrow) at proximal host bone-allograft interface at postoperative 12 months. (D) Radiograph showing nail fracture at nonunion site (arrow) at postoperative 18 months. (E) Radiograph showing that broken nail was removed, then conversion to antegrade intramedullary nail. (F) Photograph showing hemi-cortical allograft preparation for augmentation of nonunion site. (G) Radiograph showing autologuous bone graft and hemi-cortical onlay allograft was performed for augmenting nonunion site. Complete union was obtained. |
 | Figure 2(A) A 19-year-old male with intra-cortical round lesion at anterior cortex of right tibial shaft. Adamantinoma was confirmed via incisional biopsy. (B) Intraoperative photograph showing hemi-cortical resection of tumor site. (C) Photograph showing preparation of hemi-cortical allograft with accurate size with excised tumor. (D) Radiograph showing hemi-cortical allograft reconstruction with screw fixation. (E) Radiograph showing complete and sound union at host bone-allograft interface at postoperative 12 months. |
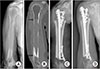 | Figure 3(A) A 62-year-old female with elongated osteolytic lesion with cortical thinning at mid shaft of right humerus. Multiple myeloma was confirmed via incisional biopsy. (B) Computered tomography scan showing elongated osteolytic lesion with cortical thinning and breakage (between two arrows). (C) Radiograph showing allograft reconstruction following wide resection of myeloma lesion, then internal fixation was done with intramedullary nail and additional plates. (D) Radiograph showing allograft was well maintained and union was obtained at both proximal and distal host bone-allograft interfaces at postoperative 12 months. |
References
1. Gitelis S, Piasecki P. Allograft prosthetic composite arthroplasty for osteosarcoma and other aggressive bone tumors. Clin Orthop Relat Res. 1991; (270):197–201.

2. Izawa H, Hachiya Y, Kawai T, et al. The effect of heat-treated human bone morphogenetic protein on clinical implantation. Clin Orthop Relat Res. 2001; (390):252–258.

3. Rougraff BT, Simon MA, Kneisl JS, Greenberg DB, Mankin HJ. Limb salvage compared with amputation for osteosarcoma of the distal end of the femur. A long-term oncological, functional, and quality-of-life study. J Bone Joint Surg Am. 1994; 76:649–656.

4. Cannon SR. Massive prostheses for malignant bone tumours of the limbs. J Bone Joint Surg Br. 1997; 79:497–506.

6. Tsuchiya H, Tomita K, Minematsu K, Mori Y, Asada N, Kitano S. Limb salvage using distraction osteogenesis. A classification of the technique. J Bone Joint Surg Br. 1997; 79:403–411.
7. Tsuchiya H, Wan SL, Sakayama K, Yamamoto N, Nishida H, Tomita K. Reconstruction using an autograft containing tumour treated by liquid nitrogen. J Bone Joint Surg Br. 2005; 87:218–225.

8. Kim KJ, Kim HS, Kang HG, et al. Reconstruction with replantation of the resected bone after low heat treatment for malignant pelvic bone tumors. J Korean Orthop Assoc. 2006; 41:519–526.

9. Han CS, Wood MB, Bishop AT, Cooney WP 3rd. Vascularized bone transfer. J Bone Joint Surg Am. 1992; 74:1441–1449.

10. Alman BA, De Bari A, Krajbich JI. Massive allografts in the treatment of osteosarcoma and Ewing sarcoma in children and adolescents. J Bone Joint Surg Am. 1995; 77:54–64.

11. Gebhardt MC, Roth YF, Mankin HJ. Osteoarticular allografts for reconstruction in the proximal part of the humerus after excision of a musculoskeletal tumor. J Bone Joint Surg Am. 1990; 72:334–345.

12. Chen TH, Chen WM, Huang CK. Reconstruction after intercalary resection of malignant bone tumours: comparison between segmental allograft and extracorporeally-irradiated autograft. J Bone Joint Surg Br. 2005; 87:704–709.
13. Ehara S, Nishida J, Shiraishi H, Tamakawa Y. Pasteurized intercalary autogenous bone graft: radiographic and scintigraphic features. Skeletal Radiol. 2000; 29:335–339.

14. Manabe J, Ahmed AR, Kawaguchi N, Matsumoto S, Kuroda H. Pasteurized autologous bone graft in surgery for bone and soft tissue sarcoma. Clin Orthop Relat Res. 2004; (419):258–266.

15. Rong Y, Sato K, Sugiura H, et al. Effect of elevated temperature on experimental swarm rat chondrosarcoma. Clin Orthop Relat Res. 1995; (311):227–231.
16. Aho AJ, Ekfors T, Dean PB, Aro HT, Ahonen A, Nikkanen V. Incorporation and clinical results of large allografts of the extremities and pelvis. Clin Orthop Relat Res. 1994; (307):200–213.
17. Asada N, Tsuchiya H, Kitaoka K, Mori Y, Tomita K. Massive autoclaved allografts and autografts for limb salvage surgery. A 1-8 year follow-up of 23 patients. Acta Orthop Scand. 1997; 68:392–395.
18. Hornicek FJ, Gebhardt MC, Tomford WW, et al. Factors affecting nonunion of the allograft-host junction. Clin Orthop Relat Res. 2001; (382):87–98.

19. Ortiz-Cruz E, Gebhardt MC, Jennings LC, Springfield DS, Mankin HJ. The results of transplantation of intercalary allografts after resection of tumors. A long-term follow-up study. J Bone Joint Surg Am. 1997; 79:97–106.

20. Enneking WF, Dunham W, Gebhardt MC, Malawar M, Pritchard DJ. A system for the functional evaluation of reconstructive procedures after surgical treatment of tumors of the musculoskeletal system. Clin Orthop Relat Res. 1993; (286):241–246.

21. Brien EW, Terek RM, Healey JH, Lane JM. Allograft reconstruction after proximal tibial resection for bone tumors. An analysis of function and outcome comparing allograft and prosthetic reconstructions. Clin Orthop Relat Res. 1994; (303):116–127.
22. Gebhardt MC, Flugstad DI, Springfield DS, Mankin HJ. The use of bone allografts for limb salvage in high-grade extremity osteosarcoma. Clin Orthop Relat Res. 1991; (270):181–196.

23. Mnaymneh W, Malinin TI, Lackman RD, Hornicek FJ, Ghandur-Mnaymneh L. Massive distal femoral osteoarticular allografts after resection of bone tumors. Clin Orthop Relat Res. 1994; (303):103–115.

24. Mankin HJ, Gebhardt MC, Jennings LC, Springfield DS, Tomford WW. Long-term results of allograft replacement in the management of bone tumors. Clin Orthop Relat Res. 1996; (324):86–97.

25. Jeon DG, Song WS, Cho WH, et al. Overlapping allograft for primary or salvage bone tumor reconstruction. J Surg Oncol. 2014; 110:366–371.

26. Judas F, Saavedra MJ, Mendes AF, Dias R. Cortical strut allografting in reconstructive orthopaedic surgery. Acta Reumatol Port. 2011; 36:24–28.




 PDF
PDF ePub
ePub Citation
Citation Print
Print




 XML Download
XML Download