Abstract
Non-steroidal anti-inflammatory drugs (NSAIDs) are commonly used in various clinical situations, with excellent analgesic, anti-pyretic and anti-inflammatory effects. In addition to gastrointestinal bleeding, which was the first adverse effect to be reported, myriad adverse effects from the digestive system, cardiovascular system, renal system and hematology have been also reported. In early 2000s, a few new cyclooxygenase (COX)-2 selective inhibitors were developed with the expectation of better gastrointestinal safety profile, most of them were withdrawn from the market due to various adverse effects, and interest in safety of NSAIDs has been increased again. Over the past two decades, research on the safety and adverse effects of NSAIDs has accumulated. In brief, celecoxib is associated with fewer gastrointestinal adverse events compared to non-selective NSAIDs. In patients receiving aspirin, the use of non-selective NSAIDs should be avoided, and if an anti-inflammatory drug is required, a COX-2 selective inhibitor should be considered. Celecoxib has been shown to have similar or better safety profile than other non-selective COX inhibitors. Additionally, the new COX-2 selective inhibitors of etorixocib and polmacoxib have been approved. Many factors should be considered when prescribing NSAIDs, as the safety profile of indivisual NSAIDs vary, and NSAIDs have a high risk of duplicate prescription because of the variety of indications and over-the-counter products. Physicians should comprehend the updated guidelines and the results of new clinical studies, and the risk factors for each individual patient should also be reviewed. Physicians should therefore contemplate new prescription strategies.
비스테로이드소염제(non-steroidal anti-inflammatory drug, NSAID)는 진통, 소염, 해열에 흔히 사용되는 약물이다. 1899년 Aspirin이 처음 판매되기 시작한 이래 현재까지 NSAID는 세계적으로 가장 많이 처방되는 약제로 일부 NSAID는 약국에서 의사의 별도 처방 없이 구매할 수 있으며, 경구약, 주사제, 외용제 등 다양한 제형으로 일상에서 널리 사용되고 있다.
1937년도 처음 위장관 출혈 및 위궤양의 부작용이 보고되었으며, 이후 소화기계, 심혈관계, 신요로계, 혈액학계에 걸친 다양한 부작용이 보고되고 있다. 특히 2004년 rofecoxib이 심혈관계 부작용에 대한 위험으로 품목 허가를 취하한 이래 NSAID의 안정성에 대한 관심이 더욱 증대되고 있다.
현재 사용되고 있는 NSAID는 무척 다양하며 각 환자별 약물 부작용에 대한 위험요소 역시 다양하므로 각 약물의 특성 및 환자의 위험요인을 모두 고려하여 NSAID를 적절하게 사용하는 것 역시 중요하다. 본 논문에서는 NSAID의 작용 기전 및 부작용, cyclooxygenase (COX)-2 선택적 NSAID 및 NSAID 선택에 대한 최근 가이드라인에 대해 정리하였다.
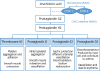
NSAID는 COX를 억제함으로써 arachidonic acid로부터 prostaglandin (PG)의 합성을 감소시킨다. PG는 다시 thromboxane, prostacycline 등으로 변화하여 혈관 확장, 혈소판 응집 등을 촉진하는데 NSAID는 이를 저해함으로써 해열, 진통, 소염 효과 및 혈관조절, 혈소판 기능조절 등의 다양한 임상적 유용성을 나타낸다(Figure 1).
이러한 COX는 COX-1, COX-2, COX-3 등으로 나뉘며, 인간에서는 COX-1 및 COX-2가 존재하는 것으로 알려져 있다. COX-1은 대부분의 세포에서 기본적으로 발현되며, 위장 점막 보호, 신장 혈류 유지, 혈소판 활성 조절과 같은 항상성 유지를 위한 prostanoids를 생성한다. 반면, COX-2는 유해 반응에 의해 염증조직 및 암조직에서 국소적으로 빠르게 유도되어 bradykinin 및 histamine 등의 생성을 촉진하여 혈관 확장 등 염증반응을 일으킨다.
NSAID는 흔히 salicylic acid 유도체, 비선택적 NSAID, COX-2 선택적 NSAID로 분류하며, COX 선택성에 따라 COX-2 부분-선택적 NSAID 및 COX-2 선택적 NSAID 등으로 분류하기도 한다. 대부분의 NSAID는 COX를 가역적으로 억제하지만, salicylic acid 유도체는 혈소판의 COX-1을 아세틸화시켜 비가역적으로 작용을 억제한다.
NSAID의 진통, 해열, 소염 효과는 대부분 염증 조직의 COX-2를 저해함으로써 나타나지만, 아직까지 특정 prostanoid pathway를 선택적으로 조절할 수 있는 NSAID는 개발되지 않은 상태로 NSAID는 다양한 prostanoid pathway 억제와 관련된 다양한 부작용을 나타낸다.
NSAID의 진통, 해열·소염 작용은 대부분 COX-2를 억제함으로써 나타나고, 또한 COX-1의 저해는 소화성궤양의 위험을 높이며 출혈 경향을 높인다. 따라서 COX-2 선택적 NSAID는 위장관계 안정성에 대한 기대와 함께 활발히 개발되어 왔고, celecoxib, rofecoxib, valdecoxib, parecoxib, lumiracoxib, etoricoxib의 6가지 악물이 개발되었으며 celecoxib, rofecoxib, valdecoxib 3가지 약물이 1998년부터 2001년에 걸쳐 미국 식품의약국 승인을 획득하였다.
그러나 2004년 rofecoxib의 사용으로 인한 심혈관질환의 발생 증가가 확인되어 rofecoxib은 품목허가를 취소하였다. 2005년 valdecoxib 역시 피부 부작용 및 심혈관계질환 발생으로 인하여 품목허가를 철수하였고, parecoxib 역시 심혈관계 부작용에 대한 우려로 품목허가를 철수하였다. Lumiracoxib은 2006년 유럽에서 승인되었으나 간독성으로 인해 2007년 캐나다, 호주, 뉴질랜드 등에서 철수하였고, 미국에서는 아직까지 승인되지 못하고 있다.
우리나라에서는 2014년 12월 etoricoxib, 2015년 2월 pomacoxib이 승인되어, 2000년 6월 COX-2 선택적 NSAID로는 처음으로 승인된 celecoxib과 함께 현재 우리나라에서는 총 3가지의 COX-2 선택적 NSAID를 사용할 수 있다. 다만 etoricoxib은 2007년 유럽에서는 승인되었으나 미국에서 는 아직까지 승인되지 못하고 있으며, 국내에서도 비교적 낮은 용량(30 mg 1회)으로 골관절염 환자에게서만 승인되었다. Polmacoxib은 현재까지 국내에서만 승인된 약물로 대규모 안전성 연구는 아직 수행되지 못한 상태이다.
COX-2 선택적 NSAID에서 심혈관계 합병증의 위험이 강력하게 나타나는 이유는 혈소판과 혈관내피세포에서 COX의 분포가 다른 것과 연관이 있다. 혈소판은 COX-1을 통해 arachronic acid를 TXA2로 전환하여 혈관 수축 및 혈소판 응집을 촉진하는 반면, 혈관내피세포는 COX-2를 통해 prostacyclin에 의한 혈관 이완을 유도한다. 따라서 COX-2 선택적 NSAID는 혈관내피세포의 COX-2를 저해해 혈관 이완은 낮추지만, 혈전을 유발하는 TXA2의 생성은 억제하지 않아 심혈관계 부작용이 발생할 수 있다. COX-2 선택적 NSAID를 사용하더라도, 많은 경우 COX-2가 억제되어 prostacyclin의 생성이 억제되면 산화질소가 상향조절되어 혈관 확장을 유지하지만, 이미 심혈관계 위험이 높은 환자에서는 혈전을 유발할 수 있다[1].
그러나 COX-2 선택적 NSAID가 비선택적 NSAID보다 위장관계 부작용의 위험도가 낮다는 강점은 명백하다. 또한 현재 사용되고 있는 COX-2 선택적 NSAID는 비선택적 NSAID보다 심혈관계 위험도가 높지 않은 것으로 여겨지고 있다. 2013년 수행된 대규모 메타분석에서, COX-2 선택적 NSAID 사용군의 상부 위장관 부작용의 risk ratio는 위약에 비해서는 높게(relative risk [RR] 1.81, 95% confidence interval [CI] 1.17–2.81) 나타났으나, naproxen에 비해서는 낮게(RR 0.37, 95% CI 0.28–0.49) 나타났다[2]. 심혈관계 부작용 역시 위약(RR 1.37, CI 1.14–1.66) 및 naproxen (RR 1.49, CI 1.16–1.92)보다는 높았으나 diclofenac 및 ibuprofen과는 유의한 차이를 보이지 않았다[2]. 또한 아스피린과 NSAID를 함께 처방할 경우, COX-2 선택적 NSAID는 아스피린의 치료효과에 영향을 주지 않는데 비해 비선택적 NSAID는 아스피린의 혈소판 응집 저하능을 약화시킬 수 있어, 2011년 Canadian Society의 가이드라인에서는 아스피린 복용자에서는 오히려 COX-2 선택적 NSAID를 처방하도록 권고하고 있다[3]. 따라서 각 NSAID 선택 시 환자별 위험요소들을 충분히 고려하는 것이 중요하겠다.
NSAID의 다양한 부작용 중 많은 부분은 PG 및 prosta-cyclin의 생성을 억제되는 것에서 기인한다. NSAID의 위장관계 부작용 및, COX-2 선택적 NSAID가 위장관계 부작용을 낮춘다는 것은 이미 잘 알려져 있으므로 간단히 언급하고, 본 논문에서는 NSAID의 심혈관계 및 신장계 부작용에 대하여 조금 더 자세히 정리하였다.
NSAID의 부작용 중 가장 흔한 것은 위장관계 부작용이다. NSAID를 복용하는 환자의 40%에서 복통, 소화불량, 가슴 쓰림 등과 같은 위장관 증상이 동반되며[4], 소화성 궤양, 천공, 출혈 등의 합병증까지 나타날 수 있고 특히 이러한 합병증은 사망의 원인이 될 수 있으므로 위장관계 독성은 NSAID의 위험성을 평가하는데 매우 중요한 1차 고려요소가 된다.
이러한 부작용의 발병기전으로는 크게 3가지가 알려져 있다. 첫째로, NSAID가 COX-1를 저해해 PGE2의 생성이 감소함으로써 위 점막 세포의 증식이 억제되고, 점막 혈류가 감소하며, 중탄산염 생성이 억제되는 등 다양한 위점막 보호기능이 전반적으로 약화된다. 둘째로, NSAID에 의해 COX-1이 억제되며 5-lipoxygenase가 활성화되어 leukotriene 등의 생산이 촉진된다. 셋째로, NSAID는 점막 세포의 직접적 괴사와 자멸을 유도한다.
특히 소화성궤양 및 위장관출혈에 대한 다른 위험요인이 동반되었을 때 부작용의 위험도는 대폭 상승한다. 65세 이상의 고령 환자, 이전에 소화성궤양 또는 위장관출혈의 병력이 있는 경우, 아스피린, 항혈전제 또는 스테로이드를 함께 복용하는 경우 등이 위험요인으로 알려져 있다[5]. 고용량 NSAID 및 혈중 반감기가 긴 sulidac, piroxicam, ketorolac 등의 NSAID 역시 위장관계 부작용이 더욱 높으며, 또한 Helicobacter pylori 역시 NSAID의 위장관계 부작용을 증가시키는 독립적 위험요인으로 기능한다[6].
이 외 COX-2 선택적 NSAID의 경우 비선택적 NSAID에 비하여 위장관계 부작용의 위험이 낮으며, 비선택적 NSAID 중에서도 nabumetone, meloxicam, etodolac 등 COX-2 부분-선택적 NSAID는 위장관계 부작용이 낮은 것으로 나타났다. 최근에는 NSAID의 하부 위장관에 대한 관심 역시 높아지고 있다. 특히 NSAID induced enteropathy는 프로톤펌프억제제 사용으로 충분히 예방되지 않기 때문에 COX-2 선택적 NSAID가 비선택성 NSAID보다는 안정성 면에서 우수할 것으로 여겨지고 있으나 추가적 연구가 필요하다[7].
아스피린은 COX-1을 선택적, 비가역적으로 저해함으로써 TXA2에 의한 혈소판 응집을 억제한다. 혈소판은 핵이 없는 세포로 새로운 단백질을 합성할 수 없으므로, 하루 100 mg의 저용량 아스피린을 복용하면 기타 다른 세포의 COX-1 기능에는 유의미한 변화를 초래하지 않으며 새로이 생성되는 혈소판의 COX-1은 충분히 저해할 수 있다. 따라서 저용량 아스피린(100 mg/day)은 심혈관계 부작용 발생 예방을 위해 현재 흔히 사용되고 있다.
아스피린 외 다른 NSAID 역시 혈소판의 COX-1을 저해함으로써 혈소판 기능이상을 유발할 수도 있으나, 아스피린처럼 COX를 비가역적으로 억제하는 것이 아니므로 약물 반감기가 지난 후에는 COX 기능이 정상화된다. 뿐만 아니라, ibuprofen, indomethacin 등의 NSAID를 아스피린과 함께 복용할 경우, 혈소판의 COX를 경쟁적으로 저해해 도리어 아스피린의 혈소판 응집 억제능을 약화시킨다. 반면, COX-2에 선택성이 있는 celecoxib의 경우 아스피린과 함께 복용하더라도 아스피린의 혈소판 응집 억제능을 약화시키지 않는다[8].
혈관 내피 세포는 혈관 확장에 필요한 다양한 prostacyclin을 합성하고 있다. 그러나 언제 어떤 COX가 기능하는지 및 다양한 NSAID가 혈관 확장에 각각 어떠한 영향을 미치는지는 아직 다 밝혀지지는 않았다. COX-2 선택적 억제제를 복용한 건강한 성인에서 thromboxane 외 다른 prostacyclin은 모두 감소한다는 결과가 알려진 후, COX-2가 특히 혈관 유지에 중요할 것으로 생각되었다. 그러나 이후의 연구들에서는 COX-1 역시 혈관 확장에서 중요한 역할을 하며, COX-2는 혈관 확장뿐 아니라 동맥경화의 발생에도 영향을 줄 것으로 여겨지고 있다[9].
2000년대 초반, COX-2 선택적 NSAID의 다른 치료효과를 검증하기 위한 대규모 위약대조 임상시험이 진행되었다. 대장 용종의 병력이 있던 환자에서 대장암의 발생 위험을 낮출 수 있을지 확인하기 위해 Adenomatous Polyp Prevention on Vioxx (APPROVe) study (rofecoxib 25 mg/day), Adenoma Prevention with Celecoxib (APC) study (cele-coxib 400 mg or 800 mg/day), Prevention of Colorectal Sporadic Adenomatous Polyps (PreSAP) study (celecoxib 400 mg/day)에서 COX-2 선택적 NSAID와 위약을 비교하였다[101112]. Alzheimer's Disease Anti-inflammatory Prevention Trial (ADAPT)에서는 알츠하이머병의 가족력이 있는 고령 환자에서 celecoxib 400 mg/day, naproxen 440 mg/day와 위약을 비교하였다[13]. 그러나 2005년, APPROVe study와 APC study의 COX-2 선택적 NSAID 사용군이 심혈관계 부작용 및 이로 인한 사망률이 높다는 결과가 보고되었고, 이후 4개의 임상연구는 모두 중단되었다.
APPROVe study에서는 rofecoxib 사용군에서 혈전·색전 관련 부작용이 높았고(RR 1.92, 95% CI 1.19-3.11) [10], APC 연구에서는 celecoxib 800 mg/day (hazard ratio [HR] 3.4, 95% CI 1.4–8.5)가 celecoxib 400 mg/day (HR 2.8, 95% CI 1.7–7.2)보다 위험도가 더 높았다[11]. ADAPT 연구는 앞의 3가지 연구보다 더 고령 환자에서(연령 중앙값 74세) 시행되었는데, celecoxib 400 mg/day에서는 위험도의 차이가 나타나지 않았으나(RR 1.1, 95% CI 0.67–1.79) naproxen 440 mg/day에서 위험도가 높아져(RR 1.63, 95% CI 1.04–2.55) 비선택적 NSAID 역시 심혈관계 부작용의 위험을 높일 수 있다는 것이 확인되었다[13].
이후 COX-2 선택적 NSAID와 naproxen, ibuprofen, diclofenac 등 다른 NSAID 간의 심혈관계 위험률을 비교한 임상연구 역시 수행되었다. 2000년 Celecoxib Long-term Arthritis Safety Study (CLASS)에서 류마티스관절염 및 골관절염 환자를 대상으로 celecoxib 800 mg, ibuprofen 2,400 mg, diclofenac 150 mg의 심혈관계 합병증을 비교해 celecoxib과 다른 NSAID간 위험률 차이는 없다고 보고하였다(RR 1.1, 95% CI 0.7–1.6) [14]. 2006년 수행된 무작위배정연구인 Multinational Etoricoxib versus Diclofenac Arthritis Long-term study (MEDAL)에서는, 역시 etorixocib 60 mg 또는 90 mg과 diclofenac 150 mg의 심혈관계 합병증 위험률 차이가 없다고 보고하였다(HR 0.96, 95% CI 0.79–1.16) [15].
NSAID의 심혈관계 합병증에 대한 영향을 비교한 메타분석 역시 시행되었다. 2013년 시행된 대규모 메타분석에서는 474개의 연구에서 NSAID의 심혈관계 합병증에 대한 위험률을 분석하였는데, ibuprofen과 naproxen은 위약과 위험률 차이가 없었으나 diclofenac은 위약에 비해 위험률이 높게 나타났다(RR 1.22, 95% CI 0.78–1.93) [2]. Celecoxib의 경우, celecoxib 200 mg, 400 mg는 위약과 위험률 차이가 없었고, 치료용량 이상인 800 mg을 사용한 경우에만 위약보다 심혈관계 위험률이 상승하였다[2].
2017년 우리나라 류마티스관절염 환자를 대상으로 NSAID의 사용과 심혈관계 부작용의 발생 위험도를 파악한 연구 역시 발표되었다. 국민건강보험공단 청구자료를 이용하여 심혈관계 합병증(관상동맥질환, 출혈성 뇌졸중, 허혈성 뇌졸중, 말초혈관질환) 발생의 odds ratio (OR)를 분석한 연구결과로, 전체 NSAID 사용군의 심혈관계 합병증 발생의 OR은 1.32 (95% CI 1.22–1.41), COX-2 선택적 NSAID 사용군에서는 1.31 (95% CI 1.18–1.45)로 나타났다[16].
최근의 연구에서는, COX-2 선택적 억제제가 비선택적 NSAID보다 심혈관계 부작용에서 안전하다는 연구결과도 발표되고 있다. 대만에서 청구자료를 이용하여 류마티스관절염 환자에서 NSAID와 급성심근경색, 그리고 뇌졸중의 위험을 분석한 연구결과가 2018년 발표되었는데, 비선택적 NSAID는 뇌졸중(OR 1.39, 95% CI 1.25–1.55) 및 급성심근경색(OR 1.82, 95% CI 1.37–2.41)의 위험을 높였으나 COX-2 선택적 NSAID는 위험도를 높이지 않았다[17].
신장에는 COX-1와 COX-2가 모두 존재하며, PG에 의한 혈관 확장을 조절하는 역할을 한다. PGE2는 원위세뇨관에서 나트륨 재흡수를 담당하고, PGE2와 PGI2는 레인-안지오텐신 시스템을 활성화시켜 포타슘 배설을 담당한다. 정상 콩팥에서는 신기능 유지에 있어 PG가 필수적인 역할을 하지는 않으나, 신기능이 저하되거나, 고령, 심부전 환자, 탈수 상황 등 신혈관 수축이 일어나는 상황에서는 PG 합성이 증가함으로써 신혈류 및 사구제 여과율을 보존한다. 만약 이러한 상태에서 NSAID를 사용할 경우 PG 합성이 저해되며 신혈류를 감소시키고, 사구체여과율을 감소시키며, 체액 저류 및 혈압 상승을 유발한다[18].
신장 조직 내에서 COX가 어떻게 분포하는지는 아직 확실하게 다 알려져 있지는 않다. 그러나 COX-1은 토리 혈관, 집합관, 간질 세포 등에 주로 존재해 신혈류 유지 및 사구체 여과율 보존을 담당한다. COX-2는 치밀반, 수지상세포, 신혈관 등에 주로 분포하며 수분 및 나트륨의 배설에 조절하는 것으로 생각된다.
건강한 고령 환자를 대상으로 매일 celecoxib 400 mg 또는 naproxen 1 g을 복용하며 사구체여과율의 변화를 비교한 연구에서, naproxen 사용군 및 celecoxib 사용군에서 사구체여과율이 각각 5.31 mg/min/1.73 m2, 0.86 mg/min/1.73 m2 감소하였고, 소변내 나트륨 배설량 역시 감소했다[19].
NSAID의 종류에 따른 고혈압 발생률을 비교한 연구 역시 수행되었다. 매일 celecoxib 800 mg, ibuprofen 2,400 mg, diclofenac 150 mg 사용한 환자를 비교한 연구에서, ibu-profen 사용 환자에서 새로이 고혈압 약제를 사용할 확률이 유의하게 높았다[20]. 2006년 114개의 임상연구를 비교한 대규모 메타분석에서는 celecoxib 사용군이 위약 및 다른 NSAID에 비하여 고혈압(RR 0.83, 95% CI 0.71–0.97) 및 신기능 저하(RR 0.61 0.40–0094)의 위험이 더 낮은 것으로 나타났으며 특히 rofecoxib 사용군에서 고혈압, 신기능 저하 위험이 높은 것으로 나타났다[21]. 2009년의 다른 메타분석에서는, celecoxib은 비선택적 NSAID에 비해 고혈압 발생 위험을 높이지 않았으나(RR 0.89, 95% CI 0.77–1.01), rofecoxib (RR 1.53, 95% CI 1.34–1.75)과 etoricoxib (RR 1.52, 95% CI 1.39–1.66)에서는 고혈압의 발병위험이 높은 것으로 나타났다[22].
NSAID로 인한 간독성은 다양하게 나타날 수 있다. 예전부터 NSAID의 간독성에 대한 보고가 있었지만, lumiracoxib이 중대한 간독성이 발생하여 결국 2007년 시장에서 퇴출된 이후 COX-2 선택적 억제제의 간독성에 대한 연구 역시 많이 이루어졌다. 특히 COX-2 및 COX-2에 의해 생성되는 PGE2 역시 간독성 약물에 의한 간괴사 과정에서 간세포 보호해 중요한 역할을 할 것으로 여겨지므로 특히 COX-2 선택적 억제제의 안정성에 대한 관심이 증대되었다.
2009년 류마티스관절염 또는 골관절염 환자에서 NSAID를 사용한 132개의 무작위임상시험을 이용하여 NSAID의 간독성에 대한 메타분석을 시행하였다. 그 결과 diclofenac 및 rofecoxib의 경우 다른 NSAID군에 비해 트랜스아민효소가 정상 상한의 3배 이상으로 상승한 환자가 많았으나, 이를 제외한 다른 NSAID에서는 간독성으로 인한 약물 중지 비율이 위약과 유사하였다[23]. NSAID 약물별 부작용 발생빈도를 비교한 2013년 프랑스 연구에서는, nimesulide (OR 4.53, 95% CI 2.83–7.27)과 aceclofenac (OR 3.67, 95% CI 1.43–9.41)에서 간독성의 위험이 높은 것으로 나타났다[24]. 2016년 출판된 리뷰 논문의 전문가 의견에 따르면, NSAID의 간독성은 드물게 발생하고, COX-2 선택적 억제제의 간독성 역시 여타의 NSAID와 비슷하거나 조금 안전할 것으로 여겨진다고 하였다[25].
2002년 parecoxib 및 그 활성 대사체인 valdecoxib이 아나필락시스, 스티븐스-존슨 증후군 등 과민반응에 대한 우려로 품목 허가가 취하되었던 바 있다. 또한 NSAID는 아스피린성 천식, 스티븐스-존슨 증후군과 같은 심각한 부작용을 나타낼 수 있으므로 있으므로 약물선택 시 과민반응의 병력은 매우 중요하게 고려되어야 한다.
Celecoxib은 sulfonamide 치환기를 첨가하여 COX-1 수용체에 접근할 수 없게 만든 제제로 sulfonamide계 항생제에 과민 반응을 보였던 환자에서 금기라고 생각하기 쉬우나 실은 그렇지 않다. Sulfonamide계 항생제에 의한 과민 반응은 sulfonamide의 방향족 아민에 달린 arylamine의 대사 물질에 의해 발생하는데, celecoxib은 방향족 아민이 없어 교차 반응이 나타나지 않는다[26].
현재까지 연구 결과를 종합하면 oxicam 제제 약물이 다른 NSAID보다 피부계 부작용이 높은 것으로 여겨진다. 2006년에는 piroxicam, ketoprofen, ketorolac 성분이 다른 NSAID와 비교하여 위장관계 및 피부 관련 유해반응의 위험이 높다는 보고가 있었고, 2007년 European Medicines Agency에서는 piroxicam은 다른 NSAID보다 피부계, 위장관계 부작용의 위험이 높으므로 더 이상 통증 조절을 위한 1차 약물로 사용하지 말도록 권고하였다. 이후 2013년에도 meloxicam, piroxicam 등 oxicam 제제 약물이 다른 NSAID보다 피부계 부작용이 높다는 연구결과가 발표되었다[24].
NSAID의 안전성에 대한 연구 결과가 늘어나며 NSAID 사용에 대한 가이드라인이 여러 전문가 그룹에서 제시되었다. 최근 10년간의 가이드라인을 정리하였다.
2009년 American Journal of Gastroenterology에서는 NSAID로 인한 소화성 궤양의 예방과 관련하여 NSAID 및 위장관 보호제의 선택에 대한 가이드라인을 제안하였다. 해당 가이드라인에서는 NSAID와 연관된 소화기계 합병증의 고위험군을 이전에 위궤양, 출혈, 천공 등의 병력이 있던 환자; 65세 이상 고령 환자; 항응고제, 스테로이드, 아스피린을 함께 복용하는 환자; 고용량 NSAID를 사용하는 환자; 심혈관질환 등 다른 동반 질환을 가진 환자로 정의하였고, 헬리코박터 감염이 NSAID에 의한 소화성 궤양의 위험을 높이므로 장기간 NSAID 복용이 필요한 환자에서 헬리코박터 제균 치료를 하는 것은 도움이 될 수 있다고 제안하였다. 또한 미소프로스톨 800 mcg나 프로톤펌프억제제가 효과적으로 위궤양을 예방할 수 있으며, COX-2 선택적 NSAID를 사용하는 환자에서도 프로톤펌프억제제는 궤양 예방에 도움이 되나, H2 blocker는 궤양 예방에 도움이 되지 않는다고 하였다. COX-2 선택적 NSAID는 비선택적 NSAID에 비해 위궤양 발생을 낮추지만, 아스피린과 함께 처방할 경우에는 COX-2 선택적 NSAID가 위궤양 보호에 효과적이지 않고, 오히려 심혈관계 부작용의 위험이 높으므로 가능하면 사용하지 않도록 권고하였다.
가이드라인에서는 소화성 궤양의 위험 요인 및 아스피린 복용 여부에 따라 환자를 구분하여 약물을 선택하도록 하였는데, 특히 아스피린 복용자에서는 오직 naproxen만을 권고하고 있으며 소화성 궤양의 위험이 높으면서 아스피린을 복용하고 있는 환자에서는 NSAID를 사용하지 않도록 권고하고 있다.
심혈관계 질환이 높은 환자에서는 가능하면 NSAID를 사용하지 않도록 권고하는 것은 같으나, 만약 환자가 아스피린을 복용하고 있다면 naproxen이 아닌 COX-2 선택적 NSAID를 사용하도록 권고한다는 점에서 이전과 차이가 있다.
2012년 발표된 헬리코박터 치료에 대한 가이드라인으로 NSAID 사용자에서 헬리코박터 치료에 대한 지침이 제시되어 있다. 헬리코박터 감염이 NSAID 복용자에서 소화성 궤양의 위험을 높이고, 제균 치료를 시행할 경우 이러한 합병증의 위험이 낮아지며, 특히 이전에 위궤양이 있던 환자에서는 NSAID 사용 전 헬리코박터 제균 치료를 반드시 시행하도록 권고하였다. 그러나 이전에 이미 장기간 NSAID를 사용했던 환자에서는 제균 치료 단독만으로는 소화성 궤양의 합병증을 낮출 수 없으므로 이후에도 지속적인 프로톤펌프억제제 복용이 필요하다고 하였다. 특히 이전에 소화성 궤양이 병력이 있던 환자에서 아스피린을 유지해야 할 경우, 헬리코박터 감염 여부에 대한 검사 및 제균 치료를 시행하면 향후 위점막 보호제를 사용하지 않더라도 소화성 궤양 및 출혈의 위험을 낮출 수 있다고 하였다.
2015년 BioMedical Central에서 무릎 골관절염 환자에서 NSAID 사용에 대한 전문가 의견을 정리하였다. 이에 따르면, (1) 비선택적 NSAID와 COX-2 선택적 NSAID의 무릎 골관절염의 치료효과는 비슷하다. (2) NSAID 사용은 상, 하부 위장관계 합병증 및 이로 인한 사망 위험을 높인다. (3) NSAID 사용에 의한 하부위장관계 합병증은 프로톤펌프억제제에 의해 예방되지 않는다. (4) Celecoxib은 비선택적 NSAID에 비해 상, 하부 위장관계 합병증의 위험이 낮다. (5) Celecoxib과 저용량 아스피린의 조합은, 비선택적 NSAID와 저용량 Aspirin의 조합에 비해 상부위장관 합병증의 위험이 낮다. (6) Celecoxib의 심혈관계 부작용의 위험은 다른 비선택적 NSAID와 유사하다. (7) COX-2 선택적 NSAID는 아스피린의 혈소판 응집 저해를 약화시키지 않는다.
역시 무릎 골관절염 환자의 약물사용에 대한 가이드라인으로, paracetamol, symptomatic slow-acting drugs for osteoarthritis, glucosamine sulfate 등 1차 약제에 치료효과가 없는 환자에서 NSAID를 사용할 경우 NSAID의 사용지침이 포함되어 있다. 소화기계 합병증의 위험이 높은 환자에서는 COX-2 선택적 억제제와 프로톤펌프억제제를 선택하고 비선택적 NSAID를 피하도록 권고하고 있다. 심혈관계 합병증의 위험이 높은 환자에서는 가능하면 naproxen을 선택하고 고용량 diclofenac, 고용량 ibuprofen, COX-2 선택적 NSAID는 피하도록 권고된다. 신장계 합병증의 위험이 높은 경우에는 NSAID를 사용하지 않도록 권고되고 있다.
NSAID는 뛰어난 진통, 해열 효과 및 염증 억제 효과를 나타내는 비교적 안전한 약제로 다양한 임상상황에서 널리 이용되는 약물이다. 2000년대 초 다양한 COX-2 선택적 억제제가 심혈관계 합병증, 간독성, 심각한 과민반응 등 다양한 부작용을 이유로 시장에서 퇴출되었으나, 2014년 etoricoxib의 사용이 가능해지고, 2015년 polmacoxib의 사용이 허가되며 임상에서 선택할 수 있는 NSAID는 늘어나고 있다.
NSAID는 적응증이 다양한 만큼 중복처방의 위험이 높으며, 의사의 처방 없이도 구매가 가능한 일반의약품 제품도 있기 때문에 환자에게 NSAID를 처방할 때에는 이러한 부분을 충분히 고려해야 한다. 또한 NSAID의 부작용 및 안정성에 대한 연구결과가 쏟아지고 있으며, 이러한 연구결과와 환자 개인의 위험요인을 고려하여 적절한 약물을 선택하는 의사의 역할과 책임은 더욱 중요해질 것이다.
이 논문은 NSAID의 작용 기전 및 부작용, NSAID의 종류 및 최근 치료지침 등을 체계적으로 기술하고 있다. NSAID는 뛰어난 진통, 해열 효과 및 염증 억제 효과를 나타내어 다양한 질병에서 널리 이용되는 약물이나 전통적인 NSAID의 위장 및 간에 대한 독성과 COX-2 선택적 억제제의 심혈관계 합병증에 이르기까지 다양한 부작용을 나타내는 약제이다. 또한 NSAID는 그 종류에 따라 효과와 부작용에 차이가 있으며, 여러 질환에서 사용되어 중복 처방의 위험이 높고, 다양한 연구에서 NSAID의 안정성에 대한 상이한 결과가 보고 되며, 최근 새로운 NSAID들이 허가를 받아 기존의 약제와 비교가 어려운 상황에서 이 논문은 NSAID사용에 좋은 지침서가 될 것으로 기대된다.
[정리: 편집위원회]
Figures and Tables
References
1. Pirlamarla P, Bond RM. FDA labeling of NSAIDs: review of nonsteroidal anti-inflammatory drugs in cardiovascular disease. Trends Cardiovasc Med. 2016; 26:675–680.

2. Coxib and traditional NSAID Trialists' (CNT) Collaboration. Bhala N, Emberson J, Merhi A, Abramson S, Arber N, Baron JA, Bombardier C, Cannon C, Farkouh ME, FitzGerald GA, Goss P, Halls H, Hawk E, Hawkey C, Hennekens C, Hochberg M, Holland LE, Kearney PM, Laine L, Lanas A, Lance P, Laupacis A, Oates J, Patrono C, Schnitzer TJ, Solomon S, Tugwell P, Wilson K, Wittes J, Baigent C. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials. Lancet. 2013; 382:769–779.

3. Bell AD, Roussin A, Cartier R, Chan WS, Douketis JD, Gupta A, Kraw ME, Lindsay TF, Love MP, Pannu N, Rabasa-Lhoret R, Shuaib A, Teal P, Theroux P, Turpie AG, Welsh RC, Tanguay JF. Canadian Cardiovascular Society. The use of antiplatelet therapy in the outpatient setting: Canadian Cardiovascular Society guidelines. Can J Cardiol. 2011; 27:Suppl A. S1–S59.

4. Sostres C, Gargallo CJ, Lanas A. Nonsteroidal anti-inflammatory drugs and upper and lower gastrointestinal mucosal damage. Arthritis Res Ther. 2013; 15:Suppl 3. S3.

5. Shorr RI, Ray WA, Daugherty JR, Griffin MR. Concurrent use of nonsteroidal anti-inflammatory drugs and oral anticoagulants places elderly persons at high risk for hemorrhagic peptic ulcer disease. Arch Intern Med. 1993; 153:1665–1670.

6. Chi TY, Zhu HM, Zhang M. Risk factors associated with nonsteroidal anti-inflammatory drugs (NSAIDs)-induced gastrointestinal bleeding resulting on people over 60 years old in Beijing. Medicine (Baltimore). 2018; 97:e0665.

7. Scarpignato C, Hunt RH. Nonsteroidal antiinflammatory drug-related injury to the gastrointestinal tract: clinical picture, pathogenesis, and prevention. Gastroenterol Clin North Am. 2010; 39:433–464.

8. Lee W, Suh JW, Yang HM, Kwon DA, Cho HJ, Kang HJ, Kim HS, Oh BH. Celecoxib does not attenuate the antiplatelet effects of aspirin and clopidogrel in healthy volunteers. Korean Circ J. 2010; 40:321–327.

9. Li S, Liu B, Luo W, Zhang Y, Li H, Huang D, Zhou Y. Role of cyclooxygenase-1 and -2 in endothelium-dependent contraction of atherosclerotic mouse abdominal aortas. Clin Exp Pharmacol Physiol. 2016; 43:67–74.

10. Bresalier RS, Sandler RS, Quan H, Bolognese JA, Oxenius B, Horgan K, Lines C, Riddell R, Morton D, Lanas A, Konstam MA, Baron JA. Adenomatous Polyp Prevention on Vioxx (APPROVe) Trial Investigators. Cardiovascular events associated with rofecoxib in a colorectal adenoma chemoprevention trial. N Engl J Med. 2005; 352:1092–1102.

11. Solomon SD, McMurray JJ, Pfeffer MA, Wittes J, Fowler R, Finn P, Anderson WF, Zauber A, Hawk E, Bertagnolli M. Adenoma Prevention with Celecoxib (APC) Study Investigators. Cardiovascular risk associated with celecoxib in a clinical trial for colorectal adenoma prevention. N Engl J Med. 2005; 352:1071–1080.

12. Arber N, Eagle CJ, Spicak J, Racz I, Dite P, Hajer J, Zavoral M, Lechuga MJ, Gerletti P, Tang J, Rosenstein RB, Macdonald K, Bhadra P, Fowler R, Wittes J, Zauber AG, Solomon SD, Levin B. PreSAP Trial Investigators. Celecoxib for the prevention of colorectal adenomatous polyps. N Engl J Med. 2006; 355:885–895.

13. ADAPT Research Group. Cardiovascular and cerebrovascular events in the randomized, controlled Alzheimer's Disease Anti-Inflammatory Prevention Trial (ADAPT). PLoS Clin Trials. 2006; 1:e33.
14. White WB, Faich G, Whelton A, Maurath C, Ridge NJ, Verburg KM, Geis GS, Lefkowith JB. Comparison of thromboembolic events in patients treated with celecoxib, a cyclooxygenase-2 specific inhibitor, versus ibuprofen or diclofenac. Am J Cardiol. 2002; 89:425–430.

15. Cannon CP, Curtis SP, FitzGerald GA, Krum H, Kaur A, Bolognese JA, Reicin AS, Bombardier C, Weinblatt ME, van der Heijde D, Erdmann E, Laine L. MEDAL Steering Committee. Cardiovascular outcomes with etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long-term (MEDAL) programme: a randomised comparison. Lancet. 2006; 368:1771–1781.

16. Cho SK, Kim D, Won S, Lee J, Park B, Jang EJ, Bae SC, Sung YK. Impact of anti-rheumatic treatment on cardiovascular risk in Asian patients with rheumatoid arthritis. Semin Arthritis Rheu. 2018; 47:501–506.

17. Chen YR, Hsieh FI, Chang CC, Chi NF, Wu HC, Chiou HY. Effect on risk of stroke and acute myocardial infarction of nonselective nonsteroidal anti-inflammatory drugs in patients with rheumatoid arthritis. Am J Cardiol. 2018; 121:1271–1277.

18. Sica DS, Schoolwerth AC, Gehr TW. Pharmacotherapy in congestive heart failure: COX-2 inhibition: a cautionary note in congestive heart failure. Congest Heart Fail. 2000; 6:272–276.
19. Whelton A, Schulman G, Wallemark C, Drower EJ, Isakson PC, Verburg KM, Geis GS. Effects of celecoxib and naproxen on renal function in the elderly. Arch Intern Med. 2000; 160:1465–1470.

20. Whelton A, Lefkowith JL, West CR, Verburg KM. Cardiorenal effects of celecoxib as compared with the nonsteroidal anti-inflammatory drugs diclofenac and ibuprofen. Kidney Int. 2006; 70:1495–1502.

21. Zhang J, Ding EL, Song Y. Adverse effects of cyclooxygenase 2 inhibitors on renal and arrhythmia events: meta-analysis of randomized trials. JAMA. 2006; 296:1619–1632.

22. Chan CC, Reid CM, Aw TJ, Liew D, Haas SJ, Krum H. Do COX-2 inhibitors raise blood pressure more than nonselective NSAIDs and placebo? An updated meta-analysis. J Hypertens. 2009; 27:2332–2341.

23. Rostom A, Goldkind L, Laine L. Nonsteroidal anti-inflammatory drugs and hepatic toxicity: a systematic review of randomized controlled trials in arthritis patients. Clin Gastroenterol Hepatol. 2005; 3:489–498.

24. Lapeyre-Mestre M, Grolleau S, Montastruc JL. Association Francaise des Centres Regionaux de Pharmacovigilance (CRPV). Adverse drug reactions associated with the use of NSAIDs: a case/noncase analysis of spontaneous reports from the French pharmacovigilance database 2002-2006. Fundam Clin Pharmacol. 2013; 27:223–230.

25. Bessone F, Hernandez N, Roma MG, Ridruejo E, Mendizabal M, Medina-Caliz I, Robles-Diaz M, Lucena MI, Andrade RJ. Hepatotoxicity induced by coxibs: how concerned should we be? Expert Opin Drug Saf. 2016; 15:1463–1475.

26. Knowles S, Shapiro L, Shear NH. Should celecoxib be con-traindicated in patients who are allergic to sulfonamides? Revisiting the meaning of ‘sulfa’ allergy. Drug Saf. 2001; 24:239–247.

27. Lanza FL, Chan FK, Quigley EM. Practice Parameters Committee of the American College of Gastroenterology. Guidelines for prevention of NSAID-related ulcer complications. Am J Gastroenterol. 2009; 104:728–738.

28. Malfertheiner P, Megraud F, O'Morain CA, Atherton J, Axon AT, Bazzoli F, Gensini GF, Gisbert JP, Graham DY, Rokkas T, El-Omar EM, Kuipers EJ. European Helicobacter Study Group. Management of helicobacter pylori infection: the Maastricht IV/ Florence Consensus Report. Gut. 2012; 61:646–664.

29. Scarpignato C, Lanas A, Blandizzi C, Lems WF, Hermann M, Hunt RH. International NSAID Consensus Group. Safe prescribing of non-steroidal anti-inflammatory drugs in patients with osteoarthritis: an expert consensus addressing benefits as well as gastrointestinal and cardiovascular risks. BMC Med. 2015; 13:55.

30. Bruyere O, Cooper C, Pelletier JP, Maheu E, Rannou F, Branco J, Luisa Brandi M, Kanis JA, Altman RD, Hochberg MC, Martel-Pelletier J, Reginster JY. A consensus statement on the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) algorithm for the management of knee osteoarthritis-from evidence-based medicine to the real-life setting. Semin Arthritis Rheum. 2016; 45:4 Suppl. S3–S11.




 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download