Abstract
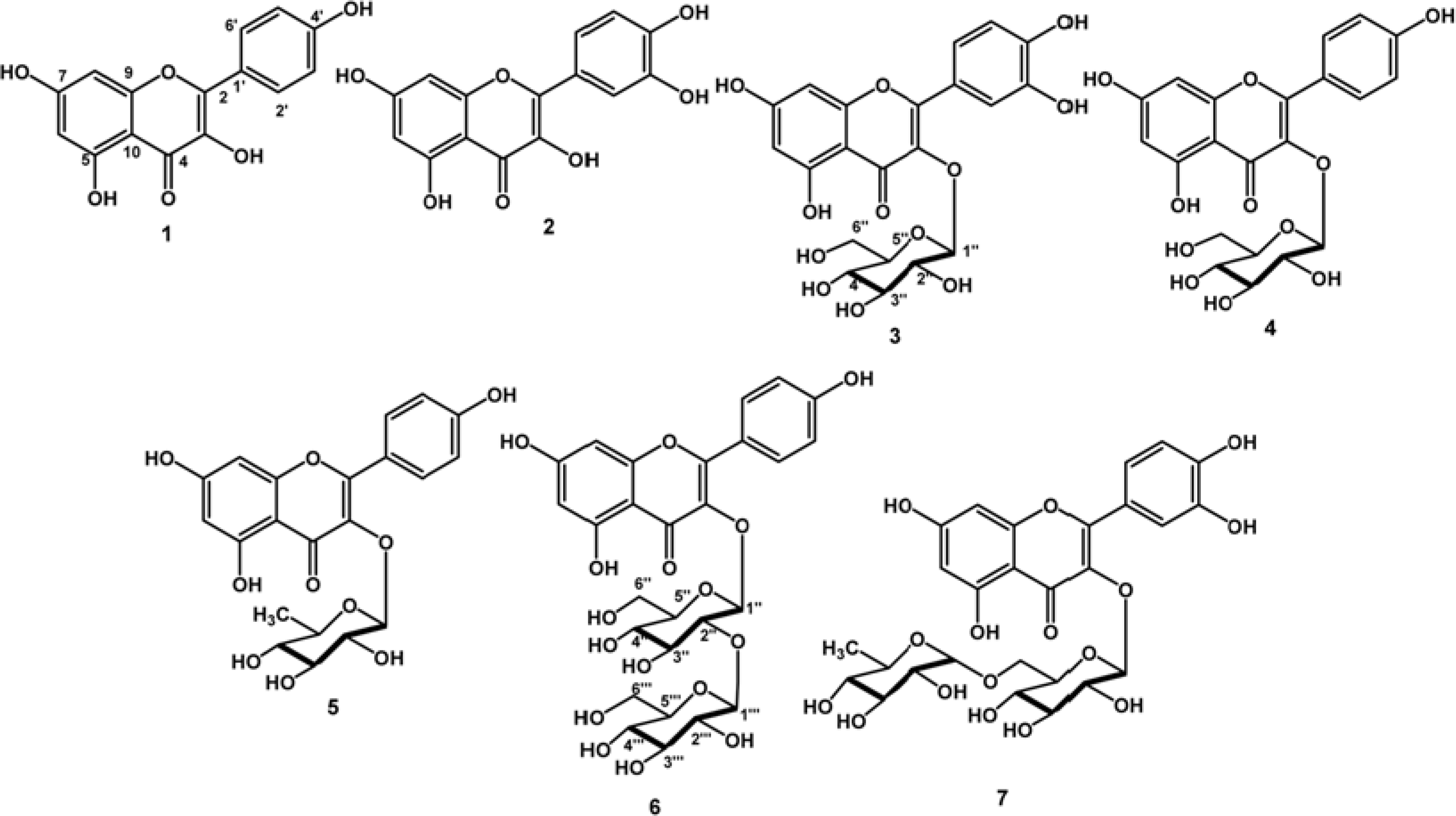
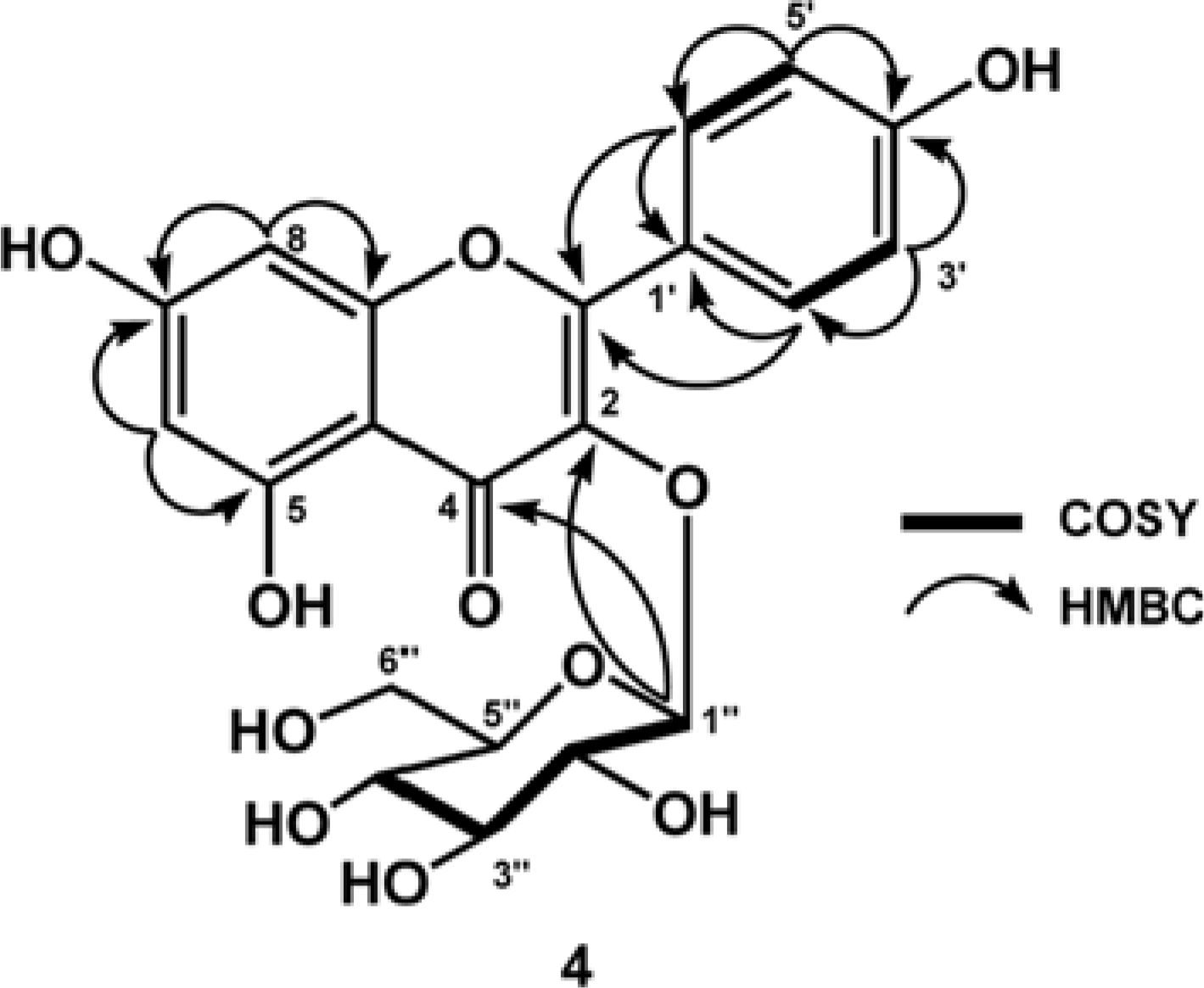
Seven flavonoid compounds, kaempferol (1), quercetin (2), quercetin-3-O-β-D-glucopyranoside (3), kaempferol-3-O-β-D-glucopyranoside (4), kaempferol-3-O-α-L-rhamnoside (5), quercetin-3-O-sophoroside (6) and quercetin-3-O-rutinoside (7), were isolated from the methanolic extract of leaves of Kalanchoe prolifera. Compounds 1–7 were isolated for first time from this plant. These compounds were evaluated their cytotoxic activity against P-388 murine leukimia cells in vitro. Among those compounds kaempferol (1) and quercetin (2) showed strongest cytotoxic activity with IC50 values of 4.45 ± 0.05 and 6.28 ± 0.02 μg/mL, respectively.
Go to : 
References
(1). Heyne K.The useful Indonesian plants: Research and Development Agency; Ministry of Forestry: Indonesia,. 1987. 845–846.
(2). Hutapea J. R.Inventory of Indonesian Medicinal Plants Vol: Research and Development Agency; Ministry of Health: Indonesia,. 1994. 117–118.
(3). Capon R. J.., Macleod J. K.., Oelrichs P. B.Aust. J. Chem,. 1986. 39:1711–1715.
(4). Yamagishi T.., Haruna M.., Yan X. Z.., Chang J. J.., Lee K. H. J.Nat. Prod,. 1989. 52:1071–1079.
(5). Supratman U.., Fujita T.., Akiyama K.., Hayashi H.Biosci. Biotechnol. Biochem. 2000. 64:1310–1312.
(6). Gaind K. N.., Singla A. K.., Boar R. B.., Copsey D. B.Phytochemistry. 1976. 15:1999–2000.
(7). Costa S. S.., Jossang A.., Bodo B. J.Nat. Prod. 1996. 59:327–329.
(8). Liu K. C. S.., Yang S. L.., Robert M. F.., Phillipson J. D.Phytochemistry. 1989. 28:2813–2818.
(9). Liu K. C. S.., Yang S. L.., Robert M. F.., Phillipson J. D. J.Nat. Prod. 1989. 52:970–974.
(10). Almeida A. P.., Da Silva S. A.., Souza M. L. M.., Lima L. M.., Rossi-Bergmann B.., de Moraes V. L.., Costa S. S.Planta Med. 2000. 66:134–137.
(11). Wu P. L.., Hsu Y. L.., Wu T. S.., Bastow K. F.., Lee K. H.Org. Lett. 2006. 8:5207–5210.
(12). Supratman U.., Fujita T.., Akiyama K.., Hayashi H.Phytochemistry. 2001. 58:311–314.
(13). Supratman U.., Fujita T.., Akiyama K.., Hayashi H.., Murakami A.., Sakai H.., Koshimizu K.., Ohigashi H.Biosci. Biotechnol. Biochem. 2001. 65:947–949.
(14). Toker G.., Memisoglu M.., Yesilada E.., Aslan M.Turk. J. Chem,. 2004. 28:745–749.
(15). Markam H. M.Techiques of Flavonoid Identification. Academic Press: London;1982. p. 41–47.
(16). Guvenalp Z.., Demirezer L. O.Turk. J. Chem. 2005. 29:163–169.
(17). Chaturvedula V. S. P.., Prakash I. J.Chem. Pharm. Res.,. 2011. 3:799–804.
(18). Kim J. W.., Kim T. B.., Yang H.., Sung S. H.Nat. Prod. Sci. 2016. 22:117–121.
(19). Lin L. J.., Huang X. B.., Lv Z. C.Springerplus,. 2016. 5:1649.
(20). Aisyah L. S.., Yun Y. F.., Julaeha E.., Herlina T.., Zainuddin A.., Hermawan W.., Supratman U.., Hayashi H.Open Chemistry Journal. 2015. 2:36–39.
(21). Islam M.., Al-Amin Md.., Siddiqi M. M. A.., Akter S.., Haque M. M.., Sultana N.., Chowdhury A. M. S.DhakaUniv. J. Sci. 2012. 60:11–14.
(22). Si C. L.., Du Z. G.., Fan S.., An L. L.Chem. Nat. Comp. 2016. 52:794–797.
(23). Furusawa M.., Tanaka T.., Ito T.., Nakaya K.., Iliya I.., Ohyama M.., Iinuma M.., Murata H.., Inatomi Y.., Inada A.., Nakanishi T.., Matsushita S.., Kubota Y.., Sawa R.., Takahashi Y.Chem. Pharm. Bull. 2005. 53:591–593.
(24). Ross S. A.., ElSohly M. A.., Sultana G. N.., Mehmedic Z.., Hossain C. F.., Chandra S.Pyhtochem. Anal. 2005. 16:45–48.
(25). Li H.., Liu Y.., Yi Y.., Miao Q.., Liu S.., Zhao F.., Cong W.., Wang C.., Xia C. J.Chromatogr. B Analyt. Technol. Biomed. Life Sci. 2017. 1048:56–63.
(26). Zhang S.., Tao Z. M.., Zhang Y.., Shen Z. W.., Qin G. W.Chin. J. Nat. Med. 2010. 8:21–24.
(27). Ganbaatar C.., Gruner M.., Mishig D.., Duger R.., Schmidt A. W.., Knölker H. J.The Open Natural Products Journal. 2015. 8:1–7.
(28). Alley M. C.., Scudiero D. A.., Monks A.., Hursey M. L.., Czerwinski M. J.., Fine D. L.., Abbott B. J.., Mayo J. G.., Shoemaker R. H.., Boyd M. R.Cancer Res. 1988. 48:589–601.
(29). Hakim E. H.., Juliawaty L. D.., Syah Y. M.., Din L. B.., Ghisalberti E. L.., Latip J.., Said I. M.., Achmad S. A. Z.Naturforsch. C. 2005. 60:723–727.
(30). Harneti D.., Tjokronegoro R.., Safari A.., Supratman U.., Loong X. M.., Mukhtar M. R.., Mohamad K.., Awang K.., Hayashi H.Phytochem. Lett. 2012. 5:496–499.
(31). Hakim E. H.., Achmad S. A.., Juliawaty L. D.., Makmur L.., Syah Y. M.., Aimi N.., Kitajima M.., Takayama H.., Ghisalberti E. L. J.Nat. Med. 2007. 61:229–236.
Go to : 
Table 1.
13C-NMR data for compounds 1 – 7 (125 MHz in CD3OD)
Table 2.
Cytotoxicity activity of compounds 1 – 7 against P-388 murine leukemia cells




 PDF
PDF ePub
ePub Citation
Citation Print
Print


 XML Download
XML Download