Abstract
Influenza is an acute respiratory disease caused by the influenza virus. Each year, it causes a significant disease burden, especially in older adults. Furthermore, influenza pandemics occasionally occur because of antigenic change. Common signs and symptoms of influenza include fever, cough, sore throat, headache, myalgia, and runny nose. Severe cases may progress to pneumonia, which causes shortness of breath, tachycardia, hypotension, and the need for supportive respiratory interventions. Mild cases are self-limited and supportive care is sufficient. Antiviral treatment shortens the clinical course if it is administered within 48 hours from the onset of disease. Neuraminidase inhibitors, such as oseltamivir, zanamivir, and peramivir, are widely used. Although annual vaccination is the best means of prevention, its effectiveness can vary from year to year and among different age and risk groups.
인플루엔자 바이러스는 라틴어로 ‘영향을 미치다’라는 뜻의 Influentia에서 유래하였다고 한다[1]. 인플루엔자는 인플루엔자 A 혹은 B 바이러스 감염에 의해 생기는 급성 호흡기 질환이다. 이 질환은 상기도와 하기도를 모두 침범할 수 있으며 발열, 두통, 기침, 인후통 등의 증상을 흔히 동반한다. 일반적으로 특별한 치료없이 저절로 회복되지만 일부에서 합병증이 동반되어 이환율과 사망률이 증가하기도 한다[2]. 온대지방에서는 주로 겨울철에 유행이 일어나며 드물게 전세계적인 대유행이 일어나기도 한다. 가장 최근의 대유행인 2009년 대유행은 2009년 봄 멕시코에서 시작해서 전 세계에서 많은 환자가 발생하였고 2010년 8월에 종식되었다(Table 1) [1]. 백신접종은 공중보건학적으로 가장 중요한 예방법이다[2]. 백신의 효과는 유행 균주의 변화와 접종대상에 따라 다양하게 나타날 수 있다[3].
인플루엔자 바이러스는 orthomyxovirus과에 속하는 RNA 바이러스로 핵산 구성에 따라 A, B, C의 3가지 타입이 있고 이중에서 A와 B가 인간에게 감염을 일으킨다[2]. 인플루엔자 A 바이러스는 바이러스 표면의 18가지의 hemagglutinin(HA 혹은 H) 항원과 11가지의 neuraminidase (NA 혹은 N) 항원의 조합에 따라 타입이 나누어 지며 100여 가지의 아형이 존재할 수 있다[4]. 바이러스의 유전자는 8개의 RNA 절편으로 이루어져 있고 전사 과정 중에서 재조합과 변이가 쉽게 생길 수 있다. 이러한 항원 변이 중 거의 해마다 일어나는 작은 변이를 항원소변이라고 하고 8개 절편 유전자 중 일부가 다른 인플루엔자 바이러스의 유전자 절편과 치환되는 것을 항원 대변이라고 하며 이는 인플루엔자의 대유행을 유발할 수 있다[2]. 숙주에 따라 감염되는 인플루엔자 바이러스 아형은 다르며 종간 장벽이 있어 다른 종에게 쉽게 질병을 일으키지는 않는다[5]. H1, H2, H3가 사람에게 주로 질병을 일으키며 인플루엔자 바이러스는 사람의 상기도에서 H 항원이 시알산(sialic acid) 수용체에 결합하면서 감염을 일으킨다[6]. 이러한 종간장벽을 극복하는 기전으로 지금까지 많이 알려진 견해는 시알산 수용체와 H항원의 결합은 종 특이성이 있어서 조류 독감 바이러스는 조류의 2,3-Sia 수용체와 결합하고 포유류 독감 바이러스는 포유류의 2.6-Sia 수용체와 결합 하지만 돼지는 2,3-Sia와 2.6-Sia 수용체를 모두 가지고 있어 바이러스 유전자의 재조합이 일어나는 mixing vessel의 역할을 한다는 것이다[5]. 그러나 최근의 연구결과들을 보면 시알산 수용체는 인간과 조류 모두에 다양한 형태로 분포하고 있고[78] 몇몇 조류의 경우 mixing vessel의 역할이 가능하다는 주장이 제기되고 있어[9] 대유행의 원인이 되는 바이러스 유전자 간의 재조합이 일어나는 원인과 과정에 대해서는 좀더 연구가 필요하다.
인플루엔자의 전파는 주로 기침, 재채기 등을 하면서 호흡기 비말이 배출되면서 근거리의 다른 사람에게 전파되는 비말감염이며 오염된 주변 환경이나 직접 신체접촉을 통한 접촉감염도 가능하다[2]. 접촉 물질에 따라 다르지만 일상생활을 할 때 접촉하는 환경표면에서 바이러스는 9시간이 지나면 생명력이 크게 떨어지고 24시간이 지나면 거의 검출되지 않는다[10]. 기관지 내시경 검사 혹은 유도가래 배출 등 aerosol이 발생할 수 있는 일부상황에서는 공기감염도 가능하다[1112].
온대지방에서는 늦가을에서 초봄 사이에 유행을 하며 매년 유행정도가 달라질 수 있다. 사망률은 0.5–1명/1,000 환자 정도이며 주로 65세 이상 고령자에서 나타난다. 인플루엔자는 기저의 만성질환 악화를 유발할 수 있어서 실제로 인플루엔자가 사망에 기여한 사례는 보고된 사망자 수보다 훨씬 많을 것으로 보인다[13]. 전세계적으로는 매년 성인의 5–10%, 소아의 20–30% 정도가 이환되는 것으로 보이며 25만 명에서 50만 명 정도의 사망자를 발생시키는 것으로 추정된다[14]. 인플루엔자의 대유행은 높은 유병률을 동반한 전세계적인 인플루엔자의 대유행을 의미하며 20세기 이후 H1N1 스페인 독감(1918), H2N2 아시아 독감(1957), H3N2 홍콩독감(1968), H1N1 신종독감(돼지독감) (2009)와 같이 약 4번의 대유행이 있었다[15].
잠복기는 보통 1–2일(1–5일)이고 바이러스 배출은 잠복기부터 시작해서 증상 시작 후 1–2일 후에 절정에 이르고 일주일 정도 후 증상이 사라지면서 검출되지 않게 된다[2]. 일부 소아나 면역저하자는 바이러스 배출이 2주 이상 지속되기도 한다[16]. 임상양상은 무증상부터 중증 감염까지 다양하게 나타날 수 있다. 발열, 오한, 두통, 근육통, 무력감, 식욕저하 등의 전신증상과 기침, 콧물, 인후통 등의 호흡기 증상이 동반될 수 있다. 안구통, 눈물, 결막염 등의 안구증상이 동반되기도 한다. 발열은 보통 3일 정도 지속되지만 8일까지 지속되기도 하고 기침과 무력감은 해열후에도 2주 정도까지 지속되기도 한다[2]. 인플루엔자 중증감염의 경우 바이러스성 폐렴이 합병되기도 하는데 전형적인 증상 후에 호흡부전이 빠르게 진행된다. 흉부방사선 사진은 미만성 양측성 경결병변을 보이며 가래검사는 세균검사에서 음성을 보인다. 세균성 폐렴이 합병되는 경우는 전형적인 증상이 호전된 후 4-14일 후 다시 발열과 기침 가래가 심해지는 이상성 양상을 보이기도 한다[3]. 2009년 대유행 당시에도 세균성 폐렴은 사망의 중요한 원인이었다. 흔한 원인균은 Streptococcus pneumoniae, S. aureus, Haemophilus influenzae, 다른 Streptococcus species, 그리고 다른 그람 음성균 등이 있다. 세균성 폐렴과 바이러스성 폐렴이 함께 합병될 수도 있다. 드물게 합병될 수 있는 질환으로 심근염과 뇌염, 뇌수막염 등이 있다[23].
진단은 임상진단과 실험실 진단이 있다. 임상진단은 환자의 상태와 증상 정의, 인플루엔자의 유병률에 따라 진단 정확도가 달라질 수 있고 인플루엔자 유행시즌에는 민감도가 70% 이상이 될 수도 있다[17]. 인플루엔자 검사는 바이러스 배출이 절정에 이를 때를 고려하여 증상발생 후 가능한 빨리 하는 것이 좋다[18]. 실험실 진단법으로는 바이러스 배양검사, 항원검사, 핵산검사, 혈청학적 검사 등이 있다. 검체는 보통 비인두에서 채취된 도촬물 혹은 흡인물을 사용한다. 하기도 질환이 있을 경우 기도흡인물과 기관지폐포 세척액(BAL)을 사용하기도 한다[19]. 바이러스 배양검사는 전통적으로 인플루엔자 바이러스를 발견하는 표준적인 실험실 진단방법 이었으나 10–14일 정도 시간이 걸린다는 점 때문에 임상에서 치료와 감염관리에는 큰 도움을 주기 어려웠다[19]. Shell vial culture나 R-mix cell 등을 사용하여 1–2일 안에 결과를 얻는 방법이 개발되어 시간을 크게 단축시켰으나[2021], 역시 임상에서의 활용도는 항원검사나 핵산 검사에 비해 떨어진다. 현재 상업적으로 사용되고 있는 항원검사법들은 인플루엔자 항원을 찾아내는 면역학적 검사법이다. 민감도가 바이러스 배양검사나 중합효소연쇄반응검사법에 비해 낮지만 현장에서 바로 시행하고 결과를 확인할 수 있는 장점이 있어서 많이 사용되고 있다. 여러 연구들에서 특이도는 98–99%로 높으나 민감도는 9.7–44%로 낮게 보고 되고 있다[222324]. 증상 시작 후 2일 내에 검사한 경우 민감도는 60%까지 올라간다는 연구도 있다[23]. 핵산 검사는 역전사 중합효소연쇄반응으로 확인한다. 역전사 중합효소연쇄반응은 민감도와 특이도에 신뢰도가 높아서 인플루엔자 확진법으로 이용된다[1925]. 하지만 적절한 인력과 시설이 필요하며 검사비가 신속항원 검사에 비해 비싸기 때문에 일반적인 인플루엔자 진단법으로 널리 이용하기는 쉽지 않다. 혈청학적 검사는 급성기와 회복기의 IgG 항체가가 4배 이상 유의하게 증가하는 것으로 진단한다. 따라서 임상적 판단을 내리는 데는 도움이 되지 않으며 진단 목적의 검사로 권고되지는 않는다[19].
고위험군이 아니고 중증 소견을 보이지 않는다면 안정 및 수분섭취를 하고 필요에 따라 해열제 등 대증요법치료를 한다. 항바이러스제는 현재 입원환자, 중증이거나 합병증이 동반된 환자, 고위험군 환자에게 투여하도록 하고 있고 저위험군이라도 증상 발생 48시간 이내에 투여가 가능할 경우 항바이러스제를 투여를 고려할 수 있다[23]. 인플루엔자에 대한 항바이러스제는 adamantane과 neuraminidase inhibitors가 현재 임상에서 광범위하게 사용하고 있는 상태이다[3]. Adamantane은 amantadine과 rimantadine이라는 경구약제들이 있고 인플루엔자 A의 matrix 2 ion channel을 억제하고 인플루엔자 B는 억제하지 않는다. 현재 유행하는 계절독감들은 모두 admantane 유도체들에게 내성을 보이고 있어 사용이 권고되지는 않는다[3]. 뉴라미니다제 억제제(neuraminidase inhibitors)는 인플루엔자 바이러스의 뉴라미니다제를 억제하며 oseltamivir, zanamivir, peramivir 등이 사용되고 있다[3]. Oseltamivir는 75 mg 하루 두 번씩 5일 복용하고 zanamivir는 10 mg 하루 두 번 5일간 흡입한다. Peramivir는 300–600 mg 1회 정주한다. 예방적 사용은 oseltamivir는 75 mg 하루 한번씩 7–10일, zanamivir는 10 mg 하루 한번씩 7–10일 사용한다. Peramivir의 예방적 사용법은 아직 정립되어 있지 않다[3]. 뉴라미니다제 억제제는 건강한 사람에게 사용할 경우 증상 호전 시간을 하루 정도 단축시킬 수 있다[26]. 2014년 Cochrane review에서 oseltamivir가 증상 호전 시간을 약간 줄여주지만 입원이나 중증합병증 예방에는 큰 효과가 없다는 보고를 했다[27]. 하지만 다른 메타분석 연구들에서는 중증 합병증 발생의 위험과 사망률을 감소시켰고 재원기간도 줄였다는 결과들을 보고했다[2628]. 특히 증상 발생 후 2일 이내 치료를 빨리 시작한 군에서 예후가 좋았다[28]. 뉴라미니다제 억제제는 예방적으로 투약했을 때에도 일부 효과가 있는 것으로 알려져있다[2729].
새로 개발되고 있거나 최근에 일부국가에서 허가받은 약제로는 헤마글루티닌(hemagglutinin)을 억제하는 약제 또는 광범위 중화항체와 바이러스의 중합효소와 핵산단백을 목표로 하는 약제들이 있다[3031]. Arbidol은 헤마글루티닌과 상호작용하여 세포막 융합을 억제시키는 약제로 중국과 러시아에서 인플루엔자 치료에 허가를 받았다[31]. 헤마글루티닌에 부착하여 이를 억제하는 단클론 중화항체에는 다양한 종류들이 있으며 실험실연구에서 여러 종류의 인플루엔자 바이러스에 효과가 있다고 보고되었고 현재 여러가지 임상연구들이 진행 중이다[30]. Nitazoxanide는 헤마글루티닌에 작용하여 바이러스의 성숙을 방해하며 현재 임상연구가 진행중이다[330]. RNA 의존성 RNA 중합효소는 인플루엔자 종류에 상관없이 변화가 잘 없는 부분으로 약제개발의 목표로 연구되어 왔다. Favipiravir가 대표적이며 일본에서는 사용허가를 받은 상태이다[31]. 이밖에 바이러스의 핵산단백을 목표로 하는 nucleozin [30]과 새로운 뉴라미니다제 억제제로 일본에서 허가 받은 laninamivir 등의 약제가 있다[3].
인플루엔자를 예방하는 가장 효과적인 방법은 예방접종이다. 모든 6개월 이상 소아와 성인은 예방접종이 권고되며 특히 고위험군에서는 우선적으로 권고된다. 이러한 고위험군으로는 65세 이상 고령자, 생후 6–59개월 소아, 만성 호흡기질환 또는 만성 심혈관계질환, 당뇨병, 신기능 장애자, 만성 간질환자, 혈색소병증, 면역저하자, 생후 6개월에서 18세 청소년에서 장기간 아스피린 복용자, 임신부, 만성 질환으로 집단시설에 치료중인 환자, 폐렴발생 위험이 높은 신경계질환자, 고도비만자(체질량지수 30 이상) 등이다[2]. 현재 생산되는 백신은 주로 특정 HA항원에 대한 항체생성에 목표를 두고 있다. 인플루엔자 백신은 유행 균주의 항원변이에 대해 해마다 평가가 필요하며 세계보건기구에서 북반구에서는 2월 남반구에서는 9월에 평가를 하여 백신에 포함될 균주에 대한 권고사항을 정한다[32]. 백신에 포함되는 균주는 보통 인플루엔자 A형에서 H1N1, H3N2 subtype을 포함하고 주로 유행하는 B형을 포함하거나(3가백신, trivalent vaccines) B형균주(Victoria, Yamagata)를 모두 포함한다(4가백신) [3]. 인플루엔자의 백신은 제형별로 불활화 백신과 생백신으로 구분한다[2]. 불활화 백신에는 바이러스 외피를 분쇄시킨 분편백신, HA, NA 성분을 정제한 아단위 백신 등이 주로 사용되고 있다[2]. 생백신은 pandemic H1N1에 대한 효과가 2010년부터 2016년까지 분석결과 15%에서 −21%로 낮게 나와서 미국에서는 2016–2017시즌부터 접종을 중단하도록 하고 있다[33].
백신에 대한 효과는 대략 50–60% 정도로 보고되고 있으나 subtype과 나이에 따라 효과가 다르게 나타나기도 한다[3435]. H3N2 subtype에 대해서는 33%까지 떨어지기도 해서(60세 이상은 24%) H3N2에 대해 면역력을 높일 수 있는 방법이 요구된다는 메타분석도 있다[34]. 65세 이상의 노인들은 항체 생성률은 떨어지지만 합병증 감소와 사망률 감소에는 효과가 증명되어 백신 접종이 권고된다[3436]. 노인들에서 면역반응을 높이기 위해 MF59같은 면역증강제를 사용하거나 피내 접종 또는 고용량 백신이 사용되기도 한다[3237]. 최근에는 인플루엔자 바이러스의 아형에 상관없이 면역성을 유도할 수 있도록 바이러스의 헤마글루티닌의 stem 부위나 matrix 2 단백질 등을 항체의 목표로 하는 광범위 백신이 개발되고 있다[3238].
인플루엔자는 매년 많은 환자가 이환되는 호흡기 바이러스질환이며 특히 노인에서 폐렴 등의 심각한 합병증과 사망을 유발할 수 있다. 항원의 대변이가 생길 때마다 전 세계적으로 대발생이 일어나기도 한다. 증상은 발열과 기침이 대표적이며 수일 내에 저절로 회복되는 환자부터 폐렴으로 사망하는 환자까지 다양하게 나타난다. 항바이러스제 치료가 필요한 경우에는 가능한 증상 발생 2일 이내에 빨리 시작할 것이 권고된다. 예방의 가장 좋은 방법은 백신 접종이며 6개월 이상 모든 소아와 성인에서 권고되고 있고 특히 고위험군에서는 더욱 우선적으로 권고되고 있다.
이번 의학강좌는 겨울철 대표적 유행 질환의 하나인 독감에 대한 것으로 독감 바이러스의 구조, 변이, 역학 등 기초적인 내용에서부터 증상, 감염 경로, 진단을 위한 방법 등에 대하여 소개하고 있다. 현재 많이 사용되고 있는 항바이러스 제제 등의 치료 약제에 대하여도 자세히 설명하고 있으며, 임상의들이 가장 관심이 많고 중요한 부분인 독감예방 접종이 필요한 고위험군, 방법, 약제 등에 대해서도 빠트리지 않고 기술하고 있어 독감에 대한 전반을 정리하고 일차 진료에 많은 도움을 줄 수 있을 것으로 생각된다.
[정리: 편집위원회]
Figures and Tables
Table 1
Summary of the key characteristics of influenza pandemics from the past one hundred years
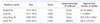
Reproduced from Saunders-Hastings PR, et al. Pathogens 2016;5:66, according to the Creative Commons license [1].
References
1. Saunders-Hastings PR, Krewski D. Reviewing the history of pandemic influenza: understanding patterns of emergence and transmission. Pathogens. 2016; 5:pii: E66.

2. Korean Association for the Study of Infectious Diseases. Infectious diseases. 2nd ed. Seoul: Koonja;2014.
4. Zhao M, Wang L, Li S. Influenza A virus-host protein interactions control viral pathogenesis. Int J Mol Sci. 2017; 18:pii: E1673.

5. Byrd-Leotis L, Cummings RD, Steinhauer DA. The interplay between the host receptor and influenza virus hemagglutinin and neuraminidase. Int J Mol Sci. 2017; 18:pii: E1541.

6. Shinya K, Ebina M, Yamada S, Ono M, Kasai N, Kawaoka Y. Avian flu: influenza virus receptors in the human airway. Nature. 2006; 440:435–436.
7. Matrosovich MN, Matrosovich TY, Gray T, Roberts NA, Klenk HD. Human and avian influenza viruses target different cell types in cultures of human airway epithelium. Proc Natl Acad Sci U S A. 2004; 101:4620–4624.

8. Walther T, Karamanska R, Chan RW, Chan MC, Jia N, Air G, Hopton C, Wong MP, Dell A, Malik Peiris JS, Haslam SM, Nicholls JM. Glycomic analysis of human respiratory tract tissues and correlation with influenza virus infection. PLoS Pathog. 2013; 9:e1003223.

9. Franca M, Stallknecht DE, Howerth EW. Expression and distribution of sialic acid influenza virus receptors in wild birds. Avian Pathol. 2013; 42:60–71.

10. Greatorex JS, Digard P, Curran MD, Moynihan R, Wensley H, Wreghitt T, Varsani H, Garcia F, Enstone J, Nguyen-Van-Tam JS. Survival of influenza A(H1N1) on materials found in households: implications for infection control. PLoS One. 2011; 6:e27932.

11. Cowling BJ, Ip DK, Fang VJ, Suntarattiwong P, Olsen SJ, Levy J, Uyeki TM, Leung GM, Malik Peiris JS, Chotpitayasunondh T, Nishiura H, Mark Simmerman J. Aerosol transmission is an important mode of influenza A virus spread. Nat Commun. 2013; 4:1935.

12. Wong BC, Lee N, Li Y, Chan PK, Qiu H, Luo Z, Lai RW, Ngai KL, Hui DS, Choi KW, Yu IT. Possible role of aerosol transmission in a hospital outbreak of influenza. Clin Infect Dis. 2010; 51:1176–1183.

13. Rothberg MB, Haessler SD, Brown RB. Complications of viral influenza. Am J Med. 2008; 121:258–264.

14. Puig-Barbera J, Burtseva E, Yu H, Cowling BJ, Badur S, Kyncl J, Sominina A. GIHSN. Influenza epidemiology and influenza vaccine effectiveness during the 2014-2015 season: annual report from the Global Influenza Hospital Surveillance Network. BMC Public Health. 2016; 16:Suppl 1. 757.

15. Su S, Gu M, Liu D, Cui J, Gao GF, Zhou J, Liu X. Epidemiology, evolution, and pathogenesis of H7N9 influenza viruses in five epidemic waves since 2013 in China. Trends Microbiol. 2017; 25:713–728.

16. Esposito S, Daleno C, Baldanti F, Scala A, Campanini G, Taroni F, Fossali E, Pelucchi C, Principi N. Viral shedding in children infected by pandemic A/H1N1/2009 influenza virus. Virol J. 2011; 8:349.

17. Boivin G, Hardy I, Tellier G, Maziade J. Predicting influenza infections during epidemics with use of a clinical case definition. Clin Infect Dis. 2000; 31:1166–1169.

18. Peaper DR, Landry ML. Rapid diagnosis of influenza: state of the art. Clin Lab Med. 2014; 34:365–385.
20. Operario DJ, Moser MJ, St George K. Highly sensitive and quantitative detection of the H274Y oseltamivir resistance mutation in seasonal A/H1N1 influenza virus. J Clin Microbiol. 2010; 48:3517–3524.

21. Higgins AD, Shaw CJ, Johnson JG, Navarro A, Chapman NA, Ewers SD, Stockwell JW, Carpenter JM, Olivo PD, Miao LY. Monoclonal antibody kit for identification of the novel 2009 H1N1 influenza A virus. J Clin Microbiol. 2010; 48:2677–2682.

22. Al Johani SM, Al Balawi M, Al Alwan B, Al Hefdhi R, Hajeer A. Validity of two rapid point of care influenza tests and direct fluorecence assay in comparison of real time PCR for swine of origin Influenza virus. J Infect Public Health. 2011; 4:7–11.

23. Choi WS, Noh JY, Huh JY, Kee SY, Jeong HW, Lee J, Song JY, Cheong HJ, Kim WJ. The clinical usefulness of the SD Bioline Influenza Antigen Test® for detecting the 2009 influenza A (H1N1) virus. Yonsei Med J. 2011; 52:683–685.

24. Tsao KC, Kuo YB, Huang CG, Chau SW, Chan EC. Performance of rapid-test kits for the detection of the pandemic influenza A/H1N1 virus. J Virol Methods. 2011; 173:387–389.

25. Ge Y, Cui L, Qi X, Shan J, Shan Y, Qi Y, Wu B, Wang H, Shi Z. Detection of novel swine origin influenza A virus (H1N1) by real-time nucleic acid sequence-based amplification. J Virol Methods. 2010; 163:495–497.

26. Dobson J, Whitley RJ, Pocock S, Monto AS. Oseltamivir treatment for influenza in adults: a meta-analysis of randomised controlled trials. Lancet. 2015; 385:1729–1737.

27. Jefferson T, Jones MA, Doshi P, Del Mar CB, Hama R, Thompson MJ, Spencer EA, Onakpoya I, Mahtani KR, Nunan D, Howick J, Heneghan CJ. Neuraminidase inhibitors for preventing and treating influenza in healthy adults and children. Cochrane Database Syst Rev. 2014; (4):CD008965.

28. Muthuri SG, Venkatesan S, Myles PR, Leonardi-Bee J, Al Khuwaitir TS, Al Mamun A, Anovadiya AP, Azziz-Baumgartner E, Baez C, Bassetti M, Beovic B, Bertisch B, Bonmarin I, Booy R, Borja-Aburto VH, Burgmann H, Cao B, Carratala J, Denholm JT, Dominguez SR, Duarte PA, Dubnov-Raz G, Echavarria M, Fanella S, Gao Z, Gerardin P, Giannella M, Gubbels S, Herberg J, Iglesias AL, Hoger PH, Hu X, Islam QT, Jiménez MF, Kandeel A, Keijzers G, Khalili H, Knight M, Kudo K, Kusznierz G, Kuzman I, Kwan AM, Amine IL, Langenegger E, Lankarani KB, Leo YS, Linko R, Liu P, Madanat F, Mayo-Montero E, McGeer A, Memish Z, Metan G, Mickiene A, Mikic D, Mohn KG, Moradi A, Nymadawa P, Oliva ME, Ozkan M, Parekh D, Paul M, Polack FP, Rath BA, Rodriguez AH, Sarrouf EB, Seale AC, Sertogullarindan B, Siqueira MM, Skret-Magierlo J, Stephan F, Talarek E, Tang JW, To KK, Torres A, Torun SH, Tran D, Uyeki TM, Van Zwol A, Vaudry W, Vidmar T, Yokota RT, Zarogoulidis P, Nguyen-Van-Tam JS. PRIDE Consortium Investigators. Effectiveness of neuraminidase inhibitors in reducing mortality in patients admitted to hospital with influenza A H1N1pdm09 virus infection: a meta-analysis of individual participant data. Lancet Respir Med. 2014; 2:395–404.

29. Okoli GN, Otete HE, Beck CR, Nguyen-Van-Tam JS. Use of neuraminidase inhibitors for rapid containment of influenza: a systematic review and meta-analysis of individual and household transmission studies. PLoS One. 2014; 9:e113633.

30. Naesens L, Stevaert A, Vanderlinden E. Antiviral therapies on the horizon for influenza. Curr Opin Pharmacol. 2016; 30:106–115.

31. Krol E, Rychlowska M, Szewczyk B. Antivirals: current trends in fighting influenza. Acta Biochim Pol. 2014; 61:495–504.
32. Houser K, Subbarao K. Influenza vaccines: challenges and solutions. Cell Host Microbe. 2015; 17:295–300.

33. Singanayagam A, Zambon M, Lalvani A, Barclay W. Urgent challenges in implementing live attenuated influenza vaccine. Lancet Infect Dis. 2017; 08. 02. DOI: 10.1016/S1473-3099(17)30360-2. [Epub].

34. Chan TC, Fan-Ngai Hung I, Ka-Hay Luk J, Chu LW, Hon-Wai Chan F. Effectiveness of influenza vaccination in institutionalized older adults: a systematic review. J Am Med Dir Assoc. 2014; 15:226.e1–226.e6.

35. Demicheli V, Jefferson T, Al-Ansary LA, Ferroni E, Rivetti A, Di Pietrantonj C. Vaccines for preventing influenza in healthy adults. Cochrane Database Syst Rev. 2014; (3):CD001269.

36. Lee WJ, Chen LK, Tang GJ, Lan TY. The impact of influenza vaccination on hospitalizations and mortality among frail older people. J Am Med Dir Assoc. 2014; 15:256–260.





 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download