Abstract
Crohn's disease is a chronic and relapsing disease that is not easily controlled with medications. It is characterized by progressive transmural inflammation, and ultimately leads to stricture and penetrating complications requiring surgery. Over the past decades, the prevalence of Crohn's disease has gradually increased in Korea. Conventional treatments with aminosalicylates, steroids, and immunosuppressants are inadequate to control its symptoms and complications. Biologic therapy shows promise for controlling disease activity and promoting mucosal healing. Despite the development of several medical therapies, the treatment of Crohn's disease remains challenging. Individually tailored treatment according to an endoscopic or symptomatic assessment is required.
크론병은 10-20대의 젊은 연령층에서 구강에서 항문에 이르는 위장관 어느 부위에서도 염증과 궤양이 발생하는 희귀난치질환이다. 서구에서 흔히 발생하고 한국인을 포함한 동양인은 드문 질환으로 알려져 있으나 우리나라에서도 최근 증가하고 있다. 1986년부터 2005년까지 20년간 서울 일부지역에서 역학연구를 시행한 결과 1990년까지는 10만 명 당 0.05명이었으나 2001년 이후에는 1.34명으로 의미 있게 증가하였다[1]. 이는 서구화된 식습관에 의한 장내 세균총의 변화 등 여러 환경요인에 의할 것으로 추정된다. 크론병의 발병은 유전적 요인, 환경요인, 장내세균총에 대한 이상 면역반응 등의 여러 복합요인이 작용할 것으로 생각되나 아직 정확한 원인은 불분명하다.
크론병은 아직 완치가 어려운 질환이지만 최근 생물학적 제제 등의 치료 도입으로 질환의 치료와 삶의 질 향상에 많은 발전을 가져와 크론병을 조기에 정확히 진단하고 치료하는 방법에 대해 알아보고자 한다.
크론병은 증상, 징후 또는 혈액검사, 대장내시경 및 영상검사의 어느 한 가지로 진단할 수 없으며 여러 임상소견과 검사소견을 포괄적으로 평가하여 진단한다. 크론병은 10대에서 20대의 젊은 층에서 흔히 발생하므로 청소년에서 복통, 설사, 체중감소를 호소하는 경우 이 질환을 염두해 두어야한다. 대장내시경은 크론병 진단에 가장 우선적으로 시행하고 말단회장을 포함한 대장 전체를 검사하고, 발생부위가 비슷한 장결핵과의 감별이 무엇보다도 중요하다.
크론병은 포착하기 어렵고 다양한 정도의 증상을 일으키는 경우가 많아 상당기간 늦게 진단되는 경우가 많다. 증상은 질환 부위, 염증의 정도, 장관 외 증상에 따라 다양하다. 주 증상은 복통(93-95%), 설사(73-78%) 및 체중감소(79-84%)이며 이러한 증상들이 수 주 이상의 기간에 걸쳐 나타난 경우 이 질환을 고려하여야 한다[2]. 복통은 침범부위에 따라 다양하나 주로 우하복부와 배꼽주위의 통증이 흔하다. 통증의 양상은 간헐적으로 쥐어짜는 듯하고 식사 후 증상이 심하고 금식하면 호전된다. 일부에서는 야간에도 통증을 호소하여 수면장애를 호소할 수 있다. 일부에서는 수년간에 걸친 경미한 염증으로 장관의 섬유화를 유발하여 협착을 초래하므로 산통을 호소하는 경우도 있다. 설사는 주로 수양성이고 수개월 이상 호전과 악화를 반복하기도 한다. 만성질환으로 에너지 소비가 증가하고 식사 후 복통이나 설사 등으로 식사 섭취가 힘들며 장관의 염증으로 흡수장애를 초래하여 체중감소가 흔히 나타난다. 또한 크론병은 젊은 연령층에서 잘 생기므로 성장기 청소년기에서는 성장장애 여부 확인이 필요하다.
항문주위 질환 또한 흔히 볼 수 있는 질환으로 상당수에서는 크론병의 전형적인 증상보다 먼저 나타나 이로 인하여 비로소 진단되기도 한다. 주 병변으로는 표재성 궤양, 농양, 쥐젖이 있고 쥐젖은 1형과 2형으로 나눌 수 있다. 1형(코끼리 귀)은 부드럽고 통증이 없으며 병변이 비교적 크다. 2형은 주로 치유된 치열이나 궤양에서 생겨 부어있으면서 딱딱하고 누르면 압통이 있다.
크론병은 질환의 경과에 따라 치루와 농양 및 협착의 2가지 형태를 보인다. 항문주위 치루는 약 15-35%에서 동반되고 소장, 방광, 질, 복강 등 주위 여러 장기와 교통이 되어 다양한 증상을 초래한다. 복강 내 농양은 심한 발열, 국한된 복부 압통 및 복막염 증상을 초래하나 심한 크론병에서는 스테로이드를 복용하고 있는 경우가 많아 스테로이드에 의해 발열이나 복막 자극증상이 감소하여 진단에 어려움이 있을 수 있다. 협착은 지속적으로 오랜 기간 염증이 있는 장관에서 발생하고 특히 협착은 수술받은 부위에서 호발한다. 협착은 장폐쇄가 나타날 때까지 증상이 없는 경우가 대부분이나, 일부에서는 암이 동반될 수 있어 내시경에서 협착이 발견되면 조직검사가 필요하다. 영상학적으로 발견되는 장의 협착은 섬유화에 의한 경우뿐만 아니라 염증에 의한 장의 부종이나 경련에 의해 가역적으로도 나타날 수 있다.
기본적 혈액검사는 전체혈구계산, C-반응단백, 적혈구 침강속도 등을 시행하나 크론병에 특이적인 혈액검사 소견은 없다. 혈액검사는 질환의 진단에 비특이적일 뿐만 아니라 질환의 심한 정도의 평가에도 민감도가 낮으나 C-반응단백, 알부민, 알부민/C-반응단백이 크론병의 활성도와 관련이 있는 것으로 알려져 있다[3]. 또 일부에서는 C-반응단백은 대장을 침범한 크론병에서는 활성도와 관련이 있으나 회장 크론병에서는 관련성이 적었다고 보고하였다[4]. 혈청에서 anti-Saccharomyces cerevisiae antibody와 antineutrophil cytoplasmic antibody의 검사는 크론병의 진단에 유용한 검사이나 일부에서는 그 민감도가 떨어진다[5]. 최근 대장 크론병에서 대변 칼프로텍틴이 다른 혈액검사에 비해 크론병의 활성도와 관련이 있어 비침습적인 질병의 활성도 검사로 주목을 받고 있다.
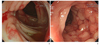
대장내시경은 크론병 진단의 가장 중요한 검사이다. 호발부위가 말단 회장부로 이를 포함한 전대장을 검사하여야 하고 이상 병변이 있는 경우 조직검사를 시행한다. 특징적인 소견은 종주궤양과 조약돌 모양이고 아프타궤양이 비연속적으로 나타나며 건너뛰기 병변, 항문주위 병변이 있다. 조직검사에서는 림프구 및 형질세포의 침윤, 국소 음와구조 변경 및 육아종이 관찰된다. 크론병의 가장 초기 소견은 아프타성 궤양이나 미란이나 다른 질환에서도 나타날 수 있는 비특이적인 소견이다[6]. 병이 진행하면 크고 깊은 궤양이 나타나고 궤양들이 사방으로 연결되면 궤양 사이사이의 점막은 부종성 변화로 돌출되고 보여 마치 조약돌을 깔아놓은 듯 한 조약돌 점막상을 보인다(Figure 1).
상부위장관내시경검사는 통상적으로 시행하지는 않고 상부위장관 증상이 있는 경우에 시행한다. 대장내시경이나 컴퓨터단층촬영(computed tomography, CT) 등 영상검사에서 이상이 없으면서 소장 크론병이 의심되는 경우는 캡슐내시경 검사를 시행하여 전형적인 궤양을 진단할 수 있으나 협착이 의심되는 경우 폐색을 초래할 수 있어 주의가 필요하다. 단일풍선 또는 이중풍선 소장내시경검사는 소장 크론병이 의심스런 병변에서 조직검사를 시행할 수 있는 장점이 있다.
내시경검사를 시행할 수 없는 경우, 농양, 치루 및 천공 등의 합병증이나 장외 소견을 진단하는데 CT검사가 유용하다. CT 소견으로는 장벽비후, 점막 증강과 장벽층화 등이 있으나 일반적인 CT는 소장의 허탈로 소장염증 여부를 진단하기에는 어려움이 있어 컴퓨터 소장조영술(CT enterography)을 이용하여 진단할 수 있다[7]. 최근 방사선 노출을 최소화한 CT검사가 사용되고 있으나 젊은 연령에서 방사선 노출에 대한 고려가 필요하다.
자기공명 소장조영술은 방사선 노출이 없으며 장관의 염증과 섬유화를 감별할 수 있는 좋은 영상법이다[7]. 특히 자기공명영상은 크론병의 중증도에 대한 평가가 가능하고 항문주위 크론병의 진단에 유용하나 검사시간이 오래 걸리고 고비용의 단점이 있다.
1986년 Vienna 분류법[8]은 진단 당시 나이에 따라 40세 미만은 A1, 40세 이상은 A2로 하고 침범부위에 따라 회장침범은 L1, 대장 L2, 회장 및 대장 L3, 상부위장관 L4로 하며 질병의 행태에 따라 B1은 염증형으로 비협착 비관통형, B2는 협착형, B3는 누공형으로 이를 과거에는 사용하였으나 최근에는 2005년에 제안된 Montreal 분류법이 많이 사용되고 있고 Table 1과 같다[9]. 장관 염증의 침범 분류할 수 있는데 국소질환은 침범 위치에 상관없이 30 cm 미만인 경우에 해당되고 광범위 질환은 침범길이 총합이 100 cm 이상인 경우이다[10].
크론병 치료의 목표는 활동성 질환의 관해를 유도하고 유지함으로써 궁극적으로는 환자의 건강과 삶의 질을 향상시키며 질병의 진행을 막아서 합병증을 예방하는 것이다. 최근에는 생물학적 제제의 도입으로 치료의 목표가 증상의 개선과 합병증 예방뿐만 아니라 점막의 치유, 깊은 치유 및 조직관해에 있으나 조직 관해는 이상적이나 아직 현실적으로 한계가 있다. 크론병의 치료에는 질병의 활동도(경증 및 중등도, 중증), 병변의 침범 부위(회장, 회장과 대장, 대장, 기타 부위) 그리고 질병의 행태(염증형, 협착형, 누공형) 등을 고려해야 한다. 크론병의 치료는 대한장연구학회의 염증성장질환 연구회에서 치료 가이드라인을 2017년 발표하였으며 이를 토대로 치료방법을 알아보고자 한다[11].
현재 사용되고 있는 5-ASA제제는 azo-bond에 의해 결합되어 있는 balsalazide와 olsalazide가 있으며 특정 pH에서 5-ASA가 분리되도록 레진 필름에 코팅된 약물, ethylcellulose 반투과막으로 코팅되어 서서히 5-ASA가 분비되는 여러 약물이 있다. 5-ASA는 염증성 장질환의 가장 대표적인 약물이나 크론병에서 치료효과는 미미하다. 그러나 약제의 부작용이 적고 복용이 간편하므로 경도의 크론병에서 2-4 g/day를 사용한다. 경도의 대장 크론병 관해유도에 설파살라진을 사용하나 소장에 국한된 경우는 효과가 미미하다. 설파살라진은 2-6 g/day 사용하고 대적구빈혈을 초래할 수 있어 엽산을 2-5 mg/day 병용투여한다. 크론병의 관해유지에 5-ASA의 효과에 대한 치료근거는 적고 수술 후 재발 방지에 대한 효과도 불분명하다.
항생제는 크론병의 화농성 합병증의 치료에 주로 사용한다. 크론병의 악화를 호전시키는데 사용하기보다는 농양, 치루가 동반되거나 회음부 침범한 크론병의 경우에 주로 사용한다. 사용하는 항생제는 메트로니다졸(10-30 mg/kg)과 시프로프록사신(1 g/day)을 1개월 이상 사용한다. 메트로니다졸은 말초신경병증 때문에 4개월 이상 사용하지 않으며 시프로프록사신은 연골장애를 초래할 수 있어 성장기에서는 사용하지 않는다.
생물학제제가 나오기 전에는 스테로이드가 중등도 및 중증의 활동기 염증성장질환의 가장 효과적인 치료제였다. 프레드니솔론은 하루 30-40 mg을 투여하고 1-2주에 효과를 판정하여 반응이 있으면 주 5 mg씩 감량한다. 빠른 감량은 재발과 관련이 있어 8주 전후의 기간에 걸쳐 서서히 감량한다. 투여 경로는 중증도에 따라 결정되어 입원이 필요할 정도의 중증은 정주 투여를 고려하지만 그 외의 경우는 경구투여한다. 효과가 없으면 관해 유도를 위한 다른 약제나 수술을 고려한다. 스테로이드는 활동성 크론병의 관해 유도에는 효과적이지만 관해 유지에는 효과적이지 않고 장기간 사용할 경우 여러 가지 부작용을 초래한다.
부데소나이드는 pH 5.5 이상에서 약제가 유리되어 말단회장 및 근위부 대장에서 대부분 방출되기 때문에 회맹부를 침범한 경도 또는 중등도의 크론병에 사용된다. 부데소나이드는 체내에서 높은 일차-통과 대사를 거치므로 통상적인 스테로이드에 비해 부작용은 적으나 프레드니솔론에 비해 염증조절 효과가 떨어진다. 권장 용량은 9 mg/day를 경구 투여하고 통상 6주 투여 후 매 2-4주당 3 mg씩 감량한다.
스테로이드 중단 후 6주 이내 재발한 경우, 1년 동안에 스테로이드를 2회 이상 사용한 경우와 스테로이드를 15 mg 이내로 감량하면 증상이 재발하는 경우에는 면역억제제나 생물학적 제제 투여를 고려한다.
크론병에서 스테로이드 의존성 또는 내약성이 있는 경우, 누공이 있는 경우는 면역조절제를 고려한다. 중등도 이상의 심한 크론병, 잦은 재발이나 3개월 이내 빠른 재발을 보인 경우, 수술 후 재발 방지목적, 생물학적 제제와 병합치료를 위해서도 면역조절제를 사용할 수 있다.
아자티오프린은 체내에서 복잡한 과정을 거쳐 비활성 및 활성 대사산물로 변하는 과정에서 관련된 효소의 활성도에 따라 효능과 독성에 차이를 보인다. 권장용량은 2-2.5 mg/kg을 처음부터 사용하거나 골수억제 부작용을 감소시키기 위해 초기에 적은 용량으로 시작하여 서서히 용량을 증가시키는 방법으로 사용할 수 있다. 그러나 작용 효과가 충분한 용량을 주었을 경우 14-16주 이상에 걸쳐 천천히 나타나므로 빠른 개선을 위해서는 스테로이드나 생물학제제와 병용 투여한다. 부작용은 구역, 구토, 췌장염, 간염이 있고 치명적인 부작용은 골수 억제이다.
1997년 장관 크론병에서 항TNF 제제의 효과에 대한 연구가 발표된 이후 현재까지 다양한 생물학적 제제를 임상에서 많이 사용하고 있고 효과 및 안정성에 대한 연구가 지속되고 있다[12]. 현재 염증성장질환에 사용 가능한 생물학제제는 인플리시맙, 아달리무맙, 골리무맙과 베돌리주맙 등이 있으며 현재 임상에서 사용 가능한 효과적인 약물이다. 생물학제제는 임상증상 완화와 관해 등의 고식적 치료 목적뿐만 아니라 점막 치유의 새로운 목적을 달성할 수 있는 유일한 약물이다.
항TNF 제제는 관해 유도와 유지에 효과적이지만 전반적인 면역억제효과로 결핵, B형간염 등의 감염증을 초래할 수 있고 드물게는 간비장T세포림프종과 같은 악성종양을 초래할 수 있으며 특히 면역조절제를 병용하는 경우 이러한 부작용이 더 많이 발생한다. α4β7 인테그린 억제제인 베돌리주맙은 장에 선택적으로 작용하기 때문에 전신적인 면역억제 효과가 적어 이러한 부작용은 적게 생긴다.
생물학제제를 사용하기 전에 환자의 증상 및 중증도의 임상지표뿐만 아니라 대장내시경, CT나 자기공명영상 소장조영술, 칼프로텍틴, C-반응단백을 종합적으로 검사하여 사용 여부 판단이 필요하고, 기회감염과 암 발생의 가능성에 대해 고려해야 한다. 기회감염 중 우리나라는 결핵에 대해 환자의 과거력이나 주변에 결핵 환자가 있었는지 조사하고 투베르쿨린 피부반응검사, 결핵 진단 혈액검사, 흉부 X선 검사를 시행한다. 잠복결핵의 경우 2개월 전 항결핵제를 사용하고 활동성 결핵의 경우 결핵이 완치된 후 생물학제제를 사용한다. B형 간염바이러스 여부 확인을 위해 HBsAg, anti-HBc 및 anti-HBs검사를 시행하고 항체가 형성되어 있지 않은 경우 백신 접종을 시행한다. 활동성 간염의 경우 항바이러스제제를 2주간 사용하고 생물학제제 중단 6개월 후까지 사용한다. 그 외에 수두, 대상포진, 사람면역결핍바이러스 검사 시행을 고려한다. 예방접종여부에 대한 조사가 필요하며 약독화된 생백신의 경우 생물학제제 투여 중에는 사용할 수 없으므로 필요하면 1개월 전에 투여한다.
생물학제제는 보편적 치료 즉 스테로이드나 면역조절제에 반응이 없거나 내약성이 없는 경우 또는 이러한 치료가 금기인 중등도-중증의 환자에서 사용한다. 인플리시맙은 크론병에 최초로 시도된 키메라 IgG1 항TNF 제제로서 0, 2, 6주 정주 투여하고, 장관 내 크론병은 2주 후 누공형 크론병은 3회 투여 후 효과를 판정하여 유효하면 8주 간격으로 유지요법을 시행한다. 아달리무맙은 전 인간형 항TNF 제제로, 2주 간격으로 피하주사하며 투여 4주 이내에 평가하여 유지요법을 시행한다. 항TNF와 다른 기전의 생물학제제에 대한 연구로 α4β7 인테그린 억제제인 베돌리주맙은 이전 항TNF 치료에 실패하였던 중등도-중증 크론병 환자에서 10주째 관해율이 의미 있게 높았다[13]. 우스테키누맙은 인터루킨-12 및 인터루킨-23의 p40 소단위에 대한 단클론 항체로 크론병 환자에서도 효과가 있다고 보고되었다[14].
생물학제제를 치료 받은 환자의 1/3 이상에서 치료 도중 반응 소실을 경험할 수 있으며 이는 혈중 약물농도가 낮거나 약제에 대한 항체의 형성으로 초래된다. 면역조절제를 병용하면 약제에 대한 항체 형성을 억제하고 약제의 청소율을 낮추어 약제 효과를 개선시킬 수 있다. 일차 무반응은 치료 시작 8-12주 후 평가하여 임상증상이 호전되지 않은 경우인데 흡연, 2년 이상의 긴 유병기간, 소장 침범, 다른 항TNF 제제에 효과가 없는 경우, 정상 C-단백반응인 경우에 흔히 볼 수 있다[15]. 일차 무반응의 경우 우선 금연을 강력히 권유하여야 하고 다른 기전의 약제 투여를 고려하여야 하나 아직 임상에 사용할 수 있는 약물이 제한되어 있다. 그러나 한 가지 항TNF 제제에 무반응을 보인 경우에도 약 50-60%에서는 다른 항TNF 제제에 반응을 보이므로 일차 무반응이 발생하면 다른 항TNF 제제로 교체하는 것도 고려해 볼 수 있다[16]. 이차 반응 소실은 치료에 잘 반응하던 환자에서 시간이 지남에 따라 임상반응이 소실되는 것으로 투여하는 약물의 용량을 증가시키거나 투여간격을 단축시켜 이를 극복한다. 또한 다른 항TNF 제제나 다른 기전의 생물학제제를 고려한다.
크론병은 조기진단이 어렵고 다양한 증상을 초래하며 장기간에 걸쳐 여러 가지 합병증이 생길 수 있는 희귀난치질환이다. 크론병의 진단에 특이적인 검사방법이 없기 때문에 임상소견, 검사실 소견 및 내시경검사나 영상 소견을 종합하여 진단하여야 한다. 치료는 증상의 완화와 합병증의 예방을 목표로 5-ASA, 스테로이드 및 면역제제를 투여할 수 있으나 치루, 협착 등의 합병증을 예방하기에는 역부족이었다. 최근에는 여러 생물학제제를 투여함으로써 증상의 조절뿐만 아니라 궁극적으로 병변의 치유에 목표를 두고 치료를 시행하고 있다. 다양한 증상과 병의 경과를 보이면서 치료가 힘든 크론병 환자 개개인에 맞추어 맞춤치료를 시행함으로써 적절한 치료를 제공하고 삶의 질을 개선시키고자 하는 적극적 관심이 필요하다.
본 원고에서는 2017년 대한장연구학회 염증성장질환연구회에서 개정한 가이드라인을 토대로 최근 우리나라에서 발생률이 증가하고 있는 크론병의 진단법과 치료법에 대해 소개하고 있다. 특히 컴퓨터 소장조영술로 인한 방사선 노출의 위험성을 고려하여 자기공명 소장조영술의 중요성을 강조하고 있고, 치료의 목표가 단순한 증상의 개선에서 점막치유를 통한 합병증 예방으로 변화한 점과 점막치유라는 목적을 달성하기 위해 항TNF제제 및 α4β7 인테그린 억제제 등 생물학제제의 효과를 강조하였다. 또한 생물학제제 치료반응 소실을 극복하기 위한 방법으로 면역조절제 병용요법과 약물의 용량증량 및 투여간격 단축 등을 제시하였다. 또한 최근 새롭게 시도되고 있는 장내미생물이식과 조혈세포이식 등 실험적 치료법의 방향성과 전망을 제시하는 등 저자의 높은 식견이 독자들에게 큰 도움을 줄 수 있을 것으로 판단된다.
[정리: 편집위원회]
Figures and Tables
References
1. Yang SK, Yun S, Kim JH, Park JY, Kim HY, Kim YH, Chang DK, Kim JS, Song IS, Park JB, Park ER, Kim KJ, Moon G, Yang SH. Epidemiology of inflammatory bowel disease in the Songpa-Kangdong district, Seoul, Korea, 1986-2005: a KASID study. Inflamm Bowel Dis. 2008; 14:542–549.

2. Korean Association for the Study of Intestinal Disease. Inflammtory bowel disease. Seoul: Daehan Medical Books;2016.
3. Qin G, Tu J, Liu L, Luo L, Wu J, Tao L, Zhang C, Geng X, Chen X, Ai X, Shen B, Pan W. Serum albumin and C-reactive protein/albumin ratio are useful biomarkers of Crohn's disease activity. Med Sci Monit. 2016; 22:4393–4400.

4. Yang DH, Yang SK, Park SH, Lee HS, Boo SJ, Park JH, Na SY, Jung KW, Kim KJ, Ye BD, Byeon JS, Myung SJ. Usefulness of C-reactive protein as a disease activity marker in Crohn's disease according to the location of disease. Gut Liver. 2015; 9:80–86.

5. Ooi CJ, Makharia GK, Hilmi I, Gibson PR, Fock KM, Ahuja V, Ling KL, Lim WC, Thia KT, Wei SC, Leung WK, Koh PK, Gearry RB, Goh KL, Ouyang Q, Sollano J, Manatsathit S, de Silva HJ, Rerknimitr R, Pisespongsa P, Abu Hassan MR, Sung J, Hibi T, Boey CC, Moran N, Leong RW. Asia Pacific Association of Gastroenterology (APAGE) Working Group on Inflammatory Bowel Disease. Asia-Pacific consensus statements on Crohn's disease. Part 2: management. J Gastroenterol Hepatol. 2016; 31:56–68.

6. Yang SK, Min YI. Colonoscopic diagnosis. Seoul: Koonja Publishing;1999.
7. Zakeri N, Pollok RC. Diagnostic imaging and radiation exposure in inflammatory bowel disease. World J Gastroenterol. 2016; 22:2165–2178.

8. Gasche C, Scholmerich J, Brynskov J, D'Haens G, Hanauer SB, Irvine EJ, Jewell DP, Rachmilewitz D, Sachar DB, Sandborn WJ, Sutherland LR. A simple classification of Crohn's disease: report of the Working Party for the World Congresses of Gastroenterology, Vienna 1998. Inflamm Bowel Dis. 2000; 6:8–15.

9. Satsangi J, Silverberg MS, Vermeire S, Colombel JF. The Montreal classification of inflammatory bowel disease: controversies, consensus, and implications. Gut. 2006; 55:749–753.

10. Van Assche G, Dignass A, Panes J, Beaugerie L, Karagiannis J, Allez M, Ochsenkühn T, Orchard T, Rogler G, Louis E, Kupcinskas L, Mantzaris G, Travis S, Stange E. European Crohn's and Colitis Organisation (ECCO). The second European evidence-based Consensus on the diagnosis and management of Crohn's disease: definitions and diagnosis. J Crohns Colitis. 2010; 4:7–27.

11. Park JJ, Yang SK, Ye BD, Kim JW, Park DI, Yoon H, Im JP, Lee KM, Yoon SN, Lee H. IBD Study Group of the Korean Association for the Study of the Intestinal Diseases. Second Korean guidelines for the management of Crohn's disease. Korean J Gastroenterol. 2017; 69:29–54.

12. Targan SR, Hanauer SB, van Deventer SJ, Mayer L, Present DH, Braakman T, DeWoody KL, Schaible TF, Rutgeerts PJ. A short-term study of chimeric monoclonal antibody cA2 to tumor necrosis factor alpha for Crohn's disease: Crohn's disease cA2 study group. N Engl J Med. 1997; 337:1029–1035.

13. Sands BE, Feagan BG, Rutgeerts P, Colombel JF, Sandborn WJ, Sy R, D'Haens G, Ben-Horin S, Xu J, Rosario M, Fox I, Parikh A, Milch C, Hanauer S. Effects of vedolizumab induction therapy for patients with Crohn's disease in whom tumor necrosis factor antagonist treatment failed. Gastroenterology. 2014; 147:618–627.

14. Feagan BG, Sandborn WJ, Gasink C, Jacobstein D, Lang Y, Friedman JR, Blank MA, Johanns J, Gao LL, Miao Y, Adedokun OJ, Sands BE, Hanauer SB, Vermeire S, Targan S, Ghosh S, de Villiers WJ, Colombel JF, Tulassay Z, Seidler U, Salzberg BA, Desreumaux P, Lee SD, Loftus EV Jr, Dieleman LA, Katz S, Rutgeerts P. UNITI–IM-UNITI Study Group. Ustekinumab as induction and maintenance therapy for Crohn's disease. N Engl J Med. 2016; 375:1946–1960.

15. Papamichael K, Gils A, Rutgeerts P, Levesque BG, Vermeire S, Sandborn WJ, Vande Casteele N. Role for therapeutic drug monitoring during induction therapy with TNF antagonists in IBD: evolution in the definition and management of primary nonresponse. Inflamm Bowel Dis. 2015; 21:182–197.

16. Swaminath A, Ullman T, Rosen M, Mayer L, Lichtiger S, Abreu MT. Early clinical experience with adalimumab in treatment of inflammatory bowel disease with infliximab-treated and naive patients. Aliment Pharmacol Ther. 2009; 29:273–278.





 PDF
PDF ePub
ePub Citation
Citation Print
Print




 XML Download
XML Download