Abstract
The incidence of vector-borne diseases has increased with climate change and developments of transportation. Malaria was eliminated in the early 1980s in Korea, but one domestic case was reported in 1993. The number of patients increased to 4,142 in 2002, and less than 700 cases of malaria are reported annually nowadays. Additionally, approximately 70 to 80 imported malaria cases were reported annually, and most of them are Plasmodium falciparum infections from Africa. Annually, 20 to 40 cases of Japanese encephalitis are reported, and the incidence is high in individuals between the ages of 40 and 59. Moreover, 313 cases of dengue fever were imported in 2016, and most of them were from Southeast Asia. In 2016, 11,000 cases of scrub typhus were reported, and most of the patients were older than 50. The number of reported cases of severe fever with thrombocytopenia syndrome has been increasing since 2013, mostly in patients older than 60. It is important to avoid vectors for the prevention, and for the doctors to diagnose the apatients as soon as possible.
절지동물은 각질화한 껍질(외골격)으로 덮여 있으며, 몸체와 부속지가 마디로 구성된 형태의 동물을 통칭한다. 곤충, 거미와 진드기, 갑각류, 지네, 노래기 등이 포함되는데, 지구상의 동물 4분의 3 이상이 절지동물에 속한다. 절지동물이 의학적으로 중요한 이유는 다양한 병원체를 사람과 동물에게 전파하는 매개체가 되기 때문이다. 매개체 전파 감염병은 이러한 매개체를 통해 병원체가 전파되는 감염병을 말한다. 의학적으로 의미 있는 의용절지동물 중 세계적으로 주목할 만한 절지동물은 모기와 진드기이다[1]. 모기의 경우 말라리아, 일본뇌염, 뎅기열, 황열, 웨스트나일열, 지카바이러스감염증 등을 매개하며, 진드기의 경우 중증열성 혈소판감소증후군(severe fever with thrombocytopenia syndrome, SFTS), 라임병, 쯔쯔가무시증, 진드기매개뇌염 등을 매개한다.
매개체 전파 감염병의 확산은 전 세계적인 관심사이다. 기후변화로 인해 매개체가 증가하고, 교통의 발달로 국경을 넘어 전파되는 사례가 빈번해지고 있다. 세계보건기구에 따르면 전 세계적으로 91개국 국민들이 말라리아 위험에 노출되어 있고, 2015년에는 약 2억 1,200만 명이 감염되어 이 중 43만명이 사망한 것으로 추정하고 있다[2]. 뎅기열 발생 역시 빠르게 증가하고 있고, 128개국에서 40억 명이 뎅기 바이러스의 위험에 노출되어 있다는 연구결과도 있다[3]. 이처럼 주목할 만한 매개체 전파 감염병 중 국내에서 주의해야 할 모기 및 진드기 매개 감염병의 국내외 동향에 대해 알아보고자 한다.
우리나라에서는 모기매개 감염병 중 말라리아와 일본뇌염을 제외한 나머지는 모두 해외유입 사례만 보고되고 있다. 세계보건기구는 2030년까지 2015년의 90% 수준까지 말라리아 발생률과 치명률을 낮추고, 적어도 35개국의 말라리아 퇴치를 목표로 하고 있으며[2], 우리나라도 이러한 매개체 전파 감염병 관리를 위해 국제적 협력체계를 공고히 하고 있다.
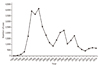
우리나라에서 발생하는 말라리아는 삼일열말라리아(Plasmodium vivax)로, 80년대 초반 퇴치된 것으로 여겨지다가 1993년 휴전선 접경지역에서 복무중이던 군인에서 환자발생이 확인된 이후 환자발생이 점차 증가하여 2000년 환자수가 4,183명으로 정점에 이르렀으나, 이후 점차 감소하여 최근에는 휴전선 접경지역에서 연 700명 이하로 발생하고 있다(Table 1, Figure 1). 국내 말라리아 발생시기는 5월에서 10월 사이에 집중되어 전체 발생의 92%를 차지하고 있다[4]. 과거에는 감염자의 대부분이 휴전선 인근 지역에 복무하는 현역군인 혹은 이 지역에서 근무 후 전역한 젊은 남자들이었으나 최근에는 민간인 환자가 더 많이 발생하고 있다. 1997년부터 위험지역에서 복무하는 군인들에게 말라리아 발생기간인 5월부터 10월까지 클로로퀸(chloroquine)을 주1회 복용하게 하고 마지막 2주간의 프리마퀸(primaquine)을 투여하는 예방화학요법을 시행하면서 군인에서 환자발생이 감소하였다[5]. 2010년부터는 클로로퀸 복용 시작 시기를 5월에서 7월로 조정하였다.
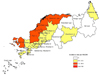
정부는 전년도 환자발생률을 근거로 매년 국내 말라리아 위험지역을 선정하여 집중관리하고 있다(Figure 2). 2017년에는 경기, 인천, 강원 지역의 30개 시·군·구를 위험지역으로 선정하여 환자조기진단, 환자관리, 주민 예방교육, 여행자 홍보 등의 말라리아 관리사업을 진행하고 있다. 모기에 의한 사람 간 전파를 예방하기 위하여 치료완료 후 1개월이 지난 말라리아 환자를 대상으로 완치조사를 시행하고 있다. 그리고 위험지역에서 매개모기 감시 및 방제사업도 병행하고 있다. 군인에서 말라리아 관리를 위하여 국방부, 국군의무사령부 등과도 지속적으로 정보를 공유하고 있다. 이러한 노력에도 불구하고 비무장지대의 모기 방제와 북한지역 환자관리에 한계가 있어 국내 말라리아 퇴치에는 어려움이 많다.
해외유입 말라리아의 경우 최근 3년간 70–80명의 환자가 보고되고 있으며, 아프리카와 아시아 여행 후 감염된 사람이 대부분이다. 해외유입 말라리아의 원충형은 열대열, 삼일열, 난형열 순이고, 치명률이 높은 열대열 말라리아의 경우 아프리카에서 감염된 사례가 가장 많다(Table 2).
모기를 매개로 전파되는 바이러스 감염병은 일본뇌염, 뎅기열, 지카바이러스 감염증, 웨스트나일열, 치쿤구니야열 등이 있고, 일본뇌염은 국내에서 지속적으로 발생하고, 나머지 감염병은 모두 해외에서 감염되어 유입된 사례로 아직 국내감염 사례는 없다. 그러나 해외여행 및 국제교류가 증가함에 따라 이러한 모기매개 감염병의 국내 유입 가능성이 제기되고 있다.
일본뇌염은 집모기(우리나라에서는 주로 작은빨간집모기[Culex tritaeniorhynchus])가 야생조류나 일부 포유류로부터 바이러스를 매개하여 감염된다[8]. 주로 돼지가 바이러스의 증폭 숙주로서의 역할을 하는 것으로 알려져 있다. 태평양 연안 아시아 지역 소아에서 발생하는 대표적인 뇌염으로 매년 전 세계적으로 68,000명의 환자가 발생하고, 약 30%의 치명률을 보이며 회복되어도 1/3 에서 신경계 합병증을 남기는 질환이다. 일단 일본뇌염에 걸리면 특별한 치료방법이 없으므로 예방이 최선이며 예방 접종사업과 관련하여 개선된 백신을 개발하기 위한 연구가 지속되고 있다. 일본뇌염은 ‘감염병의 예방 및 관리에 관한 법률’에 따라 제2군 감염병으로 지정되어 관리중이다.
우리나라에서는 1946년 인천지역 주한 미군에서 최초의 환자발생이 보고되었고, 1949년 5,616명의 환자가 발생하여 이 중 2,729명이 사망하였으며, 1958년에는 약 6,897명의 일본뇌염 환자가 발생하여 이 중 2,177명이 사망하는 대유행이 있었다(Figure 3) [8]. 이후 1960년부터 1968년까지 연간 1,000–3,000명의 환자가 발생하였으나, 1971년 일본뇌염 백신이 도입된 이후 환자발생이 급격히 감소하였다. 1982년 1,197명의 환자가 발생하는 마지막 유행이 있은 후부터 2009년까지 환자발생이 연간 10명 이하로 거의 퇴치수준에 이르렀다. 2010년 이후 연간 20–40건이 보고되고 있으며 40–50대에서 가장 많은 환자가 발생한다(Table 3). 일본뇌염 예방접종이 도입되기 이전에는 5–15세 소아 연령층에서 가장 많은 환자가 발생하였으나 이들 연령층은 예방접종사업을 통해 면역을 획득하면서 일본뇌염이 국가필수예방접종으로 지정된 1985년 이전에 소아·청소년기를 보낸 40대 이상에서 주로 환자가 발생한다.
뎅기열은 전 세계적으로 매년 100여국가에서 5천만에서 1억 명의 환자가 발생하고, 수십만 건의 중증사례와 2만건의 사망이 보고되고 있다[9]. 주로 열대 및 아열대 지역에서 발생하고 적도를 기준으로 남북 위도 35° 이내에서 주로 환자가 발생한다[10]. 지역적으로는 강수량과 온도, 비계획적인 급격한 도시화가 질병 발생에 영향을 주고, 항공기술의 발전으로 인한 국제 여행객의 증가로 온대지역에서도 해외유입 사례가 증가하고 있다.
우리나라도 해외유입 뎅기열 환자가 지속적으로 확인되고 있다. 2011년 72건, 2012년 149건, 2013년 252건, 2014년 165건이 보고되었고, 특히 2016년에는 동남아시아 국가에서 환자 증가로 국내유입사례가 313건이 보고되었다[11]. 뎅기열은 하계휴가가 시작되는 7월 이후부터 발생이 증가한다. 추정 감염지역으로는 동남아시아가 대부분으로, 2015년에 보고된 255건 중 253건이 아시아 국가에서 유입되었다.
웨스트나일열은 아프리카, 남부 유럽, 중동, 아시아, 호주, 남미 등에서 환자가 발생하고 있으며[10], 국내에서는 2012년 에 아프리카에서 유입된 사례 1건이 보고되었다. 병원소는 까마귀, 어치 등의 조류이고, 모기(주로 집모기속[Culex genus])에 물려서 감염된다[10]. 웨스트나일열은 치명률과 신경계 후유증 발현율이 일본뇌염과 비슷한 수준이며, 우리나라에도 까마귀 등의 중간 숙주와 매개모기가 서식하고 있어 토착화 가능성에 대해 밀접한 감시가 필요하다.
지카바이러스감염증에 감염된 임신부가 소두증을 가진 신생아를 출산한 사례가 보고되면서 세계보건기구는 2016년 2월 1일 국제 공중보건위기상황(Public Health Emergency of International Concern)을 선포하였고, 11월 19일 위기상황을 해제하였다. 국내에는 서식하지 않는 이집트숲모기(Aedes aegypti)에 의해 주로 전파되나, 국내에서 서식하는 흰줄숲모기(Aedes albopictus)에 의해서도 전파가 가능하다. 국내에서는 2016년 1월 29일 제4군 감염병으로 지정하여 관리하고 있으며, 2016년에 17건의 해외유입 사례가 보고되었다.
우리나라에서 대표적인 진드기매개 감염병으로는 쯔쯔가무시증과 SFTS가 있다. 이 두 감염병은 최근 우리나라에서 환자발생이 증가하고 있으며, 특히 SFTS의 경우 치료제나 백신이 없어 예방교육의 필요성이 강조되고 있다.
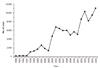
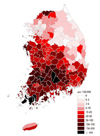
쯔쯔가무시증 국내 환자발생은 1951년 주한 국제연합군에서 처음 발생하였고, 1986년에 혈청학적으로 확인된 이후 환자발생에 대한 감시는 1994년부터 이루어졌다. 고발생 지역을 중심으로 예방교육이 이루어지고 있으나, 1998년 이후 수년간의 주기로 계단식으로 증가하고 있고 2016년에는 11,105건(잠정치)이 보고되었다(Figure 4) [12]. 환자는 활순털진드기 분포지역을 따라 전남, 경남, 전북, 충남지역에서 주로 발생하며, 10–11월에 가장 많은 환자가 보고된다 (Figure 5) [12]. 이는 매개진드기 유충이 주로 9월에 처음 나타나기 시작하여, 10월과 11월에 그 수가 정점에 달하는 것과 관련이 있다[13]. 2015년 신고·보고된 9,513명 중 역학조사가 완료된 8,939명의 자료분석 결과, 대부분의 환자는 50대 이상이고 농촌지역은 농작업 시 노출, 도시지역은 여가 활동이나 일시적인 농작업 참여로 인한 노출이 많았다.
SFTS는 참진드기를 매개로 하여 SFTS 바이러스(Bunyaviridae family)가 전파되어 발생하는 감염병으로, 전 세계적으로 중국, 일본, 한국에서 주로 보고되고 있다. 중국에서 최초로 SFTS 환자가 보고되었고, 현재까지 가장 많은 환자가 확인된 국가이다. 2009년 3월부터 7월까지 중국 중부 및 동북부 지역에서 고열과 함께 소화기증상, 혈소판·백혈구감소, 다발성 장기부전 등의 증상이 있는 원인불명 집단발병이 있었으며, 2011년 SFTS 바이러스에 의한 감염병인것으로 밝혀졌다[14]. 중국에서는 2011년부터 2014년까지 2,750명의 SFTS 환자가 확진되었고, 증가추세에 있다[15]. 일본에서는 2013년 1월 첫 환자 확인 이후 2016년 2월까지 170명의 환자가 확진되었다[16].
국내에서는 2013년 5월 첫 환자가 보고된 이후 2013년 36명, 2014년 55명, 2015년 79명, 2016년 169명으로 환자 보고가 증가하고 있다[12]. 2013에서 2016년까지 339명의 환자가 보고되었고, 사망자수는 73명이었다. 주로 5–10월에 환자발생이 많았고, 60세 이상 노인에서 많이 보고 되었다. SFTS 감염의 국내 주요 매개종인 작은소피참진드기는 전국에 고르게 분포하고 있고, 의사와 국민들의 SFTS에 대한 인지도가 높아짐에 따라 환자 보고가 증가할 것으로 예상된다.
1993년 이후 휴전선 인근 지역에서 말라리아 환자가 지속적으로 발생하고 있다. 예방접종으로 환자발생이 감소하였으나 2010년 이후 일본뇌염 환자가 40–50대를 중심으로 연간 20–40명이 발생한다. 그리고 해외여행 증가로 열대열 말라리아, 뎅기열, 치쿤구니야열, 지카바이러스감염증 환자도 지속적으로 유입되고 있다. 또한 농작업, 야외활동 등의 과정에서 매개진드기에 노출되어 쯔쯔가무시증이나 SFTS 환자발생도 계속되고 있다. 지구온난화와 국제교류의 증가로 매개체 전파 감염병 발생이 증가할 수 있다. 매개체 전파 감염병을 예방하기 위해서는 모기나 진드기 등 매개 절지동물에 노출되지 않는 것이 중요하다. 아울러 의사들이 매개체 전파 감염병 환자를 조기에 진단하는 것이 환자의 치료효과를 향상시킬 수 있다.
Figures and Tables
 | Figure 3Annual numbers of Japanese encephalitis cases. JEV, Japanese encephalitis vaccine; NIP, National immunization program. Reproduced from Korea Centers for Disease Control and Prevention. Epidemiology and management of vaccine preventable diseases. 5th ed. Cheonju: Korea Centers for Disease Control and Prevention; 2017 [8]. |
References
1. Young TS. Medical arthropod. Korea Society of Infectious Disease. Infectious disease. Seoul: Kunja;2014. p. 1005–1025.
2. World Health Organization. World malaria report 2016. Geneva: World Health Organization;2016.
3. Brady OJ, Gething PW, Bhatt S, Messina JP, Brownstein JS, Hoen AG, Moyes CL, Farlow AW, Scott TW, Hay SI. Refining the global spatial limits of dengue virus transmission by evidence-based consensus. PLoS Negl Trop Dis. 2012; 6:e1760.

4. Korea Centers for Disease Control and Prevention. Malaria management guideline. Cheongju: Korea Centers for Disease Control and Prevention;2017.
5. Yeom JS, Ryu SH, Oh S, Choi DH, Song KJ, Oh YH, Lee JH, Kim YA, Ahn SY, Yang HY, Cha JE, Park JW. Evaluation of anti-malarial effects of mass chemoprophylaxis in the Republic of Korea army. J Korean Med Sci. 2005; 20:707–712.

6. Yeom JS, Jun G, Kim JY, Lee WJ, Shin EH, Chang KS, Bang JH, Oh S, Kang JY, Park JW. Status of Plasmodium vivax malaria in the Republic of Korea, 2008-2009: decrease followed by resurgence. Trans R Soc Trop Med Hyg. 2012; 106:429–436.

7. World Health Organization. Guidelines for the treatment of malaria. 3rd ed. Geneva: World Health Organization;2015.
8. Korea Centers for Disease Control and Prevention. Epidemiology and management of vaccine preventable disease. 5th ed. Cheongju: Korea Centers for Disease Control and Prevention;2017.
9. World Health Organization. Global strategy for dengue prevention and control, 2012-2020. Geneva: World Health Organization;2012.
10. Thomas SJ, Endy TP, Rothman AL, Barrwtt AD. Flaviviruses. In : Bennett JE, Dolin R, Blaser MJ, editors. Mandell, Douglas and Bennett's principles and practice of infectious diseases. 8th ed. Philadelphia: Elsevier;2015. p. 1881–1903.
11. Korea Centers for Disease Control and Prevention. Infectious diseases surveillance yearbook 2015. Cheongju: Korea Centers for Disease Control and Prevention;2016.
12. Korea Centers for Disease Control and Prevention. Tick and mite borne disease management guideline. Cheongju: Korea Centers for Disease Control and Prevention;2017.
13. Kim DM. Rickettsia. Korea Society of Infectious Disease. Infectious disease. Seoul: Kunja;2014. p. 709–726.
14. Yu XJ, Liang MF, Zhang SY, Liu Y, Li JD, Sun YL, Zhang L, Zhang QF, Popov VL, Li C, Qu J, Li Q, Zhang YP, Hai R, Wu W, Wang Q, Zhan FX, Wang XJ, Kan B, Wang SW, Wan KL, Jing HQ, Lu JX, Yin WW, Zhou H, Guan XH, Liu JF, Bi ZQ, Liu GH, Ren J, Wang H, Zhao Z, Song JD, He JR, Wan T, Zhang JS, Fu XP, Sun LN, Dong XP, Feng ZJ, Yang WZ, Hong T, Zhang Y, Walker DH, Wang Y, Li DX. Fever with thrombocytopenia associated with a novel bunyavirus in China. N Engl J Med. 2011; 364:1523–1532.

15. Li Y, Zhou H, Mu D, Yin W, Yu H. Epidemiological analysis on severe fever with thrombocytopenia syndrome under the national surveillance data from 2011 to 2014, China. Zhonghua Liu Xing Bing Xue Za Zhi. 2015; 36:598–602.
16. National Institute of Infectious Diseases. Severe fever with thrombocytopenia syndrome (SFTS) in Japan, as of February 2016. IASR. 2016; 37:39–40.




 PDF
PDF ePub
ePub Citation
Citation Print
Print






 XML Download
XML Download