Abstract
The objectives of this article are to review current pharmacologic approaches for the treatment of osteoporosis in Korea. Calcium and vitamin D supplementation are necessary for osteoporotic patients with inadequate calcium intake and low vitamin D nutritional status, which is a risk factor of osteoporosis. Several pharmacologic therapies are available for treatment of osteoporosis. Antiresorptive agents, bisphosphonates, selective estrogen receptor modulators, denosumab, estrogens, and tibolone are the basis of therapy. Antiresorptive medications reduce the rates of bone remodeling. Several drugs have shown their ability to reduce vertebral and/or nonvertebral fractures in patients with osteoporosis. Bisphosphonates that reduced bone loss and fragility are usually the mainstay of the treatment of osteoporosis. The recently registered denosumab shows similar anti-fracture efficacy by neutralizing receptor activator of nuclear factor-κB ligand, however, marked differences in reversibility can be observed between the two drugs. The anabolic agents, teriparatide, stimulates new bone formation, increases bone density, and reduces fractures. Other treatment options such as hormone replacement therapy, tibolone, raloxifene, and bazedoxifene are also reviewed in this article. Pharmacologic treatments of osteoporosis are associated with adverse effects, but the benefits generally far surpass the risks.
골다공증 치료제는 골흡수억제제와 골형성촉진제로 나눌 수 있다. 골흡수억제제로는 비스포스포네이트(bisphosphonate), 랄록시펜(raloxifene), 바제독시펜(bazedoxifene), 데노수맙(denosumab), 에스트로겐(estrogen) 등이 있다. 골흡수억제제를 투여하면 골량이 유지되거나 골소실을 억제하며 새로운 골절 위험도가 감소한다. 골량을 증가시키는 골형성촉진제로는 부갑상선호르몬이 사용되고 있다.
약물치료를 하는 경우에도 적절한 운동과 칼슘, 비타민D 섭취가 필요하며 흡연과 지나친 음주는 금하여야 한다. 추가적인 골소실 방지와 골절의 위험성을 감소시키기 위하여 치료가 가능한 원인을 찾아 제거하여야 한다.
골다공증 약물치료를 시작하는 기준은 지침을 발표하는 기관에 따라 차이가 있으나 일반적으로 폐경 후 여성과 50세 이상의 남성에서 (1) 대퇴골 혹은 척추 골절이 있었던 경우, (2) 골밀도 T-값 -2.5 이하로 골다공증이 있는 경우, (3) 골감소증이 있으면서 과거의 기타 골절, 골절의 위험이 증가된 이차성 원인, 세계보건기구에서 제시한 10년 내 대퇴골 골절위험도가 3% 이상이거나 주요한 골다공증 골절(척추, 대퇴골, 손목, 상완골 포함) 위험도가 20% 이상인 경우에는 치료해야 한다고 권고하고 있다.
적절한 영양, 특히 칼슘과 비타민D는 골격의 성장, 유지뿐만 아니라 골다공증의 예방과 치료에 중요하다. 칼슘과 비타민D의 영양상태가 적절하지 않은 경우 혈액의 칼슘 농도를 정상으로 유지하기 위하여 부갑상선호르몬 농도가 증가(이차성 부갑상선기능항진증)하고, 이에 의해 골교체율이 증가하며 이어서 골소실과 골절 위험이 증가한다. 국민건강영양조사에 따르면 칼슘은 섭취가 가장 적은 영양소이다. 폐경 후 골다공증 여성을 대상으로 비타민D 영양상태를 반영하는 혈청 25(OH)D 농도를 분석한 결과 비타민D 불충분이 전세계적인 현상이었고, 한국도 결핍이 심한 나라 중의 하나였다. 우리나라에서 칼슘과 비타민D 섭취 부족은 고령이거나, 시골에서 거주하는 경우 더 많이 관찰되었다[1]. 50세 이상의 성인에서 칼슘섭취가 낮은 경우 골밀도가 감소한 현상을 관찰할 수 있었고, 골다공증의 위험도가 증가하였다[2].
칼슘은 역치영양소로 필요한 양보다 적게 섭취하면 골량이 감소하지만, 섭취를 필요 이상으로 증가시켜도 더 이상의 이익은 없는 것으로 알려져 있다. 2015년 발표된 보건복지부의 영양소섭취기준에 따르면 50세 이상 한국 여성의 칼슘 권장섭취량은 하루 800 mg이고, 대한골대사학회에서는 하루 800-1,000 mg의 칼슘섭취를 권장하고 있다. 칼슘보충제 투여는 위장장애나 변비 이외에는 중대한 부작용이 없지만, 고칼슘혈증, 신결석증, 고칼슘뇨증이 있는 환자에게는 칼슘 투여를 줄이거나 중단하여야 한다. 칼슘보충제를 과다하게 복용하면 심근경색 등 심혈관질환의 위험도가 증가한다는 발표가 있으며, 이에 대해 미국골대사학회(American Society for Bone and Mineral Research)에서는 칼슘보충제에 대해 소량을 섭취해도 이득이 있고, 많이 섭취하는 것이 반드시 좋은 것은 아니며, 노인이나 신장기능이 나쁜 경우 칼슘보충제가 심혈관질환의 위험도를 높일 가능성이 있다고 밝히고 있다.
자외선에 의해 피부에서 생성되거나 음식을 통해서 섭취되는 비타민D는 골격 성장 및 유지, 무기질의 항상성 유지에 필수적인 호르몬이고, 골다공증의 예방과 치료뿐만 아니라 근력, 근육 수축 및 신경근육기능 조절에도 중요한 역할을 한다. 비타민D의 여러 가지 대사물 중의 하나인 비활성형 비타민D (cholecalciferol)는 칼슘이나 종합영양제 또는 골다공증 치료제인 비스포스포네이트와 복합제로 시판되거나 단독으로 시판되고 있다.
우리나라의 경우 2015년 발표된 보건복지부의 비타민D의 충분섭취량은 19–49세의 경우 하루 400 IU (10 µg)로 증가하였고 65세 이상에서는 600 IU로 5년 전에 비해 증가했지만, 많은 골다공증 연구에서는 이보다 많은 용량의 비타민D 섭취를 권하고 있다. 대한골대사학회에서는 하루 800 IU의 섭취를 권장하고 있다. 비타민D는 체내 지방에 저장이 되기 때문에 비활성형 비타민D에 의한 독성 증상이 나타나면 치료를 중단한 후에도 수주간 증상이 나타날 수 있다. 약리적 비타민D 투여의 가장 중요한 부작용은 장에서 칼슘과 인의 흡수 증가, 골격의 골흡수 증가에 의한 고칼슘혈증, 고인산혈증 및 고칼슘뇨증 등이다.
비스포스포네이트는 생체 내에서 무기질의 침착과 용해를 조절하는 pyrophosphate의 유도체이다. 파골세포에 의한 골흡수를 강력하게 억제하는 비스포스포네이트는 체내에 흡수된 후 골격의 무기질인 수산화인회석 결정에 선택적으로 결합한다. 골의 무기질에 결합되어 있던 비스포스포네이트는 파골세포의 골흡수에 의해 국소적으로 방출되고 이에 노출된 파골세포는 활성이 억제되고 형태도 변한다. 비스포스포네이트는 파골세포에서 분비되는 산과 리소솜 효소의 분비를 억제하여 골흡수를 감소시킨다.
임상에서 골다공증 치료에 사용되는 비스포스포네이트에는 알렌드로네이트, 리세드로네이트, 이반드로네이트, 졸레드로네이트 등이 있다. 비스포스포네이트 복용법으로는 매일 공복에 복용하는 방법 이외에도 환자의 순응도를 높이기 위하여 일주일에 한번, 한 달에 한번 복용하는 용법도 사용되고 있다. 주사제의 경우 3개월에 한번 정맥주사를 하는 이반드로네이트, 일 년에 한번 정맥주사를 하는 졸레드로네이트도 사용되고 있다. 비스포스포네이트는 생체흡수율이 매우 낮아 경구투여 시 음식, 칼슘, 철분 등과 함께 복용하면 흡수율이 더욱 감소되고, 공복에 200 mL 이상 충분한 양의 물과 함께 복용해야 하며, 약물투여 후 약 30분 이상 공복을 유지해야 한다. 투약 후 30분간 앉거나 일어선 자세를 유지하여 역류성 식도염을 방지해야 한다. 고용량의 경구용 비스포스포네이트를 투여하는 경우나 주사용 비스포스포네이트를 투여할 경우에 급성기 반응(발열, 근육통, 관절통 등)이 초반에 발생할 수 있으나, 대부분 3일 이내에 자연 소실되며, 반복 투여 시에는 점차 감소된다. 예방적으로 해열 진통제, 항히스타민, 스테로이드 등을 사전에 사용할 수도 있다. 일과성 저칼슘혈증이 발생될 수 있으며, 특히 칼슘과 비타민D 영양상태가 좋지 않은 경우 칼슘과 비타민D의 보충이 필요하다. 비스포스포네이트를 정맥 주사할 경우 혈액 내에 칼슘과 복합체를 형성하여 신장기능에 장애를 줄 수 있으므로 정해진 주입속도를 준수해야 한다. 저칼슘혈증, 골연화증, 임산부, 수유부, 크레아티닌 청소율이 30 mL/min 미만인 경우는 사용하지 않는다. 홍체염, 결막염 및 포도막염 등의 안과적 이상반응을 일으킬 수 있다는 보고도 있다.
우리나라에서 1998년 이후 사용되기 시작한 알렌드로네이트(alendronate)의 경우, 척추 골절이 있는 폐경 후 여성을 대상으로 2년간 5 mg, 이후 10 mg을 하루 한번씩 36개월간 투여한 연구에서 추가 척추 골절의 위험도가 47-55% 감소하였다[3]. 척추 골절이 없고 골밀도만 감소해있는 폐경 후 여성에서도 추가 척추 골절 위험도가 44% 감소하였고, 대퇴 경부의 T-값이 −2.5 이하인 경우 임상적 골절 위험도가 36% 감소하였다[4]. 폐경 후 여성에서 알렌드로네이트를 5년간 투여 후 추가로 5년을 더 투여한 연구에서 비척추 골절은 투여군과 플라세보군 간에 차이가 없었으나, 임상적 척추 골절의 상대 위험도는 투여군에서 55% 감소하였다[5].
알렌드로네이트를 10년간 경구투여한 임상연구에서 요추골밀도는 13.7% 증가되었고, 대퇴부와 전신골밀도의 경우 8-10년에는 증가된 골밀도를 잘 유지하는 것으로 알려졌다[6]. 알렌드로네이트를 매일 복용하는 경우보다 알렌드로네이트 70 mg을 일주일에 한번 복용하는 투여법에 대한 순응도 및 선호도가 좀더 높다. 알렌드로네이트 70 mg은 비타민D와 복합제로도 사용되고 있다. 매주 투여하는 알렌드로네이트는 매일 투여하는 것과 유사하게 골흡수를 억제하고 골량과 골격의 강도에 비슷한 효과를 나타낼 수 있다[7].
알렌드로네이트는 남성 골다공증의 치료에도 유용하게 사용된다. 골다공증이 있는 남성 241명을 대상으로 하루 10 mg의 알렌드로네이트를 2년간 투여한 결과 알렌드로네이트를 투여받은 남성은 척추골밀도가 약 7.1% 증가하였고, 대퇴경부 골밀도가 2.5% 증가하였다. 알렌드로네이트 투여군의 척추 골절 발생이 감소하였고, 신장감소도 유의하게 예방되었다[8].
치료 전 척추 골절이 하나 이상인 85세 미만의 기동 가능한 폐경 후 여성을 대상으로 리세드로네이트(risedronate) 5 mg을 하루 한번 3년간 투여한 연구에서 척추 골절이 플라세보군에 비해 41% 감소하였다. 골절 감소의 65%는 첫 1년에 관찰되었으며 3년간 비척추 골절의 누적 발생률은 39% 감소되었다. 리세드로네이트 치료에 의해 형성된 골격은 조직학적으로 정상이었으며, 위장관 부작용을 포함한 안전성도 플라세보군과 유사했다[9]. 리세드로네이트는 골밀도가 매우 낮은 70세 이후의 여성 노인에서 대퇴골절 발생 위험도를 30-40% 감소시킨다는 보고도 있다[10].
리세드로네이트 5 mg을 5년간 투여한 연구에서 새로운 척추 골절의 위험도는 59% 감소하여 3년째의 결과인 49% 감소에 비해서 더욱 감소하였다. 골교체율의 표지자도 감소된 상태로 유지되었고, 요추 골밀도는 치료 전에 비해 9.3% 증가하였다고 보고하고 있다. 리세드로네이트 5 mg을 7년간 투여한 연구에서 요추 골밀도가 11.5%, 전체 대퇴부 골밀도가 3.9% 증가하였고 척추 골절에 대한 억제효과도 지속된다는 보고를 하고 있다[11]. 리세드로네이트는 남성 골다공증 환자의 골밀도를 향상시키고, 척추 및 비척추 골절의 위험도를 낮춘다[12]. 리세드로네이트는 매일 복용하는 5 mg, 한 주에 한번 복용하는 35 mg, 한 달에 한번 복용하는 150 mg 제형이 있고, 비타민D와 복합되어 있는 제형도 있다.
요추 골절이 있는 폐경 후 골다공증 여성을 대상으로 이반드로네이트(ibandronate) 2.5 mg을 매일 투여한 군과 20 mg을 격일로 12번 투여하는 방법을 매 3개월마다 반복한 군을 비교한 3년간의 연구에서 매일 투여군과 3개월마다 격일로 12번 투여군의 척추 골절은 위약군에 비해 각각 62%, 50% 감소하였고, 비척추 골절의 감소는 투여군 간에 차이가 없었으나 대퇴 경부의 골밀도 T-값이 −3.0 이하인 군에서는 골절 위험도가 각각 69%, 37% 감소하였다.
골다공증이 있는 폐경 후 여성을 대상으로 이반드로네이트 2.5 mg과 한 달에 한번 150 mg 투여를 비교한 연구에서 치료 1년 후 요추 골밀도는 각각 3.9%, 4.9% 증가하여 한 달에 한번 150 mg을 투여하는 치료법이 2.5 mg을 매일 투여하는 치료에 비해 열등하지 않았다[13].
졸레드로네이트(zoledronate)는 5 mg을 1년에 1번씩 3년간 정맥 투여한 골절예방 연구에서 대조군과 비교하여 혈청 골표지자가 유의하게 감소되었으며, 요추골밀도가 6.7%, 대퇴골 경부 골밀도가 5.1% 증가되었다. 척추 골절은 약 70%, 대퇴골 골절은 41%, 비척추 골절은 25% 감소되었다[16]. 대퇴골 골절이 있었던 환자를 대상으로 수술 치료 90일 이내에 졸레드로네이트를 사용한 경우에 임상적 골절을 35% 감소시켰으며 사망률을 28% 감소시켰다[17]. 졸레드로네이트를 9년간 투여한 연구에서 마지막 3년간은 투여를 중단해도 골밀도의 감소나 골절의 증가가 관찰되지 않아서 6년 투여 이후에는 적어도 3년간은 투약을 중단할 수 있다는 연구가 최근 발표되었다[18]. 졸레드로네이트는 남성 골다공증 환자에서도 척추 골절의 위험도를 유의하게 감소시킨다. 졸레드로네이트 4 mg은 악성 종양으로 인한 고칼슘혈증, 골전이 등에 항암제와 병행되는 치료법으로도 사용된다.
비스포스포네이트를 3-5년 이상 장기간 투여할 경우 드물게 아래의 이상 반응이 발생할 수 있다. 2003년 비스포스포네이트와 관련된 턱뼈괴사bisphosphonate-related osteonecrosis of the jaw, BRONJ)가 처음으로 문헌 보고되었고[19], 이후 발표된 국내 조사에서는 BRONJ의 발생 빈도가 비스포스포네이트 사용 환자 중 0.04%로 추정된다고 보고하고 있다[20]. 데노수맙과 혈관신생억제제에서도 턱뼈괴사가 발생하기 때문에 최근에는 medication-related osteonecrosis of the jaw (MRONJ)로도 불리워진다. MRONJ는 치아 발치, 임플란트 및 구강 내 수술 등 침습적 치료 이후 매우 드물게 발생하는 것으로 알려져 있고, 일부 자연적으로 발병할 수 있지만, 대개는 발치나 구강 내 수술과 연관되어 발생하고, 비스포스포네이트를 장기간 투여할수록 발병 위험이 높아진다. 일단 발생하고 나면 치료가 어렵기 때문에 고위험군의 환자에 있어서는 예방이 최우선적으로 고려되어야 한다.
MRONJ는 (1) 골흡수억제제 또는 혈관신생억제제를 과거에 복용하였거나, 또는 현재 복용하고 있는 경우, (2) 악골(턱뼈) 부위에 뼈가 노출되어 있거나 구강내 또는 구강외로 누공이 8주 이상 지속되는 경우, (3) 턱 부위에 방사선 치료를 받은 과거력이나 골전이가 없는 경우에 진단을 할 수 있다. 비스포스포네이트의 경우에는 주사제가 경구제제보다 MRONJ 발병위험이 높다. 경구로도 장기간 투여할 경우 위험률이 증가할 수 있다. 음주 및 흡연, 고령, 악성종양, 만성신부전, 당뇨병, 항암요법, 스테로이드제 등의 위험인자가 있는 경우에는 MRONJ 발병위험이 증가할 수 있다[21].
2007년 장기간 비스포스포네이트 제제를 복용하는 환자에서 사소한 외상으로도 대퇴골이 골절되는 특이한 형태의 골절이 보고되었고, 이는 기존의 대퇴골 골절과 양상이 다르기 때문에 비전형 대퇴골 골절이라 불리운다. 비스포스포네이트 사용에 의해 예방되는 척추, 대퇴골 골절 등의 숫자를 고려할 때 비전형 대퇴골 골절의 발생 빈도는 매우 낮으며, 비스포스포네이트 사용에 따른 골다공증 골절의 감소에 의한 이득이 더 많다[2223].
비스포스포네이트는 투약 중단 후에도 골격의 미네랄에 결합하여 남아있고 이에 의해 골흡수 억제작용이 유지되기 때문에, 골절 예방 효과는 유지시키면서 부작용의 위험성을 감소시킬 수 있는 약물휴지기를 고려하게 되었다[24]. 약물치료 지속여부는 임상적인 판단이 중요하며, 골밀도의 변화, 골다공증 골절 위험인자의 평가가 포함되어야 한다. 골다공증 골절의 위험도가 높거나 대퇴부 골밀도의 T-값이 -2.5 이하로 계속 낮을 경우에는 비스포스포네이트를 중단하지 않고 지속적으로 사용하거나 다른 약물로 교체하는 것을 고려할 수 있다. 비스포스포네이트의 투여기간은 정해져 있지 않지만 처음 3-5년간 약물치료 후에는 환자의 골절위험도에 따라 평가를 하여 치료기간을 개별화한다(Figure 1) [25].
선택적 에스트로겐 수용체 조절제(selective estrogen receptor modulator, SERM)는 에스트로겐 수용체와 결합하여 리간드로 작용할 수 있는 다양한 비스테로이드 복합체를 지칭한다. SERM의 효과는 사용되는 SERM의 종류, 에스트로겐 수용체 종류, 호르몬과 반응하는 유전자 조절부위, 각종 전사인자와 조절단백질 등에 의해 결정된다. 다양한 SERM이 개발되어 있으나 랄록시펜과 바제독시펜이 폐경 후 골다공증의 예방 및 치료제로 사용되고 있다. SERM에 의한 척추 골절 감소 효과는 증가되는 골밀도에 비해 기대 이상으로 큰 것으로 골교체율의 감소, 골질과 미세구조의 향상, 기계적인 역학의 변화 등으로 설명하기도 한다.
랄록시펜은 benzothiophene의 변형체로 장기간 투여하면 골밀도가 증가하고, 척추 골절을 감소시킨다. 폐경 후 골다공증 환자 7,705명을 대상으로 하루 60, 120 mg의 랄록시펜을 3년간 투여한 Multiple Outcomes of Raloxifene Evaluation (MORE) 연구에서 대퇴경부의 골밀도는 각각 2.1%, 2.4% 증가하였고, 척추 골밀도는 각각 2.6%, 2.7% 증가하였다. 또한 척추 골절은 60, 120 mg/day 군에서 각각 30%, 50% 감소되었으나, 비척추 골절의 발생이 감소하지는 않았다. 4년간의 MORE 연구에서 하나 이상의 새로운 척추 골절 감소 비교위험도는 랄록시펜 60 mg/day을 사용하였을 경우 36% 감소되었다. 4년째만을 분석하였을 때 새로운 척추 골절을 39% 감소시켰으며 이는 3년간의 자료분석과 유사한 결과를 보여주고 있다[26].
최근 연구에 의하면 랄록시펜의 유방암의 예방효과는 타목시펜과 유사하며, 이상반응은 보다 적은 것으로 밝혀졌다. 미국 식품의약국에서는 골다공증을 가진 폐경 후 여성, 유방암 발생의 위험도가 높은 여성에서 침윤성 유방암의 위험성을 감소시키기 위한 랄록시펜의 사용을 2007년 승인하였다. 랄록시펜은 열성 홍조와 다리 경련의 발생 빈도를 증가시키며, 열성 홍조는 약물투여 수개월 내에 12–15%의 환자에서 발생한다. 이로 인해 약물복용을 중단하는 경우는 드물다. 관상동맥질환에는 영향을 주지 않으며 정맥혈전색전증과 치명적 뇌졸중의 위험도를 증가시키나, 사망률에는 차이가 없다는 보고도 있다[27].
바제독시펜(bazedoxifene)은 indole 계통의 SERM이다. 폐경 후 골다공증 환자에게 바제독시펜 20 mg을 하루에 한번 3년간 경구투여한 결과 새로운 척추 골절의 위험도가 42% 감소되었으나, 비척추 골절의 위험도는 골절 위험도가 증가되어 있는 군에서만 낮추었다[28]. 폐경 후 골다공증 여성에서 하루 바제독시펜 20 mg을 5년간 경구투여한 결과, 새로운 척추 골절의 발생위험도가 감소하였고, 골절의 위험도가 높았던 군에서는 비척추 골절의 위험도를 낮추었다[29]. 바제독시펜 투여군에서 열성 홍조와 다리 경련의 발생이 증가한다. 심부정맥혈전증의 발생 빈도는 에스트로겐과 유사하게 증가하지만, 유방암의 발생 빈도는 차이가 없었다. 최근에는 SERM과 에스트로겐을 병합투여하는 tissue selective estrogen complex (TSEC)가 시도되고 있다. TSEC을 투여할 경우 여성호르몬에 의한 자궁내막증식이 억제되고 열성 홍조 등의 갱년기 증상이 개선된다는 보고가 있다.
파골세포 활성화에 중요한 싸이토카인인 receptor activator of nuclear factor-κB ligand (RANKL)는 조골세포 또는 활성화된 면역세포에서 생성된다. RANKL은 파골세포 및 전구세포에 위치한 수용체 receptor activator of nuclear factor-κB와 결합하여 파골세포의 형성과 활성을 촉진한다. 데노수맙은 RANKL에 대한 인간 단클론성 항체이다.
폐경 후 골다공증 환자에게 데노수맙 60 mg을 6개월에 한번씩 36개월간 피하 주사한 연구에서 척추 골절의 위험도는 위약군에 비해 68% 감소하였고, 대퇴 골절은 40%, 비척추 골절은 20% 감소하였다[30]. 데노수맙을 8년간 투여한 연구에서 척추 골밀도는 18.4%, 대퇴부 골밀도는 8.3% 증가하였다[31]. 국내에서 폐경 후 골다공증 여성을 대상으로 12개월간 시행한 연구에서 데노수맙 주사군은 12개월 후 기저치에 비해 요추 골밀도가 5.5% 증가하였고, 대퇴부의 골밀도도 증가하였다[32].
데노수맙 60 mg 매 6개월 투여와 알렌드로네이트 70 mg 매주 투여의 효과와 안전성을 관찰하기 위해 1,189명의 폐경 후 여성을 대상으로 시행한 연구에서 데노수맙 투여군의 전체 대퇴골 골밀도는 투여 12개월에 알렌드로네이트군에 비해 유의하게 증가하였고, 대퇴골 경부, 요추 골밀도도 유의하게 증가하였다. 데노수맙 투여군의 골표지자는 알렌드로네이트군에 비해 유의하게 감소하였다. 데노수맙 3년 투여 시 습진, 단독을 포함한 연조직염 등의 이상반응이 의미 있게 증가되었고, 데노수맙을 8년간 투여한 연구에서 8건의 턱뼈괴사와 2건의 비전형 대퇴골 골절이 발생하였다[31].
에스트로겐은 열성 홍조, 발한, 심계 항진 등의 폐경 후 증상을 완화시킬 뿐만 아니라, 폐경 후 가속화된 골소실을 방지하고, 증가된 골재형성을 감소시키고, 장을 통한 칼슘 흡수를 증가시키며 요칼슘의 손실을 감소시킨다. 폐경 이후 장기간 에스트로겐을 투여할 경우 골다공증의 발생을 지속적으로 예방할 수 있고, 65세 이상의 노인에게 에스트로겐을 투여하는 경우에도 골밀도의 증가를 관찰된다. Women's Health Initiatives (WHI) 연구에서 에스트로겐 투여군에서는 새로운 척추 골절, 비척추 골절, 대퇴부 골절의 발생 빈도가 감소되었다. 에스트로겐과 프로게스틴을 함께 투여한 군에서는 플라세보군에 비해서 골절의 위험도가 대퇴부 33%, 비척추 골절 25%, 전체 골절 15–32% 감소하였고[33], 에스트로겐만 투여한 군에서는 플라세보군에 비해서 골절의 위험도가 대퇴부 35%, 임상적 척추 골절 36%, 손목 골절 42%, 전체 골절 29% 감소하였다[34].
자궁이 있는 여성이 에스트로겐과 프로게스토겐을 병합사용하면 자궁내막암의 위험도가 호르몬치료를 받지 않는 폐경 후 여성보다 증가하지 않는다. 에스트로겐과 유방암의 관계에 대하여 WHI 연구에서 에스트로겐과 프로게스토겐을 5년 이상 병합사용하면 침습 유방암의 위험도가 플라세보군에 비해 24% 증가하였다. 반면에 에스트로겐만을 사용한 군에서는 유방암의 위험도가 통계적으로 유의하지 않았지만 플라세보군에 비해서 21% 감소하였다[35].
여성호르몬의 투여를 위해서 위험과 이득에 대한 충분한 설명과 논의가 필요하며, 개개인의 치료 목표를 고려하여 사용하는 것이 좋고, 가능하면 낮은 용량을 시도하는 것이 바람직하다. 또한 심혈관질환의 일차예방이나 이차예방을 위한 목적으로는 사용하지 않아야 한다. 에스트로겐의 효과를 최대로 얻기 위해서는 폐경 직후부터 사용하는 것이 좋다. 한편 갱년기 증상의 치료에는 여성호르몬 치료가 가장 효과적인 것으로 알려져 있다.
티볼론(tibolone)은 체내에서 에스토로겐, 프로게스토겐, 안드로겐으로 전환된다. 유방과 자궁내막 조직은 자극하지 않으면서 폐경 증상을 완화하고 폐경 후 골소실을 예방한다. 골다공증이 있는 여성에서 티볼론 1.25 mg을 3년간 투여한 연구에서 플라세보군에 비해서 새로운 척추 골절의 상대위험도는 45%, 비척추 골절은 26% 감소하였다[36].
Teriparatide는 미국 식품의약국의 승인을 받은 골다공증 치료제 중 유일한 골형성촉진제로 부갑상선호르몬(parathyroid hormone, PTH)의 1-34 아미노 말단 부위로 이루어진다. 이 부위는 1-84개의 아미노산으로 이루어진 PTH와 동일한 생리학적 활성을 갖는다. PTH를 지속적으로 투여하면 파골세포의 활성과 수가 증가하여 골량이 감소하나, 간헐적으로 낮은 용량의 PTH를 하루에 한번씩 주사로 투여하면 골량이 증가한다.
PTH의 골형성작용에는 Wnt 경로, Runx2, RANKL, osteoprotegerin, insulin-like growth factor 등이 관여한다고 알려져 있다[37]. 또한 PTH는 뼈의 내막세포가 조골세포로 되는 것을 유도하여 조골세포의 수와 활성을 증가시킨다. 성숙한 조골세포의 세포자멸사를 억제한다.
척추 골절이 있는 폐경 후 여성 1,637명을 대상으로 20 또는 40 µg의 PTH(1–34)를 매일 피하주사한 연구에서 새로운 척추 골절의 비교위험도는 각각 0.35, 0.31로 감소하였고 새로운 비척추 골절의 비교위험도는 각각 0.47, 0.46으로 감소하였다. 플라세보군에 비해 20 또는 40 µg의 PTH(1–34) 투여군은 척추골밀도가 9, 13% 증가하였고, 대퇴경부 골밀도는 3, 6% 증가하였다. 전신 골밀도는 플라세보군에 비해 2-4% 증가하였고, 오심과 두통 등 경미한 부작용만 있었다[38]. Teriparatide를 사용한 연구들의 메타분석에서도 척추 골절의 위험도는 70% 감소하였고, 비척추 골절 위험도는 38% 감소하였다[39]. 권장용량은 1일 1회 20 µg이며, 대퇴부 또는 복부에 피하주사 한다. 이 약의 투약기간은 최대 24개월이다. 최근 주 1회 피하주사제인 teriparatide 56.5 µg도 임상에서 사용되고 있으며 새로운 척추 골절 위험도를 80% 감소시켰다고 보고하고 있다. 이 약의 최대 투약기간은 72주이다[40].
적절한 칼슘, 비타민D 섭취가 골다공증 약물치료에 필요하다. 골다공증 치료제 중 골흡수억제제로는 비스포스포네이트, 선택적 에스트로겐 수용체, 데노수맙, 에스트로겐, 티볼론 등이 있다. 골흡수억제제를 투여하면 골량이 유지되거나 골소실을 억제하며 새로운 골절 위험도가 감소한다. 골형성촉진제로 유일하게 사용되고 있는 부갑상선호르몬은 골량을 증가시키고, 골절 위험도를 감소시킨다. 골다공증 약물치료에는 이상반응이 있을 수 있으나, 약물치료에 의해 얻는 이득이 손실보다 매우 크다.
평균 수명의 증가와 함께 고령사회로 진입하면서 골다공증의 관리가 중요한 문제로 대두되고 있다. 본 논문은 증거중심의 객관적인 시각으로 골다공증의 다양한 치료약제를 잘 정리한 리뷰논문으로 각 약제의 대표 임상연구와 특징을 소개하고 사용 시 주의해야 할 내용 및 새로운 약제에 대하여도 적절하게 기술하였다. 그간 골다공증 치료약제에 대한 다양한 연구결과가 발표되면서 진료현장에서 혼란이 야기된 부분도 있는데 이에 대하여도 임상진료지침과 신뢰할만한 근거자료를 통하여 간략하게 잘 정리하였다. 한편 최근 비스포스포네이트의 부작용으로 선택의 폭이 증가한 선택적 에스트로겐 수용체 조절제의 적절한 사용 및 새로 출시될 신약 데노수맙의 효과 및 사용방법을 알아보았고, 최근 보험 등재되는 골형성촉진제인 부갑상선호르몬의 효과 및 사용방법을 살펴보아 임상가들에게 많은 도움이 될 것으로 사료된다.
[정리: 편집위원회]
Figures and Tables
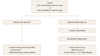 | Figure 1Proposed algorithm for the selection of candidates for drug holidays and principles of monitoring. BMD, bone mineral density. a)T-score at any site still ≤2.5 after bisphosphonate therapy, previous fracture of the hip or spine, and secondary osteoporosis from chronic diseases or medication. Adapted from Lee SH et al. J Bone Metab 2015;22:167-174, according to the Creative Commons license [25]. |
References
1. Lee YK, Chang JS, Min YK, Byun DW, Park Y, Ha YC. Low calcium and vitamin D intake in Korean women over 50 years of age. J Bone Miner Metab. 2016; 09. 28. [Epub]. DOI: 10.1007/s00774-016-0782-7.

2. Kim KM, Choi SH, Lim S, Moon JH, Kim JH, Kim SW, Jang HC, Shin CS. Interactions between dietary calcium intake and bone mineral density or bone geometry in a low calcium intake population (KNHANES IV 2008-2010). J Clin Endocrinol Metab. 2014; 99:2409–2417.

3. Black DM, Cummings SR, Karpf DB, Cauley JA, Thompson DE, Nevitt MC, Bauer DC, Genant HK, Haskell WL, Marcus R, Ott SM, Torner JC, Quandt SA, Reiss TF, Ensrud KE. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures: Fracture Intervention Trial Research Group. Lancet. 1996; 348:1535–1541.

4. Cummings SR, Black DM, Thompson DE, Applegate WB, Barrett-Connor E, Musliner TA, Palermo L, Prineas R, Rubin SM, Scott JC, Vogt T, Wallace R, Yates AJ, LaCroix AZ. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures: results from the Fracture Intervention Trial. JAMA. 1998; 280:2077–2082.

5. Black DM, Schwartz AV, Ensrud KE, Cauley JA, Levis S, Quandt SA, Satterfield S, Wallace RB, Bauer DC, Palermo L, Wehren LE, Lombardi A, Santora AC, Cummings SR. FLEX Research Group. Effects of continuing or stopping alendronate after 5 years of treatment: the Fracture Intervention Trial Long-term Extension (FLEX). A randomized trial. JAMA. 2006; 296:2927–2938.

6. Bone HG, Hosking D, Devogelaer JP, Tucci JR, Emkey RD, Tonino RP, Rodriguez-Portales JA, Downs RW, Gupta J, Santora AC, Liberman UA. Alendronate Phase III Osteoporosis Treatment Study Group. Ten years' experience with alendronate for osteoporosis in postmenopausal women. N Engl J Med. 2004; 350:1189–1199.

7. Kim KJ, Min YK, Koh JM, Chung YS, Kim KM, Byun DW, Kim IJ, Kim M, Kim SS, Min KW, Han KO, Park HM, Shin CS, Choi SH, Park JS, Chung DJ, Mok JO, Baek HS, Moon SH, Kim YS, Lim SK. VALUE Study Group. Efficacy and safety of weekly alendronate plus vitamin D3 5600 IU versus weekly alendronate alone in Korean osteoporotic women: 16-week randomized trial. Yonsei Med J. 2014; 55:715–724.

8. Orwoll E, Ettinger M, Weiss S, Miller P, Kendler D, Graham J, Adami S, Weber K, Lorenc R, Pietschmann P, Vandormael K, Lombardi A. Alendronate for the treatment of osteoporosis in men. N Engl J Med. 2000; 343:604–610.

9. Harris ST, Watts NB, Genant HK, McKeever CD, Hangartner T, Keller M, Chesnut CH 3rd, Brown J, Eriksen EF, Hoseyni MS, Axelrod DW, Miller PD. Effects of risedronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis: a randomized controlled trial. Vertebral Efficacy with Risedronate Therapy (VERT) study group. JAMA. 1999; 282:1344–1352.

10. McClung MR, Geusens P, Miller PD, Zippel H, Bensen WG, Roux C, Adami S, Fogelman I, Diamond T, Eastell R, Meunier PJ, Reginster JY. Hip Intervention Program Study Group. Effect of risedronate on the risk of hip fracture in elderly women. Hip Intervention Program study group. N Engl J Med. 2001; 344:333–340.

11. Mellstrom DD, Sorensen OH, Goemaere S, Roux C, Johnson TD, Chines AA. Seven years of treatment with risedronate in women with postmenopausal osteoporosis. Calcif Tissue Int. 2004; 75:462–468.

12. Ringe JD, Farahmand P, Faber H, Dorst A. Sustained efficacy of risedronate in men with primary and secondary osteoporosis: results of a 2-year study. Rheumatol Int. 2009; 29:311–315.

13. Miller PD, McClung MR, Macovei L, Stakkestad JA, Luckey M, Bonvoisin B, Reginster JY, Recker RR, Hughes C, Lewiecki EM, Felsenberg D, Delmas PD, Kendler DL, Bolognese MA, Mairon N, Cooper C. Monthly oral ibandronate therapy in postmenopausal osteoporosis: 1-year results from the MOBILE study. J Bone Miner Res. 2005; 20:1315–1322.

14. Eisman JA, Civitelli R, Adami S, Czerwinski E, Recknor C, Prince R, Reginster JY, Zaidi M, Felsenberg D, Hughes C, Mairon N, Masanauskaite D, Reid DM, Delmas PD, Recker RR. Efficacy and tolerability of intravenous ibandronate injections in postmenopausal osteoporosis: 2-year results from the DIVA study. J Rheumatol. 2008; 35:488–497.
15. Cho IJ, Chung HY, Kim SW, Lee JW, Lee TW, Kim HS, Kim SG, Choi HS, Choi SH, Shin CS, Oh KW, Min YK, Koh JM, Rhee Y, Byun DW, Chung YS, Park JH, Chung DJ, Shong M, Hong EG, Lee CB, Baek KH, Kang MI. Efficacy of a once-monthly pill containing ibandronate and cholecalciferol on the levels of 25-hydroxyvitamin D and bone markers in postmenopausal women with osteoporosis. Endocrinol Metab (Seoul). 2015; 30:272–279.

16. Black DM, Delmas PD, Eastell R, Reid IR, Boonen S, Cauley JA, Cosman F, Lakatos P, Leung PC, Man Z, Mautalen C, Mesenbrink P, Hu H, Caminis J, Tong K, Rosario-Jansen T, Krasnow J, Hue TF, Sellmeyer D, Eriksen EF, Cummings SR. HORIZON Pivotal Fracture Trial. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med. 2007; 356:1809–1822.

17. Lyles KW, Colon-Emeric CS, Magaziner JS, Adachi JD, Pieper CF, Mautalen C, Hyldstrup L, Recknor C, Nordsletten L, Moore KA, Lavecchia C, Zhang J, Mesenbrink P, Hodgson PK, Abrams K, Orloff JJ, Horowitz Z, Eriksen EF, Boonen S. HORIZON Recurrent Fracture Trial. Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med. 2007; 357:1799–1809.

18. Black DM, Reid IR, Cauley JA, Cosman F, Leung PC, Lakatos P, Lippuner K, Cummings SR, Hue TF, Mukhopadhyay A, Tan M, Aftring RP, Eastell R. The effect of 6 versus 9 years of zoledronic acid treatment in osteoporosis: a randomized second extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2015; 30:934–944.

19. Song KE, Min YK, Lee JK, Lee KB, Joo HJ, Kwack KS, Chung YS. A probable case of oral bisphosphonate-associated osteonecrosis of the jaw and recovery with parathyroid hormone treatment. Curr Ther Res Clin Exp. 2008; 69:356–362.

20. Lee JK, Kim KW, Choi JY, Moon SY, Kim SG, Kim CH, Kim HM, Kwon YD, Kim YD, Lee DK, Min SK, Park IS, Park YW, Kook MS, Park HJ, Baek JA, Park JW, Kwon TG. Bisphosphonates-related osteonecrosis of the jaw in Korea: a preliminary report. J Korean Assoc Oral Maxillofac Surg. 2013; 39:9–13.

21. Kim KM, Rhee Y, Kwon YD, Kwon TG, Lee JK, Kim DY. Medication related osteonecrosis of the jaw: 2015 position statement of the Korean Society for Bone and Mineral Research and the Korean Association of Oral and Maxillofacial Surgeons. J Bone Metab. 2015; 22:151–165.

22. Shane E, Burr D, Abrahamsen B, Adler RA, Brown TD, Cheung AM, Cosman F, Curtis JR, Dell R, Dempster DW, Ebeling PR, Einhorn TA, Genant HK, Geusens P, Klaushofer K, Lane JM, McKiernan F, McKinney R, Ng A, Nieves J, O'Keefe R, Papapoulos S, Howe TS, van der Meulen MC, Weinstein RS, Whyte MP. Atypical subtrochanteric and diaphyseal femoral fractures: second report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res. 2014; 29:1–23.

23. Yang KH, Min BW, Ha YC. Atypical femoral fracture: 2015 position statement of the Korean Society for Bone and Mineral Research. J Bone Metab. 2015; 22:87–91.

24. Adler RA, El-Hajj Fuleihan G, Bauer DC, Camacho PM, Clarke BL, Clines GA, Compston JE, Drake MT, Edwards BJ, Favus MJ, Greenspan SL, McKinney R Jr, Pignolo RJ, Sellmeyer DE. Managing osteoporosis in patients on long-term bisphosphonate treatment: report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res. 2016; 31:16–35.

25. Lee SH, Gong HS, Kim TH, Park SY, Shin JH, Cho SW, Byun DW. Position statement: drug holiday in osteoporosis treatment with bisphosphonates in South Korea. J Bone Metab. 2015; 22:167–174.

26. Delmas PD, Ensrud KE, Adachi JD, Harper KD, Sarkar S, Gennari C, Reginster JY, Pols HA, Recker RR, Harris ST, Wu W, Genant HK, Black DM, Eastell R. Mulitple Outcomes of Raloxifene Evaluation Investigators. Efficacy of raloxifene on vertebral fracture risk reduction in postmenopausal women with osteoporosis: four-year results from a randomized clinical trial. J Clin Endocrinol Metab. 2002; 87:3609–3617.

27. Barrett-Connor E, Mosca L, Collins P, Geiger MJ, Grady D, Kornitzer M, McNabb MA, Wenger NK. Raloxifene Use for the Heart (RUTH) Trial Investigators. Effects of raloxifene on cardiovascular events and breast cancer in postmenopausal women. N Engl J Med. 2006; 355:125–137.

28. Silverman SL, Christiansen C, Genant HK, Vukicevic S, Zanchetta JR, de Villiers TJ, Constantine GD, Chines AA. Efficacy of bazedoxifene in reducing new vertebral fracture risk in postmenopausal women with osteoporosis: results from a 3-year, randomized, placebo-, and active-controlled clinical trial. J Bone Miner Res. 2008; 23:1923–1934.

29. Silverman SL, Chines AA, Kendler DL, Kung AW, Teglbjærg CS, Felsenberg D, Mairon N, Constantine GD, Adachi JD. Bazedoxifene Study Group. Sustained efficacy and safety of bazedoxifene in preventing fractures in postmenopausal women with osteoporosis: results of a 5-year, randomized, placebo-controlled study. Osteoporos Int. 2012; 23:351–363.

30. Cummings SR, San Martin J, McClung MR, Siris ES, Eastell R, Reid IR, Delmas P, Zoog HB, Austin M, Wang A, Kutilek S, Adami S, Zanchetta J, Libanati C, Siddhanti S, Christiansen C. FREEDOM Trial. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med. 2009; 361:756–765.

31. Papapoulos S, Lippuner K, Roux C, Lin CJ, Kendler DL, Lewiecki EM, Brandi ML, Czerwinski E, Franek E, Lakatos P, Mautalen C, Minisola S, Reginster JY, Jensen S, Daizadeh NS, Wang A, Gavin M, Libanati C, Wagman RB, Bone HG. The effect of 8 or 5 years of denosumab treatment in postmenopausal women with osteoporosis: results from the FREEDOM Extension study. Osteoporos Int. 2015; 26:2773–2783.

32. Koh JM, Chung DJ, Chung YS, Kang MI, Kim IJ, Min YK, Oh HJ, Park IH, Lee YS, Kravitz B, Waterhouse B, Nino A, Fitzpatrick LA. Assessment of denosumab in Korean post-menopausal women with osteoporosis: randomized, double-blind, placebo-controlled trial with open-label extension. Yonsei Med J. 2016; 57:905–914.

33. Cauley JA, Robbins J, Chen Z, Cummings SR, Jackson RD, LaCroix AZ, LeBoff M, Lewis CE, McGowan J, Neuner J, Pettinger M, Stefanick ML, Wactawski-Wende J, Watts NB. Women's Health Initiative Investigators. Effects of estrogen plus progestin on risk of fracture and bone mineral density: the Women's Health Initiative randomized trial. JAMA. 2003; 290:1729–1738.

34. Jackson RD, Wactawski-Wende J, LaCroix AZ, Pettinger M, Yood RA, Watts NB, Robbins JA, Lewis CE, Beresford SA, Ko MG, Naughton MJ, Satterfield S, Bassford T. Women's Health Initiative Investigators. Effects of conjugated equine estrogen on risk of fractures and BMD in postmenopausal women with hysterectomy: results from the women's health initiative randomized trial. J Bone Miner Res. 2006; 21:817–828.

35. Manson JE, Chlebowski RT, Stefanick ML, Aragaki AK, Rossouw JE, Prentice RL, Anderson G, Howard BV, Thomson CA, LaCroix AZ, Wactawski-Wende J, Jackson RD, Limacher M, Margolis KL, Wassertheil-Smoller S, Beresford SA, Cauley JA, Eaton CB, Gass M, Hsia J, Johnson KC, Kooperberg C, Kuller LH, Lewis CE, Liu S, Martin LW, Ockene JK, O'Sullivan MJ, Powell LH, Simon MS, Van Horn L, Vitolins MZ, Wallace RB. Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women's Health Initiative randomized trials. JAMA. 2013; 310:1353–1368.

36. Cummings SR, Ettinger B, Delmas PD, Kenemans P, Stathopoulos V, Verweij P, Mol-Arts M, Kloosterboer L, Mosca L, Christiansen C, Bilezikian J, Kerzberg EM, Johnson S, Zanchetta J, Grobbee DE, Seifert W, Eastell R. LIFT Trial Investigators. The effects of tibolone in older postmenopausal women. N Engl J Med. 2008; 359:697–708.

37. Cipriani C, Irani D, Bilezikian JP. Safety of osteoanabolic therapy: a decade of experience. J Bone Miner Res. 2012; 27:2419–2428.

38. Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY, Hodsman AB, Eriksen EF, Ish-Shalom S, Genant HK, Wang O, Mitlak BH. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med. 2001; 344:1434–1441.

39. Han SL, Wan SL. Effect of teriparatide on bone mineral density and fracture in postmenopausal osteoporosis: meta-analysis of randomised controlled trials. Int J Clin Pract. 2012; 66:199–209.

40. Nakamura T, Sugimoto T, Nakano T, Kishimoto H, Ito M, Fukunaga M, Hagino H, Sone T, Yoshikawa H, Nishizawa Y, Fujita T, Shiraki M. Randomized teriparatide [human parathyroid hormone (PTH) 1-34] Once-Weekly Efficacy Research (TOWER) trial for examining the reduction in new vertebral fractures in subjects with primary osteoporosis and high fracture risk. J Clin Endocrinol Metab. 2012; 97:3097–3106.





 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download