Abstract
Infantile hemangioma (IH) is the most common type of benign tumor during infancy. Due to their propensity to spontaneously involute, most IHs can be left untreated. However, IHs located in particular anatomic areas and those with complications need rapid and active treatment. It is often challenging for clinicians to predict which IHs are in need of systemic treatment. Data from various studies have revealed further insights into IH. The treatment options include propranolol, steroids, interferon-α, vincristine, surgical excision, and laser therapy. More infants are now treated with propranolol than were previously treated with oral corticosteroids, and the full implications of this shift in practice are not yet clear. This paper summarizes the pathogenesis, clinical course and current recommendations for management of IHs.
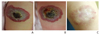
영아혈관종은 소아에서 발생하는 가장 흔한 양성 혈관종양으로, 영아의 약 2.6-4.5%에서 발생하는 것으로 알려져 있다[123]. 영아혈관종 발생의 위험인자에 대해서는 뚜렷이 밝혀져 있지는 않으나, 미숙아, 저체중출생아, 여아(여아:남아 2.4:1), 백인에서 발생빈도가 좀 더 높은 것으로 알려져 있다[45]. 특징적으로 생후 약 1년까지 증식하다가, 이후 수개월간 크기 변화를 보이지 않는 시기를 거쳐, 수년간 서서히 줄어드는 양상을 보이며 혈관종의 성장 및 퇴행의 정도는 사람들마다 큰 차이가 있다. 대부분의 경우, 영아혈관종은 크기가 작고, 합병증이 없으며 저절로 줄어들어 치료를 필요로 하지 않는다. 하지만, 환아의 약 5-10%에서는 혈관종의 위치에 따라 신체기능의 손상을 동반할 수도 있고, 증식속도가 빨라 크기가 커지면서 주변 조직의 손상을 일으키기도 하며, 드물게 생명을 위협하기도 하여 치료를 필요로 한다[6]. 형태학적으로 혈관종이 피부층에서 차지하고 있는 위치에 따라 superficial type, deep type, mixed type으로 나뉜다[7]. 즉 병변이 표재진피에 국한되어 있는 경우 superficial type으로 정의하고 망상진피에 존재하는 경우에는 deep type으로 분류한다. 한편 superficial type과 deep type이 혼재하는 병변의 경우 mixed type이라고 한다. Superficial type인 경우 밝은 핑크색, 붉은색을 보이나, deep seated type의 경우 푸르게 보이거나 피부색과 같은 덩어리처럼 보이기도 한다(Figure 1).
영아혈관종의 병리기전은 현재 명확히 밝혀져 있지는 않으며, 여러 요소들이 복합적으로 관여하리라 생각된다. North 등[8]은 혈관종의 endothelial-like cell이 erythrocyte-type glucose transporter protein인 glucose transporter 1 (GLUT-1)을 표현함을 확인하였고, 이는 영아혈관종의 특징적인 표지자로 다른 혈관 병변과의 감별을 하는데 있어 유용하게 사용되고 있다. GLUT-1의 경우 태반의 융모막 융모에서도 발현되고 있어, 몇몇 연구에서는 태반과 영아혈관종의 연관성 또한 제시되고 있다[9].
영아혈관종은 특징적으로 endothelial-like cell의 빠른 증식을 보여, 혈관신생 혹은 혈관형성과의 연관성에 대한 연구도 활발히 진행되고 있다. 증식기의 영아혈관종의 경우, circulating endothelial progenitor cell이 증가되어 있고, 혈관종 조직에서 CD34, CD133, lymphatic vessel endothelial hyaluronan receptor-1 (LYVE1)과 vascular endothelial growth factor receptor-2가 증가되어 있음이 확인되었다[101112]. 정상 lymphatic endothelial cell의 특이 표지자인 LVYE1과 immature vascular marker인 CD34에 양성인 점은 혈관종이 endothelial cell의 분화 과정 및 혈관종 세포의 성숙의 장애가 혈관종의 초기 빠른 성장의 원인이라는 사실을 시사한다.
영아혈관종의 가장 특징적인 임상양상은 약 1년간의 증식기를 거쳐, 저절로 수년 동안 퇴화하는 것이다. 영아혈관종은 초기에는 창백, 모세혈관 병변, 멍 혹은 출생 시 손상으로 보이기도 한다. 일반적으로 생후 2-4주경 눈에 보이게 커지나, 일부는 출생 후 몇 개월이 지나서야 커져서 발견되는 경우도 있다. 일반적으로 생후 2개월 경 혈관종의 크기는 2배가 되고, 3-5개월 경 최대 크기의 약 80%까지 도달하며, 생후 1년째 가장 크기가 커지나, 일부의 경우 2년째 까지도 증식하는 경우도 있다[1819].
대부분의 경우, 치료 없이 정기적으로 꾸준히 경과 관찰하며 질환에 대한 자연경과에 대해 보호자에게 이해시키는 것만으로 충분하나, 약 12%의 환자에 있어서는 합병증이 우려되어 치료가 필요하다. 혈관종의 가장 흔한 합병증은 괴사이며, 치료를 요하는 영아혈관종의 약 25%를 차지한다[20]. 혈관종 중심부가 회백색으로 변하는 경우, 표피의 괴사가 시작되었다는 징후로 볼 수 있으며, 기저귀 닿는 부위, 아랫입술, 목 등이 괴사가 잘 동반되는 부위이다. 혈관종은 통증을 동반하지는 않으나, 괴사가 일어날 시 통증이 동반될 수 있으며, 환아의 신체활동에 제약을 받을 수 있다[2122]. 출혈은 드물며 1% 미만에서 발생한다고 알려져 있다. 또한 병변의 위치에 따라 기능적 장애가 발생할 수 있으며, 눈 주위에 발생한 경우 약시, 난시, 사시 등이 발생할 수 있고, 기도에 발생한 경우 호흡곤란이 발생할 수 있다. 영아혈관종은 간, 췌장, 비장, 중추신경계에도 역시 발생할 수 있으며 대개 무증상이나, 드물게 위장관계 출혈, 심부전, 폐쇄성 황달, 중추신경계 손상 등의 합병증을 동반할 수도 있다[2324]. 피부의 혈관종이 광범위하거나 여러 군데 있는 경우, 복강 내 혈관종이 존재할 확률이 높다고 알려져 있다. 따라서, 광범위하거나 5개 이상의 피부 혈관종이 있는 경우 복부 초음파가 추천된다[25].
영아혈관종의 경우 임상양상과 자연경과가 아주 다양하고, 혈관종의 위치 및 범위 등을 고려 시 개개인마다 치료 목표 및 기대치가 다르므로, 치료의 시작 및 중단을 결정하는데 있어 어려움이 있을 수 있다. 또한 질환의 자연경과 상 저절로 없어지는 경우가 많아, 약제 선택 시 부작용과 치료효과의 측면을 충분히 고려하여야 한다.
2008년 Leaute-Labreze 등[28]이 심질환을 가진 환아에게 프로프라놀롤을 투여 후, 우연히 얼굴에 위치한 큰 영아혈관종이 급속도로 작아지는 것을 발표 한 후, 다수의 연구그룹에서 혈관종 환자를 대상으로 경구 베타차단제를 사용하였으며, 부작용은 거의 없이 우수한 효과를 보고하였다. 프로프라놀롤 이외 티몰롤(timolol), 나돌롤(nadolol)과 같은 다른 베타차단제 또한 효과를 보인다는 연구결과도 있으나, 현재 가장 많이 연구되고 사용되는 베타차단제는 프로프라놀롤이다. 프로프라놀롤의 영아혈관종에서의 치료효과가 발표된 지 얼마 지나지 않아 프로프라놀롤은 영아혈관종 치료의 주된 약제로 자리잡았으며, 국내에서도 그 사용이 점차 늘고 있으며 좋은 결과를 보여주고 있다(Figure 2) [2930]. 헤만지올(Hemangiol)은 프로프라놀롤의 시럽제제로 이미 유럽, 미국 식약청 승인을 받았으며, 국내에서도 식약청 승인 후 2016년 6월 출시되어 영아에게 편리하게 투약할 수 있게 되었다.
베타차단제가 영아혈관종에 어떻게 치료효과를 나타내는지에 대한 명확한 기전을 밝혀져 있지 않으나, 일부 연구에서 혈관 수축이 병변의 호전에 주요한 역할을 할 것이라 보고된 바 있다[31]. 즉, 프로프라놀롤이 작용 초기에는 말초혈관의 수축작용을 통해 치료 시작 후 수 시간 내에 색조의 옅어짐과 병변의 부드러워짐 등의 변화를 보인다고 보고되었다. 반면 수일 이후의 작용 후기에는 혈관내피 성장인자 및 염기성섬유모세포성장인자 등의 혈관형성 인자 등의 혈관형성 인자를 억제하고, 모세혈관내피세포의 세포자멸사를 자극함으로써 병변의 호전을 나타낸다고 보고되었다[32]. 최근에는 프로프라놀롤이 세포 외 기질의 재구성 및 혈관생성에 주요한 역할을 하는 matrix metalloproteinase 9과 human brain microvascular endothelial cells에 선택적으로 작용하여 이들의 활성을 저해한다는 연구결과도 제시되고 있다[33]. 또한 베타차단제가 hypoxia-inducible factor-1α의 발현을 억제한다는 연구결과도 제시되었다[16] .
Itinteang 등[16]은 renin-angiotensin system이 혈관종의 생리에 역할을 한다고 보고하였다. 즉, angiotensin II에 의해 infantile hemangioma-derived blast cell proliferation이 유발되며, renin이 높을 경우 angiotensinogen이 angiotensin I으로 변환되고, 이는 angiotensin II를 증가시켜, 영아혈관종의 세포증식을 유발한다. 따라서 베타차단제는 renin을 억제시켜, 결국 angiotensin II를 억제시켜, 영아혈관종의 치료에 역할을 한다는 가설이다.
프로프라놀롤은 일반적으로 0.5-1 mg/kg/day로 시작하여 2-3 mg/kg/day까지 증량하여 유지하며 치료기간은 수개월에서 1년 사이이나, 일부에서는 2년 이상 사용하기도 한다. 치료 시작 시 일반적으로 입원하여 용량 증량을 하나, 2개월 이상의 영아의 경우 혈당이상이나 심혈관계 및 호흡기 동반질환이 없다면 외래에서도 시작 가능하다[7]. 치료종료 6개월 이내 약 20%에서 재발이 나타나며, 이 경우 프로프라놀롤을 다시 투여 시 호전을 기대할 수 있다[3034]. 심혈관질환이 있는 경우, 천식 등 호흡기계질환이 있는 경우, 저혈당의 병력이 있는 경우, 프로프라놀롤에 과민반응을 보이는 경우 투약할 수 없으며, PHACE 증후군의 경우 동반된 심혈관, 뇌혈관 기형으로 인해 심뇌경색의 우려가 있어 프로프라놀롤의 사용은 추천되지 않는다.
1960년대 혈소판감소증을 치료하기 위해 스테로이드를 투여한 환자에서의 혈관종의 호전을 관찰한 이후[38], 경구 스테로이드는 영아혈관종의 1차 치료약제였으나 최근에는 1차 약제로 베타차단제를 사용하는 빈도가 점점 늘어나고 있다. 스테로이드의 혈관종에 대한 작용기전은 명확하지는 않으나, adipocytic differentiation의 촉진, anti-adipogenic factor의 억제, 그리고 anti-vasculogenesis 등이 관여하리라 생각된다[3940]. 일반적으로 하루 2-3 mg/kg의 경구 프레드니손(prednisone)을 수개월간 사용하게 되며, 사용 시작 후 수주 이내 혈관종의 증식은 줄어드는 것으로 알려져 있다[4142]. 하지만 쿠싱형 얼굴, 기분변화, 수면장애, 고혈압, 면역억제, 부신기능억제, 위 불편감, 뼈성장 저하 등의 부작용이 있어 소아에서 사용 시 주의를 요한다[4344].
혈관종에서의 빈크리스틴(vincristine) 사용에 대한 연구는 많지 않으며, 대개 소규모 연구이다. 일반적으로 프로프라놀롤이나 스테로이드를 사용할 수 없거나, 반응이 없는 혈관종에 사용하며, 많은 경우 이 두 약제 사용 시 치료가 잘 되므로, 빈크리스틴의 사용빈도는 점차 줄어드는 추세이다. 빈크리스틴은 Kaposiform hemangioendothelioma나 tufted angioma와 같은 혈관 기형에도 일부 효과가 있는 것으로 되어 있으며, Kasabach-Merritt phenomenon을 동반한 혈관종에도 사용할 수 있다[47]. 변비, 복통, 장마비, 턱통증, 말초신경병증과 같은 신경계 합병증이 주된 부작용이나, 백혈구 감소, 빈혈 등도 발생할 수 있다. 빈크리스틴의 경우 혈관 형성을 억제하고, 종양과 혈관내피세포의 자멸사를 유도하여 혈관종의 증식을 저해하는 것으로 생각된다[4849].
일반적으로 혈관종이 거의 다 호전된 후 잔존해 있는 상처 혹은 섬유지방조직을 제거하기 위하여 수술을 시행한다. 하지만, 혈관종이 증식기에 있는 경우라 하더라도 생명을 위협하거나 신체기관에 심각한 이상을 초래하는 경우, 약물치료를 시행할 수 없는 경우 수술적 제거를 시행하기도 한다[56].
영아혈관종의 자연경과 및 관련 합병증에 대한 이해가 점점 깊어지고, 프로프라놀롤을 치료에 사용하면서 혈관종 관련 연구 및 치료가 빠르게 발전되고 있는 추세이다. 혈관종의 위치 및 범위에 따라 임상양상과 자연경과가 아주 다양하여 치료를 시작하는 데 있어 어려움이 있을 수 있다. 임상 판단에 따라 혈관종의 합병증이 뚜렷할 때까지 치료를 미루는 경우가 있으나, 치료의 기본 목적이 흉터를 최소화하고 정상 피부로 되돌리는데 있음을 고려 시, 영아혈관종 증식기의 어느 단계에서 어떻게 치료를 시작하는 것이 피부 변성을 최소화하는지에 대한 연구가 필요할 것으로 생각된다.
본 원고는 영아에서 가장 흔히 발생하는 양성 종양인 영아혈관종의 발생 빈도 및 위험인자, 분류, 증식기 및 자연퇴행기 등의 특성, 최근 제시되고 있는 다양한 병인론, 임상양상과 합병증, 치료의 적응증 및 최신 치료방법에 대하여 체계적으로 기술한 종설이다. 특히 아직 규명되지는 않았으나 최근에 활발한 연구결과를 통하여 제시되고 있는 병리기전들과 현재 미국과 유럽에서 영아혈관종의 first line 치료제로 사용되고 있는 propranolol의 작용기전과 용법, 용량에 대하여 자세히 기술하고 있어서 임상의들에게 교육적 가치가 높고 치료 지침서로 사용할 수 있는 종설로서 의의가 있다.
[정리: 편집위원회]
Figures and Tables
References
1. Dickison P, Christou E, Wargon O. A prospective study of infantile hemangiomas with a focus on incidence and risk factors. Pediatr Dermatol. 2011; 28:663–669.

2. Luu M, Frieden IJ. Haemangioma: clinical course, complications and management. Br J Dermatol. 2013; 169:20–30.

3. Munden A, Butschek R, Tom WL, Marshall JS, Poeltler DM, Krohne SE, Alio AB, Ritter M, Friedlander DF, Catanzarite V, Mendoza A, Smith L, Friedlander M, Friedlander SF. Prospective study of infantile haemangiomas: incidence, clinical characteristics and association with placental anomalies. Br J Dermatol. 2014; 170:907–913.

4. Drolet BA, Swanson EA, Frieden IJ. Hemangioma Investigator Group. Infantile hemangiomas: an emerging health issue linked to an increased rate of low birth weight infants. J Pediatr. 2008; 153:712–715.

5. Hemangioma Investigator Group. Haggstrom AN, Drolet BA, Baselga E, Chamlin SL, Garzon MC, Horii KA, Lucky AW, Mancini AJ, Metry DW, Newell B, Nopper AJ, Frieden IJ. Prospective study of infantile hemangiomas: demographic, prenatal, and perinatal characteristics. J Pediatr. 2007; 150:291–294.

6. Tan ST, Itinteang T, Leadbitter P. Low-dose propranolol for infantile haemangioma. J Plast Reconstr Aesthet Surg. 2011; 64:292–299.

7. Puttgen KB. Diagnosis and management of infantile hemangiomas. Pediatr Clin North Am. 2014; 61:383–402.

8. North PE, Waner M, Mizeracki A, Mihm MC Jr. GLUT1: a newly discovered immunohistochemical marker for juvenile hemangiomas. Hum Pathol. 2000; 31:11–22.

9. Barnes CM, Huang S, Kaipainen A, Sanoudou D, Chen EJ, Eichler GS, Guo Y, Yu Y, Ingber DE, Mulliken JB, Beggs AH, Folkman J, Fishman SJ. Evidence by molecular profiling for a placental origin of infantile hemangioma. Proc Natl Acad Sci U S A. 2005; 102:19097–19102.

10. Kleinman ME, Greives MR, Churgin SS, Blechman KM, Chang EI, Ceradini DJ, Tepper OM, Gurtner GC. Hypoxia-induced mediators of stem/progenitor cell trafficking are increased in children with hemangioma. Arterioscler Thromb Vasc Biol. 2007; 27:2664–2670.

11. Dadras SS, North PE, Bertoncini J, Mihm MC, Detmar M. Infantile hemangiomas are arrested in an early developmental vascular differentiation state. Mod Pathol. 2004; 17:1068–1079.

12. Yu Y, Flint AF, Mulliken JB, Wu JK, Bischoff J. Endothelial progenitor cells in infantile hemangioma. Blood. 2004; 103:1373–1375.

13. Drolet BA, Frieden IJ. Characteristics of infantile hemangiomas as clues to pathogenesis: does hypoxia connect the dots? Arch Dermatol. 2010; 146:1295–1299.
14. Walter JW, Blei F, Anderson JL, Orlow SJ, Speer MC, Marchuk DA. Genetic mapping of a novel familial form of infantile hemangioma. Am J Med Genet. 1999; 82:77–83.

15. Grimmer JF, Williams MS, Pimentel R, Mineau G, Wood GM, Bayrak-Toydemir P, Stevenson DA. Familial clustering of hemangiomas. Arch Otolaryngol Head Neck Surg. 2011; 137:757–760.

16. Itinteang T, Brasch HD, Tan ST, Day DJ. Expression of components of the renin-angiotensin system in proliferating infantile haemangioma may account for the propranololinduced accelerated involution. J Plast Reconstr Aesthet Surg. 2011; 64:759–765.

17. Youmbissi TJ, Tedong F, Fairbank ST, Blackett-Ngu K, Mbede J. Plasma renin activity studies in a group of African neonates and children. J Trop Pediatr. 1990; 36:128–130.

18. Tollefson MM, Frieden IJ. Early growth of infantile hemangiomas: what parentsXMLLink_XYZ photographs tell us. Pediatrics. 2012; 130:e314–e320.
19. Chang LC, Haggstrom AN, Drolet BA, Baselga E, Chamlin SL, Garzon MC, Horii KA, Lucky AW, Mancini AJ, Metry DW, Nopper AJ, Frieden IJ;. Growth characteristics of infantile hemangiomas: implications for management. Pediatrics. 2008; 122:360–367.

20. Haggstrom AN, Drolet BA, Baselga E, Chamlin SL, Garzon MC, Horii KA, Lucky AW, Mancini AJ, Metry DW, Newell B, Nopper AJ, Frieden IJ. Prospective study of infantile hemangiomas: clinical characteristics predicting complications and treatment. Pediatrics. 2006; 118:882–887.

21. Chamlin SL, Haggstrom AN, Drolet BA, Baselga E, Frieden IJ, Garzon MC, Horii KA, Lucky AW, Metry DW, Newell B, Nopper AJ, Mancini AJ. Multicenter prospective study of ulcerated hemangiomas. J Pediatr. 2007; 151:684–689.

22. Maguiness SM, Hoffman WY, McCalmont TH, Frieden IJ. Early white discoloration of infantile hemangioma: a sign of impending ulceration. Arch Dermatol. 2010; 146:1235–1239.
23. Lopriore E, Markhorst DG. Diffuse neonatal haemangiomatosis: new views on diagnostic criteria and prognosis. Acta Paediatr. 1999; 88:93–97.

24. Boon LM, Burrows PE, Paltiel HJ, Lund DP, Ezekowitz RA, Folkman J, Mulliken JB. Hepatic vascular anomalies in infancy: a twenty-seven-year experience. J Pediatr. 1996; 129:346–354.

25. Horii KA, Drolet BA, Baselga E, Frieden IJ, Metry DW, Morel KD, Newell BD, Nopper AJ, Garzon MC;. Risk of hepatic hemangiomas in infants with large hemangiomas. Arch Dermatol. 2010; 146:201–203.

26. Frieden IJ, Reese V, Cohen D. PHACE syndrome. The association of posterior fossa brain malformations, hemangiomas, arterial anomalies, coarctation of the aorta and cardiac defects, and eye abnormalities. Arch Dermatol. 1996; 132:307–311.

27. Drolet BA, Chamlin SL, Garzon MC, Adams D, Baselga E, Haggstrom AN, Holland KE, Horii KA, Juern A, Lucky AW, Mancini AJ, McCuaig C, Metry DW, Morel KD, Newell BD, Nopper AJ, Powell J, Frieden IJ. Prospective study of spinal anomalies in children with infantile hemangiomas of the lumbosacral skin. J Pediatr. 2010; 157:789–794.

28. Leaute-Labreze C, Dumas de la Roque E, Hubiche T, Boralevi F, Thambo JB, Taieb A. Propranolol for severe hemangiomas of infancy. N Engl J Med. 2008; 358:2649–2651.

29. Chung SH, Park DH, Jung HL, Shim JW, Kim DS, Shim JY, Park MS, Koo HH. Successful and safe treatment of hemangioma with oral propranolol in a single institution. Korean J Pediatr. 2012; 55:164–170.

30. Yun YJ, Gyon YH, Yang S, Lee YK, Park J, Park M. A prospective study to assess the efficacy and safety of oral propranolol as first-line treatment for infantile superficial hemangioma. Korean J Pediatr. 2015; 58:484–490.

31. Nguyen J, Fay A. Pharmacologic therapy for periocular infantile hemangiomas: a review of the literature. Semin Ophthalmol. 2009; 24:178–184.

32. Leaute-Labreze C, Taieb A. Efficacy of beta-blockers in infantile capillary haemangiomas: the physiopathological significance and therapeutic consequences. Ann Dermatol Venereol. 2008; 135:860–862.
33. Annabi B, Lachambre MP, Plouffe K, Moumdjian R, Beliveau R. Propranolol adrenergic blockade inhibits human brain endothelial cells tubulogenesis and matrix metalloproteinase-9 secretion. Pharmacol Res. 2009; 60:438–445.

34. Bagazgoitia L, Hernandez-Martin A, Torrelo A. Recurrence of infantile hemangiomas treated with propranolol. Pediatr Dermatol. 2011; 28:658–662.

35. Guo S, Ni N. Topical treatment for capillary hemangioma of the eyelid using beta-blocker solution. Arch Ophthalmol. 2010; 128:255–256.

36. Ni N, Langer P, Wagner R, Guo S. Topical timolol for periocular hemangioma: report of further study. Arch Ophthalmol. 2011; 129:377–379.

37. Chakkittakandiyil A, Phillips R, Frieden IJ, Siegfried E, Lara-Corrales I, Lam J, Bergmann J, Bekhor P, Poorsattar S, Pope E. Timolol maleate 0.5% or 0.1% gel-forming solution for infantile hemangiomas: a retrospective, multicenter, cohort study. Pediatr Dermatol. 2012; 29:28–31.

38. Zarem HA, Edgerton MT. Induced resolution of cavernous hemangiomas following prednisolone therapy. Plast Reconstr Surg. 1967; 39:76–83.

39. Khan ZA, Boscolo E, Picard A, Psutka S, Melero-Martin JM, Bartch TC, Mulliken JB, Bischoff J. Multipotential stem cells recapitulate human infantile hemangioma in immunodeficient mice. J Clin Invest. 2008; 118:2592–2599.

40. Greenberger S, Boscolo E, Adini I, Mulliken JB, Bischoff J. Corticosteroid suppression of VEGF-A in infantile hemangioma-derived stem cells. N Engl J Med. 2010; 362:1005–1013.

41. Enjolras O, Riche MC, Merland JJ, Escande JP. Management of alarming hemangiomas in infancy: a review of 25 cases. Pediatrics. 1990; 85:491–498.

42. Dinehart SM, Kincannon J, Geronemus R. Hemangiomas: evaluation and treatment. Dermatol Surg. 2001; 27:475–485.

43. Boon LM, MacDonald DM, Mulliken JB. Complications of systemic corticosteroid therapy for problematic hemangioma. Plast Reconstr Surg. 1999; 104:1616–1623.

44. Lomenick JP, Backeljauw PF, Lucky AW. Growth, bone mineral accretion, and adrenal function in glucocorticoid-treated infants with hemangiomas: a retrospective study. Pediatr Dermatol. 2006; 23:169–174.

45. Chowdri NA, Darzi MA, Fazili Z, Iqbal S. Intralesional corticosteroid therapy for childhood cutaneous hemangiomas. Ann Plast Surg. 1994; 33:46–51.

46. Sutula FC, Glover AT. Eyelid necrosis following intralesional corticosteroid injection for capillary hemangioma. Ophthalmic Surg. 1987; 18:103–105.

47. Kwon EK, Seefeldt M, Drolet BA. Infantile hemangiomas: an update. Am J Clin Dermatol. 2013; 14:111–123.
48. Schirner M, Hoffmann J, Menrad A, Schneider MR. Antiangiogenic chemotherapeutic agents: characterization in comparison to their tumor growth inhibition in human renal cell carcinoma models. Clin Cancer Res. 1998; 4:1331–1336.
49. Kung AL, Zetterberg A, Sherwood SW, Schimke RT. Cytotoxic effects of cell cycle phase specific agents: result of cell cycle perturbation. Cancer Res. 1990; 50:7307–7317.
50. Barlow CF, Priebe CJ, Mulliken JB, Barnes PD, Mac Donald D, Folkman J, Ezekowitz RA. Spastic diplegia as a complication of interferon Alfa-2a treatment of hemangiomas of infancy. J Pediatr. 1998; 132:527–530.

51. Jimenez-Hernandez E, Duenas-Gonzalez MT, Quintero-Curiel JL, Velasquez-Ortega J, Magana-Perez JA, Berges-Garcia A, Arellano-Galindo J. Treatment with interferon-alpha-2b in children with life-threatening hemangiomas. Dermatol Surg. 2008; 34:640–647.

52. Heyns AD, Eldor A, Vlodavsky I, Kaiser N, Fridman R, Panet A. The antiproliferative effect of interferon and the mitogenic activity of growth factors are independent cell cycle events. Studies with vascular smooth muscle cells and endothelial cells. Exp Cell Res. 1985; 161:297–306.

53. Stier MF, Glick SA, Hirsch RJ. Laser treatment of pediatric vascular lesions: port wine stains and hemangiomas. J Am Acad Dermatol. 2008; 58:261–285.

54. David LR, Malek MM, Argenta LC. Efficacy of pulse dye laser therapy for the treatment of ulcerated haemangiomas: a review of 78 patients. Br J Plast Surg. 2003; 56:317–327.





 PDF
PDF ePub
ePub Citation
Citation Print
Print




 XML Download
XML Download