Abstract
Catheter ablation is one of the major treatment options for patients with arrhythmia. It has been widely used since radiofrequency energy was adopted as a power source. Technical progress has resulted in better outcomes, better efficiency, and safer procedures. However, mechanisms of some forms of arrhythmia such as atrial fibrillation have not been fully elucidated in order to obtain a more favorable success rate. Therefore, progress in the basic research field to understand the mechanisms and substrates of arrhythmia as well as technical progress is essential for overcoming current obstacles in this therapeutic method.
부정맥 치료의 양대산맥은 항부정맥제를 이용한 약물치료와 전극도자절제술에 의한 비약물적 치료이다. 전극도자절제술은 항부정맥제의 부작용을 피할 수 있으며 높은 시술 성공률로 인하여 특히 21세기 들어 시술 건수가 급속하게 증가하였다. 이 논문에서는 이 시술의 발전과정과 최신 기술, 각 부정맥별 시술개요 등에 대해 기술하고자 한다.
RF 에너지는 일반적으로 카테터 말단의 전극과 피부에 부착한 패치 사이에서 전달된다. RF 발생기는 500-1000 kHz 정도의 주파수를 가진 비변조 싸인파 교류 전류를 만들어낸다. 전극의 크기는 피부 패치의 크기에 비해 매우 작기 때문에 전류의 밀도는 전극과 이 전극이 닿아있는 심근의 경계에서 가장 높게 되며, 이로 인해 저항열이 이 부위에서 발생하게 된다. 저항열의 크기는 전류의 제곱에 비례한다. 또한 전류의 밀도는 거리의 제곱에 반비례하므로 저항열의 크기는 거리의 4제곱에 반비례한다. 따라서 거리가 2배 증가하면 발생되는 열은 1/16로 급격히 줄어든다. 그러므로 RF 에너지에 의한 병변은 크기가 작고 경계가 뚜렷하다. 전극에서 1-2 mm 떨어진 부위까지만 저항열에 의해 병변이 만들어진다. 더 깊은 부위의 병변은 전도된 열에 의해 만들어진다. RF 병변 용적의 대부분은 이 전도열에 의해 생성되는 것이다.
조직의 온도가 적어도 50℃에 도달해야 비가역적인 변화가 일어나 성공적인 절제술이 가능하다[5]. 하지만 과열이 되면 혈장에서 혈전이 생기기 쉽게 되며 물의 비등점인 100℃에 도달하면 끓어올라 공기 성분이 급팽창하면서 발포가 일어나 조직에 손상을 줄 위험이 있다. 조직은 과열되면 응괴가 형성되고 탄화되는 과정을 밟게 된다. 이 결과 임피던스의 급격한 증가가 일어나게 되면, RF 전류가 조직으로 전도되는 것을 방해하여 충분한 크기의 병변이 생기지 않는다. 모니터링의 목적은 성공적인 절제술에 충분한 열을 제공함과 동시에 과열로 인한 합병증을 막는 데에 있다. 모니터링 방법에는 온도 또는 임피던스 변화의 감시, 심장 내 심초음파(intracardiac echocardiography)를 이용한 혈액의 비등감시 등이 있다.
온도측정은 가장 직관적인 방법 중의 하나이다. 도자 말단에 부착한 thermocouple 또는 thermistor로 측정한다. 전극과 조직의 경계면에서 발생한 열이 도자로 전달되어 측정되는 것이다. 온도감시의 가장 중요한 제한점은 조직의 온도가 도자의 온도보다 높다는 것이다. 혈류가 빠른 부위일수록, 전극의 크기가 클수록 도자 온도와 조직의 온도차가 크다. 성공적인 절제술을 위해서는 일반적으로 도자온도가 50-70℃에 도달하도록 한다. 단, 냉각도자들은 정상적인 절제술 중에 도자온도가 40℃를 넘는 일은 드물다.
임피던스 모니터링은 전극을 통해 직접 측정이 가능하므로 추가장비가 필요하지 않다. 절제술로 조직에 적절한 병변이 만들어진다면 초기 보다 5-10 ohm 정도 임피던스가 감소한다. 조직과열로 응괴 또는 탄화가 일어나면 임피던스는 급격하게 상승한다. 하지만 임피던스의 상승은 온도증가보다 늦게 나타나므로 조직과열을 조기에 발견하기는 불가능하다.
심장 내 심초음파를 이용하게 되면 도자 말단부의 조직 접촉상태와 병변의 형성을 직접 관찰할 수 있다(Figure 1). 또한 과열로 인해 혈액이 비등하는 것을 기포의 발생으로 알아낼 수 있다. 기포 발생이 안되도록 RF 파워를 조절하는 방법이 안전성과 효율성면에서 우수하다[6]. 하지만 비등점에 도달되지 않은 경우에는 비록 조직이 과열되었다 하더라도 알 수가 없다. 즉, 기포가 없더라도 과열이 없다고 말할 수는 없다. 또한 최근에 널리 사용되는 냉각도자의 경우 냉각용 식염수가 절제술 중 도자 말단에서 계속 방출되므로 초음파로 기포의 존재를 확인하기는 어렵다.
전술한 바와 같이 RF에 의해 만들어지는 병변은 크기가 매우 작다. 따라서 상대적으로 안전한 반면, 정확한 부위에 시술이 이루어져야만 성공할 수 있게 된다. 정확한 시술부위를 찾기 위해서는 정확한 매핑이 필요하고 이를 위해서는 정확한 해부학적 정보가 필요하다. 특히 복잡한 부정맥의 시술을 위해서는 2차원적인 조영술 영상보다 심장의 3차원적인 정보가 시술시간의 단축과 성공적인 시술을 위해 유용하다. 심장의 해부학적인 정보와 전기적인 정보를 동시에 제공하는 시스템을 전기해부학적 매핑시스템(electroanatomical mapping system)이라 하며, 가장 많이 사용되는 상용시스템으로는 Carto (Biosense-Webster, Diamond Bar, CA, USA; Figure 2)와 NavX (St. Jude Medical, St. Paul, MN, USA; Figure 3) 시스템이 있으며, 그 외에 Rhythmia (Boston Scientific, Marlborough, MA, USA)가 최근 개발된 바 있다. 이들 시스템들은 심장의 전기적인 정보들을 3차원 영상으로 재구성하며, 컴퓨터단층촬영이나 자기공명영상촬영 영상을 불러와 통합시킬 수 있어(Figure 2) 시술자는 마치 심장을 들여다 보며 시술하는 것과 같은 환경을 제공받는다.
냉각도자의 개발은 RF 절제술 발전에 중요한 기여를 했다. 냉각을 통해 도자 말단 전극의 과열을 막음으로써 더 많은 파워를 보낼 수 있게 되었고 좀더 깊은 병변을 만들 수 있게 되었다. 응괴도 적게 생기므로 임피던스의 상승도 드물다. 단, 실제 조직온도와의 차이는 더욱 커지기 때문에 비등에 의한 발포현상은 더 나타나기 쉽다. 냉각도자는 특히 심외막에서의 도자절제술에서 유용하다. 심외막은 혈류가 없어 이에 의한 냉각이 이루어지지 않으므로 쉽게 온도가 올라가 적절한 RF 에너지 투여가 어렵다.
성공적인 도자절제술을 위해서는 도자의 말단이 적절한 압력으로 심근에 접촉해야 한다. 접촉 압력을 향상시키는 방법은 그렇지 않은 경우에 비해 유의하게 경벽성 병변을 잘 만들 수 있다[7]. 이에 도자 말단의 압력을 모니터링하는 기술들이 개발되어 임상에 적용되고 있다. SmartTouch 시스템(Biosense-Webster)과 TactiCath 시스템(St. Jude Medical)이 대표적인 도자들이다.
성공적인 전극도자절제술을 위해서는 해당 부정맥의 기전이 무엇인지, 제거해야 할 기질은 무엇인지를 정확히 판별해야 한다. 그러기 위해서는 치밀한 전기생리학 검사가 필수적이며 시술자는 치료하려는 부위의 해부학적인 정보를 정확히 알고 있어야 한다.
가장 흔한 종류인 방실결절회귀빈맥은 기전이 방실결절 주위의 급속전도로와 완속전도로 사이에 형성되는 회귀이다. 치료해야 할 부위는 완속전도로이다. 완속전도로는 해부학적으로 동정맥동의 전방에 존재한다. 전기도에서 완속전도로의 신호가 보이는 부위를 표적으로 한다. 또는 완속전도로 부위를 매핑해서 치료의 표적으로 삼는다. 치료 시 주의할 사항은 방실차단 발생의 예방이다. 치료 대상 주위에 방실결절이 존재하므로 RF 에너지를 주는 동안에는 AH간격의 변화 등에 특히 주의를 기울여야 한다.
또 다른 흔한 종류는 방실부전도로의 존재로 인해 생길 수 있는 방실회귀빈맥이다. 이 경우 치료의 대상은 방실부전도로가 된다. 방실판막륜에 존재하는 방실부전도로의 위치를 매핑을 통해 파악한 다음 해당 부위에 RF 에너지를 줘서 치료한다. 일반적으로 심실조율을 하면서 RF 에너지가 실방전도를 차단시키는지 관찰하면서 치료한다. Wolff-Parkinson-White 증후군과 같이 조기흥분이 있는 경우에는 조율하지 않고 동리듬 중에 치료할 수도 있다.
국소성 심방빈맥은 치료의 대상이 자동능이 증가되었거나 미세회귀를 발생시키는 국소 부위가 된다. 심방 내에 회귀회로가 형성되어 발생하는 심방조동과 같은 부정맥은 회귀회로의 위치가 어디인지 파악한 다음 회귀회로 중 어느 부위가 가장 협부인지를 보고 치료표적을 결정한다. 가장 흔한 종류인 전형적인 심방조동은 회귀회로가 삼첨판막륜 주위이며 협부는 하대정맥과 삼첨판막륜의 사이가 된다. 이와 같은 부정맥들은 심실상성부정맥들에 비해 해부학적인 정보가 중요하므로 3차원 매핑이 유용하다.
심방세동 절제술에서 주요 치료표적은 폐정맥이다[8]. 절제술 부위의 복잡성과 환자별 해부학적 구조의 차이로 인해 3차원 매핑은 필수적으로 이용되고 있다. 비발작성 심방세동의 경우 폐정맥 고립술에 추가로 선형병변 절제술, 복잡파편화전기도(complex fractionated electrogram) 부위의 절제, 신경절 절제 등이 추가로 고려된다. 최근 가이드라인에서 일반적인 대상은 I군 또는 III군의 항부정맥제 투여에도 불구하고 증상이 있는 심방세동 환자에서 유형별로 다음과 같이 전극도자 절제술을 권고하고 있다. 발작성(권고강도 I, 증거수준 A), 발작성의 일차치료(권고강도 IIa, 증거수준 B), 지속성(권고강도 IIa, 증거수준 A), 지속성의 일차치료(권고강도 IIb, 증거수준 C), 장기 지속성(권고강도 IIb, 증거수준 B)과 같다[9]. 아직까지 절제술이 사망률, 뇌졸중, 심부전 등을 줄여줄 수 있는지는 증거가 부족한 상황이다. 이는 현재 진행중인 CABANA (Catheter Ablation versus Antiarrhythmic Drug Therapy for Atrial Fibrillation Trial), EAST (Early Treatment of Atrial Fibrillation for Stroke Prevention Trial) 연구 등이 증명해줄 수 있을 것으로 기대한다. 시술 합병증 발생률과 연관된 인자들은 고령, 여성, CHADS2 점수 ≥2이다[101112]. 또한 좌심방의 절제술은 자기공명영상촬영으로 발견할 수 있는 무증상의 작은 뇌경색을 유발시킬 수 있다. 하지만 대부분은 시간이 경과하면서 해결되거나 사라지는 것으로 보인다.
구조적인 심질환이 없는 환자의 특발성 심실빈맥은 크게 심실 우출로 부위에서 발생하는 심실빈맥과 좌심실의 섬유속을 포함한 회귀로 인해 생기는 심실빈맥으로 구분된다. 모두 시술 성공률이 우수하여 약물치료 시도 없이 일차치료로 전극도자절제술을 고려할 수 있다.
구조적인 심질환이 있는 환자에서 발생하는 심실빈맥은 돌연심장사의 위험이 높아 치료의 근간은 심장사의 예방이다. 따라서 삽입형 제세동기(implantable cardioverter defibrillator) 수술이 필수적이고 전극도자절제술은 보조적인 수단이 된다. 이들 심실빈맥에서는 섬유화/반흔과 같은 부정맥 기질의 위치를 제대로 파악하는 것이 중요하므로 3차원 매핑시스템의 사용이 유용하다. 이미 촬영한 컴퓨터 단층촬영이나 자기공명영상촬영 영상의 통합 외에, 최근에는 심초음파 영상을 실시간으로 통합해서 볼 수 있는 시스템(CartoSound, Biosense-Webster) 등이 도입되어 임상에서 사용되고 있다.
전극도자절제술을 통해 각종 부정맥을 완치시키거나 항부정맥제로는 조절이 불가능했던 질환들을 가진 환자에게 도움을 줄 수 있다. 기술적인 발전은 시술 부작용과 시술 시간을 줄여주고 있으며 시술 성공률을 높여주고 있다. 우리가 기전을 완전히 이해한 부정맥들은 성적이 좋지만 그렇지 못한 심방세동, 기질적인 심질환이 있는 심실빈맥, 심실세동의 경우 그렇지 못하다. 따라서 기술적인 부분과 함께 부정맥의 기전 이해에 대한 기초연구 분야들도 함께 진전이 이루어져야 완벽한 시술로 발전해 나갈 수 있을 것이다.
본 논문은 부정맥 치료의 근간 중 약물 치료외에 심장 내과 의사가 할 수 있는, 침습적 방법인 도자 절제술에 대하여 상세히 기술하고 있다. 고주파가 도자 절제술의 에너지 원으로 가장 많이 사용되고 있기 때문에, 그를 이용한 절제술의 과학적 원리에서부터 효과적인 절제술을 위한 최신 기술의 발전에 대해서도 자세히 설명하고 있다. 다양한 부정맥 중에서 전극 도자 절제술로 도움을 받을 수 있는 질환에 대한 소개가 잘 되어 있고, 또 도자 절제술로도 한계가 있는 질환에 대해서 정리가 잘 되어 있다. 임상의들이 일선 진료에서 부정맥 환자를 대할 때, 어떤 치료의 선택들이 있는지 환자에게 권유할 수 있는 좋은 지침을 제공할 수 있을 것으로 생각된다.
[정리: 편집위원회]
Figures and Tables
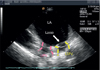 | Figure 1Intracardiac echocardiography image during atrial fibrillation ablation. LA, left atrium; Lasso, circular-mapping catheter for mapping; LIPV, left inferior pulmonary vein; LSPV, left superior pulmonary vein. |
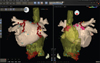 | Figure 2Electroanatomical mapping using Carto system (Biosense-Webster, Diamond Bar, CA, USA). Reconstructed cardiac computed tomography images of the right and left atria are integrated in this electroanatomical map. Red dots indicate ablation sites around the pulmonary veins. Pink dots indicate ablation sites showing complex fractionated electrogram. |
References
1. Scheinman MM, Morady F, Hess DS, Gonzalez R. Catheter-induced ablation of the atrioventricular junction to control refractory supraventricular arrhythmias. JAMA. 1982; 248:851–855.

2. Huang SK, Bharati S, Graham AR, Lev M, Marcus FI, Odell RC. Closed chest catheter desiccation of the atrioventricular junction using radiofrequency energy: a new method of catheter ablation. J Am Coll Cardiol. 1987; 9:349–358.

3. Jackman WM, Wang XZ, Friday KJ, Roman CA, Moulton KP, Beckman KJ, McClelland JH, Twidale N, Hazlitt HA, Prior MI, Margolis PD, Calame JD, Overholt ED, Lazzara R. Catheter ablation of accessory atrioventricular pathways (Wolff-Parkinson-White syndrome) by radiofrequency current. N Engl J Med. 1991; 324:1605–1611.

4. Calkins H, Sousa J, el-Atassi R, Rosenheck S, de Buitleir M, Kou WH, Kadish AH, Langberg JJ, Morady F. Diagnosis and cure of the Wolff-Parkinson-White syndrome or paroxysmal supraventricular tachycardias during a single electrophysiologic test. N Engl J Med. 1991; 324:1612–1618.

5. Haines DE. The biophysics of radiofrequency catheter ablation in the heart: the importance of temperature monitoring. Pacing Clin Electrophysiol. 1993; 16(3 Pt 2):586–591.

6. Oh S, Kilicaslan F, Zhang Y, Wazni O, Mazgalev TN, Natale A, Marrouche NF. Avoiding microbubbles formation dur-ing radiofrequency left atrial ablation versus continuous microbubbles formation and standard radiofrequency ablation protocols: comparison of energy profiles and chronic lesion characteristics. J Cardiovasc Electrophysiol. 2006; 17:72–77.

7. Lee C, Choi EK, Kong HJ, Choy YB, Kim HC, Oh S. Generating radiofrequency ablation lesions using magnetically coupled bipolar catheters. Pacing Clin Electrophysiol. 2011; 34:934–938.

8. Haissaguerre M, Jais P, Shah DC, Takahashi A, Hocini M, Quiniou G, Garrigue S, Le Mouroux A, Le Metayer P, Clementy J. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 1998; 339:659–666.

9. January CT, Wann LS, Alpert JS, Calkins H, Cigarroa JE, Cleveland JC Jr, Conti JB, Ellinor PT, Ezekowitz MD, Field ME, Murray KT, Sacco RL, Stevenson WG, Tchou PJ, Tracy CM, Yancy CW. ACC/AHA Task Force Members. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the Heart Rhythm Society. Circulation. 2014; 130:e199–e267.
10. Hoyt H, Bhonsale A, Chilukuri K, Alhumaid F, Needleman M, Edwards D, Govil A, Nazarian S, Cheng A, Henrikson CA, Sinha S, Marine JE, Berger R, Calkins H, Spragg DD. Complications arising from catheter ablation of atrial fibrillation: temporal trends and predictors. Heart Rhythm. 2011; 8:1869–1874.





 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download