Abstract
Sperm banking is an important option to maintain the male fertilization capacity or induce pregnancy even though under the era of in vitro fertilization. The medical indications for sperm banking are generally consisted of 3 categories. There are cases on planning the permanent contraception like vasectomy or cancer patients to be scheduled the chemotherapy or radiotherapy as first category, male infertile patients with severe oligozoospermia or artificially harvested sperm ie, from microscopic epididymal sperm aspiration or testicular sperm extraction et cetera for the artificial insemination with husband sperm as second category, and the therapeutic donor insemination as third category. Of these three categories, the sperm donation program accompanies various complicated practical, ethical and legal issues. Therefore, highly regulated statements are mandatory in order to secure safety and the complete practices for voluntary sperm donors and infertile couples both. In aspect of administrative structure of sperm bank, there are 3 types that are national based to be established in the most of European countries and China, public based in Japan, and commercially available in the USA. Additionally, each country has different standard guidelines, regulation statements, act and law to control the sperm donation program as well as different cultural or religious background. Nevertheless, we need a consensus document to operate the sperm bank with the standard guidelines to be well revised according to each country's ethical perspectives as well as contemporary scientific evolution. This article will provide what is the Korean model for ideal sperm bank with the history of sperm cryopreservation and banking, background and prerequisite for the public sperm bank operation, and also expected effects.
정자은행이란 정자를 채취한 뒤 동결보존액과 혼합하여 동결용 바이알에 넣고 -196℃ 액체질소 탱크 속에 동결시켜 보관하였다가 필요할 때 필요한 양만을 녹여 수태를 위한 인공수정, 시험관아기시술 등의 보조생식술 혹은 생명과학 분야의 연구에 사용하는 보관시설과 방법을 말한다[12]. 정자은행은 최근 보조생식술의 발전에도 불구하고 가임력 보존과 수태기회 제공의 측면에서 없어서는 안되는 생식의학의 중요한 분야의 하나이다. 동결정자의 장기적 보존과 이용은 지난 반세기 동안 이루어진 냉동생물학의 발전을 토대로 세포손상을 극소화 할 수 있는 glycerol 등 동결보존제와 세포배양액의 개발 그리고 프로그램 동결기 등 동결 및 해동기술 발전이 크게 기여하였다. 이와 같은 동결기술 발전을 기반으로 동결정자를 이용하여 임신한 경우는 문헌상 동결기간이 최장 23년이며 2015년 현재 부산대병원 정자은행에서는 13년의 기록을 보유하고 있다.
정자은행의 운영형태는 국가, 공공 혹은 상업으로 나누어지며 은행의 효율적 운영을 위해서는 정자 동결 해동을 위한 시설과 기술뿐만 아니라 표준운영지침, 관련법 규정 확립 그리고 국가적 네트워크 구축 등이 선행되어야 한다. 특히 우리나라와 같이 초저출산 상태로 인한 인구절벽 등의 사회적 국가적 문제에 직면한 상태에서는 정자은행의 효율적 운영을 통하여 가임력 보존뿐만 아니라 출산과 양육의 조건이 갖추어진 불임부부에서 가임 기회를 줌으로써 인구문제 해결에도 상당히 기여할 수 있을 것으로 기대된다.
저자는 한국에서의 공공정자은행의 설립과 운영에 앞서 정자 동결보존과 정자은행의 역사, 설립 배경과 필요성, 국내외의 관련법 규정과 관리, 동결정자를 이용한 인공수정의 종류와 방법, 정자 공여자의 결정과 정자 획득(지침 등)에 대하여 기술하고자 한다.
의학에서 동결보존기술은 후일의 연구나 불임치료 등의 이용목적으로 결빙점 이하의 온도에서 세포의 기능을 가역적으로 정지 보존시키는 냉동생물학의 한 분야로서 발전하여 왔다. 최근 냉동생물학은 단순한 동결보존 목적 외에도 병든 조직의 파괴, 세포구조의 보존과 같은 의학을 비롯한 생태계의 연구 분야에서 광범위하게 이용되고 있다. 불임분야에서도 냉동생물학적 지식이 보조생식술의 발달과 함께 정자, 난자와 배아의 동결보존 및 해동과 관련된 기술에도 적용되어 임상에서 널리 이용되고 있다.
정자 동결보존의 역사를 고찰해보면 1776년 Spallanzani가 눈 속에서 인간정자의 생존을 관찰함으로써 정자에 대한 저온효과와 동결보존에 관련된 연구가 처음 시작되었다[3]. 그 후 약 1세기가 경과한 후 Mantegazza [4]에 의해 소의 정자를 동결보존하여 종우를 보존하려는 축산목적과 전쟁에서 사망한 남편의 아이를 수태하기 위한 목적으로 정자은행의 필요성이 처음으로 소개되었으며 당시의 동결정자의 생존율은 약 10%에 불과하였다. 1946년 영국 국립의학연구소의 Rostand와 Cole [5]에 의해 glycerol의 동해방지효과가 밝혀진 이후 1949년 Polge 등[6]에 의해 처음으로 glycerol을 이용한 정자의 동결이 시도되었다. 이 기술은 초기에는 동물의 번식을 위해 널리 이용되었지만 인간에게는 오랫동안 적용되지 않다가 1953년 Bunge와 Sherman [7]에 의해 드라이아이스에서 동결된 인간 정자가 해동된 뒤 수정되어 정상적으로 배아가 발생되는 것을 처음으로 발견되었다. 이어 1953년 Polge에 의해 인간 동결정자를 이용한 최초의 임신이 보고된 바 있으며, 1964년에는 액화질소에서 동결된 정자를 이용한 인공수정으로 출산이 처음으로 보고되었다[8]. 같은 해 동결보존제인 dimethyl sulfoxide가 정자에 대한 독성이 있다는 사실도 처음으로 밝혀졌다. 이러한 과학적 결실에도 불구하고 인간에서 동결 정자를 이용한 불임치료는 1970대에 와서야 임상적으로 보편화되었다[9].
불임 치료목적의 정자은행은 1964년 미국 아이오와주와 일본 동경에서 처음으로 설립되었다. 1976년에 미국에서 미국조직은행(American Association of Tissue Banks)이 설립되고 그후 항암치료나 방사선치료와 같은 정자형성을 저해하는 치료나 정관절제술에 앞서 수정능을 보존하거나 비배우자인공수정을 위한 상업적 정자은행으로 발전되었다. 현재 미국에는 Cryos International®, California Cryobank® 등 대표적인 상업적 정자은행, 주립대학병원, 불임전문센터 등에 약 650개의 정자은행이 운용되고 있다. 1980년에는 노벨상 수상자 전용 정자은행이 설립되어 일반인들에게 화제를 모은 적도 있으며 가족 간 생식세포 공여, 대리모 등도 충분한 상담과 법적절차 완료를 전제로 허가되고 있다. 지난 30년간 정자은행을 통해 매년 3만 명씩 약 100만 명의 출산이 비배우자인공수정으로 이루어진 바 있다. 유럽은 미국의 상업적 정자은행과는 다르게 프랑스나 영국 등의 주요국에서 중앙정자은행과 지역거점병원에 설립된 정자은행을 네트워크화한 국가정자은행 형태로 운영되고 있다. 프랑스에서는 1973년 정부가 관리 하는 중앙정자은행(Centre d'Etude et de Conservation du Sperme)과 지역 거점대학병원에 23개의 정자은행이 설립되었으며 현재 28개로 확대되어 있다[10]. 영국은 주요 도시에 있는 국민건강보험 병원에 불임센터와 함께 정자은행이 설립되어 운영되고 있다[11]. 유럽에서도 덴마크는 미국과 같이 Private Denmark Sperm Bank같은 상업적 정자은행이 운용되고 있다. 반면 노르웨이, 핀란드와 같은 출산율이 높은 스칸디나비아 국가나 이태리에서는 비배우자 인공수정이 금지되고 있지만 농수산물의 우수 종자 보존과 같이 북슬라브족의 우수한 정자를 국가차원에서 보존하고 있다. 아시아권인 중국에서도 1981년 국가정자은행이 후난성에 최초로 설립되어 1983년 동결정자를 이용한 최초의 출산이 이루어졌으며 2015년 현재 17개성의 거점병원에 정자은행과 체외수정센터가 설립되어 운영 중에 있다. 중국의 국가정자은행시스템의 특이점은 강력한 인구억제 정책을 시행하던 시절에도 국가가 남성인자에 의한 난임 부부에서 1가구 1자녀가 가능하도록 국가 차원에서 정자공여 서비스를 하고 있다는 점이다. 최근 1가구 2자녀 정책으로 전환된 이후 난임 부부의 정자은행 이용이 급격히 증가되고 있다. 일본은 동경정자은행협회나 일본정자은행 등 비영리 단체나 영리목적으로 정자은행을 운영하는 불임센터가 공존하고 있으며 전국적으로 15개의 정자은행이 설립되어 있다. 독신녀나 동성부부의 비배우자인공수정, 대리모 출산, 미국이나 태국 등 해외의 정자은행 프로그램 등을 광범위하게 허용하고 암환자에서 정자동결보존을 돕는 시민연대가 활동하는 등 정부와 민간이 협력하여 인구 증대를 위한 국가적 역량을 극대화하고 있다.
국내에서도 동결정자를 이용한 수태는 1983년대 고려의대에서 최초로 시도되어 1986년 최초의 출산이 이루어졌으며, 현대적 개념의 개방형 정자은행은 1997년 부산대병원에서 최초로 설립된 이래 2000년 서울대병원, 2003년 전남대병원에 정자은행이 설립되었지만 2003년 생명윤리 및 안전에 관한 법률 제정 이후 비배우자인공수정은 급속히 위축된 상태에 있다. 또한 정관절제술과 같은 영구피임술이나 정자형성을 장애하는 항암요법이나 방사선 치료에 앞서 가임능 보존을 위한 정자은행의 기능도 거의 전무한 안타까운 실정에 있다. 2015년 현재 382개소의 인공수태인증병원에 양질의 정자 동결보존시설과 인력들을 갖추고 있지만 남성불임 환자에서 치료 중 채취된 정자를 향후 배우자인공수정 목적으로 자체적으로 운영하는 정자보존클리닉에 동결보존하는 수준으로 제한적으로 이용되고 있다. 향후 국내에서 설립 운용될 정자은행의 모델은 문화적 배경이나 현행법 정신을 고려할 때 유럽식의 국가정자은행 시스템을 벤치마킹하여 정부의 재정지원 하에 무상 정자수급을 원칙으로 하는 공공정자은행 형태로 운영하는 것이 타당할 것으로 생각된다.
최근의 메르스 사태에서 보듯이 한국이 질환의 진단과 치료에서는 세계 최고 수준의 기술력을 가지고 있지만 대규모 이환 상태에서 이러한 기술을 시스템화하여 운영하지 못함으로써 국민건강이나 국익에 엄청난 손실을 끼친 것과 같이 난임진단과 치료기술 또한 세계 최상의 수준이지만 정자은행이라는 가임력 보존과 난임치료시스템을 효율적으로 이용할 수 없다면 그 결과는 메르스 사태와 유사하다고 할 것이다. 공공정자은행의 설립과 운영의 배경과 필요성에 대하여 인구학, 정책, 법률, 윤리, 경제 및 의학 측면에서 분석한 점은 다음과 같다.
인구학적 측면에서 보면 한국은 세계 최하위권인 220위의 합계 출산율 1.19명 이하의 초저출산 인구구조를 가지고 있다. 이러한 상황의 지속 시 인구학자 헤리 덴트는 2018년 인구절벽에 의한 대공황을 경고하였으며, 미래학자 토마스 프레어는 2300년 한국인 소실의 원년이 되고 심지어는 인구학자 데이빗 콜먼은 2750년 인구소멸국가 1호가 될 것이라고 예견하고 있다. 따라서 지금은 인구증대를 위한 거국적 노력이 필요한 시점이며 의학적 접근도 중요한 해결책의 하나가 된다. 그 중에서도 공공정자은행은 미래지향적으로 국가가 필요한 가임력 보존과 유지 기능뿐만 아니라 양질의 출산 자원을 보유함으로써 저출산이라는 국가적 문제를 해결할 수 있는 대안이 될 수 있다.
정부의 정책적 측면에서 보면 2015년에 발표된 정부의 제3차 저출산 고령화 대책에서도 조기 결혼 장려나 이민정책의 강화를 제안하고 있지만 현실적으로 성공하기엔 거의 불가능한 정책들로 판단된다. 결혼은 가정을 통한 개인의 행복 추구 차원에서 이루어지는 것으로 국가가 절대 주도하여 할 일이 못되며 이민정책 또한 프랑스의 경우에서 보듯이 이민족의 이주로 인해 심각한 경제적 불균등 및 새로운 사회 갈등 구조를 유발할 위험성이 도사리고 있다. 그나마 난임치료가 보험급여 대상으로 변경된 것은 다행으로 생각되지만 향후 교과서적 치료법의 하나인 생식세포의 동결보존까지 보험급여가 확대되어야 할 것이다. 최근 동아시아 주변국에서도 인구 증대를 통하여 미래의 노동력을 확보한다는 새로운 국가 시책이 수립되어 이미 중국은 수십 년간 지속된 1가구 1자녀 정책을 포기하고 2자녀로 상향한 뒤 정자은행을 이용한 수태가 급격히 증가되고 있으며, 일본은 남성불임에 대한 현금 지원에서 보험 급여화를 통한 지원으로 전환함으로써 인구증대를 위한 보다 적극적인 정책 전환을 시도하고 있다. 따라서 불임이라는 소수의 의료 수요자를 위한 정책적 배려 차원에서 공공정자은행의 설립과 운영은 필수불가결한 정책적 선택이 될 것이다.
국가적 측면에서 보더라도 한국은 경제협력개발기구 국가 중 유일하게 어떠한 정자은행 서비스 체계를 갖추지 못한 국가이며 따라서 공공정자은행 측면만으로 본다면 후진국인 셈이다. 유럽에서와 같이 거점정자은행을 중앙정자은행을 중심으로 네트워크화 하여 양질의 정자 획득 및 공급체계를 구축하고 각 정자은행의 질 관리를 용이하게 할 수 갖추어야 한다. 이러한 공공정자은행 서비스는 양질의 정자자원을 보유하여 국민 보건복지의 수준을 높일 수 있을 뿐만 아니라 유사한 문화적 배경을 가진 후발 아시아권 국가들에게 벤치마킹의 기회를 제공할 것이다.
법률적 윤리적 측면에서는 소셜 네트워크 서비스 혹은 불법 웹사이트를 통한 불법 정자 난자의 매매나 소위 대리부 모집 등으로 인한 심각한 사회적 부작용이 발생하고 있다. 불법 정자 난자 매매 적발 건수는 2011년 381건, 2012년 403건, 2013년 871건으로 매년 급격히 증가되고 있는 실정이다. 심지어는 국내의 정자은행 서비스가 부재함으로써 최근 외국의 상업적 정자은행으로부터 국제 특송을 통해 공급된 비배우자인공수정용 정자를 이용하여 인공수정을 요구하는 경우도 점증하고 있다. 따라서 공공정자은행을 통해 건강한 정자가 수급 되는 시스템이 구축됨으로써 불법 정자의 공급을 원천적으로 차단할 수 있다. 또한 정자은행을 위한 최적의 표준운용프로토콜 완성을 통해 윤리적 권고사항을 최대한 담보할 수 있을 것으로 기대된다.
경제적 측면에서는 2006년에서 2015년까지 10년간 저출산 고령화 해소에 총 152조의 국가 예산을 투입하였지만 저출산의 해소 기미는 보이지 않고 있는 등 출산의 획기적 증대 위한 정책개발은 현실적으로 매우 어려운 측면이 많다. 반면 건강한 정자의 공급체계 구축은 출산과 양육의 조건과 환경을 갖춘 불임부부에서 최소의 경비로써 가임의 기회를 제공하는 확실한 방법이 될 것이다.
의학적 측면에서 보면 난치성 남성불임 환자의 증가 추세를 나타내는 데 남성불임의 20-30%가 입양이나 비배우자인공수정이 필요한 일차성 정자형성장애나 무정자증 환자로 약 20만 명, 연간 약 3만 명에서 시술되는 정관절제술과 같은 영구피임술 및 기타 불임유발수술이나 항암화학요법, 방사선치료와 같이 고환독성을 유발하는 치료에 앞서 자가 정자동결보존으로 가임능 보존이 필요한 경우가 약 30만 명, 총 50만 명의 불임환자가 의료혜택의 사각지대에 있는 것으로 추정된다. 특히 한국이 정관절제술 대비 정관복원술시술 례가 세계 최고 수준에 있는 현실도 공공정자은행의 설립을 더 이상 미룰 수 없는 이유인 것이다.
정자은행은 문화적, 인구학적, 경제적, 법적 배경이 다르기 때문에 나라별로 법규정이나 표준운영지침 등도 각각 상이한 체계를 가지고 있다[12,13,14,15,16,17,18,19,20,21]. 이러한 운영형태의 다양성에도 불구하고 공여자로 부터 정자의 획득과 방출과 관련한 행위들은 의학적 윤리적 법적 기준에 부합하여야 하고 특히 국가나 공공의 운영형태를 선택할 경우 정부의 관리지원 및 재정지원이 필수적이다. 정자은행 설립과 운영에 관한 국제적 컨센서스는 1978년 프랑스 파리에서 처음 개최된 인간정자의 동결보존에 관한 국제학회에서 처음으로 마련되었다. 현재 정자은행의 관리 감독은 프랑스는 생명의학청(Agence de la Biomédecine), 영국은 보건성 산하의 Human Federation and Embryology Authority, 미국은 식품의약국 산하 Human Cell & Tissue Bank Product에서, 중국은 처음에는 중앙정부에서 관리감독을 하였으나 2007년 이후에는 각 성의 위생부로 이관되어 시행되고 있다. 한국은 정부 주도하의 국가 혹은 공공정자은행의 설립 없이 대통령소속 국가생명윤리심의위원회와 보건복지부 산하 한국생명윤리정책연구원에서 주로 생식세포의 관리와 운영에 대하여 생명윤리적 측면에서 지원하고 있는 실정이다. 이중 미국은 전문학회인 미국생식의학회(American Society for Reproductive Medicine)에서 제정된 정자의 선별, 동결보존과 비배우자 간 인공수정에 관한 지침이 1986년 최초 제정된 이후 비배우자 간 인공수정의 빈도가 증가되고 성교전파성질환 중 후천성면역결핍증의 정액을 통한 전파위험이 커지면서 2004년까지 6회에 걸쳐 개정되어 정자은행의 표준운용지침으로 이용되고 있다. 그 외에도 실험실 혹은 임상검사실에서 사용되는 정자의 동결과 해동에 관련된 표준 기술지침으로는 세계보건기구가 제정한 Laboratory manual for the examination of human semen and sperm-cervical mucus interaction (4th edition, 1999)이 널리 이용되고 있다[22].
국내의 정자은행의 운영과 관련된 법규정으로는 1990년대 초 신선정액을 이용한 비배우자인공수정이 후천성면역결핍증 관리규정에 저촉됨으로써 사회적 문제가 된 이래 1993년 대한의학협회의 "인공수태윤리에 관한 선언" 그리고 2011년 대한산부인과학회의 보조생식술 윤리지침이 제정 선포됨으로써 비배우자인공수정, 체외수정 및 배아이식 등의 인공수태시술에 있어서 윤리의식의 제고와 과학적 시술원칙의 준수를 위한 전문학회의 자율선언이 처음으로 제시된 바 있다. 관련 법률로서는 2003년 생명윤리 및 안전에 관한 법률(법률 제7150호, 2003년 12월 29일 제정, 2005년 1월 1일 시행), 생명윤리 및 안전에 관한 법률시행령(대통령령 제18621호, 2003 년 12월 30일 공포, 2005년 1월 1일 시행) 및 생명윤리 및 안전에 관한 법률시행규칙(보건복지부령 제305호, 2004년 12월 30일 공포, 2005년 1월 1일 시행)이 공표된 후 4회에 걸쳐 전부 혹은 일부 개정된 바 있다. 이와 같이 관련 법률이 제정 공표되어 보조생식술을 포함한 생명과학기술의 수행에 있어서 생명윤리 및 안전을 확보하여 인간의 존엄과 가치를 침해하거나 인체에 위해를 주는 것을 방지하고 생명과학기술이 인간의 질병 예방 및 치료 등을 위하여 개발 이용될 수 있는 법률적 환경이 조성되었다. 정자은행과 관련한 주요 내용으로는 금전 재산상의 이익 또는 그 밖의 반대급부를 조건으로 정자, 난자 혹은 배아를 제공 또는 이용하거나 이를 유인 알선한 경우 3년 이하의 징역에 처할 수 있도록 규정하고 있다. 이와 같이 신선 정액 혹은 비정상적인 정자를 이용한 비배우자인공수정이나 상업적 정자 매매행위가 엄격히 금지되는 실정에서 불법정자매매를 방지하고 치료불능의 남성인자에 의한 난임 부부를 위하여 공여정자의 획득과 방출을 보다 활성화 할 수 있도록 명확한 법적 규정 제정과 함께 합법적으로 운영될 수 있는 공공정자은행의 설립과 운영이 절실한 실정이다.
정자은행은 운영형태의 다양성에도 불구하고 공공정자은행의 성공적 운영을 위해서는 다음과 같은 3가지 선결 조건이 필요하다. 첫째, 자발적 무상공여자의 모집, 선별검사 및 보상, 정자의 획득, 동결, 보존, 해동 및 방출, 의무기록 등 정보의 보존, 관리 및 이용, 전문인력 등을 규정한 한국형 표준운용지침이 과학적 근거, 생명윤리적 가이드라인 그리고 법률적 규정에 따라 우선적으로 제정되어야 한다. 물론 표준운용지침 제정 시 생명윤리학 및 사회적 컨센서스에 의한 권고사항을 생명과학 및 의학적 기술로 최대한 반영하여야 하며, 반면 생명윤리학적 가이드라인도 반드시 비배우자인공수정이 필요한 난임부부를 위해 시대적 가치를 반영하여 보다 유연성 있게 전향적 자세로 작성되어야 한다. 둘째, 표준운용지침에 따라 공공정자은행을 운영하기 위한 정보전산 프로그램 개발과 함께 거점병원 및 불임전문병원에 설치된 거점공공정자은행을 네트워크하여 정자자원의 효율적인 관리와 이용을 극대화하여야 한다. 이들 병원 중 중앙정자은행을 지정하여 공여정자를 이용한 임신 및 출산 등 비배우자 인공수정의 결과 수집, 관련 정보의 통계학적 분석 및 결과의 공개, 중앙 및 지방정부의 지원 예산 수립, 신청 및 지출, 기타 공공정자은행의 주요 업무활동에 대한 연보 발간 등의 업무를 수행하도록 하여야 한다. 셋째, 공공정자은행의 설립과 운영지원을 보다 명확히 하기 위한 관련법 및 규정이 필요하다.
이상의 3가지 선결조건의 완성과 함께 각론적 측면에서 제기 될 수 있는 다음과 같은 다소 복잡하고 민감한 사안에 대하여 의학적 윤리적 법률적 검토 후 명확한 가이드라인이 마련되어야 한다. 검토되어야 할 사안에는 자발적 정자 공여자의 수급 증대를 위한 활동 범위와 내용, 자발적 정자 공여자에 대한 적절한 보상 범위, 릴레이 기증을 통해 획득된 공여 정자를 이용한 비배우자인공수정 가능 여부, 가족간 정자공여 가능 여부, 근친혼을 방지하기 위한 적정 정자 공여 회수, 비배우자인공수정으로 태어난 아이가 사춘기 이후 생물학적 아버지를 찾을 수 있는 지에 대한 문제, 생물학적 아버지가 골수이식 등 의학적 인도주의적 목적으로 비배우자인공수정으로 태어난 아이를 찾을 수 있는지에 대한 여부, 비배우자인공수정으로 태어난 아이가 생물학적 부모로 부터 상속권이 있는 지 여부, 사체로부터 수태 목적의 정자 채취 가능 여부, 미망인이 남편의 동결 정자를 이용하여 수태 가능 여부, 미혼녀나 동성부부가 비배우자인공수정으로 수태 가능 여부, 외국 정자은행으로부터 국제운송을 통해 공급된 정자로 국내에서 시술 가능 여부, 의료관광을 통해 입국한 외국환자에게 비배우자인공수정 시술 시 추가적으로 필요한 조치, 국외에서 시행될 비배우자인공수정을 위해 공여정자의 국제 배송 가능 여부, 비배우자인공수정과 관련된 의무 기록의 보존 기간 등이 있다.
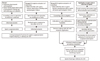
정자 동결보존의 대상은 배우자인공수정과 비배우자인공수정 목적으로 나누어질 수 있다(Figure 1). 배우자인공수정에는 정관절제술과 같은 영구피임술이나 가임 연령층 암환자에서 고환독성이 있는 화학요법이나 방사선치료 등을 앞둔 경우(제1군) 그리고 불임환자의 완전한 평가 후 폐색성 무정자증이나 고도의 정자형성장애로 진단된 뒤 채취된 정자를 보조생식술 등의 불임시술에 사용한 뒤 남은 정자의 동결보존이 필요한 경우(제2군)이다. 세포내정자주입술과 같은 보조생식술의 발달로 인해동결정자를 이용한 비배우자인공수정의 필요성은 감소되고 있는 반면 부고환이나 고환으로부터의 정자흡입술과 같은 외과적 술기에 의한 정자채취의 기회가 증가되어 남편으로부터 채취된 정자의 동결보존과 배우자인공수정의 기회는 오히려 증가되고 있다. 나머지 비배우자인공수정은 완전한 평가 후 정세포가 없는 무정자증이나 정자 채취가 불가능한 고도의 정자형성장애가 동반된 남성불임 환자에서 자발적 무상 정자 공여자로부터 선별검사 후 채취된 건강한 정자를 이용하여 수태를 시도하는 경우(제3군)이다.
정관절제술을 시행하기 전에 후일 애기를 원할 때를 대비하여 정자가 동결 보존될 수 있다. 국내에서 연간 약 30,000례의 정관절제술이 시행되는데 비하면 정관절제술이 영구피임술이며 정관복원술이 100% 성공할 수 없다는 점 그리고 수술 전 정자동결보존의 필요성과 장점에 대하여 잘 홍보되어 있지 못한 실정에 있다. 동결보존을 원하는 경우 술전 2-3일의 금욕 후 최대 2-3회 사정액을 채취한다. 이 정액으로 최소 6회의 자궁 내 인공수정과 2회 이상의 체외수정을 시도할 수 있다.
조정기능이나 사정장애를 유발할 수 있는 질환이나 치료에 앞서 정자가 동결 보존될 수 있다. 병의 진행에 의해 조정기능이 억제될 수 있는 종양으로 백혈병, 임파종, 고환종양 등이 있다. 이들 환자에서 정자의 동결보존은 암이 진단된 뒤 가능하면 빠를수록 좋다. 그 외에도 고환독성 혹은 사정장애가 예견되는 치료로는 항암요법, 방사선치료 외에도 후복막임파절절제술 같은 수술이 있다. 이들 환자군에서도 정관수술에서와 같이 의사나 환자에게 치료 시작 전에 정자동결보존의 필요성에 대해 인식시키는 것이 중요하다. 암환자에서 해동 후 0.2-4.2×106/mL의 운동성이 있는 정자를 이용한 체외수정에서 수정률은 60%, 임신율은 40% 정도 된다. 암환자에서 임신율은 임파종에서 가장 좋으며 고환종양에서 가장 낮은 것으로 알려져 있다.
감정자증 환자에서 수회에 걸쳐 채취된 정자를 동결 보존하여 수주 몇 달간 저장한 뒤 해동하여 낮은 속도로 원심 분리하여 원래보다 높은 농도 혹은 운동성을 가진 정자를 얻을 수 있다. 이러한 방법은 정자의 운동성이 떨어진 약정자증 환자에서도 적용될 수 있다.
분할사정법은 정액의 양이 과도하게 많거나 항정자항체가 증가되었거나 정장액의 질이 좋지 않는 경우 정자의 농도나 질을 높이기 위하여 이용될 수 있다. 따라서 양질의 분할사정액을 동결 보존하여 사용한다면 보다 높은 임신율을 얻을 수 있다.
남편 정자가 정상인 경우에도 부인의 배란일에 일시적 혹은 영구적으로 내원할 수 없는 경우, 심리적 장애로 정자를 적절한 시기에 채취할 수 없는 경우에도 동결보존할 수 있다.
부고환 혹은 고환으로부터 직접 채취된 정자 중 첫 번째 체외수정에서 사용되고 남은 정자를 동결 보존하여 적어도 2회 이상의 체외수정을 시도할 수 있으므로 정자 채취를 위한 불필요한 외과적 처치를 줄이고 경비 절감 효과를 얻을 수 있다.
정액질의 변동이 심한 남성에서 신선정액 만으로 임신이 불가능한 경우 채취된 정자가 양질인 경우 동결보존이 필요하다.
비배우자인공수정을 위한 정자공여자에 대하여 유전질환, 정신질환, 성교 전파성질환 등의 선별검사와 채취된 정액에 대한 정액검사가 시행되어야 한다. 정자공여자로 선택하기에 앞서 정자의 공여와 동결보존에 대한 충분한 설명을 통해 이해시킨 뒤 불임부부를 위해 공여자가 자발적으로 동의해야 한다. 연령적 측면에서는 상염색체 돌연변이의 빈도가 낮은 40세 이하의 공여자가 좋다. 물론 정자공여자는 한민족의 혈통을 지닌 자로 국한되어야 하며, 다만 피시술자 난임부부 중 한쪽이 한민족이 아닌 경우에는 예외로 할 수 있다. 자발적 정자공여 희망자에 대해서는 먼저 병력, 과거력 및 가족력이 조사되고 신체검사가 시행되어야 한다. 과거력 상 동성연애자, 약물남용자, 6개월 이내에 1명 이상의 성파트너를 가진 자, 후천성면역결핍증후군환자 혹은 우려가 있는 자와의 성접촉을 한 자, 1년 이내에 성교전파성질환에 감염된 병력이 있는 자 등 성교전파성질환의 이환가능성이 높은 군은 공여자에서 제외되어야 한다. 병력상 정신질환, 당뇨, 간질, 관상동맥질환 등이 있거나, 신체검사상 요도분비물, 외성기 궤양, 콘틸로마가 있는 경우에도 공여자로서 이용될 수 없다. 가족력으로는 친가 및 외가의 조부모 및 삼촌, 부모 그리고 형제에서 다운증후군, 정신지체, 간질, 근조절능 이상, 조기노화(50세 이전), 난청(60세 이전), 시력소실, 백내장(40세 이전), 정신분열증, 조울증, 구개열, 구개순, 선천성만곡족, 척추결손 또는 수두증, 선천성심질환, 선천성고관절기형, 2회 이상의 유산 또는 사산, 당뇨병, 갑상선질환, 진행성신질환, 만성피부병, 낭종성섬유화증, 관절염(50세 이전), 조기사망(50세 이전) 등의 유무에 대하여 조사해야 한다. 정액채취는 최소 2-3일의 금욕 후 정자은행에서 자위행위로 채취된 뒤 동결 전 정액검사가 시행된다. 동시에 흉부단순촬영, 요검사를 통한 임질, 비임균성요도염, 트리코모나스감염, 진균감염 및 신질환 유무, ABO-Rh 혈액형검사, 혈청검사를 통한 간기능 이상, B형 및 C형 간염, 거대세포 바이러스감염 및 매독 감염 유무를 확인하기 위한 선별검사가 시행된다. 비배우자 공여정자의 정액검사 소견은 세계보건기구 2010기준으로 정액량은 1.5 mL 이상, 농도는 15×106/mL 이상, 운동성은 40% 이상, 형태는 정상 정자가 4% 이상, 생존정자 58% 이상 이어야 하며 그리고 해동 후 생존율도 50% 이상 되어야 한다. 염색체검사는 유전적 선별검사의 강화를 위해 공여자 선별검사 중에 포함되기도 하지만, 가계력이 적절히 조사되고 유전질환의 잠재적 위험이 없다면 꼭 시행할 필요는 없다. 혈액형 또한 과거의 검사결과를 공여자가 정확하게 알고 있다면 시행하지 않아도 된다. 검사결과 정신적 육체적으로 건강하며 유전질환이나 성교전파성질환과 같은 전염성질환이 없으며 채취된 정액이 정상범위 내의 소견을 보이면 최종적으로 책임자의 확인과정을 거쳐 정자는 동결보존된다. 동결보존된 정자는 정자공여 6개월 후 공여자에 대한 후천성면역결핍증의 혈청검사가 완료된 뒤 비배우자인공수정의 적응이 되는 남성불임환자의 치료목적으로 이용될 수 있다. 반복 공여자인 경우에는 매 6개월마다 선별검사를 반복하여 재선별하여야 한다. 이상과 같은 정상적인 선별검사를 통해 획득된 공여정자를 이용한 비배우자인공수정에서 선천성 기형의 빈도는 정상에서 보다 약 1/5로 줄일 수 있다. 추가하여 현행법상 사체에서 수태 목적의 정자 채취는 엄격히 금지된다.
불임부부가 비배우자 정자 선택 시 고려되는 공여자의 체형, 유전, 혈연적 특성으로 혈액형, 신장, 체중, 체형, 홍채, 모발색, 모발형, 피부색, 성격, 학력, 직업, 취미, 성씨 본관 등을 조사하여야 한다.
비배우자인공수정이 필요한 불임부부는 치료에 앞서 남성인자에 관한 검사를 포함하여 완전한 평가를 통해 비배우자인공수정의 의학적 적응증에 해당되는지 확인되어야 한다. 이에 관한 기록이 첨부 또는 보존되고 시술이 시행되기 전에 반드시 재검토되어야 한다. 물론 임신의 금기증, 유전질환과 관련된 가족력, 성교전파성질환의 이환, 생식기 이상 및 생식능 유무 등 여성불임인자에 대해서도 충분히 조사되어야 한다. 물론 여성불임인자에 의해 임신이 될 수 없거나, 여성 성기에 감염이 있거나 감염될 위험이 높은 경우 그리고 부부 어느 한쪽에 만성질환, 정신박약이 있거나 자식을 양육할 능력이 없는 경우에는 비배우자인공수정이 시도될 수 없다. 비배우자인공수정을 원하는 부부는 시술과정을 이해하고 부부간에 시술에 대한 충분한 협의와 숙려기간을 거친 후 이에 대한 남편의 동의가 반드시 있어야 한다. 비배우자인공수정이 경우에 따라서는 심한 정신적 후유증이 동반될 수 있다는 점도 충분히 설명되어야 한다. 필요한 경우 부부 모두에서 전문 카운슬러와의 상담이나 정신과 전문의에 의한 정신과적 평가가 권유될 수 있다. 시술대상 부부는 비배우자인공수정으로 태어난 출생아를 정상적으로 부양할 능력이 있어야 하며 부모로서 사회적 도덕적 법적 의무를 다하여야 함을 확인하여야 한다.
공여정자를 이용한 인공수정이나 체외수정은 현대의학과 생명의 존엄성에 입각하여 정도 관리에 최선을 다하여야 한다. 자발적 정자공여자로 부터 무상 획득된 정자는 비배우자인공수정이 필요한 불임부부에게 무상으로 제공되어야 한다. 다만 동결정자의 해동, 처리, 운송 및 인공수정과 관련된 시술비만 청구되어야 한다. 또한 한 명의 공여자로부터 채취된 정자를 이용한 임신횟수는 근친혼의 발생위험으로 일정 횟수 이하로 제한되어야 한다. 동일 공여자의 정자를 인공수정에 이용할 수 있는 횟수는 나라에 따라 기준이 다르며, 1명의 공여자로 부터 중국은 5명 이내의 임신을, 영국은 10명 이상의 출생이 되지 않도록, 미국은 인구 80만 명당 25명 이내의 출생이 되도록 권유되고 있다. 국내에서는 대부분의 정자은행에서 1명의 공여자로부터 최대 5명에게 정자를 공여하는 것을 원칙으로 하고 있다. 향후 발생할 수 있는 법적 분쟁의 예방을 위해 비배우자인공수정의 결정과 시술과정에 전문 카운셀러나 법조인의 자문에 따른 법적 확인절차가 반드시 필요하다.
공공정자은행의 설립과 운영으로 인한 기대효과는 인구사회학, 의료서비스, 법률, 과학기술, 경제 및 연구 인프라 구축 측면에서 평가될 수 있다. 인구사회학적 측면에서는 자연임신을 통한 연간 5천여 명 이상의 출산 증대로 초저출산에 처한 국가적 인구문제 해결과 미래의 우수한 출산 및 유전 자원을 보유할 수 있으며, 의료서비스 측면에서는 피임과 암치료 관련 공공의료서비스 질 향상, 정자은행을 통한 불임치료 네트워크를 통해 난임이라는 소수의 의료 수요자를 위한 의료 복지적 대처가 가능해지며, 법률적 측면에서는 관련법 규정의 제정을 통해 불법 정자 및 난자 매매 근절하고, 과학기술적 측면에서는 정자동결 및 해동 기술개선, 정자 선택 프로그램 개발 등 정보화사업, 난치성 불임의 대체 치료기술개발 및 관련 특허출원 및 등록 기회를 제공하고, 경제적 측면에서는 난치성 불임 환자의 치료비 등 국가 재정의 절감, 연구 인프라 구축 측면에서는 정자학, 생식의학과 동결공학 연구 기반 및 거버넌스를 확립하고, 창조 의료산업적 측면에서는 2차 정자은행의 관리운영과 정자동결보존 관련기술 이전으로 산학협력 등 의료산업 발전, 재외국민을 위한 한민족 정자공여의 국제적 네트워크 구축, 아시아권 환자의 한국 정자은행 이용으로 의료관광산업을 촉진할 수 있을 것으로 기대된다.
불임은 임신을 원하는 가임 연령대에 있는 부부의 약 15%에서 발생하며 불임과 관련된 선천성 후천성 질환의 증가, 환경오염, 가족계획에 의한 저출산 및 매스컴의 홍보효과로 인해 불임 클리닉을 찾는 남성불임환자 수는 매년 증가되고 있다. 최근 보조생식술의 괄목할만한 발전으로 수태의 기회가 많아졌음에도 불구하고 이중 상당수가 비배우자인공수정 혹은 입양이 필요한 무정자증 혹은 난치성 감약정자증 환자이다. 그 외에도 조정기능이 약화되었거나 이에 영향을 줄 수 있는 질환이나 치료, 영구피임술 등으로 인해 배우자 정자의 동결보존이 필요한 임상증례 또한 급격히 증가되고 있는 실정이다. 따라서 인구 및 생식의학 분야에서 극한적 상황에 처해 있는 한국의 실정에서 배우자인공수정의 기회를 보장함과 동시에 건강한 정자가 치료적 비배우자인공수정에 이용되기 위해서는 정자은행의 표준운영지침 확립과 관련법 보완이 선결되어야 하며 이를 기반으로 국가의 관리와 재정지원이 담보된 공공정자은행의 설립과 운영이 시급히 요구된다.
우리나라는 현재 저출산으로 인한 인구경제학적 위기에 직면해 있을 뿐만 아니라 기존의 난임, 불임부부의 임신 및 출산율 증가에 정자은행이 이용되고 있음에도 불구하고 정자은행의 표준운영지침이나 관련법이 확립되어 있지않으므로 본 논문은 매우 시기적절하다고 하겠다. 본 논문은 최근 출산률 저하와 불임 부부의 증가로 인한 인구감소의 위기를 맞고 있는 대한민국에 있어서, 남성불임으로 인한 임신 불가에 대한 치료 방향을 제시하고 있다. 시험관아기시술 등의 보조생식술의 비약적인 발전에도 불구하고 아직까지 비폐쇄성무정자증 남성은 본인의 자식을 가질 확률이 매우 낮다. 이러한 것을 보완하기 위하여 비배우자인공수정을 시행 할 수 있으나, 다른 나라와는 달이 국내에서는 그 시설 및 법률적인 제약으로 인하여 널리 행하여지지 않고 있다. 이런 상황에 대한 해결 방안으로 공공정자은행의 필요성 및 법률적인 내용을 정리하여 자세히 기술 하였다. 한국 내의 공공정자은행의 설립의 방향 및 필요성을 적극적으로 피력했다는 점에서 의의가 있는 논문이라 판단된다.
[정리: 편집위원회]
Figures and Tables
References
1. Mahony MC, Morshedi M, Scott RT, DeVilliers A, Erasmus E. Role of spermatozoa cryopreservation in assisted reproduction. In : Acosta AA, Swanson RJ, Ackerman SB, Kruger TF, van Zyl JA, Menkveld R, editors. Human spermatozoa in assisted reproduction. Baltimore: William & Wilkins;1986. p. 310–318.
2. Hafez ES, Arias E. Andrology, semen banks, and IVF centers: HIV/ARC/STD. Arch Androl. 1988; 21:75–119.

3. Royere D, Barthelemy C, Hamamah S, Lansac J. Cryopreservation of spermatozoa: a 1996 review. Hum Reprod Update. 1996; 2:553–559.

4. Mantegazza P. Fisiologia sullo sperma umano. Rendic Reale Instit Lomb. 1866; 3:183–186.
5. Rostand J, Cole R. Glycerine et resistance du sperme aux basses temperature. Acad Sci Paris. 1946; 222:1524–1525.
6. Polge C, Smith AU, Parkes AS. Revival of spermatozoa after vitrification and dehydration at low temperatures. Nature. 1949; 164:666.

7. Bunge RG, Sherman JK. Fertilizing capacity of frozen human spermatozoa. Nature. 1953; 172:767–768.

8. Sawada Y. The preservation of human semen by deep freezing. Int J Fertil. 1964; 9:525–532.
9. Witt MA. Sperm banking. In : Lipshultz LI, Howards SS, editors. Infertility in the male. St. Louis: Mosby;1997. p. 501–505.
10. Daudin M, Rives N, Walschaerts M, Drouineaud V, Szerman E, Koscinski I, Eustache F, Saias-Magnan J, Papaxanthos-Roche A, Cabry-Goubet R, Brugnon F, LeLannou D, Barthelemy C, Rigot JM, Freour T, Berthaut I, Giscard d'Estaing S, Touati F, Melin-Blocquaux MC, Blagosklonov O, Thomas C, Benhamed M, Schmitt F, Kunstmann JM, Thonneau P, Bujan L. Sperm cryopreservation in adolescents and young adults with cancer: results of the French national sperm banking network (CECOS). Fertil Steril. 2015; 103:478–486.e1.

11. Tomlinson MJ, Pooley K, Pierce A, Hopkisson JF. Sperm donor recruitment within an NHS fertility service since the removal of anonymity. Hum Fertil (Camb). 2010; 13:159–167.

12. Linden JV, Centola G. New American Association of Tissue Banks standards for semen banking. Fertil Steril. 1997; 68:597–600.

13. American Society for Reproductive Medicine. Minimal genetic screening for gamete donors. Fertil Steril. 2002; 77:6 Suppl 5. S15–S16.
14. American Society for Reproductive Medicine. Guidelines for sperm donation. Fertil Steril. 2002; 77:6 Suppl 5. S2–S25.
15. American Society for Reproductive Medicine. Guidelines for sperm donation. Fertil Steril. 2004; 82:Suppl 1. S9–S12.
16. American Society for Reproductive Medicine. 2002 Guide-lines for gamete and embryo donation: a practice committee report: guidelines and minimum standards. Fertil Steril. 2004; 82:Suppl 1. S8.
17. Ethics Committee of the American Society for Reproductive Medicine. Using family members as gamete donors or surrogates. Fertil Steril. 2012; 98:797–803.
18. Ethics Committee of the American Society for Reproductive Medicine. Interests, obligations, and rights in gamete donation: a committee opinion. Fertil Steril. 2014; 102:675–681.
19. British Andrology Society. British Andrology Society guidelines for the screening of semen donors for donor insemination (1999). Hum Reprod. 1999; 14:1823–1826.
20. Gazvani R, Hamilton MP, Simpson SA, Templeton A. New challenges for gamete donation programmes: changes in guidelines are needed. Hum Fertil (Camb). 2002; 5:183–184.

21. Scandinavian recommendations: sperm donation. Bull Med Ethics. 2003; (191):8–9.
22. Rowe PJ, Comhaire FH, Hargreave TB, Mahmoud , Ahmed MA. WHO manual for the standardized investigation, diagnosis and management of the infertile male. Cambridege: Cambridge University Press;2000.




 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download