Abstract
In female sexual dysfunction (FSD), psychological and contextual factors significantly influence organic components of sexual response and behavior. The hormonal environment also affects FSD. Therefore, a tailored medical approach to each individual's sexual symptom is inevitable. This paper reviews currently available pharmacological treatment of FSD including the most recent advances and future targets in pharmacotherapy. In hormonal therapies for FSD, efficacy of estrogens and androgens on the treatment of vaginal atrophy, low sexual desire, and small subsets of genital arousal disorder, respectively, have been demonstrated. However, we need more data regarding long-term safety. There are two non-hormonal agents approved by the US Food and Drug Administration. Flibanserin has shown marginal benefit over placebo for the treatment of hypoactive sexual desire disorder. Ospemifen has shown beneficial effect on vulvovaginal pain from hormone related atrophy although it requires a longer period data to assess safety in other female genital organs, such as uterus and ovaries. Controversies still remain regarding hormonal therapies for FSD. Besides, some of the developing drugs still require more reliable safety and efficacy data. However, pharmacologic treatment of FSD is a promising field yet to be explored.
여성의 성 반응과 성적 행동은 호르몬 상태, 정서적 상태, 환경, 신체적 상태 등을 비롯해 개인의 감정적 경험, 성에 대한 태도, 문화적 배경 등 다양한 요소들이 관여하여 나타나는 결과이다. 따라서 기질적 원인의 성기능장애 환자를 치료할 때 임상적인 증상뿐만 아니라 증상발현에 영향을 미치는 인자의 개선에도 관심을 가져야 한다.
여성에서 성호르몬은 나이가 듦에 따라 감소한다. 당연히 성호르몬의 감소는 성기능에 영향을 미친다. 특히 성호르몬의 변화는 여성 외부 생식기의 위축을 유발할 뿐만 아니라 혈관, 신경, 정신심리적 면에서도 영향을 미칠 수 있다. 에스트로겐 보충요법은 폐경기 여성의 호르몬보충치료로 이미 오랫동안 사용되고 있으며, 남성호르몬, 특히 테스토스테론 보충요법은 아직 논란이 있으나, 경험적으로 치료에 이용되고 있다. 성욕과 성각성에 영향을 미치는 약물 중 테스토스테론요법 이외에 중추신경계의 반응을 조절하는 다수의 후보약물이 개발되고 있다. 최근 미국에서는 여성성욕저하장애(hypoactive sexual desire disorder)의 치료제로 플리반세린(flibanserin), 여성 외음부통증 치료제로 오스페미펜(ospemifene) 등이 미국 식품의약국(Food and Drug Administration, FDA)의 승인을 받아 치료에 이용되고 있다[12345].
따라서 임상적으로 이용되고 있는 여성성기능장애 약물치료의 최신지견을 비롯하여 향후 치료법으로 효과가 기대되는 약물요법에 대해 고찰하여 보고자 한다.
여성성기능장애 환자의 치료를 시작하면서 기본적으로 이루어져야 할 것은 상담을 통한 적절한 성지식의 제공과 성상대자와의 성생활에 대한 의사의 충분한 이해, 환자와 성상대자 간의 잘못된 성지식이나 습관은 없는지 등을 파악하는 것이다. 또한, 성기능장애를 치료하기 위한 세부적인 처치를 시작하기 전에 환자의 전신상태와 심리적 상태를 정확히 파악하여 필요하다면 정신심리적인 치료를 선행하거나 병행하는 것도 권장되고 있다. 이러한 경우 부부가 동반하여 상담을 받고 성상대자가 치료에 동참하는 것을 권장하고 있다.
원인에 따른 약물치료를 시작하기 전에 가역적으로 교정할 수 있는 것은 가능한 시작하도록 한다. 생활습관 중 흡연, 음주, 습관성 약물복용, 과격한 운동, 식이요법 등도 성기능에 영향을 미칠 수 있으므로 적절히 조절하도록 하여야 한다. 또한 다이어트 약, 만성적인 스트레스, 만성피로, 우울증 역시 성기능에 영향을 줄 수 있으므로 가능한 원인을 찾아 제거하도록 하거나 이를 조절할 수 있는 적절한 치료를 시작하여야 한다[6]. 항우울제 중 선택적 세로토닌수용체 억제제(selective serotonin reuptake inhibitor)는 성욕감소, 성흥분, 극치감 지연의 부작용이 발생하는 것으로 알려져 있다. 성기능장애가 이런 약물의 복용과 관련이 있는 것으로 의심된다면 가능하면 성기능 부작용이 적은 다른 선택적 세로토닌수용체 억제제나 부프로피온(bupropion hydrochloride)같은 약물로 바꾸도록 한다. 부프로피온의 경우 대뇌에서 도파민 수용체를 자극하여 성욕을 증진시키는 효과를 기대할 수 있어 호르몬 수치가 정상인 성욕저하 환자에게 사용하면 도움이 된다[789]. 고혈압 약제 중 성기능장애를 유발할 수 있는 베타차단제나 이뇨제는 칼슘통로차단제나 안지오텐신 전환효소 억제제(angiotensin converting enzyme inhibitor)로 바꾸도록 한다. 칼슘차단제나 안지오텐신 전환효소 억제제는 외성기 혈류량을 증가시켜 성기능에 긍정적인 효과를 보인다[6]. 시메티딘(cimetidine), 라니티딘(ranitidine) 등의 H2 수용체억제제 역시 성욕감퇴 효과가 있다. 그러므로 약물복용을 중지하거나 성기능감퇴 효과가 없는 파모티딘(famotidine)으로 약제를 변경하도록 한다[6]. 장기간의 경구피임약 복용은 혈중 유리테스토스테론의 감소로 성기능장애를 유발할 수 있다[910]. 피임약을 복용하고 있는 여성이 성기능장애를 호소한다면, 피임약 복용을 중단하고 비경구용 피임방법을 이용하게 하는 것이 좋다.
중추신경계에서 에스트로겐은 시상하부와 시각교차앞구역에 가장 고농도로 존재한다[11]. 이는 방향화 과정에 의해 테스토스테론으로 전환된다[11]. 따라서 성행동의 조절에 중추신경계에 존재하는 에스트로겐 농도가 상당한 영향을 미친다. 뿐만 아니라, 중추신경계에는 에스트로겐수용체 또한 다량으로 존재한다. 이들 수용체는 catecholaminergic, serotonergic, cholinergic, gamma-aminobutyric acidergic system에 상호작용하여 신경 전달체의 활성을 조절하는데 관여한다. 또한 에스트로겐 중 에스트라디올은 프로게스테론 수용체 발현을 증진시켜 신경망의 활성을 조절한다. 이와 같이 성호르몬의 신경계에 미치는 영향뿐만 아니라 호르몬부족으로 인한 전신증상, 질환경의 변화 등이 여성성기능장애를 더욱 악화시키는 데 기여하므로 적절한 호르몬환경을 유지시키는 것은 여성성기능장애의 치료에서 매우 중요하다[12]. 에스트로겐의 상태는 직접적으로는 외음부 피부의 성적 민감도에 유지에 중요하다. 또한 전신적인 폐경 관련 증상(혈관운동증상, 수면장애, 피로, 권태감, 인지기능저하 등)이 있는 경우 간접적으로도 성적능력에 영향을 미칠 수 있다. 따라서 여성에서 적정한 호르몬수치는 다양한 이유로 성기능 유지에 중요하다[12]. Freeman 등[13]의 코호트연구(Penn Ovarian Aging Study)에서 폐경 후 여성의 35%, 갱년기여성의 22%가 성욕감퇴를 보였다. 이들의 연구에서는 에스트로겐 수치가 낮은 것과 성욕이 양의 상관관계를 보였다. 336명의 45-55세 여성을 대상으로 한 Melbourn Women's Health Project에서는 조금 다른 결과를 보여, 에스트로겐 농도가 성교통, 성행위의 빈도에는 영향이 없었다[14]. 한편 에스트로겐 농도는 성적 반응과 관계 있었다. 그러나 전반적으로는 호르몬 수치 변화보다 폐경 전 성기능 정도, 파트너와의 관계 등이 성기능 변화에 더 중요한 영향을 미쳤다.
따라서 호르몬치료를 결정함에 있어서 고려하여야 할 점은 성기능장애가 있는 여성이 어느 정도까지 치료효과를 기대하고 있는가, 발생 가능한 부작용에 대해 이해하고 있는가, 그리고 호르몬치료의 적응증에 해당이 되는지, 아니면 호르몬치료의 위험군인지 등을 고려하여 환자에게 충분히 이해시킨 후 시작해야 한다. 여성성기능장애에서 각각의 호르몬 영향은 복합적이며 상호 보완적이기 때문에 각각의 호르몬보충치료가 성반응 단계에 따라 미칠 수 있는 효과를 단정 지을 수는 없다. 그러나 적절한 성반응을 이끌어 내기에 부족한 상태에서 보충되는 경우는 도움이 될 수 있다.
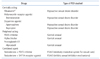
폐경 전 여성과 폐경 후 여성의 호르몬치료는 다르게 고려하여야 한다. 정상적으로 배란을 하고 생리주기가 규칙적인 여성의 성기능장애에 에스트로겐이나 프로제스테론 치료가 효과적인지는 아직 근거가 부족하다. 반면 생리주기가 불규칙적이거나 자궁내막증 등 다른 병인이 있어서 치료가 필요한 경우, 정상적인 주기로 배란을 하지 못하는 경우, 무월경, 과다월경 등은 폐경 전이라도 호르몬치료가 필요하다. 에스트로겐과 프로제스테론 모두 부족 시 성반응을 비롯하여 성적 만족감 등이 저하되기 때문에 이를 보충하여 정상치를 유지하는 것은 중요하다[101112131415]. 특히 에스트로겐 보충치료는 전반적으로 성반응 단계의 모든 부분에 긍정적인 증상 경감 효과를 얻을 수 있지만 극치감 장애에 대해서는 아직 관련된 연구 결과가 부족하다(Table 1). 프로제스테론은 성욕이나 성 각성 반응에 도움을 주기는 하지만 단독 투여가 성기능장애 문제를 치료하는데 도움이 되는 지에 대해서는 아직 충분히 연구되어 있지 않다(Table 1). 호르몬 보충치료 부작용으로 sex hormone binding globulin이 상승할 수 있는데, 이로 인해 안드로겐의 체내 농도 변화가 생길 수 있다[1011]. 이는 결과적으로 성기능에 영향을 줄 수 있다. 따라서 폐경 전 여성에서 호르몬치료가 필요한 경우에는 치료 전 기본적인 호르몬 상태를 점검하고 주기적으로 sex hormone binding globulin과 안드로겐수치를 모니터 할 필요가 있다. 뿐만 아니라, 유방암, 자궁암, 지질대사 변화 등 호르몬보충치료로 유발될 수 있는 전신적인 부작용에 대한 면밀한 관찰도 반드시 필요하다. 특히 심혈관질환, 호르몬 의존성 종양의 가족력이나 과거력이 있는 경우는 전신적인 보충치료를 하기 전에 국소치료나 호르몬치료 외의 다른 방법이 효과적일 지 고려하여 보아야 한다. 폐경여성에서도 성기능장애를 호소할 경우 환자의 증상과 치료 요구도에 따라 호르몬치료의 방법을 선택하되 주기적인 검사를 함께 하는 것이 안전하다.
위축성질염, 재발성 세균성질염, 외음부위축 등 폐경 후 에스트로겐 감소로 생기는 국소 질환은 호르몬보충치료로 개선될 수 있다. 외음부의 국소적인 증상은 전신투여보다는 연고, 크림 등 국소도포치료가 효과적이며 유방암, 자궁암 등 전 투여 시 발생할 수 있는 부작용을 줄 일 수 있다.
일반적인 전신투여방법은 경구투여가 보편적이며, 그 밖에 피부에 붙이는 패취제제, 피하주사가 사용된다. 자궁절제로 자궁이 없는 경우에는 에스트로겐제제만 투여한다. 자궁이 있는 경우에는 자궁내막암의 예방을 위해 프로제스테론이 함유되어 있는 제제를 사용한다[15].
에스트로겐의 투여만으로는 유리 테스토스테론이 감소하여 성욕감소, 성적반응 감퇴 등이 병발할 수 있다. 이를 고려하여 소량의 남성호르몬을 병용할 수 있다. 대표적인 약제가 티볼론이다[16]. 티볼론은 합성에스트로겐으로 약한 남성호르몬 효과가 있다. 폐경기여성에서 티볼론제제 투여로 다른 에스트로겐 투여군보다 여성성기능지수가 유의하게 증가한 보고가 있다[16]. 성기능장애가 있는 폐경여성을 대상으로 한 무작위대조연구에서 티볼론과 전신적인 호르몬 치료(경피 에스트라디올-노르에티스테론 아세테이트, transdermal estradiol-norethisterone acetate) 투여효과를 비교하였을 때, 24주 후 성기능은 파트너의 유도에 따른 성생활에서 티볼론 투여그룹이 의미 있게 반응도가 증가하였다[16].
자연적으로 폐경되는 여성은 안드로겐이 급격히 감소하지 않는다. 물론 젊은 여성에 비해 나이가 든 폐경 후 여성은 노화의 결과로 혈중 테스토스테론이 낮아진다[17]. 여성에서 폐경 외에도 테스토스테론이 낮아지는 경우는 수술적 폐경, 난소기능부전, 뇌하수체저하증, 안드로겐부족증후군 등이 있다. 폐경에 의해 테스토스테론 감소 등 안드로겐수치의 변화뿐 아니라 수용체의 발현도 영향을 받을 것으로 본다. Jun과 Yoon [18]은 폐경 전, 폐경 후 여성의 질에서 안드로겐 수용체의 발현변화를 관찰하였다. 질 조직에서 안드로겐 수용체의 발현은 폐경 전에 비해 폐경 후 여성에서 감소되었고, 이는 성기능의 변화와도 상관관계가 있었다.
안드로겐 부족증후군과 같은 경우 테스토스테론 보충치료가 도움이 될 수 있다. 테스토스테론 보충요법은 골소실, 근력감퇴, 기억력감퇴, 인지기능의 변화를 개선시킬 수 있으며, 함께 성기능장애 증상도 개선시킬 수 있다[1920] (Table 1).
Shifren과 Avis [19]는 외과적 절제로 폐경이 된 31세-56세 여성 75명을 대상으로 테스토스테론 150, 300 µg 패취와 위약의 효과를 12주간 투여하며 비교하였다. 결과를 보면 150, 300 µg 투여군 모두에서 위약보다 의미 있게 혈중 총 테스토스테론, 유리 테스토스테론, 생체이용가능 테스토스테론치가 증가하였고, 성기능지표가 향상되었다. 그러나 테스토스테론 상승으로 인한 혈중콜레스테롤, 중성지방 등 지질관련 혈액검사 수치 변화나 여드름, 다모 등의 관련 부작용은 없었다.
전신적인 또는 국소적인 남성호르몬 투여 시 심혈관계에서는 고지혈증, 혈관계질환 빈도증가, 체중증가 등이 있을 수 있다. 또한 안면 다모 또는 수염, 여드름, 저음, 남성형 탈모 등의 부작용이 생길 수 있다. 발생학적으로 남성의 음경과 유사기관인 음핵은 음핵비대가 생기기도 한다. 따라서, 성호르몬 의존성 종양의 기왕력이 있거나 심한 혈관질환자 또는 심혈관질환 고위험군은 안드로겐 보충치료를 피하는 것이 좋다. 남성호르몬 과다투여 후 정상으로 회복되는 기간은 약제에 따라 달라 수개월 이상이 소요될 수 있다[1920].
비교적 최근의 무작위 위약대조연구에서 테스토스테론 젤을 16주간 질에 도포한 경우, 폐경 전 여성이나 폐경 후 여성 모두 자가 보고한 성기능은 향상되는 효과를 보였다고 한다[20]. 경피적으로 사용한 테스토스테론은 아로마타아제(aromatase)에 의한 여성호르몬으로의 전환이 없고 국소적으로 장기에 바로 흡수되어 작용하는 것으로 보고 있다[20].
여성에 있어서 남성호르몬보충에 대해서는 아직까지도 논란이 있다. 테스토스테론을 이용한 치료는 아직까지는 안전성과 효과를 뒷받침할 만한 잘 계획된 연구가 부족하고 장기 사용 시 안전성의 문제가 있으므로 꼭 필요한 환자에게 주기적인 검사를 시행하며 신중히 사용하여야 한다.
오스페미펜은 선택적 에스트로겐수용체 조절제(selective estrogen receptor modulator, SERM)로 증등도-중증의 성교통 치료제로 미국에서는 2013년 FDA의 승인을 받아 사용되고 있다.
SERM이란 에스트로겐 수용체에 결합할 수 있는 비호르몬성 물질로서 표적 장기에 따라 에스트로겐 혹은 항에스트로겐처럼 다르게 작용하는 양면성을 가지고 있다. 이를 이용하여 골다공증 치료제, 유방암 치료제, 질건조증 치료제 등으로 쓰이게 되었다. 대부분의 SERM은 뼈에서는 에스트로겐처럼 작용하고, 유방에서는 항에스트로겐으로 작용한다. 그러나 자궁과 질 점막에 대한 효과는 균일하지 않다. 오스페미펜은 질 조직을 좀 더 두텁고 덜 취약하게 만들어 성교통을 감소시키는 효과가 있는 것으로 알려져 있다. 이로 인해 2차적으로 성생활이 개선될 수 있으나, 성교통 이외에 다른 성기능장애에 대한 직접적인 치료 효과는 아직 연구되어 있지 않다(Table 1).
오스페미펜의 효과에 대해 외음부 및 질 위축증을 가진 폐경 후 여성을 대상으로 한 무작위 대조군비교 임상연구가 진행되었다. 12주 치료 후 위약을 투여한 여성들에 비해 오스페미펜으로 치료한 여성들에서 성교통이 통계적으로 유의하게 개선됐음을 보여주었다[12].
그러나, 아직 이 약에 대한 실질적인 광범위한 임상시험 데이터는 부족하다. 더욱이 호르몬은 아니지만 호르몬수용체를 조절하는 기능으로 인해 저용량 에스트로겐 치료요법처럼 혈전형성 위험도가 높아지고, 일부 여성에서는 자궁내막을 자극하여 자궁내막증식증 또는 자궁암의 발병 위험이 있을 수 있어 위험군에서는 사용을 권장하지 않으며, 장기치료 시 주의할 필요가 있다.
플리반세린은 2015년 8월에 미국 FDA의 승인을 받아 폐경 전 여성의 후천적, 전반적인 성욕구저하장애의 치료제로 사용되고 있다. 플리반세린은 5HT(5-hydroxy-tryptamine)1A 항진효과와 5HT2 길항 효과를 동시에 가지고 있는 약물이다. 전두엽피질의 피라미드 뉴론에서 글루타메이트를 억제한다[3]. 만성적으로 복용할 경우 전두엽 전방에서 (1) 5HT를 억제, (2) 도파민과 노르에피네프린 분비를 상승, (3) 기본적인 도파민, 노르에피네프린 수치를 상승, (4) 중격측좌핵에서 기본적인 노르에피네프린 수치 상승효과를 보인다[34]. 성욕구장애가 있는 폐경 전 여성을 대상으로 한 3상 임상연구에서 위약 대비 플리반세린 100 mg 취침 전 매일 복용이 성기능 설문지(Female sexual function index, FSFI)의 욕구, 전반적인 성기능(FSFI 총점)이 통계적으로 의미 있게 향상되었다[4]. 또한 성생활과 관련된 고통이나 곤란함을 확인하는 설문에서도 약물복용으로 좋아지는 결과를 보였다[45]. 한편, 52주 장기복용에도 플리반세린의 효과는 유지되고 심각한 부작용은 없었다[5]. 플리반세린 복용과 관련하여 위중한 부작용은 1% 미만이었고, 흔한 부작용은 졸리움, 메스꺼움, 어지러움, 피로감 등으로 전체적으로 10% 이하로 보고되었다[45].
그러나, 플리반세린의 성욕장애 치료효과는 통계적으로는 의미 있는 차이는 있으나 경계선상의 호전에 있는 정도로 위약에 비해 확연하게 차이가 나지 않는 점 때문에 실제 사례에 치료 시 얼마나 좋은 효과를 보여줄 수 있을지 추가 데이터가 필요하며, 보다 광범위한 장기연구도 필요하다.
브리멜라노타이드(bremelnotide, P-141)는 알파-멜라노사이트(alpha-melanocyte) 자극 호르몬의 합성 유사체이다. 이는 대뇌의 멜라노콜틴 수용체(MC3R, MC4R)에 작용, 비교적 자연스러운 성반응을 일으키는 약물로 알려져 있다. 이 약의 2상 연구에서 위약과 대비하여 성욕, 성각성, 성적자극신호에 대한 외부생식기의 반응이 의미 있게 증가되는 효과를 보였다. 이 연구의 대상 환자들은 성욕감퇴를 비롯한 성에 관련된 고충도 통계적으로 의미 있게 경감되었다고 보고되었다. 2015년 현재 3상 임상시험이 진행 중에 있다[2122].
여성 성기능장애의 약물치료지금까지 보고된 부작용으로는 구역이 가장 흔하며(12.5%), 그 외에 구토, 홍조, 두통, 코막힘, 졸림, 일시적인 수축기혈압 상승 등이 있었다. 부작용의 정도는 대부분 경미하다.
도파민 수용체를 자극하면 성 충동과 반응이 자극되어 중추에서의 성 각성과 욕구가 증진된다. 비특이적 도파민 수용체 길항제인 아포몰핀(apomorphine)이 폐경 전 여성에서 성욕/성흥분장애 치료효과가 있는 것으로 보고된 바 있다. 그러나 도파민 길항제 관련해서는 2000년대 초반의 연구 외에 후속 연구가 발표되지 않았다[23].
부프로피온(bupropion)은 도파민과 노르에피네프린 재흡수 억제제이다. 항우울제로 쓰이지만 직접적인 세로토닌 증진 효과는 없다. 여성성욕저하장애 치료제로 공식적으로 인가 받지는 않았으나 의사의 판단에 따라 사용되고 있다. 성욕장애과 성흥분장애를 가지고 있는 폐경 전 여성을 대상으로 한 위약대조시험연구에서 경도-중등도의 호전효과를 보았다[789]. 이 밖에도 트라조돈(trazodone) 같이 성기능 관련 부작용이 없는 항우울제나 항불안제를 테스토스테론과 병합하는 치료법 등이 연구되고 있다[2425]. 이는 성반응에 연관된 신경내분비 반응의 균형을 이뤄 성욕장애, 성흥분장애를 치료하는 원리이다[2425].
혈관 확장제는 남성의 발기부전 치료와 유사한 개념으로 연구되어왔다. 주로 질, 음핵, 음순 등 혈관이 풍부하여 성각성 반응에 중요한 역할을 하는 말단 성 기관(sexual organ)에서 성적 자극에 대한 반응으로 혈관 확장에 따른 혈류개선으로 성각성 장애 치료효과를 얻기 위한 연구들이 시도되고 있다(Table 2).
여성의 음핵, 질, 소음순에 phospho-diesterase (PDE) 이형체가 존재한다[2426]. 선택적인 제5형 억제제(PDE5 inhibitors)는 cGMP의 분해를 억제하여 질과 음핵 평활근의 이완을 돕는다. 이런 배경으로 성흥분장애 여성의 치료제로 PDE5 억제제가 다년간 연구되어 왔다.
그러나 다수의 연구에서 폐경기 여성에 선택적 PDE5 억제제 중 하나인 실데나필 투여가 유의한 효과를 보이지 못하였다. 이론적으로는 성 호르몬(안드로겐과 에스트로겐)의 적절한 농도가 선택적 PDE5 억제제의 효과를 볼 수 있는 전제조건이라고 여겨지고 있다[24]. 또한 남성에서도 PDE5 억제제는 성욕이 어느 정도 있었느냐에 따라 반응이 결정되며, 성욕을 증진시키는 효과는 없기 때문에 여성에서도 이 점을 간과할 수 없다.
선택적 PDE5 억제제는 아직 여성성기능장애의 치료제로서 승인되지는 않았으나 성 각성장애가 있는 폐경기 전후 여성 중 선택된 경우에 효과적일 것으로 기대되고 있으며, 이를 바탕으로 치료 약제로서 개발하기 위한 연구가 지속되고 있다.
비특이적 알파 차단제인 펜톨아민(phentolamine)은 혈관확장의 효과로 성각성장애의 치료제로서 오랜 기간 연구되어 왔다. 그러나, 폐경 후 여성에서는 호르몬 보충치료를 하지 않은 경우에는 위약과 별 다른 차이가 없었다[27]. 지금까지의 제한적 연구로는 펜톨아민은 에스트로겐 환경이 적절한 경우의 성각성장애 여성에서 효과적일 것으로 여겨진다. 그러나, 아직까지는 몇몇 연구만 진행되었을 뿐, 실제로 임상치료에 적용할 수 있는 안전성 및 유효성에 대한 객관적 근거는 부족하다.
여성성기능장애는 맞춤치료가 필요한 대표적인 분야라고 할 수 있다. 작용이 다른 두 가지 약제를 복합하여 사용한다면 좀 더 넓은 범위의 치료가 가능할 것으로 기대할 수 있다. 최근 임상연구가 진행 중인 복합제는 크게 두 가지 다른 기전으로 치료효과를 얻는다. 성적으로 건강한 여성에서 생리적 및 주관적 성적 반응을 증진시키는 테스토스테론과 병합하는 약물을 치료하고자 하는 원인에 따라 달리한다(Table 2). 성욕저하/성흥분장애의 발생 기전은 크게 두 가지로 성적 자극에 반응이 무뎌져서 생기는 경우와 성적 자극에 대한 반응이 지나치게 억제되어 생기는 경우로 구분할 수 있다[29]. 복합제는 (1) 병합하는 약물을 성적자극에 대해 더뎌진 반응을 활성화시키는데 도움을 주는 약(PDE5 억제제, sildenafil 50 mg)으로 병합하거나, (2) 지나치게 반응을 억제하는 기전을 조절하여 성반응을 증진시키는 약(5-HT1A 수용체 부분 길항제, buspirone 10 mg)을 병합하는 것이다[2930]. 또한, 테스토스테론 설하정과 발데나필 10 mg을 필요에 따라 복용하여 생식기의 성적 반응을 증진시키는 병합약제도 시도되고 있다[2930].
여성의 성반응은 정신적 요소, 주변 관련 요소 및 신체적 요소가 복합적으로 연관하여 일어난다. 따라서 성기능장애도 복합적 요인이 관여한다. 여성성기능장애의 치료는 개개인의 상태와 상황을 종합적으로 판단하여 치료하여야 한다. 여성에서 기질적 원인으로 인한 성기능장애의 치료는 우선 정상적으로 성호르몬환경이 유지되고 있는 지를 먼저 살펴야 한다. 적절한 성호르몬 수치가 유지되고 있지 않을 경우 부족한 호르몬을 보충하는 것이 도움이 된다. 호르몬치료는 부작용을 반드시 주의하여야 한다. 여성성기능장애의 치료제로 많은 약물들이 개발되고 있으나 안전성과 장기적인 효과의 검증이 필요한 실정이다. 그러나, 최근 플리반세린과 오스페미펜 등 약물요법의 등장은 그 동안 제한적이었던 여성성기능장애 약물치료에 새로운 문을 열어 줄 것으로 기대되고 있다.
여성 성기능장애는 남성 성기능장애와 같이 유병율이 높은 질환이나 현재 명확한 치료 방법 부족한 상황이다. 이와 같은 상황에서 2015년 여성의 성욕구 저하 장애 치료제로 플리반세린이 FDA의 승인을 받음으로서 여성 성기능장애 치료에 많은 도움이 될 것으로 보인다. 이와 같은 상황에서 현재 여성의 성기능장애 치료를 위해 사용되고 있는 치료 약물의 특징과 장단점에 대해 잘 정리가 된 논문이며 실제 임상에서 여성 성기능장애 치료제를 사용하는데 많은 도움이 될 것으로 기대된다.
[정리: 편집위원회]
Figures and Tables
References
1. Portman D, Palacios S, Nappi RE, Mueck AO. Ospemifene, a non-oestrogen selective oestrogen receptor modulator for the treatment of vaginal dryness associated with postmenopausal vulvar and vaginal atrophy: a randomised, placebo-controlled, phase III trial. Maturitas. 2014; 78:91–98.

2. Goldstein SR, Bachmann GA, Koninckx PR, Lin VH, Portman DJ, Ylikorkala O. Ospemifene Study Group. Ospemifene 12-month safety and efficacy in postmenopausal women with vulvar and vaginal atrophy. Climacteric. 2014; 17:173–182.

4. Derogatis LR, Komer L, Katz M, Moreau M, Kimura T, Garcia M Jr, Wunderlich G, Pyke R. VIOLET Trial Investigators. Treat-ment of hypoactive sexual desire disorder in premenopausal women: efficacy of flibanserin in the VIOLET Study. J Sex Med. 2012; 9:1074–1085.

5. Jayne C, Simon JA, Taylor LV, Kimura T, Lesko LM. SUN-FLOWER study investigators. Open-label extension study of flibanserin in women with hypoactive sexual desire disorder. J Sex Med. 2012; 9:3180–3188.

6. Yoon H. Management of female sexual dysfunction. Korean Andrology Society. Textbook of andrology. 2nd ed. Seoul: Koonja Publishing;2010. p. 501–510.
7. Segraves RT, Clayton A, Croft H, Wolf A, Warnock J. Bupro-pion sustained release for the treatment of hypoactive sex-ual desire disorder in premenopausal women. J Clin Psycho-pharmacol. 2004; 24:339–342.

8. Segraves RT, Croft H, Kavoussi R, Ascher JA, Batey SR, Foster VJ, Bolden-Watson C, Metz A. Bupropion sustained release (SR) for the treatment of hypoactive sexual desire disorder (HSDD) in nondepressed women. J Sex Marital Ther. 2001; 27:303–316.

9. Davis AR, Castano PM. Oral contraceptive and sexuality. In : Goldstein I, Meston CM, Davis SR, Traish AM, editors. Women's sexual function and dysfunction: study, diagnosis and treatment. New York: Taylor & Francis;2005. p. 290–296.
10. Wierman ME, Nappi RE, Avis N, Davis SR, Labrie F, Rosner W, Shifren JL. Endocrine aspects of women's sexual function. J Sex Med. 2010; 7(1 Pt 2):561–585.

11. Wierman ME. Sex steroid effects at target tissues: mechanisms of action. Adv Physiol Educ. 2007; 31:26–33.

12. Park K, Kim MK, Kim KW, Ahn KY, Lee SE, Ryu SB. Effect of delayed estrogen replacement on clitoral corpus cavernosal blood flow and histologic composition in rabbit. Korean J Urol. 2004; 45:268–273.
13. Freeman EW, Sammel MD, Lin H, Gracia CR, Pien GW, Nelson DB, Sheng L. Symptoms associated with menopausal transition and reproductive hormones in midlife women. Obstet Gynecol. 2007; 110(2 Pt 1):230–240.

14. Dennerstein L, Dudley E, Burger H. Are changes in sexual functioning during midlife due to aging or menopause? Fertil Steril. 2001; 76:456–460.

15. De Ziegler D, Fanchin R. Progesterone and progestins: appli-cations in gynecology. Steroids. 2000; 65:671–679.

16. Laan E, van Lunsen RH, Everaerd W. The effects of tibolone on vaginal blood flow, sexual desire and arousability in post-menopausal women. Climacteric. 2001; 4:28–41.

17. Burger HG, Dudley EC, Cui J, Dennerstein L, Hopper JL. A prospective longitudinal study of serum testosterone, dehydro-epiandrosterone sulfate, and sex hormone-binding globulin levels through the menopause transition. J Clin Endocrinol Metab. 2000; 85:2832–2838.

18. Jun JH, Yoon H. Effect of menopause on the expression of an-drogen receptors in human vagina. Korean J Androl. 2004; 22:24–30.
19. Shifren JL, Avis NE. Surgical menopause: effects on psycholo-gical well-being and sexuality. Menopause. 2007; 14(3 Pt 2):586–591.
20. White WB, Grady D, Giudice LC, Berry SM, Zborowski J, Snabes MC. A cardiovascular safety study of LibiGel (testo-sterone gel) in postmenopausal women with elevated cardio-vascular risk and hypoactive sexual desire disorder. Am Heart J. 2012; 163:27–32.

21. Pfaus J, Giuliano F, Gelez H. Bremelanotide: an overview of preclinical CNS effects on female sexual function. J Sex Med. 2007; 4 Suppl 4. 269–279.

22. Safarinejad MR. Evaluation of the safety and efficacy of bremelanotide, a melanocortin receptor agonist, in female sub-jects with arousal disorder: a double-blind placebo-controlled, fixed dose, randomized study. J Sex Med. 2008; 5:887–897.

23. Caruso S, Agnello C, Intelisano G, Farina M, Di Mari L, Cianci A. Placebo-controlled study on efficacy and safety of daily apomorphine SL intake in premenopausal women affected by hypoactive sexual desire disorder and sexual arousal disorder. Urology. 2004; 63:955–959.

24. Nappi RE, Cucinella L. Advances in pharmacotherapy for treat-ing female sexual dysfunction. Expert Opin Pharmacother. 2015; 16:875–887.

26. Schoen C, Bachmann G. Sildenafil citrate for female sexual arousal disorder: a future possibility? Nat Rev Urol. 2009; 6:216–222.

27. Rubio-Aurioles E, Lopez M, Lipezker M, Lara C, Ramirez A, Rampazzo C, Hurtado de Mendoza MT, Lowrey F, Loehr LA, Lammers P. Phentolamine mesylate in postmenopausal women with female sexual arousal disorder: a psychophysiological study. J Sex Marital Ther. 2002; 28 Suppl 1. 205–215.

28. Kielbasa LA, Daniel KL. Topical alprostadil treatment of female sexual arousal disorder. Ann Pharmacother. 2006; 40:1369–1376.

29. Van Rooij K, Poels S, Bloemers J, Goldstein I, Gerritsen J, van Ham D, van Mameren F, Chivers M, Everaerd W, Koppeschaar H, Olivier B, Tuiten A. Toward personalized sexual medicine (part 3): testosterone combined with a Serotonin1A receptor agonist increases sexual satisfaction in women with HSDD and FSAD, and dysfunctional activation of sexual inhibitory mechanisms. J Sex Med. 2013; 10:824–837.

30. Van der Made F, Bloemers J, Yassem WE, Kleiverda G, Everaerd W, van Ham D, Olivier B, Koppeschaar H, Tuiten A. The influence of testosterone combined with a PDE5-inhibitor on cognitive, affective, and physiological sexual functioning in women suffering from sexual dysfunction. J Sex Med. 2009; 6:777–790.





 PDF
PDF ePub
ePub Citation
Citation Print
Print




 XML Download
XML Download