Abstract
The clinical significance of prostate cancer is increasing markedly with an increased population of aged persons and Westernized behavior patterns. Accordingly, the role of prostate imaging is also becoming important in the early diagnosis of prostate cancer. Transrectal prostate ultrasound (TRUS) is used for the estimation of prostate volume as well as the detection of prostate cancer, seen as focal hypoechoic lesions. Almost all prostate tissue biopsies are performed under the guidance of TRUS. One of the important issues in prostate imaging is the visualization of suspected prostate cancer lesions. In order to obtain detailed information regarding a suspected prostate lesion, contrast-enhanced imaging is utilized, using microbubbles and elastography. In addition, magnetic resonance imaging-ultra sonography (MRI-US) fusion imaging, in which the ultrasound machine archives magnetic resonance (MR) images and facilitates MRI-US fusion imaging-guided biopsy, has been revealed to be superior to conventional ultrasound-guided biopsy. Prostate MR is usually performed in patients with confirmed prostate cancer, after prostate biopsy for the evaluation of tumor staging or follow-up changes after chemotherapy, hormone therapy, or radiation therapy. In particular, the evaluation of seminal vesicles is crucial for accurate identification of tumor staging. Advanced functional MR techniques, including diffusion-weighted imaging, dynamic contrast-enhanced imaging, and MR spectroscopy, also have potential in the localization of prostate cancer. In summary, the role of prostate imaging in the diagnosis and localization of prostate cancer is increasing. Advanced technologies in ultrasound and MR imaging may have important roles in localization of prostate cancer and image-guided biopsy.
전립선의 영상기법에는 전립선 초음파, 자기공명영상, 컴퓨터단층촬영 등의 기기를 이용한다. 전립선 초음파는 전립선질환이 의심되는 경우 쉽게 시행할 수 있는 검사이며 전립선의 부피 및 전립선암에서 보일 수 있는 저에코의 국소적인 병변의 여부 등을 판단할 수 있다. 또한 전립선 초음파영상 유도 하에서 조직검사를 시행할 수 있다. 전립선 자기공명영상은 전립선암이 확진된 환자에서 병기 결정, 수술의 계획, 합병증의 예측 등에 사용될 수 있으며 최근 확산계수 영상 등은 종양의 위치 결정에 많은 도움을 주고 있다. 컴퓨터단층촬영은 전립선 자체에 대한 영상분석보다는 임파절에 대한 전이나 다른 장기나 뼈로의 전이 여부를 판정하는 데에 많은 도움이 된다. 본 종설에서는 전립선암의 영상에 사용되는 다양한 영상기기 및 영상기법을 소개하고 최근에 도입되고 있는 새로운 조직검사기법 등에 대한 소개를 통하여 전립선암의 진단에 있어서 영상기법의 역할에 대해서 논해보고자 한다.
정상 성인에서의 전립선의 크기는 길이 3 cm, 폭 4 cm, 전후 직경 3 cm 가량으로 전체 전립선의 용적은 15-20 mL 정도이다[1]. 조직학적인 선조직의 분포에 따라 분류하는 맥닐(McNeal)의 구역별 분류에 의하면 전립선은 선조직과 선조직이 없는 섬유근 구역으로 나누어지며 선조직은 다시 요도주변선구역, 이행구역, 중심구역, 그리고 주변구역의 총 5개 구역으로 나누어지게 된다. 이행구역은 정상 전립선의 경우 전립선 전체 선 조직의 약 5%를 구성하는데 전립선 비대증의 경우 주로 이행구역에서 발생하기 때문에 전립선 비대증의 경우 매우 그 용적이 크게 된다. 이행구역에서는 전립선암의 약 15-20%가 발생하게 된다. 중심구역은 전립선기저부에서 정구에 이르는 역삼각추 모양의 선조직이며 주로 전립선의 기저부에 위치하게 되며 전립선암의 약 10% 정도가 중심구역에서 발생하게 된다. 전립선 조직의 약 70%를 차지하는 주변구역은 전립선의 후방, 측방 및 첨부를 구성하고 있으며 전립선암의 약 70-75%에서 발생하게 된다. 한편 전립선의 약 30%를 차지하는 전방 섬유근 구역은 선조직이 없으므로 일반적인 전립선암은 발생하지 않는다[2].
전립선의 경직장 초음파 검사는 환자가 측와위로 누워있는 상태에서 5-9 MHz의 초음파 탐촉자를 직장 내에 위치시킨 후 시행하게 된다. 경직장 초음파 검사에서 전립선의 횡단면, 종단면, 그리고 양측 정낭과 정관을 평가할 수 있는 사단면의 영상을 확인하여야 한다[3].
정상 전립선은 비교적 균일한 에코를 가진 구조물로 보이게 되며 전방부의 섬유근구역은 대부분 저에코를 보이는 경우가 많고, 중앙부의 유도는 고에코를, 그리고 요도 주위의 이행구역은 저에코를 보인다. 일반적으로 중심구역과 주변구역은 뚜렷이 구별되어 보이지는 않으나 어떤 경우에는 중심구역의 에코가 약간 낮게 보여서 주변구역과 구별되어 지기도 한다. 이행구역은 전립선 비대증이 증가할수록 더욱 명확하게 보이게 되는데 대부분 저에코 혹은 혼합형 에코의 병변으로 보이게 된다(Figure 1).
경직장 초음파는 혈중 전립선특이 항원의 상승이 있거나 직장수지검사 결과 이상이 있을 경우 전립선암의 가능성을 평가하기 위하여 시행하게 된다. 경직장 초음파 검사는 전립선의 크기 평가, 직장 수지검사상 만져지지 않는 전립선 병변의 발견이나 평가, 혹은 조직검사 시 생검의 영상 유도 등에 유용하다[3].
경직장 초음파에서 전립선암의 소견은 국소적인 저에코의 병변으로 보이는 경우가 많다(Figure 2). 하지만 염증, 섬유화, 경색, 전립선 비대증 등인 경우에도 저에코의 국소적인 병변으로 보이기 때문에 진단의 정확성은 만족할 만하지 않다. 다양한 연구결과에 의하면 일반적으로 국소적인 저에코의 병변이 보이는 경우에 전립선암일 확률은 20-40% 정도로 알려져 있다[3]. 이처럼 국소적인 저에코의 소견만으로는 전립선암의 정확도가 떨어지기 때문에 국소적인 저에코의 병변을 좀 더 자세하게 분석하여 전립선암을 진단하려고 하는 연구가 있는데 국소적인 저에코의 병변의 결절상의 모양을 보이는 경우, 불규칙한 경계를 보이는 경우, 혈관성이 증가되어 있는 경우, 병변이 변연부에 위치하고 있는 경우에는 그러한 저에코의 병변이 전립선암일 가능성이 높으며 상기 4개의 항목이 모두 양성인 경우에 전립선암을 확률은 약 80% 로 보고된 바가 있다(Figure 3) [4]. 한편, 전립선암의 경우에도 약 60% 정도 만이 저에코를 보이고 나머지 40% 정도는 주변 조직과 구분되지 않는 등에코를 보이는 것으로 알려져 있다. 전립선암은 주변 정상 조직 보다 초음파의 투과도가 좋아서 경직장 초음파 검사상 저에코를 보이게 되지만 암조직이 주위 정상 전립선 조직 사이로 파고 들어가는 침습적인 형태로 성장하여 정상 전립선 조직과 암조직이 섞여 있는 경우에는 경직장 초음파 검사에서 등에코를 보이게 된다[5]. 드물게 전립선암이 고에코를 보이는 경우도 있는데 그 이유는 전립선암이 석회화가 있는 주위 전립선 조직을 감싸거나 종양 자체의 석회화 등에 의한 것으로 알려져 있다. 또한 전립선암이 국소적으로 분포하지 않고 전립선 전체를 침범한 경우이거나 국소적 병변이기는 하지만 주위 정상 조직과 구분되지 않는 경우 등에는 국소적 병변을 보이지 않고 미만성으로 보이거나 혹은 전립선 초음파 상 보이지 않을 수도 있다.
전립선암의 진단에 있어서 회색조 초음파 외에 색 도플러나 출력 도플러를 시행함으로써 그 발견율을 높일 수는 있지만 가양성률도 증가되어 특이도가 감소하므로 전립선암의 진단에 있어서 색 도플러나 출력 도플러의 진단의 유용성은 아직 명확하게 확립되지 않았다. 하지만 전립선암 환자에 있어서 국소적인 병변의 증가된 혈류신호는 전립선암의 병리학적 예후인자인 글리슨 점수와 유의한 상관관계를 나타내어 임상적으로 의미가 있는 전립선암의 진단에 도움이 될 수 있을 것으로 기대된다(Figure 4).
전립선의 자기공명영상은 대부분 경직장 초음파 유도 조직검사를 통하여 전립선암이 확진된 환자를 대상으로 시행하나 최근에는 전립선항원수치는 증가하여 전립선암이 의심되지만 조직검사에서 전립선암이 확진되지 않은 환자의 표적 조직검사나 능동적 감시(active surveillance) 환자를 정하기 위한 방법으로 사용될 수 있다. 전립선암이 확진된 환자의 경우 전립선암의 병기 결정, 전립선암의 수술 전 계획, 치료방침의 결정 등에 사용된다. 전립선 자기공명영상의 프로토콜에는 T2 강조 영상이 가장 중요하다고 할 수 있는데, T2 강조 영상을 통하여 구역해부학, 전립선 피막, 전립선암의 정낭으로의 침습 등을 평가 할 수 있다. 주변구역은 내부에 액체성분이 많아서 T2 강조 영상에서 고신호강도를 보이고 중심구역은 저신호강도를 보이며 이행구역은 중간이나 저신호 강도를 보이기 때문에 각 구역의 구분이 가능하다. 전방섬유근구역은 그 구성성분이 주로 섬유와 근세포이기 때문에 저신호 강도를 보이게 된다. T1 강조 영상에서 전립선은 구역에 관계없이 저신호강도를 보이기 때문에 전립선의 각 구역을 잘 보여줄 수는 없으나 조직검사 후의 출혈여부나 전립선 주위의 지방조직, 방광주위조직, 림프절의 평가에 도움이 된다. 전립선암의 병기결정에 정낭의 침습여부를 자기공명영상에서 평가하는 것이 중요한데, 정상 정낭의 모양은 포도송이 같은 특정적인 모양을 보이고, 내강은 T2 강조 영상에서 고신호강도를 보이며 T1 강조 영상에서는 저신호강도를 보이는 액체로 차 있다. 때로는 정낭이 위축되거나 미만성 정낭벽의 비후를 보이는 경우도 있는데 이는 노화 혹은 안드로젠의 자극 감소 등에 의한다고 생각한다.
전립선암의 자기공명 소견도 T2 강조 영상에서 잘 보이게되는데 주변구역에서 정상적인 고신호강도 대신 저신호강도의 병변으로 보이게 된다(Figure 5). 때로는 전립선 생검 시 생긴 출혈이 자기공명영상의 신호에 영향을 주어 위양성 혹은 위음성의 결과를 보이므로 영상 분석에 주의가 필요하며 이러한 출혈의 효과를 줄이기 위해서 전립선 생검 후 최소한 3주 이상의 시간적인 여유를 추천하는 기관들도 많다. 전립선암이 정낭을 침범한 경우는 Figure 6와 같이 정낭의 모양이 파괴되고 T2 강조 영상에서 저신호강도의 종괴가 보이는 경우 진단할 수 있다.
전립선 자기공명은 이러한 병기의 결정 이외에도 배부정맥 복합체(dorsal vein complex)의 평가나 전립선 첨부, 막성요도(membranous urethra) 등에 대한 평가를 통하여 수술의 계획, 난이도 예측, 및 수술 후 요실금 등의 합병증에 대한 필요한 정보를 얻을 수도 있다[67]. 최근에는 3T 등 고테슬라 자기공명을 이용한 기능적 자기공명영상을 비롯한 자기공명영상의 기술이 눈부시게 발전하고 있다. 동적 조영증강 자기공명영상, 확산강조영상, 자기공명분광술 등이 그대표적인 기능적 자기공명영상이라고 볼 수 있다.
종양이 발생하면 혈관생성인자의 합성과 분비로 인하여 새로운 혈관생성이 일어나게 되는데 종양의 혈관생성은 정상 조직에 비하여 혈관벽의 투과성이 증가하는 현상이 일어나게 되고 자기공명 조영제를 정맥 주사한 뒤에 조영제의 평균전이시간, 혈류, 투과성, 간질 부피 등의 수치들이 증가하게 된다. 또한 이러한 차이에 의하여 정상 조직과 암조직을 구별할 수 있게 된다. 확산 강조영상은 물분자의 확산 성질을 이용한 영상기법으로서 암이 있는 경우 높은 세포 밀도로 인하여 물의 확산을 제한되고 겉보기 확산계수(apparent diffusion coefficient) 값은 감소하게 된다(Figure 7). 최근의 확산강조영상과 조직학적인 분석을 비교하였던 연구에 의하면 확산강조영상에서 명확하게 보이는 변은 글리슨점수가 더 높게 나왔다는 보고가 있다.
정상 전립선 조직의 경우에는 구연산염 발생대사에 의하여 구연산염의 함량이 높으나 전립선암의 경우에는 구연산염 산화대사에 의하여 콜린 수치가 상승하게 되는데 이러한 차이를 이용한 것이 자기공명분광술이다. 하지만 자기공명분광술은 긴 검사시간, 후처리나 자장 균질화를 위한 보정 등으로 인하여 결과가 변화될 수 있고 또한 전립선 생검에 의한 출혈에 의하여 영향을 받는 것이 그 한계점이라고 할 수 있다.
최근 전립선암의 발병률이 급속하게 증가하고 전립선암에 대한 선별검사가 많아짐에 따라 전립선암의 진단을 위한 조직검사가 매우 급속하게 증가하고 있다. 일반적으로 전립선암의 조직검사를 위해서는 초음파영상 유도 하 조직검사를 시행하고 있으며 전립선에 대하여 무작위로 조직검사를 하는 계통적 무작위 생검이 표준 검사로 시행되고 있다. 각 병원마다 조직검사의 검체는 6개 내지 12개의 조직을 얻게된다. 이러한 초음파영상 유도 하 전립선 생검에 있어서 최근 좀더 생검 진단율을 높이기 위한 기술들이 개발되고 있다. 대표적인 최근 기술의 예는 조영증강 초음파(contrast enhanced ultrasonography), 탄성초음파 (sonoelastography) 그리고 자기공명영상과 초음파의 영상융합 등의 임상적 유용성이 보고되고 있다.
미세기포(microbubble)을 이용한 초음파 조영제는 간에 국소적인 병변이 있는 경우 그 병변의 분석에 많은 도움이 되고 있으며 최근에 그 적응증이 전립선으로 확장되는 추세이다. 조영제의 역할을 하는 미세기포의 크기는 2내지 6 마이크로 미터 정도의, 적혈구보다 좀 작은 크기를 가지며 내부에 가스로 차있고 인지질 혹은 알부민 피막으로 덮혀 있는 구조를 가진다. 적혈구 정도의 크기이기 때문에 혈관 내에서만 존재하는 혈액 저류조영제로 사용될 수 있고 암조직의 혈류, 혈액량, 모세혈관투과성 등을 평가할 수 있다[8].
전립선암의 초음파 조영증강 소견은 초음파 조영제의 주사 이후 약 15 내지 20초만에 급격한 조영증강을 보이며 주위 조직에 비하여 대조도가 증가하고 전립선내의 혈관의 비대칭성을 보이는 것으로 보고된 바가 있다[9]. 또한 조영증강 영상 초음파에서의 최고 강도는 전립선암의 글리슨 점수나 신생혈관형성(neovascularization)으로 인한 미세혈관밀도(microvessel density)와 상관관계가 있다고 알려져 있다[1011].
도플러 초음파의 경우 미세혈관을 영상화 할 수 없는 단점이 있지만, 초음파 조영제를 사용 시 작은 혈관에서 나오는 신호를 증가시켜 혈관 내 신호를 증폭시키는 역할을 하므로 전립선암의 진단에 도움이 된다는 보고들이 있다. 최근에 시행된 메타분석에서 전반적인 민감도와 특이도는 70%, 74% 정도이며, 진단능에 상승은 있으나, 계통적 무작위 생검을 대체할 만큼의 결과는 얻지 못하고 있다[12]. 한편 초음파 조영제는 종양의 혈관성을 반영하고 있기 때문에 조직학적인 악성도를 반영할 수 있다는 연구들이 있다. Mitterberger 등[13]의 연구에 따르면 2세대 초음파 조영제인 소노뷰(sonovue)를 사용하였을 때, 표적 조직생검에서 얻은 조직의 글리슨 점수가 계통적 생검에서 얻은 글리슨점수보다 그 점수의 평균이 더 높아, 좀 더 악성도가 높은 종양을 찾는 경향이 있어 환자의 예후 판단에 더 도움이 될 수 있을 것으로 기대된다. 또한 이러한 초음파 조영제는 계속 연구되고 있으며 특정 바이오 마커의 발견이나 유전자 치료제 및 항암제의 치료제를 전달하는 전달체로서의 유용성에 대해서 전임상 연구들이 보고되고 있으며 임상적용에의 가능성을 보여주고 있다.
암조직은 혈관뿐 아니라, 세포의 밀도도 증가되어 있다. 증가된 세포밀도는 조직의 탄성에 변화를 초래하고, 이와 같은 조직 탄성의 변화를 찾기 위한 검사방법이 탄성초음파(sonoelastography)이다. 전립선 조직검사의 유도로 탄성초음파를 이용할 시, 체계적 무작위 조직검사보다 암의 진단율이 더 높아, 조직검사의 숫자를 줄일 수 있다는 가능성이 제시되기도 하였다(Figure 8) [14]. 회색조 초음파와의 전향적 비교에서도 전립선암의 진단율이 51.1%대 39.4%로 탄성초음파의 진단율이 높은 것으로 보고되었다[15]. 최근 쉐어웨이브(shear wave)를 이용한 전립선의 탄성초음파 결과가 보고되었는데, 37 kPa의 값을 기준으로 할 때 96.2%의 민감도와 96.2%의 특이도가 보였다는 좋은 결과가 발표되었다[16]. 추후 연구가 뒷받침 되어야겠지만, 이러한 객관성을 갖춘 탄성초음파의 경우 생검에서 음성으로 나올 검체의 숫자를 줄일 수 있어 유망한 기법으로 생각된다.
초음파의 한계를 극복하기 위한 또 다른 방법으로 최근 자기공명영상과 초음파 영상의 융합영상 유도 하 조직검사에 대한 보고들이 있다. 조직검사 전에 찍은 자기공명영상을 초음파 기기 미리 저장하고 있다가 초음파영상과 실시간으로 융합하여, 자기공명영상에서 의심되는 병변을 표적화하는데 도움이 될 수 있다(Figure 9). 특히 이전의 조직 검사에서 음성으로 나왔으나 전립선특이항원의 증가로 인한 재생검 환자에서, 기존의 계통적 조직검사의 한계를 극복할 수 있을 것으로 기대되고 있다[17]. 또한 글리슨 점수와 상관관계가 높은 것으로 보고 되고 있는 확산계수영상과 융합될 경우, 전립선에서 가장 악성도가 높게 예측되는 부분을 선택적으로 조직검사 할 수 있어, 조직검사 이후 수술에서 악성도가 상승하는 경우를 줄일 수 있으며, 임상적인 의미가 떨어지는 전립선암으로 잘못 분류되는 위험도를 낮출 수 있다[18]. 이와 같은 새로운 영상기법으로, 능동적감시(active surveillance) 대상 환자의 선별, 자기공명영상유도 초점형 초음파(magnetic resonance guided focused ultrasonography)등의 국소적 치료에서의 영상 유도 등 전립선암에서의 영상의 역할은 더욱 더 중요할 것으로 생각된다. 하지만 자기공명영상-초음파 융합영상은 초음파 검사 시 프로브에 의한 압박에 의한 전립선의 해부학적 변화에 의한 자기공명영상과의 오등록(misregistration)은 해결되어야 할 문제이다.
본 종설에서는 전립선암의 진단에 있어서 영상의 역할 및 다양한 영상기법과 그 특징 등을 서술하였다. 전립선암은 그 발병률이 점점 증가하는 만큼 그 영상의 역할도 커질 것으로 생각된다. 특히 조직검사 시 어느 부위를 조직검사 할지에 대한 자세한 정보를 제공하여 줄 수 있다면 좀더 정확한 전립선암의 진단 및 치료 방향 결정에 많은 도움을 줄 수 있을 것으로 기대한다. 최근에는 해부학적인 정보 외에도 종양의 혈관성 혹은 주위 물분자의 확산 등을 이용한 다양한 자기공명영상기법들이 소개되고 있다. 이러한 기법들은 전립선암의 위치 파악에 많은 도움이 될 것으로 기대된다.
본 논문은 최근 급격히 증가하고 있는 전립선암의 진단에 있어서 초음파와 자기공명영상을 포함한 영상의학검사의 역할에 대하여 기술하고 있다. 경직장초음파검사는 전립선암의 계통적 무작위 조직검사에 더해서 전립선암의 위치를 확인하고 병소를 겨냥한 생검을 통하여 진단율을 높일 수 있으며 자기공명영상검사는 전립선암의 임상병기를 확인하고 적절한 치료방침을 결정하는데 도움을 준다. 그 외에 본 논문은 전립선암의 위치뿐만이 아니라 종양의 혈관성과 악성도를 예측할 수 있는 최신 영상진단 기법들을 소개하여 보다 정확한 진단 뿐 만이 아니라 최선의 치료방침을 환자에게 제시하기위한 영상의학적 접근과 역할을 잘 정리하였다고 판단된다.
[정리: 편집위원회]
Figures and Tables
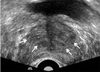 | Figure 1Transrectal ultrasound of benign prostate hyperplasia. Transrectal ultrasound of 69-year-old man shows relatively well defined low echoic area suggesting benign prostate hyperplasia (arrows). |
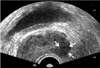 | Figure 2Transrectal ultrasound (TRUS) of prostate cancer involving left peripheral zone of prostate. TRUS of 71-year-old man shows well defined low echoic area involving left peripheral zone of prostate. Pathologic report after TRUS guided biopsy revealed that prostate cancer with Gleason score of 7 (4+3). |
 | Figure 3Schematic drawing of focal lesion seen on transrectal ultrasound (TRUS). The figure shows algorithm for the evaluation of suspicious focal lesion seen on TRUS. The diagram suggested four criteria including nodular shape, irregular outline, increased vascularity, and peripheral location for the suspicion of prostate cancer. |
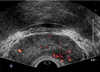 | Figure 4Increased vascularity of prostate cancer on transrectal ultrasound. Power Doppler image of 65-year-old man shows increased vascularity on low echoic lesion on left peripheral zone of prostate. |
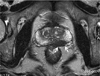 | Figure 5Magnetic resonance imaging finding of prostate cancer. T2 weighted axial image of 65-year-old man shows low signal intensity of left peripheral zone. Also note contour bulging of this lesion suggesting periprostatic invasion (arrows). |
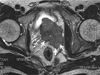 | Figure 6Magnetic resonance imaging finding of seminal vesicle invasion in prostate cancer. T2 weighted axial scan reveals definite low signal intensity mass involving whole seminal vesicle (arrows). |
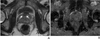 | Figure 7Diffusion weighted image of prostate cancer. (A) T2 weighed axial scan shows suspicious ill- defined low signal intensity area in anterior transitional zone (arrows). (B) Apparent diffusion coefficient map of same patient reveals that definite low signal in same area. Pathologic report after prostatectomy reveals prostate cancer was in same area. |
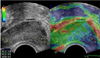 | Figure 8Elastography of prostate cancer. Elastography of 75-year-old man shows the difference of elasticity between area 1 and area 2. Targeted biopsy on area 2 revealed prostate cancer with Gleason score of 7 (4+3). E1_b, elasticity on 1 area; E2_b, elasticity on 2 area; E2/E1, elasticity ratio. |
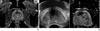 | Figure 9Magnetic resonance imaging-ultrasonography fusion image of prostate cancer. (A) apparent diffusion coefficient map of 68-year-old man with history of negative transrectal ultrasound guided biopsy results showed definite signal drop on anterior area of prostate, which suggest prostate cancer on this area. (B) Magnetic resonance imaging-ultrasonography fusion image guided biopsy was performed on this area and the pathologic report revealed that prostate cancer with Gleason score of 8 (4+4). |
References
1. Benson MC, Whang IS, Pantuck A, Ring K, Kaplan SA, Olsson CA, Cooner WH. Prostate specific antigen density: a means of distinguishing benign prostatic hypertrophy and prostate cancer. J Urol. 1992; 147:815–816.

2. McNeal JE. Regional morphology and pathology of the prostate. Am J Clin Pathol. 1968; 49:347–357.

3. Choi BI. Ultrasound diagnosis of the abdomen. In : Moon MH, Kim SH, editors. Prostate. Seoul: Ilchokak;2006. p. 346–360.
4. Lee HY, Lee HJ, Byun SS, Lee SE, Hong SK, Kim SH. Classification of focal prostatic lesions on transrectal ultrasound (TRUS) and the accuracy of TRUS to diagnose prostate cancer. Korean J Radiol. 2009; 10:244–251.

5. Littrup PJ, Bailey SE. Prostate cancer: the role of transrectal ultrasound and its impact on cancer detection and management. Radiol Clin North Am. 2000; 38:87–113.

6. Lee SE, Byun SS, Lee HJ, Song SH, Chang IH, Kim YJ, Gill MC, Hong SK. Impact of variations in prostatic apex shape on early recovery of urinary continence after radical retropubic prostatectomy. Urology. 2006; 68:137–141.

7. Lee SE, Byun SS, Hong SK, Lee HJ, Kim YJ, Chang IH, Gill MC. Anatomical analysis of prostate and surrounding struc-tures: points to consider during radical retropubic prostatectomy. Korean J Urol. 2006; 47:568–577.

8. Lee HJ, Chung JH. The application of contrast enhanced ultrasound in molecular imaging. J Korean Soc Ultrasound Med. 2009; 28:139–145.
9. Seitz M, Gratzke C, Schlenker B, Buchner A, Karl A, Roosen A, Singer BB, Bastian PJ, Ergün S, Stief CG, Reich O, Tilki D. Contrast-enhanced transrectal ultrasound (CE-TRUS) with cadence-contrast pulse sequence (CPS) technology for the identification of prostate cancer. Urol Oncol. 2011; 29:295–301.

10. Jiang J, Chen Y, Zhu Y, Yao X, Qi J. Contrast-enhanced ultrasonography for the detection and characterization of prostate cancer: correlation with microvessel density and Gleason score. Clin Radiol. 2011; 66:732–737.

11. Weidner N, Carroll PR, Flax J, Blumenfeld W, Folkman J. Tumor angiogenesis correlates with metastasis in invasive prostate carcinoma. Am J Pathol. 1993; 143:401–409.
12. Li Y, Tang J, Fei X, Gao Y. Diagnostic performance of contrast enhanced ultrasound in patients with prostate cancer: a meta-analysis. Acad Radiol. 2013; 20:156–164.

13. Mitterberger M, Pinggera GM, Horninger W, Bartsch G, Strasser H, Schafer G, Brunner A, Halpern EJ, Gradl J, Pallwein L, Frauscher F. Comparison of contrast enhanced color Doppler targeted biopsy to conventional systematic biopsy: impact on Gleason score. J Urol. 2007; 178:464–468.

14. Pallwein L, Mitterberger M, Struve P, Horninger W, Aigner F, Bartsch G, Gradl J, Schurich M, Pedross F, Frauscher F. Comparison of sonoelastography guided biopsy with systematic biopsy: impact on prostate cancer detection. Eur Radiol. 2007; 17:2278–2285.

15. Brock M, von Bodman C, Palisaar RJ, Loppenberg B, Sommerer F, Deix T, Noldus J, Eggert T. The impact of real-time elastography guiding a systematic prostate biopsy to improve cancer detection rate: a prospective study of 353 patients. J Urol. 2012; 187:2039–2043.

16. Barr RG, Memo R, Schaub CR. Shear wave ultrasound elastography of the prostate: initial results. Ultrasound Q. 2012; 28:13–20.
17. Fiard G, Hohn N, Descotes JL, Rambeaud JJ, Troccaz J, Long JA. Targeted MRI-guided prostate biopsies for the detection of prostate cancer: initial clinical experience with real-time 3-dimensional transrectal ultrasound guidance and magnetic resonance/transrectal ultrasound image fusion. Urology. 2013; 81:1372–1378.





 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download