Abstract
Ultrasonography in obstetrics is increasingly used for the screening of chromosomal abnormalities as well as for prenatal diagnosis of congenital abnormalities with safety and technological advancements. In the first trimester, it is important to confirm normal intrauterine pregnancy with viability, detect the abnormalities of uterus and adnexa, determine the number of fetuses and assess chorionicity and amnionicity in case of multiple pregnancy. After establishment of gestational age accurately by crown-rump length, thickened fetal nuchal translucency, absence of nasal bone, tricuspid regurgitation, reverse a wave of ductus venosus and cystic hygroma can be markers for screening of chromosomal abnormalities. In addition, the scan also offers an opportunity to detect gross structural abnormalities, which could help improve the prognosis by early prenatal intervention. In the second trimester, aneuploidy (trisomy 21, 18, 13, Turner syndrome) and genetic syndromes could be detected by major structural defects and soft markers. It is important to consider that many malformations may not be detected prenatally even by qualified practitioners and appropriate equipment, and to counsel patients about the potential for false-positive or false-negative results.
산과 영역에서의 초음파 검사는 태아와 임신부에 안전하게 사용할 수 있는 진단검사법으로 현재 널리 사용되고 있다. 최근에는 복부초음파 뿐만 아니라 경질초음파의 해상도 향상 및 도플러초음파, 3차원초음파의 개발 등으로 산전진단으로서의 초음파의 역할이 더욱 중요시되고 있다. 해부학적 기형의 진단을 위한 산전초음파는 주로 제2삼분기에 시행되어 왔으나 고해상도 기술의 발전으로 점차 제1삼분기에 시행하는 기형아 선별검사로서도 그 이용이 확대되고 있다. 이 시기에 시행하는 목덜미투명대와 두개내투명대의 측정 및 코뼈의 유무 확인 등을 통하여 염색체와 구조적 이상을 조기 예측할 수 있게 되었고 경질초음파를 이용하여 심장기형의 이른 진단도 가능해졌다. 이에 임신 초, 중기에 시행하는 산전초음파를 통하여 태아의 이상을 선별해내는 방법에 대해 여러 문헌고찰을 통해 정리해보고자 한다.
임신 제1삼분기에 초음파 검사를 통하여 정상 자궁 내 임신이 진단되면 임신주수 5-6주경에 임신낭과 태아를 확인하고 태아 심박동을 측정할 수 있다. 배아의 수를 확인하고 다태임신의 경우에는 임신낭과 난황낭의 수를 통하여 융모막성, 양막성을 결정하기에 가장 적합한 시기이다. 정상 임신 이외에도 유산, 자궁 외 임신, 임신성 융모 질환 등의 비정상 임신을 감별하고 자궁기형 및 부속기 종양을 확인하는것도 제1삼분기에 시행해야 할 검사항목이다(Table 1).
임신 제1삼분기는 임신주수를 확인하기에 가장 적합한 시기로 산모의 마지막 월경기간의 첫날을 기준으로 계산한 임신주수가 부정확할 때에는 임신 6-9주에 측정하는 머리엉덩길이를 이용하여 추정이 가능하다. 측정방법은 태아의 정중 시상면에서 중립적 자세를 취할 때에 태아의 머리에서 엉덩이까지의 최대 직선 길이를 측정하는 것이다(Figure 1). 임신주수에 따라 구조적 이상과 정상변이를 판단하는 기준이 달라지고 선별검사의 정확도가 변동되기 때문에 정확한 임신주수의 확인은 분만예정일의 결정뿐 아니라 태아 이상의 정확한 진단을 위해서도 매우 중요하다.
제1삼분기에 염색체 이상의 선별검사로서 대표적으로 사용하고 있는 초음파 표지자는 태아 목덜미투명대이다. 이는 태아의 목 뒤 연조직과 피부 사이에 체액이 차있는 무에코 영역으로 증가되어 있는 경우에는 홀배수체 등의 염색체 이상과 주요 구조적 이상뿐 아니라 불량한 임신 예후와도 관련이 있다고 알려져 있다[12]. 매우 작은 수치를 측정해야 하므로 위양성과 위음성을 줄이기 위해서는 숙련된 검사자가 임신 11주에서 13주6일 사이(태아 머리엉덩길이 45-84 mm)에 올바른 방법으로 측정하는 것이 필요하다[34]. 태아의 목이 중립자세를 취한 상태에서 코뼈와 제4뇌실이 보이는 정중 시상면이어야 하고, 태아의 머리와 흉곽이 화면의 75%를 넘도록 확대하여 태아가 양막과 떨어져 있을 때 가장 넓은 투명대의 내부를 측정하여야 한다(Figures 2,3). 2차원 초음파 상에서 태아의 정확한 정중 시상면 영상을 얻기 힘든 경우에는 3차원 초음파를 통해 얻을 수 있다. 기준치는 고정된 수치(3 mm나 3.5 mm)를 사용하거나 태아의 머리엉덩길이에 기준한 95 백분위수를 이용할 수 있다[245].
이 외에도 코뼈 형성부전, 삼첨판 역류, 비정상적인 정맥관 파형, 림프물 주머니 등이 발견될 경우 염색체 이상과의 연관성을 고려해야 한다. 코뼈의 길이는 목덜미투명대를 측정하는 동일한 화면에서 코뼈와 코뼈를 덮고 있는 피부, 코끝에 의한 에코가 한꺼번에 보일 때 측정하며, 정상 염색체 태아의 0.5-3%에서 코뼈가 없을 수 있는 것에 비하여 다운증후군의 60-70%, 에드워드증후군의 53-55%, 파타우증후군의 34-45%에서 관찰되지 않으므로 선별검사로서 사용될 수 있다[467]. 주의해야 할 점은 태아 코뼈 골화가 이루어지는 임신 11주 이후에 측정하여야 하고 인종간 코뼈 길이의 차이가 많아 국내의 기준을 참고해야 한다는 것이다[8].
삼첨판 역류가 11-14주 사이에 발견되는 경우에 염색체 이상과 연관이 있으며 정상 염색체 태아의 4%에서 발견되는 것에 비해 다운증후군의 68%, 에드워드증후군의 33%에서 관찰되었다(Figure 4) [910]. 또한 태아의 심장기형이 있는 경우에도 발생빈도가 높아지는 것으로 보고되고 있다[11].
정맥관은 제대동과 하대정맥 사이를 연결하는 부위의 혈관으로 심방수축 시에 a wave가 역류하는 소견을 보일 경우 염색체 이상 및 심장기형과 관련이 있다. 정상 염색체 태아의 4%에서 발견되는 것에 비해 염색체 이상 태아의 69%에서 관찰되었고 심장기형의 태아에서도 발생빈도가 매우 높게 보고되고 있다(Figure 5) [12].
림프물 주머니는 목 뒤쪽 또는 후외측에 하나의 대칭적 또는 양측 낭성 구조로 나타나고, 그 내부에 중격이 존재하기도 한다(Figure 6). 이는 목덜미에만 국한되기도 하고 태아의 등을 따라 또는 전신에 걸쳐 피하 부종으로 나타나기도 한다. 림프물 주머니를 나타내는 태아의 60% 이상에서 염색체 이상을 나타내고 이 중에서 터너증후군이 가장 많이 차지하고 있다[13].
이와 같이 염색체 이상의 선별검사로서 초음파가 유용하게 사용되고 있을 뿐만 아니라 주요 구조적 이상의 일부가 제1삼분기에도 진단 및 예측될 수 있다. 목덜미투명대와 동일한 화면에서 측정할 수 있는 두개내투명대(제4뇌실, intracranial translucency)를 이용하여 척추 이분증과 후두와 기형의 진단을 예측하는 방법이 제시되고 있다. 두개내투명대는 뇌교의 후부 경계와 제4뇌실의 맥락총 사이의 무에코성 공간으로 정상 태아에서는 목덜미투명대와 평행하게 관찰되나 척추이분증 태아의 경우에는 관찰되지 않고 댄디워커 기형에서는 95 백분위수보다 크게 측정된 경우들이 보고되고 있다(Figure 2) [1415]. 두개내투명대의 한국인 기준치에 대해서는 국내 연구를 참고할 수 있다[16].
그 외에도 제1삼분기에 진단될 수 있는 대표적인 구조적 이상으로는 무뇌아나 무두개증, 뇌류, 전전뇌증, 주요 심장기형 (좌심형성부전증후군, 기능적 단심실, 심실중격결손 등), 복벽 질환(제대 탈장, 복벽갈림증), 폐쇄성 요로질환(후부요도판막증후군, 통배설강기형, 요도폐쇄), 심한 형태의 골격 이형성증, 양막대증후군 등이 있다(Figure 7). 제1삼분기에 조기진단하여 적절한 시기에 태아 치료를 시행할 경우 예후를 향상시킬 수 있는 대표적인 예로는 폐쇄성 요로질환에서 방광-양막강 단락술을 시행하여 신장기능을 보존한 경우가 보고되고 있다[17].
임신 4-8주에 전뇌가 정상적으로 분리되지 못해 발생하는 전전뇌증은 정상적으로 제1삼분기에 보여야 하는 나비모양 (양측 뇌실에 맥락얼기가 가득차 보이는 소견)이 보이지 않는 단일뇌실 소견으로 진단할 수 있고 양막의 일부가 태아에 붙어 발생하는 양막대증후군은 심한 경우에 동반되는 복벽결손, 뇌류, 사지절단 등의 소견으로 진단될 수 있다.
그러나 제1삼분기에서의 진단을 위해서는 정확한 임신주수의 확인이 선행되어야 하고 추적관찰이 필요한 질환에 대한 정확한 이해가 필요하다. 무뇌아나 무두개증은 두개골 골화가 이루어지는 시기인 9주 이전에는 진단할 수 없고, 임신 8-11주에는 생리적 중장 탈출이 정상이므로 11주 이전에는 제대 탈장을 진단할 수 없다. 복벽 질환이 제1삼분기에 진단될 수 있으나 제대 탈장과 복벽 갈림증을 감별하기 위해서는 제2삼분기의 검사를 통한 확진이 필요하고 폐쇄성 요로질환이나 큰방광증의 일부는 자연적으로 소실되기 때문에 추적관찰을 해야 한다. 태아 심장기형의 경우 임신 12주 이후에 경질초음파를 이용하여 일부 진단할 수 있으나 임신중기 초음파에 비해 진단의 민감도와 정확도가 떨어지므로 선별검사 상 고위험군에 제한하여 시행하고 반드시 추적관찰을 하는 것이 중요하다.
임신 제2삼분기는 세부적인 해부학적 구조 및 기능을 보다 정밀하고 구체적으로 검사할 수 있는 시기로 국가별로 정밀초음파 검사를 시행하는 시기 및 대상에 약간의 차이가 있으며, 주로 임신주수 18-22주에 잘 훈련된 숙련자에 의해 시행되도록 권장되고 있다[18]. 국내에서는 대부분의 임신부에게 정밀초음파를 시행하고 있는 반면, 일부 국가에서는 고위험군 또는 일반초음파에서 이상이 발견된 경우에만 정밀초음파를 시행하기도 한다. 이 시기의 검사를 통하여 태아의 해부학적 구조뿐 아니라 성장 및 발달, 위치, 건강 상태와 양수, 태반, 탯줄 등의 이상 유무까지 확인할 수 있으나 태아 자세나 양수 양 등에 의해 검사의 정확도가 영향을 받고 기형의 정도, 초음파 기계 및 검사자의 숙련도에 따라 검사 결과의 차이를 보일 수 있다. 또한 모든 선천성 기형을 산전에 진단할 수는 없고, 기형의 종류에 따라 발견 시기가 다르다는 것을 고려하여 상담하는 것이 중요하다.
초음파 검사로 진단을 의심할 수 있는 대표적인 염색체 이상으로는 다운증후군, 에드워드증후군, 파타우증후군, 터너증후군 그리고 일부 유전 증후군이 있는데 이의 진단을 위한 여러 표지자들이 지속적으로 개발되어 왔다.
21번 세염색체증인 다운증후군은 가장 흔한 염색체 이상으로 약 25%에서만 주요 구조적 이상을 발견할 수 있기 때문에 미세한 구조적 이상의 경우는 산전초음파에 의한 진단이 어렵다[1920]. 이에 산전진단을 높이기 위한 여러 시도를 통해 주요 구조적 이상 외에도 초음파로 발견할 수 있는 소프트 마커가 제시되고 있으며 이외에도 단두증, 편평한 프로필, 돌출혀, 태아수종, 흉막삼출, 심낭삼출 등의 소견이 관찰될 수 있다(Table 2, Figure 8) [21]. 국내 자료로는 서울아산병원에서 10년간 다운증후군으로 진단된 경우의 산전초음파 소견을 빈도 별로 정리한 표가 있다(Table 3).
18번 세염색체증인 에드워드증후군은 두 번째로 많은 염색체 이상으로 80% 이상에서 초음파 이상 소견이 관찰되어 임신초기와 중기에서의 진단율이 높다[22]. 대부분의 경우에서 임신중기부터 자궁 내 태아발육지연이 나타나고 산전초음파에서 주요 구조적 이상 및 소프트 마커를 관찰할 수 있다(Table 4, Figure 9) [2123]. 심장기형(심실중격결손, 심방중격결손, 방실중격결손, 양대혈관우심실기시, 좌심실형성부전증 등)이 가장 많고 근골격계 기형(곤봉발, 흔들의자바닥모양발, 주먹쥔손과 겹쳐진 손가락, 요골무형성, 사지단증, 전신성관절구축 등), 중추신경계기형(뇌량무형성, 뇌실확장, 댄디워커 기형, 소뇌큰수조의 확장, 신경관결손 등), 두개안면기형(두개골 모양 이상, 작은턱증, 구순구개열, 소이증 또는 처진귀 등), 복부기형(식도폐쇄증, 횡격막탈장, 제대 탈장 등), 비뇨기계기형(수신증, 말굽콩팥, 방광출구폐쇄증, 낭성이형성증 등) 등이 관찰될 수 있다[24].
13번 세염색체증인 파타우증후군은 상염색체이상 중 세 번째로 많으며 90% 이상에서 초음파 검사상 주요 구조적 이상이 관찰된다(Table 5,Figure 10) [2125]. 중추신경계기형(뇌실확장증, 전전뇌증, 뇌량형성부전, 뇌류 등)과 두개안면기형(단안증, 작은턱증, 경사진이마, 입술입천장갈림증, 작은안구증, 두눈가까움증 등)이 많이 발견되고 이 외에도 심장기형(심실중격결손, 심방중격결손, 우심증, 양대혈관우심실기시, 좌심실형성부전증 등), 근골격계 기형(축뒤다지증, 손발가락굽증, 겹쳐진 손가락 등), 다낭성 신장질환, 제대 탈장 등이 동반될 수 있다. 대부분 자궁 내 태아사망 또는 유아기 사망 등의 매우 불량한 예후를 나타내므로 태아염색체 검사를 통한 확진이 필요하다.
터너증후군은 가장 흔한 성염색체 이상으로 직은 키, 낮은 머리카락선, 짧은 목, 물갈퀴목, 난소 기능상실, 불임, 무월경, 성선구조 미발달 등의 이상을 나타낸다. 산전초음파 소견으로는 림프물 주머니가 가장 흔하게 보이며 그 외에도 태아수종, 신장기형(말굽콩팥, 골반콩팥, 단일 콩팥, 중복 신우 등), 심장기형(대동맥축착 등), 사지단증 등이 나타날 수 있다(Figure 11).
CATCH 22 증후군(22번 염색체의 미세결실)은 심장기형, 얼굴기형, 흉선저형성증, 입천장갈림증, 저칼슘증을 특징으로 하는 질환으로 약 80%에서 심장기형이 동반된다(Figure 12) [26]. 주로 뿔 줄기 결함(활로씨 4징, 대동맥궁 단절, 심실 중격 결손증, 총동맥간증, 양대혈관 우심실 기시, 대동맥 축착 등)이 동반되어 이러한 심장질환이 진단되는 경우에는 CATCH 22 증후군에 대한 의심이 필요하다[27]. 이 외에도 안면기형(두눈먼거리증, 두드러진 콧등, 작은턱증 등), 입천장갈림증, 흉선저형성증, 양수과다증, 신장 또는 근골격계 기형 등이 발견될 수 있다[28].
산전초음파의 발달을 통해 염색체 및 구조적 이상의 진단시기를 앞당기고 민감도와 정확도의 향상을 이루어 내었으며, 이를 통해 일부 선천성 질환에 대해 적절한 시기에 태아 치료를 시행할 수 있었다. 그러나 모든 선천성 기형이 산전에 진단될 수 없음을 고려하는 동시에, 민감도의 향상과 함께 높아진 위양성률과 여전히 존재하는 위음성률에 대한 정확한 이해를 가지고 상담하는 것이 매우 중요하다.
본 논문은 산전관리에서 산전 초음파 선별검사의 진단적 의의를 잘 기술하였고, 초음파 기술의 발전에 의해 산전 유전질환 진단의 유용성에 대해 체계적으로 기술하였다. 최근 초음파의 발전으로 인해 태아의 해부학적인 기형뿐 만 아니라 태아의 염색체 이상에 대한 선별검사로서 초음파 검사의 유용성이 높아지고 있다. 태아 이상에 대한 산전 진단은 태아 및 신생아 치료를 출생 후 신생아의 예후를 개선시킬 수 있어, 선천성 심장 기형을 비롯한 선천성 기형 신생아의 최근 생존률을 증대시켜오고 있다. 또한 세염체증을 비롯한 염색체 이상을 가진 태아의 해부학적 특성을 이용하여 선별검사를 시행하고 있어, 임신 중 태아 염색체 이상 진단이 가능하게 되었으며 이를 통해 산전 상담의 기회도 제공하고 있다.
[정리: 편집위원회]
Figures and Tables
Figure 2
Ultrasound image in the mid-sagittal plane of the fetus showing the nuchal translucency (NT), nasal bone (NB) and intracranial translucency (IT). Th, thalamus; MB, midbrain; BS, brain stem; CM, cisterna magna.
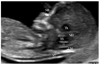
Figure 3
Ultrasound image of the fetus with increased nuchal translucency thickness (3.4 mm) at 12.3 weeks of gestation.

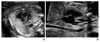
Figure 4
(A) Color and (B) pulsed wave Doppler of tricuspid regurgitation at 12.4 weeks of gestation.
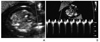
Figure 5
Abnormal Doppler waveforms across the ductus venosus in the parasagittal plane of the fetus at 11.6 weeks of gestation.
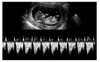
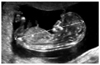
Figure 6
Cystic hygroma with generalized skin edema (A) in the sagittal plane and (B) the transverse plane of the fetal head at 12.1 weeks of gestation. CRL, crown-rump length.
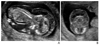
Figure 7
First trimester structural abnormalities. (A) Holoprosencephaly; monoventricle with absent butterfly sign in the transverse plane of the fetal head at 12.5 weeks of gestation. (B) Amniotic band syndrome; thin membranes (arrow) attached to the lower extremities resulted in limb defects at 11.5 weeks of gestation. (C) Acrania; calvarium was absent and remained cranial contents protruded above orbits in the sagittal plane of the fetus at 12.5 weeks of gestation. (D) Bladder outlet obstruction; an enlarged bladder was observed in the male fetus at 13.1 weeks of gestation. Posterior urethral valves was confirmed postnatally and renal function was normal with prenatal vesico-amniotic shunting.
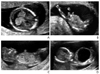
Figure 8
Second trimester sonographic findings in trisomy 21. (A) Absent nasal bone in the mid-sagittal plane of the fetal profile. (B) Cystic hygroma in the transverse plane of the fetal head. (C) Atrioventricular septal defect in the four-chamber view of the fetal heart. (D) Duodenal atresia; the double-bubble sign in the transverse plane of the fetal abdomen.
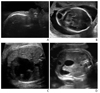
Figure 9
Typical second trimester ultrasonographic findings in trisomy 18. (A) Bilateral choroid plexus cysts and (B) strawberry-shaped skull in the transverse plane of the fetal head. (C) Clenched hands with overlapping fingers and (D) rocker bottom foot in 3D image. (E) Club foot; the plantar surface of the foot was seen in the same plane as the tibia.
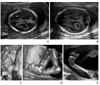
Figure 10
Second trimester structural anomalies in trisomy 13. (A) Holoprosencephaly; monoventricle and fused thalamus in the transverse plane of the fetal head. (B) Omphalocele; the transverse plane of the fetal abdomen showed 11×12mm sized herniated mass into the umbilical cord. (C) Proboscis; coronal image of the face showed protruding tissue above the orbit.

Figure 11
Cystic hygroma with generalized edema in the sagittal plane (A) and the transverse plane (B) of the fetus with Turner syndrome at 16.5 weeks of gestation.
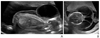
Figure 12
Second trimester ultrasonographic findings in CATCH 22 syndrome. (A) Absent thymus in the 3-vessel view of the fetal heart. (B) Interrupted aortic arch; the ascending aorta was straight and a transverse aortic arch was not demonstrated.
References
1. Souka AP, Snijders RJ, Novakov A, Soares W, Nicolaides KH. Defects and syndromes in chromosomally normal fetuses with increased nuchal translucency thickness at 10-14 weeks of ges-tation. Ultrasound Obstet Gynecol. 1998; 11:391–400.

2. Snijders RJ, Noble P, Sebire N, Souka A, Nicolaides KH. UK multicentre project on assessment of risk of trisomy 21 by ma-ternal age and fetal nuchal-translucency thickness at 10-14 weeks of gestation. Fetal Medicine Foundation First Trimester Screening Group. Lancet. 1998; 352:343–346.

3. Oh SY, Hong JS, Seol HJ, Hwang HS, Park HS, Kim K, Ko HS, Kwak DW, Kim MY, Park MH, Oh MJ, Park JS, Kim SJ. Korean Society of Ultrasound in Obstetrics and Gynecology Research Group. 2014 First-trimester ultrasound forum from the Korean Society of Ultrasound in Obstetrics and Gynecology. Obstet Gynecol Sci. 2015; 58:1–9.

4. Sonek J, Nicolaides K. Additional first-trimester ultrasound markers. Clin Lab Med. 2010; 30:573–592.

5. Kurjak A, Kupesic S, Matijevic R, Kos M, Marton U. First tri-mester malformation screening. Eur J Obstet Gynecol Reprod Biol. 1999; 85:93–96.

6. Cicero S, Curcio P, Papageorghiou A, Sonek J, Nicolaides K. Absence of nasal bone in fetuses with trisomy 21 at 11-14 weeks of gestation: an observational study. Lancet. 2001; 358:1665–1667.

7. Kagan KO, Cicero S, Staboulidou I, Wright D, Nicolaides KH. Fetal nasal bone in screening for trisomies 21, 18 and 13 and Turner syndrome at 11-13 weeks of gestation. Ultrasound Obstet Gynecol. 2009; 33:259–264.

8. Jung E, Won HS, Lee PR, Kim A. Ultrasonographic measure-ment of fetal nasal bone length in the second trimester in Ko-rean population. Prenat Diagn. 2007; 27:154–157.

9. Huggon IC, DeFigueiredo DB, Allan LD. Tricuspid regurgi-tation in the diagnosis of chromosomal anomalies in the fetus at 11-14 weeks of gestation. Heart. 2003; 89:1071–1073.

10. Falcon O, Faiola S, Huggon I, Allan L, Nicolaides KH. Fetal tri-cuspid regurgitation at the 11+0 to 13+6-week scan: association with chromosomal defects and reproducibility of the method. Ultrasound Obstet Gynecol. 2006; 27:609–612.

11. Faiola S, Tsoi E, Huggon IC, Allan LD, Nicolaides KH. Likeli-hood ratio for trisomy 21 in fetuses with tricuspid regurgitation at the 11 to 13+6-week scan. Ultrasound Obstet Gynecol. 2005; 26:22–27.

12. Maiz N, Nicolaides KH. Ductus venosus in the first trimester: contribution to screening of chromosomal, cardiac defects and monochorionic twin complications. Fetal Diagn Ther. 2010; 28:65–71.

13. Donnenfeld AE, Lockwood D, Lamb AN. Prenatal diagnosis from cystic hygroma fluid: the value of fluorescence in situ hybridization. Am J Obstet Gynecol. 2001; 185:1004–1008.

14. Bornstein E, Goncalves Rodríguez JL, Alvarez Pavon EC, Quiroga H, Or D, Divon MY. First-trimester sonographic find-ings associated with a Dandy-Walker malformation and inferior vermian hypoplasia. J Ultrasound Med. 2013; 32:1863–1868.

15. Chaoui R, Benoit B, Mitkowska-Wozniak H, Heling KS, Nicol-aides KH. Assessment of intracranial translucency (IT) in the detection of spina bifida at the 11-13-week scan. Ultrasound Obstet Gynecol. 2009; 34:249–252.

16. Lee MY, Won HS, Jeong BD, Hyun MK, Lee HY, Shim JY, Lee PR, Kim A. Measurement of intracranial translucency using three-dimensional ultrasound and Volume IT. Prenat Diagn. 2012; 32:472–475.

17. Kim SK, Won HS, Shim JY, Kim KS, Lee PR, Kim A. Successful vesicoamniotic shunting of posterior urethral valves in the first trimester of pregnancy. Ultrasound Obstet Gynecol. 2005; 26:666–668.

18. Salomon LJ, Alfirevic Z, Berghella V, Bilardo C, Hernandez-Andrade E, Johnsen SL, Kalache K, Leung KY, Malinger G, Munoz H, Prefumo F, Toi A, Lee W. ISUOG Clinical Standards Committee. Practice guidelines for performance of the routine mid-trimester fetal ultrasound scan. Ultrasound Obstet Gynecol. 2011; 37:116–126.

19. Song HK, Ryu HM, Roh SH, Park SH, Kim MY, Kim ES, Han HW, Choi SK, Lee YH, Yoo SJ. Prenatal diagnosis and sono-graphic findings of down syndrome: review of 30 cases. Korean J Obstet Gynecol. 1997; 40:2826–2832.
20. Vintzileos AM, Egan JF. Adjusting the risk for trisomy 21 on the basis of second-trimester ultrasonography. Am J Obstet Gynecol. 1995; 172:837–844.

21. Yeo L, Vintzileos AM. The second trimester genetic sonogram. In : Callen PW, editor. Ultrasonography in obstetrics and gynecology. 5th ed. London: Elsevier Health Sciences;2011. p. 70–111.
22. Nyberg DA, Kramer D, Resta RG, Kapur R, Mahony BS, Luthy DA, Hickok D. Prenatal sonographic findings of trisomy 18: review of 47 cases. J Ultrasound Med. 1993; 12:103–113.

23. Cho RC, Chu P, Smith-Bindman R. Second trimester prenatal ultrasound for the detection of pregnancies at increased risk of trisomy 18 based on serum screening. Prenat Diagn. 2009; 29:129–139.

24. Song MJ. Fetal sonography for the detection of chromosomal abnormality. J Korean Soc Ultrasound Med. 2011; 30:75–82.
25. Papp C, Szigeti Z, Toth-Pal E, Hajdu J, Joo JG, Papp Z. Ultra-sonographic findings of fetal aneuploidies in the second tri-mester: our experiences. Fetal Diagn Ther. 2008; 23:105–113.

26. Momma K. Cardiovascular anomalies associated with chromo-some 22q11.2 deletion syndrome. Am J Cardiol. 2010; 105:1617–1624.





 PDF
PDF ePub
ePub Citation
Citation Print
Print








 XML Download
XML Download