Abstract
Malnutrition of hospitalized patients is a prevailing issue, especially in the perioperative period. As the elderly population increases progressively, surgeons should become more alert to preventing the risk of iatrogenic malnutrition. The consequences of malnutrition, such as delayed wound healing, exposure to infection, pressure sores, gastrointestinal bacterial overgrowth, and compromised immunity can be prevented or attenuated by vigorous nutritional support. Enhanced recovery after surgery is a multimodal perioperative care pathway designed to achieve early recovery for patients undergoing major surgery, in which nutritional intervention is the most important and integral part. Preoperative nutritional assessment, intraoperative considerations against postoperative nutritional problems, and an appropriate postoperative nutritional supply will result in better outcomes of surgery, and, in turn, in reduced postoperative complications, shorter hospital stays, and decreased medical costs. Though enteral nutrition is preferable over parenteral nutrition, parenteral nutrition should be supplemented selectively in those for whom enteral nutrition will inevitably be inadequate.
일찍이 병원 내 입원된 환자의 영양실조의 문제는 여러 학자들에 의해 지적되어 왔으며 특히 외과환자에서는 39%까지 발생할 수 있으므로 의료진에 대한 영양학적 교육이 필요하다[1]. 그러나 최근까지도 전통적 방식의 수술 전 환자 전처치와 각종 검사에 따르는 금식기간의 반복, 수술 후 상당 기간 지속되는 침상안정과 기준도 없는 중환자실 입실, 수술 후 방귀가 나오기 전까지 금식을 유지하는 등 여러 세대에 걸쳐 도제식으로 교육된, 검증되지 않은 외과적 원칙이 고수되어 왔다. 때문에 외과중환자는 내과환자에 비해 더욱 영양공급 부족의 위험성에 노출되기 쉬우며(risk of iatrogenic malnutrition) 고령화 추세에 따라 노인 수술환자의 경우 더 높은 위험성을 내포한다. 따라서 수술환자에 대한 영양치료는 의료진들의 문제점 인식을 통해 환자를 위한 더 나은 조치를 취할 수 있다[2]. 무엇보다도 영양실조의 결과로서 나타날 수 있는 창상치유의 지연, 쉬운 감염 노출, 욕창 발생, 위장관 병원성 세균의 증식, 면역력 감소의 현상들을 막아 수술의 결과를 향상시키고 합병증을 예방할 수 있다는 점에서 영양치료는 매우 중요한 치료 과정의 하나라고 할만 하다[3456]. 이 글은 최근 제시되고 있는 각종 가이드라인과 임상영양 관련 논문을 참고하여 외과환자의 수술 전후 영양치료의 최신 개념과 방침에 대해 소개하고 정리하고자 한다.
수술 전후 외과환자의 영양치료를 언급함에 있어서 fast-track surgery 혹은 enhanced recovery after surgery (ERAS)의 개념을 먼저 얘기 안 할 수 없다. Fast-track surgery는 마취 및 진통요법의 발달과 최소침습수술이 가능해짐에 따라 수술 전후 환자의 스트레스와 통증을 완화하고 각종 배액관, 카테터 및 튜브의 삽입을 최소화 하며 영양 및 재활에 초점을 맞추어 환자의 회복을 극대화하는 개념을 말한다[7]. 이는 20세기 후반에 개념의 형성이 이뤄지기 시작하여 초기에는 당일 수술을 위한 일일 입원환자를 대상으로 적용되기 시작하였으나 점차 고령 환자의 대장 및 직장수술, 전립선수술, 대동맥류수술 같은 위험도가 극히 높은 수술에서 효과를 입증하기 위한 연구들이 진행되었다. 그러나 2000년 이후 복강경수술의 급격한 팽창으로 위암이나 대장암 등의 큰 수술에서도 최소침습수술이 가능하게 되었고 전에 비해 환자의 회복이 빨라지는 효과에 대해 단순히 수술적 기법의 적용 외에 다른 요소들이 없는지 살펴보게 되면서 ERAS 프로그램의 개념이 대두되고 있다. 즉 fast-track surgery의 개념과 ERAS의 개념이 다르지 않으나 2001년 북유럽 국가 의료진에 의해 최초로 제안되어 조직화된 연구기법을 적용하고 학회 차원의 연구 및 학술활동이 진행되는 이유로 ERAS의 용어가 더 많이 사용되는 추세이다. 아직까지 ERAS의 공식적으로 제시된 한글 표기는 없다[8].
전통적인 수술 전후 환자의 치료과정에서는 수술에 따르는 스트레스가 대사에 미치는 영향을 피할 수 없다는 전제 하에 소극적 대증요법으로 대처할 뿐이었지만, ERAS프로그램에서는 적극적으로 수술 전후 환자의 스트레스를 감소시키기 위한 개입을 통해 영양학적 측면의 관리와 수술에 따르는 합병증의 예방, 건강 회복에 걸리는 기간을 단축하여 병원 재원 일수를 줄이고 전체적으로 의료비를 절감하는 효과를 가져올 수 있다(Figure 1) [89].
ERAS 프로그램의 적용과 그 효과에 대한 연구가 우리나라에서는 아직 활발하지 못하다. 수술 전 영양불량 환자의 적극적인 영양공급에 따른 수술결과의 비교연구, 수술 후 빠른 경장영양 공급의 효과에 대한 연구, 비위관 삽입이나 배액관 삽입을 안하는 방침에 대한 연구, 수술 후 적극적인 통증치료에 대한 연구 등이 산발적으로 진행되어 왔고 현재 진행 중인 것도 있다. 하지만 대부분의 연구가 Figure 1의 개별적인 항목에 대한 안전성 검증이나 효과에 관한 것일 뿐 여러 항목을 아우르는 ERAS 프로그램의 효과 검증에 대한 연구는 매우 미미하다.
ERAS 프로그램의 각 항목 가운데 수술 전후 영양치료의 면에서 특히 중요한 항목을 살펴보면 다음과 같다.
첫째, 수술 시작 약 2시간 전 탄수화물 음료의 섭취가 중요하다. 수술 전 환자의 심리적 불안을 해소하고 수술 후 겪을 수 있는 인슐린 저항성 등의 대사적 저해 요인에 대한 전 처치로 사용될 수 있으며 전체적으로 환자의 재원기간 단축의 효과가 있다. 여러 무작위 전향적 연구가 있으며 마취 시 발생할 수 있는 흡인성 호흡기 합병증이나 수술에 따르는 합병증에서의 문제점은 없어서 안전성이 확보되었으나 인슐린 저항성을 낮추거나 재원기간을 줄이는 면에 대한 입증에서는 대체로 긍정적 효과를 보이고 있지만 재원기간이 짧을 수 밖에 없는 작은 수술 환자가 포함되었거나 당뇨 등의 다른 문제가 있는 환자가 포함되는 등 연구디자인 상의 문제로 아직은 확실한 근거의 마련이 어려운 상태이다[10].
둘째, 수술 전 금식 및 장준비를 잘 해야 한다. 전신마취를 하기에 다른 위험 요인이 없는 어린이 혹은 성인이라면 수술 전 건더기가 있는 음식을 제외한 액상의 음료는 두 시간 전까지 섭취할 수 있으며 합병증을 유발할 위험보다는 오히려 갈증 해소와 허기짐 감소, 위 내용물의 감소효과를 볼 수 있다[1112]. 수술 전 하제를 이용한 기계적 장준비는 수술의 결과에 아무런 이득이 없으며[13], 하제로 사용되는 인산나트륨의 신장손상 가능성에 대한 식품의약품안전처의 의약품안전성서한이 2013년 3월 배포되기도 하였다. 수술 전 금식기간은 최소화하는 것이 좋고 기계적 장준비는 대장내시경검사 외에는 계획된 수술을 위해 시행할 필요는 없다.
셋째, 통증조절과 장운동에 신경 써야 한다. 경막 외 국소마취주사는 수술 후 장운동의 장애나 장폐색을 줄일 수 있다[14]. 국소마취주사 외에 마약성 진통제를 함께 투여한 경우에 대해서는 장운동과의 연관성 근거가 없다. 그러나 통증조절이 잘 되면 스트레스 호르몬의 방출을 줄이고 수술 후 인슐린 저항성을 낮출 수 있다[15]. 돌발 통증에 대해서는 non-steroidal anti-inflammatory drug를 추가하거나 경막 외 Bupivacaine bolus 주사를 사용할 수 있다. 정맥을 이용한 환자조절 진통장치(intravenous patient-controlled analgesia)는 경막 외 통증조절에 비해 효과가 미미하다.
넷째, 수술 후 오심 및 구토조절을 해야 한다. 수술 중 마취에 사용되는 가스 마취제, 근이완제, 마약성 진통제 류는 수술 직후 발생하는 오심이나 구토의 원인이 될 수 있다. 또한 수술 후 투여되는 각종 진통제도 한 원인이 될 수 있는데 이로 인해 경구섭취가 저해된다면 이 또한 영양공급의 측면에서 위험요소가 될 수 있다. 수술 후 오심, 구토를 일으키기 쉬운 고위험도 환자군에는 여성, 비흡연자, 가스 마취제를 사용한 환자, 오랜 시간 수술과 마취가 된 환자 등이 있다. 그러므로 고위험도 환자를 대상으로 하는 항구토제를 이용한 선제적 예방 조치는 꼭 필요하며, serotonin receptor antagonist는 되도록 수술 끝 무렵에 주사하는 것이 가장 효과적이다[16].
다섯째, 수술 후 조기 경구섭취를 고려한다. 수술 후 금식을 유지하게 되는 원인은 장운동이 회복되지 않은 상태에서 폐흡인의 위험성, 위장관 수술로 새롭게 만들어진 문합부위의 손상이나 누출의 가능성, 재수술을 하게 될 가능성 등이 우려되기 때문일 것이다. 하지만 대장을 제외한 위와 소장의 운동은 수술 후 24시간 이내에 회복되기 때문에[17] 장운동에 대한 우려는 거의 없으며, 수술기법의 발전과 자동문합기의 사용으로 문합부위의 손상이나 누출의 위험이 거의 없기 때문에 환자가 목삼킴의 문제나 의식의 저하 등이 없다면 모든 종류의 수술에서 수술 후 24-48시간 이내에 칼로리를 섭취하는 것이 환자의 회복을 촉진하며 감염 합병증을 낮추고 재원기간 단축을 꾀할 수 있다.
여섯째, 퇴원기준의 설정이 필요하다. 계획된 수술에서는 퇴원계획이 입원이나 입원 전 상담 시 이미 마련되어야 한다. 그 이유는 환자가 혼자 살거나 거동이 불편하여 이동수단에 도움을 필요로 하는 경우, 경제적 요인으로 사회복지 분야의 도움을 필요로 할 수 있고 이러한 사회경제적 요인이 영양학적 측면에서도 매우 중요한 배경 요인이 될 수 있기 때문이다. 또한 퇴원을 하기 위한 기준으로서 환자가 어떠한 도움 없이도 혼자서 영양섭취에 지장을 받지 않을 상태여야 하며 만일 도움을 필요로 한다면 가정에서의 정맥영양, 관급식 관리, 보조 영양식품의 공급 등의 계획이 마련되어야 한다.
수술 전 준비 단계에서 환자를 평가하는 과정에서 심폐기능, 만성질환여부, 수술에 지장을 줄 수 있는 과거력 등 여러 가지 체크 항목이 있지만 대개 영양상태에 대한 평가는 무시되기 쉽다. 영양불량의 가장 중요한 요건 두 가지는 섭취 불량과 염증의 여부이다. 흔히 평가의 도구로 의존하기 쉬운 생화학검사 가운데 많이 사용되는 알부민의 경우 비교적 긴 반감기로 급성 질환에서 의미를 따지기 어렵고 짧은 반감기로 많이 사용되는 transthyretin의 경우에도 염증의 정도에 따라 매우 큰 변화를 보일 수 있으므로 오히려 계획된 수술의 경우 수술 전 섭취량의 변화 및 몸무게의 변화에 대한 청취와 이학적 검사를 통한 체지방량, 근육량, 손아귀 쥐는 힘을 측정하는 악력 테스트를 체크하는 것이 더 도움이 된다.
검증된 영양검색 도구는 외래환자나 중환자실 환자 누구에나 쉽게 적용하여 쏠림 없는 결과를 보일 수 있어야 하지만 현재까지 발표되어 사용되고 있는 검색도구 가운데 어느 한 가지도 완벽하지 않다. 대표적인 것으로 Malnutrition Universal Screening Tool (MUST), Nutritional Risk Index (NRI), Nutritional Risk Screening (NRS-2002), Mini Nutritional Assessment (MNA), Subjective Global Assessment (SGA) 등이 있다. 그 가운데 1차검색과 2차검색으로 나누고 환자의 영양상태와 질환별 중증도를 점수로 반영한 NRS-2002와 판별의 세밀도는 낮지만 쉽게 적용이 가능한 SGA가 재원기간, 수술 후 합병증, 사망률 등에서 좀 더 강력한 예측력을 보이는 것으로 보고되었다[18]. 검색도구의 선택은 기관과 의사의 선호도에 따라 선택될 수 밖에 없지만 어느 한 가지라도 꼭 적용되어 평가를 거치는 것이 수술 전후 영양학적 위험도를 낮출 수 있는 길이다. 인력부족이나 시간부족 등의 원인으로 영양검색 도구의 적용이나 전체적인 평가가 어렵다면, 1) 최근 한 달 동안 10-15%의 체중감소, 2) 체질량지수 <18.5, 3) 혈장 알부민 <30 g/L (간이나 콩팥 질환의 동반 없이)의 3가지 조건을 따져보아 어느 한 가지라도 해당이 있다면 영양학적 위험도가 있다고 볼 수 있다.
검색을 통해 영양학적 위험도가 높은 환자로 판명될 경우 심근경색의 위험이 있는 환자가 심장문제에 대한 해결을 위해 수술을 늦출 수 있듯이 수술을 연기하고 영양학적 위험도를 낮출 수 있는 조치를 취해야만 한다. 심장문제가 있는 환자에서 과거의 심근경색으로 손상된 부위를 완전히 재건할 수는 없지만 수술의 충격을 이겨낼 수 있는 조건으로 약물이나 중재적 시술을 통해 만드는 것과 마찬가지로 영양학적으로 문제가 있는 환자는 영양실조 자체를 해결할 수 있는 것은 아니지만 일 주일 정도의 짧은 기간으로 영양학적 위험도에서 벗어날 수 있는 중재적 치료를 시도할 수 있다. 연기된 약 일 주일 정도 기간 동안 영양공급을 통해 수술 후 감염 합병증 감소 등의 효과를 본 질병군은 식도, 간담췌 및 대장질환 등이고 두경부질환의 비교연구에서는 효과가 입증되지 않았다[1920].
영양공급의 방법은 환자가 25 kcal/kg/day 정도의 에너지와 1.5-2 g/kg/day의 단백질을 섭취할 수 있는가에 달려있다. 필요량의 50-70% 내외의 섭취만 가능하다면 정맥영양(parenteral nutrition, PN)이나 경구보충제(oral nutritional supplement)를 통한 보충이 필요하다. 50% 미만일 경우 경관급식을 시도하거나 처음부터 경장영양(enteral nutrition)이 불가능한 상태라면 PN을 고려하여야 한다. 영양공급에 따른 평가는 체중의 변화, 섭취량의 변화, 인체계측 등의 이학적 검사나 생화학검사를 통해 판정 내릴 수 있다.
수술 전 금식 권고사항에 대해서는 되도록 짧게 기간을 잡는 것이 좋으며 마취 2시간 전 탄수화물 강화 음료의 섭취를 권유하는 ERAS 그룹의 주장도 있지만 전 세계적으로 통용되는 미국마취과학회(American Society of Anesthesiologists)의 권고에 따르면 튀김이나 기름진 음식에 대해서는 8시간, 가벼운 식사는 6시간, 맑은 유동식에 대해서는 2시간까지 허락된다[21].
수술 후 영양공급에 차질이 우려되거나 오랜 시간을 요하는 큰 수술의 경우 환자가 겪을 수 있는 대사적 충격이나 영양학적 위험도를 고려하여 외과의사는 환자에게 경장영양 공급로 확보를 꼭 고려해야 한다. 대표적인 예로서 식도절제술이나 췌-십이지장절제술이 있다. 이러한 수술을 받은 환자는 수술 후 경구섭취에 제한이 따르기 쉽기 때문에 목적하는 수술이 완성되고 나면 영양공급을 위한 공장루 카테터를 삽입하여 수술 후 경장영양공급을 하면 정맥영양을 시도하는 환자에 비해 감염성 합병증의 위험과 재원기간의 감소를 꾀할 수 있다.
이와 함께 수술 중 영양학적 측면에서 매우 중요한 역할을 할 수 있는 부분이 마취과의사의 영역이다. 수술 중 수액공급이 너무 과도할 경우 수술 후 위장관운동에 장애를 유발할 수 있고 심폐기능이나 창상 합병증에도 악영향을 줄 수 있다. 너무 제한적으로 수액 공급을 하는 것도 창상의 혈류감소를 초래할 수 있기 때문에 신중하고 정확한 양의 전해질 및 수액공급이 요구된다. 전통적으로 pulmonary artery wedge pressure, central venous pressure를 측정하는 것이 보편적인 혈역동학적 모니터기법이었으며 좀 더 정밀한 변화 양상의 측정을 위해서는 trans-esophageal echocardiography를 사용할 수 있다[22]. 최근 자동화된 closed-loop system 등의 장비개발로 출혈량이 많거나 혈역동학적 안정성이 낮은 수술에서도 최적화된 수액공급을 하기 위한 노력들이 진행 중이다[23].
수술이 끝나면 수술부위, 수술의 범위, 수술시간, 환자의 전신상태, 활력 징후, 만성질환 여부 등 여러 조건에 따라 영양공급의 경로, 종류, 방법을 결정할 수 있다. 대부분의 계획된 수술이라면 영양공급이 중단되어야 할 이유는 거의 없고 중단되어서도 안 된다. ERAS 그룹의 수술 후 조기 경구섭취의 원칙에서도 밝힌 바와 같이 메타분석을 통해 조기 경구영양공급이 위장관 문합부위의 누출 위험, 장운동의 회복 등에 악영향을 미치지 않음이 증명되었다[24]. 또 다른 메타분석에서도 위장관 수술 24시간 이내에 빠른 경장영양이 수술 후 합병증, 재원기간, 사망률에서 더 나은 결과를 보고하였다[25]. 그러므로 특별한 다른 문제가 없는 한 수술 후 조기 영양공급의 원칙을 지키는 것이 환자를 위해 더 좋은 조치라고 할 수 있다.
수술의 부위에 따라 두경부수술로 경구섭취가 곤란하다면 비위관을 이용한 경관급식을 우선적으로 시도하고 정맥영양을 통한 보충을 시도한다. 지속적으로 혹은 영구적으로 경구섭취가 곤란한 상황이라면 위루술이나 공장루를 이용한 튜브 경장영양을 고려한다. 식도, 위장관, 간담췌 수술의 경우 문합부의 누출 위험이나 경구섭취에 제한이 없다면 빠른 식이 진행을 시도하되 수술이 크고 상당 기간 경구섭취가 곤란한 경우 공장루를 이용한 경장영양을 시도한다. 대장수술의 경우에도 대개는 일 주일 이내에 식이 진행이 가능하며 절제부위에 따라 인공장루를 만들게 될 경우 설사가 잦기 때문에 단순한 경구섭취 이외에 보조 정맥영양이 필요할 수 있다. 신경외과 수술의 경우 의식장애가 동반된 환자라면 비위관을 이용한 빠른 식이 진행이 가능하며 영구적으로 의식회복이 어려운 경우라면 위장루를 통한 경관급식을 고려하는 것이 좋다. 비위관 가운데 위장관 감압용으로 사용하는 실리콘 제제의 비위관은 내경에 비해 굵기가 두꺼워서 인후나 식도, 위벽에 접촉성 궤양을 유발하기 쉽다. 폴리우레탄 제제의 급식전용 비위관은 관벽의 두께가 얇아서 직경에 비해 내경이 크되 매우 유연하고 부드러워서 접촉성 궤양 유발의 위험도가 더 낮다. 반면에 위루관이나 공장루관으로 사용되는 상품들은 실리콘, 라텍스, 폴리우레탄 등 여러 종류의 재질이 사용되어 생산되고 있다.
일단 경관 유동식이 시작되면 처음에는 10-20 mL/hr 정도의 속도로 시작하여 단계적으로 공급량을 증가시킬 수 있다. 적절한 공급량의 결정은 여러 가지 에너지 요구량을 계산하는 수식(25-30 kcal/kg [ideal body weight])을 사용하거나, indirect calorimeter를 사용할 수 있으며, 환자의 모니터를 위해 인체계측검사, bioimpedance analysis test, 생화학 검사 등을 통해 확인한다. 위장관의 저항력이 떨어져 쉽게 공급량 증가의 진행이 안 되는 경우 정맥영양으로 보충을 할 필요가 있다. 경구섭취가 가능한 경우에도 단계적으로 맑은 유동식, 진한 유동식, 연식 등의 순서로 진행이 되는데 간혹 의료진들이 맑은 유동식만으로도 환자의 영양공급이 충분히 되고 있다고 오해를 하는 경우가 있고 연식을 공급하는 경우에도 섭취량을 따지지 않고 충분한 공급이 이뤄진다고 잘못 판단하는 경우가 있다. 맑은 유동식으로만 섭취를 하는 경우 아무리 포만감을 느낄 정도로 많은 부피를 섭취하여도 단위 부피당 칼로리가 낮아서 에너지 요구량을 충족시키기 어려우며 연식의 경우에도 환자의 먹는 양이 적다면 얼마든지 짧은 기간 내에 영양부족에 빠질 수 있음을 인식하고 철저한 모니터를 하여야 한다.
그 반대로 경관급식의 경우 계산된 양보다 과량이 투여되는 위험이 있을 수 있다. 과량 공급 시 무엇보다 폐흡인의 위험이 높아질 수 있으며 소장의 허혈성 괴사라는 치명적인 합병증을 유발할 수도 있다[26]. 그러므로 경관급식을 시행하는 경우 경관급식 전용 펌프를 사용하는 것이 안전성 및 유효성에서 우월하다[27].
수술 후 경장영양이 전혀 불가능한 상황에서는 정맥영양을 고려하여야 한다[28]. 정맥영양을 언제 시작하는 것이 좋은가에 대해 논란이 있지만 수술 직후의 스트레스나 외상 후 겪을 수 있는 혈역동학적 불안정이 어느 정도 가라앉는 48시간에서 72시간 이후에 시작하는 것이 권고되며, 그럼에도 불구하고 일 주일 이상 너무 늦추는 것은 너무 일찍 시작하는 것 이상으로 안 좋다[2930]. 그리고 경장영양이 에너지 요구량의 60%를 못 미칠 경우에는 보조적 수단으로서 공급을 고려해야 한다.
환자가 당뇨병이 있는지 여부에 관계없이 한 때 수술 전후 혈당조절을 110 mg/dL 아래로 철저하게 조절하는 것이 권장되기도 하였으나 저혈당의 에피소드를 겪는 것 보다는 Surviving Sepsis Campaign [31] 등의 여러 가이드라인에서 밝힌 바와 같이 180 mg/dL 아래로 느슨한 조절을 권유하고 있다. 하지만 수술에 의한 손상이 크지 않고 패혈증이나 장기 부전 등의 중환자적 요소가 있지 않은 상황이라면 110-140 mg/dL 사이에서 조절할 것이 권유된다.
경구섭취가 어려워서 일 주일 이상의 인위적인 경장영양이나 정맥영양이 지속될 경우에는 비타민과 trace elements의 부족 여부를 점검하고 필요량을 보충하는 것이 좋다. 대부분의 trace elements는 환자가 겪는 질병의 종류와 경중에 따라 필요량이 달라질 수 있으며 혈중농도가 부족 여부를 알려주는 지침계 역할을 못하는 경우가 많아서 결핍에 빠질 수 있다는 인식이 중요하다[28].
영양치료의 종료시점은 충분한 경구섭취가 가능해지는 시점, 경관급식의 경우 용량 조절이 필요 없이 일정하게 공급될 수 있으며 체중 변화, 섭취량 변화, 인체계측, 생화학검사 등에서 큰 변동이 없이 매월 혹은 격월로 검사를 할 수 있을 정도로 안정적일 경우이다. 정맥영양의 경우 드물게 지속적인 가정정맥영양을 요하는 경우를 제외하고는 경구섭취나 경관급식이 안정화되면 중단해야 한다. 정맥영양의 경우 중단하는 과정에서 점진적 감량은 필요 없고 즉시 중단할 수 있다.
외상환자의 경우에 적용될 수 있는 영양치료의 일반적인 원칙은 수술 전후 환자의 영양치료와 크게 다르지 않다. 특히 외상환자에서 조기 경장영양은 사망률 감소의 이점이 좀 더 명백하게 메타분석에서 보고되었다[32]. 위장관 손상이 없이 혈역동학적으로 안정적인 경우라면 24시간 이내에 경장영양을 시작하는 것이 좋다. 장기 경구섭취가 어렵다면 비위관을 삽입을 하거나 개복수술 시 영양공급을 위한 공장루를 고려한다. 뇌손상 등으로 4주 이상 경관급식을 요할 경우 위루술을 이용한다.
경장영양과 정맥영양 두 분야 모두 면역영양치료법을 적용할 수 있다. 면역영양치료의 정의는 일정 수준 이상의 면역학적 효과를 나타내는 성분을 강화함으로써 환자의 면역력에 영향을 주어 원하는 영양치료의 효과를 얻는 것이라고 할 수 있다. 면역영양치료에 사용될 수 있는 면역영양성분에는 arginine, glutamine, omega-3 fatty acid, ribonu-cleotide, selenium 외에 몇 가지 antioxidants 등이 있다. 이들 성분을 수술 전 이미 영양부족이 있어서 면역학적 문제를 가진 환자들에게 적절하게 이용하면 패혈증, systemic inflammatory reaction syndrome 등에 도움을 줄 수 있고 특히 외상환자나 화상환자에서는 결정적인 역할이 입증되기도 하였다. 하지만 아직 논란의 여지가 많고 몇 가지 성분에 대해서는 역효과에 대한 보고도 있어서 좀 더 명백한 근거 확보가 요구되는 분야로서 많은 연구 과제를 지닌 미개척 분야라고 할 수 있다.
수술 전후 외과환자의 영양치료에 대한 요약은 다음과 같다. 수술 전 면밀한 영양학적 준비와 평가로 수술의 결과를 향상시킬 수 있다. 수술 후 조기 경장영양은 금기사항만 없다면 꼭 필요하다. 정맥영양은 필요한 경우 너무 늦지 않게 사용될 수 있으며, 경장영양이 부족한 경우 보충 역할을 할 수 있다. 면역영양치료는 적절한 대상을 상대로 시행될 경우 효과를 볼 수 있다. 기존의 가이드라인과 프로토콜을 따르는 것이 영양지원에 도움이 될 수 있지만 지역, 질병분포, 가용 자원에 알맞은 고유의 프로토콜을 마련하는 것이 가장 적절하다.
수술 전후 영양치료의 중요성은 단지 수술 전 영양실조의 문제가 있었던 환자에 국한되는 것이 아니다. 수술 전 정상 영양상태의 건강한 사람도 수술의 종류에 상관없이 수술에 따른 손상과 영양학적 위험에 노출될 수 있으며, 적절한 영양지원을 통해 수술의 결과를 향상 시킬 수 있다. 영양학적 위험에 놓인 환자의 경우 수술 전후 적절한 영양공급을 통해 합병증을 예방하는 등 수술의 결과 향상은 물론이고 재원기간의 단축과 치료비용 절감의 효과를 가져올 수 있다. 수술 전후 영양지원의 적정성 평가는 임상의료 질 관리의 차원에서 접근되어야 한다.
본 논문은 외과 환자의 수술 전후 처치에 있어 관행되는 영양 치료의 문제점을 지적하면서 적절한 수술 전후 영양 지원이 합병증 및 재원일수를 줄이는 등 수술 결과를 향상시킬 수 있다고 기술하고 있습니다. 일반적인 수술 전후의 영양 처치 원칙을 기술함은 물론 면역영양치료, Fast-track surgery 또는 ERAS와 같은 최신 지견을 같이 소개함으로써 향후 외과환자의 영양 처치의 방향을 제시하고 있습니다. 특히 이런 적극적인 영양관리가 임상의료의 질관리 측면에서 중요함을 시사하고 있어 의의가 있는 논문이라고 판단됩니다.
[정리: 편집위원회]
Figures and Tables
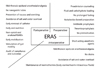 | Figure 1Enhanced recovery after surgery protocol (From Varadhan KK, et al. Crit Care Clin 2010;26:527-547 with permission from Elsevier) [9] |
References
1. Bruun LI, Bosaeus I, Bergstad I, Nygaard K. Prevalence of malnutrition in surgical patients: evaluation of nutritional support and documentation. Clin Nutr. 1999; 18:141–147.

2. Drover JW, Cahill NE, Kutsogiannis J, Pagliarello G, Wischmeyer P, Wang M, Day AG, Heyland DK. Nutrition therapy for the critically ill surgical patient: we need to do better. JPEN J Parenter Enteral Nutr. 2010; 34:644–652.

3. Santos JI. Nutrition, infection, and immunocompetence. Infect Dis Clin North Am. 1994; 8:243–267.

5. Haydock DA, Hill GL. Impaired wound healing in surgical patients with varying degrees of malnutrition. JPEN J Parenter Enteral Nutr. 1986; 10:550–554.

8. Fearon KC, Ljungqvist O, Von Meyenfeldt M, Revhaug A, Dejong CH, Lassen K, Nygren J, Hausel J, Soop M, Andersen J, Kehlet H. Enhanced recovery after surgery: a consensus review of clinical care for patients undergoing colonic resection. Clin Nutr. 2005; 24:466–477.

9. Varadhan KK, Lobo DN, Ljungqvist O. Enhanced recovery after surgery: the future of improving surgical care. Crit Care Clin. 2010; 26:527–547.

10. Awad S, Varadhan KK, Ljungqvist O, Lobo DN. A meta-analysis of randomised controlled trials on preoperative oral carbohydrate treatment in elective surgery. Clin Nutr. 2013; 32:34–44.

11. Brady M, Kinn S, Ness V, O'Rourke K, Randhawa N, Stuart P. Preoperative fasting for preventing perioperative complications in children. Cochrane Database Syst Rev. 2009; (4):CD005285.

12. Brady M, Kinn S, Stuart P. Preoperative fasting for adults to prevent perioperative complications. Cochrane Database Syst Rev. 2003; (4):CD004423.

13. Cao F, Li J, Li F. Mechanical bowel preparation for elective colorectal surgery: updated systematic review and meta-analysis. Int J Colorectal Dis. 2012; 27:803–810.

14. Jorgensen H, Wetterslev J, Moiniche S, Dahl JB. Epidural local anaesthetics versus opioid-based analgesic regimens on postoperative gastrointestinal paralysis, PONV and pain after abdominal surgery. Cochrane Database Syst Rev. 2000; (4):CD001893.
15. Rodgers A, Walker N, Schug S, McKee A, Kehlet H, van Zundert A, Sage D, Futter M, Saville G, Clark T, MacMahon S. Reduction of postoperative mortality and morbidity with epidural or spinal anaesthesia: results from overview of randomised trials. BMJ. 2000; 321:1493.

16. Gan TJ, Meyer T, Apfel CC, Chung F, Davis PJ, Eubanks S, Kovac A, Philip BK, Sessler DI, Temo J, Tramer MR, Watcha M. Department of Anesthesiology, Duke University Medical Center. Consensus guidelines for managing postoperative nausea and vomiting. Anesth Analg. 2003; 97:62–71.

17. Waldhausen JH, Shaffrey ME, Skenderis BS 2nd, Jones RS, Schirmer BD. Gastrointestinal myoelectric and clinical patterns of recovery after laparotomy. Ann Surg. 1990; 211:777–784.

18. Mueller C, Compher C, Ellen DM. American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) Board of Directors. A.S.P.E.N. clinical guidelines: nutrition screening, assessment, and intervention in adults. JPEN J Parenter Enteral Nutr. 2011; 35:16–24.
19. Jie B, Jiang ZM, Nolan MT, Zhu SN, Yu K, Kondrup J. Impact of preoperative nutritional support on clinical outcome in abdominal surgical patients at nutritional risk. Nutrition. 2012; 28:1022–1027.

20. Senkal M, Zumtobel V, Bauer KH, Marpe B, Wolfram G, Frei A, Eickhoff U, Kemen M. Outcome and cost-effectiveness of perioperative enteral immunonutrition in patients undergoing elective upper gastrointestinal tract surgery: a prospective randomized study. Arch Surg. 1999; 134:1309–1316.

21. American Society of Anesthesiologists Committee. Practice guidelines for preoperative fasting and the use of pharmacologic agents to reduce the risk of pulmonary aspiration: application to healthy patients undergoing elective procedures: an updated report by the American Society of Anesthesiologists Committee on Standards and Practice Parameters. Anesthesiology. 2011; 114:495–511.
22. Gutierrez MC, Moore PG, Liu H. Goal-directed therapy in intraoperative fluid and hemodynamic management. J Biomed Res. 2013; 27:357–365.

23. Rinehart J, Liu N, Alexander B, Cannesson M. Review article: closed-loop systems in anesthesia: is there a potential for closed-loop fluid management and hemodynamic optimization? Anesth Analg. 2012; 114:130–143.
24. Osland E, Yunus RM, Khan S, Memon MA. Early versus traditional postoperative feeding in patients undergoing resectional gastrointestinal surgery: a meta-analysis. JPEN J Parenter Enteral Nutr. 2011; 35:473–487.

25. Lewis SJ, Andersen HK, Thomas S. Early enteral nutrition within 24 h of intestinal surgery versus later commencement of feeding: a systematic review and meta-analysis. J Gastrointest Surg. 2009; 13:569–575.

26. Gwon JG, Lee YJ, Kyoung KH, Kim YH, Hong SK. Enteral nutrition associated non-occlusive bowel ischemia. J Korean Surg Soc. 2012; 83:171–174.

27. Mo JA, Lee SH, Jeon MH, Kim KS, Kim HS, Jang JY, Lee MD. Efficacy of feeding pump for patients on enteral tube feeding: a systematic literature review and analysis. Korean J Gastroenterol. 2014; 63:99–106.

28. Braga M, Ljungqvist O, Soeters P, Fearon K, Weimann A, Bozzetti F. ESPEN. ESPEN guidelines on parenteral nutrition: surgery. Clin Nutr. 2009; 28:378–386.

29. Casaer MP, Mesotten D, Hermans G, Wouters PJ, Schetz M, Meyfroidt G, Van Cromphaut S, Ingels C, Meersseman P, Muller J, Vlasselaers D, Debaveye Y, Desmet L, Dubois J, Van Assche A, Vanderheyden S, Wilmer A, Van den Berghe G. Early versus late parenteral nutrition in critically ill adults. N Engl J Med. 2011; 365:506–517.

30. Vanderheyden S, Casaer MP, Kesteloot K, Simoens S, De Rijdt T, Peers G, Wouters PJ, Coenegrachts J, Grieten T, Polders K, Maes A, Wilmer A, Dubois J, Van den Berghe G, Mesotten D. Early versus late parenteral nutrition in ICU patients: cost analysis of the EPaNIC trial. Crit Care. 2012; 16:R96.

31. Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, Sevransky JE, Sprung CL, Douglas IS, Jaeschke R, Osborn TM, Nunnally ME, Townsend SR, Reinhart K, Kleinpell RM, Angus DC, Deutschman CS, Machado FR, Rubenfeld GD, Webb SA, Beale RJ, Vincent JL, Moreno R. Surviving Sepsis Campaign Guidelines Committee including the Pediatric Subgroup. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013; 41:580–637.





 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download