Abstract
Type 2 diabetes mellitus and diabetic complications have sharply increased and have become an important issue to resolve. The goal of treatment of type 2 diabetes is to prevent the development and progress of diabetic complications by successful glycemic control. Various treatment modalities are used in the glycemic control of diabetic patients, such as lifestyle modification, oral hypoglycemic agent, insulin, insulin analogues, and GLP-1 agonist. Although there are many treatment guidelines for glycemic control, the key to successful therapy for type 2 diabetes is precise insight on the nature of the disease, characteristics of the patient, and knowledge of the therapy. Therefore, it is important to learn about antihyperglycemic drug therapy. Sulfonylurea, metformin, α-glucosidase inhibitor, glinide, thiazolidinedione, and SGLT2 inhibitor are used in monotherapy for the glycemic control of diabetic patients. However, the failure rate of monotherapy is not low at the beginning or during the course of treatment. When monotherapy fails, the next step is combination therapy. A well-chosen combination treatment method will help to achieve the glycemic goal before the use of insulin. In conclusion, it is essential to achieve a precise insight into the characteristics of the drug, considerations in drug choice, and the advantages/disadvantages of combination therapy. The most important thing is the appropriate individualization of the treatment after understanding the current state of diabetic patients, such as diabetic complications, age, lifestyle, body weight, hypoglycemia risk, and economic state.
전세계적으로 과체중 및 비만 인구의 증가에 따라 제2형 당뇨병의 발생도 급증하고 있으며 당뇨병으로 인한 영양 및 에너지 대사의 이상은 미세혈관 합병증 및 대혈관 합병증을 초래하여 특히 심혈관계 합병증으로 인한 사망률의 발생 또한 증가시키고 있다.
당뇨병은 병태생리학적으로 췌장 베타세포의 인슐린 분비 장애, 인슐린 저항성으로 인한 간 포도당 신합성 증가, 말초(특히 근육)에서 포도당 이용 장애로 발생하며 이외에도 인크레틴 작용 결함, 염증 매개불질의 증가, 유리지방산의 증가 등으로 인하여 다양한 장기에 다양한 장애를 초래하는 질환이다. 최근에는 당뇨병의 발생기전에 다른 내분비기관들과 같이 췌장의 베타세포와 인슐린 표적 장기간에 작용하는 되먹임 기전의 장애가 관여한다는 주장이 나오고 있다[1]. 혈당 증가에 의해 자극된 베타세포에서 인슐린을 분비하면 인슐린이 표적 장기에 작용하여 포도당, 아미노산, 유리지방산 등의 이용을 매개하고 이들 표적 장기는 인슐린의 필요 정도에 대한 정보를 베타세포에 보낸다는 가설로 아직까지 표적장기에서 베타세포로 정보를 전달하는 기전에 대해서는 알려진 바 없다.
당뇨병의 치료목적은 당뇨병성 합병증의 발생을 억제하고 이미 발생한 합병증의 진행을 지연시키는데 있으며 이를 위한 근본적인 치료는 성공적인 혈당조절과 혈압조절 그리고 혈중지질농도 조절을 하는 것이다. 당뇨병 환자에게 발생하는 일련의 증상이나 합병증은 주로 고혈당과 관련 된 다양한 기전에 의해 초래되는 것으로 혈당조절은 당뇨병 환자를 관리하는데 있어서 중요한 시작점이라고 할 수 있다. 당뇨병 환자가 혈당조절 목표에 도달하기 위해 생활습관 개선(임상영양요법과 운동요법)과 약물치료를 하고 있지만 당뇨병의 유병기간이 증가함에 따라 당뇨병은 진행하는 질환이기 때문에 많은 환자에서 혈당조절에 실패하고 있다. 2012년에 발표된 대한 당뇨병학회의 Diabetes Fact Sheet in Korea에서도 치료를 받고 있는 당뇨병 환자들의 75%가 경구 혈당강하제로 혈당조절을 하고 있었으며 우리나라의 혈당조절 목표인 6.5% 이하로 조절되고 있는 환자는 30% 정도밖에 되지 않았다.
제2형 당뇨병 환자에서 혈당조절 목표에 도달하고 혈당을 유지하기 위해서는 영양요법과 운동요법을 지속하면서 당뇨병이 진행함에 따라 추가적인 치료가 필요하다. 이때 경구 혈당강하제의 병합요법이 중요한 치료 선택이 될 수 있다.
1920년대에 인슐린이 발견되어 당뇨병의 치료에 사용되어 오다가 1950년대부터 경구 혈당강하제로 설폰요소제와 메트포르민이 사용되었고 1990년대가 되어서야 고혈당의 발생 기전에 대한 많은 연구결과를 토대로 알파글루코시다제억제제, 티아졸리딘디온, 글리나이드, DPP4 억제제, 그리고 최근에 SGLT2 억제제가 개발되어 현재 당뇨병 환자의 혈당조절에 사용되고 있다.
1950년도 후반에 메트포르민이 소개되면서 본격적으로 사용되어 현재는 당뇨병의 약물치료를 시작할 때 1차 선택약이자 병합요법의 중요한 초석의 위치를 차지하고 있다. 주요 작용기전은 인슐린저항성을 완화시켜 간에서 포도당 신합성과 글리코겐분해 억제하고 근육에서 포도당 섭취를 촉진하며 글리코겐합성을 증가시킨다[2]. 또한 지방산 산화를 억제하고 중성지방 농도를 낮추어 지방산보다 포도당을 에너지원으로 더 사용하게 한다. 인슐린저항성 완화, 체중감소, 혈중지질농도 감소 등의 좋은 효과가 있어서 당뇨병 환자의 초기 단독요법의 1차 선택약으로 사용되고 있지만 임신 및 수유, 중증 간, 신 장애(혈중 크레아틴닌; ≥1.5 mg/dL 남자, ≥1.4 mg/dL 여자), 중증 감염, 탈수, 심폐부전 시 금기이고 (Table 1) 80세 이상의 노인이나 신기능저하를 동반한 환자에서는 사용에 주의를 요한다.
췌장 베타세포의 설폰요소 수용체에 결합하여 전위의존성 칼륨 통로를 닫아 칼슘이 세포 내로 유입되면서 인슐린을 분비를 촉진시키는 것이 주요 작용기전이며 췌장 외 작용으로 포도당의 산화를 증가시키고 인슐린 수용체 후 경로를 활성화시켜 당 수송을 증가시키는 효과도 있지만 고혈당의 유무와 관계없이 췌장에서 인슐린 분비를 증가시키기 때문에 저혈당의 발생이 빈번하고 체중증가를 유발한다. 설폰요소제는 췌장 베타세포에서 인슐린 분비를 자극하여 혈당을 저하시키는 기전을 가지고 있기 때문에 약물치료의 이차성 실패가 발생하며 A Diabetes Outcome Progression Trial에서는 5년 이내에 다른 계열의 약제보다 많은 34% 정도(메트포르민 21%, 로시글리타존 15%)의 약물의 이차성 실패가 발생하는 것을 관찰 할 수 있었다[3].
설폰요소제와 같이 인슐린 분비를 촉진시키는 작용을 하지만 약효의 발현이 빠르고 작용 시간이 짧아 설폰요소제와 비교하여 저혈당을 많이 유발하지 않는다. 주로 식후 혈당강하에 효과적이며 공복혈당조절에는 효과가 미미하여 당화혈색소가 7.5% 이상인 당뇨병 환자에서 병합요법으로 많이 사용된다. 최근 발표된 미국당뇨병학회의 약물치료 권고안에는 언급되지 않았지만 당화혈색소가 6.5-7.5%인 당뇨병 환자에서 설폰요소제와 같은 적응증으로 사용할 수 있다. 설폰요소제보다 비교적 복용시간이 자유로우며 작용시간이 짧기 때문에 식사습관이 불규칙하거나 저혈당이 많은 환자에서 유리하지만 체중증가는 설폰요소제와 비슷하다. 다른 약제들과 비슷하게 신장기능이나 간기능장애를 동반한 환자에서는 사용에 주의를 요한다 (Table 1).
소장에서 다당류를 단당류로 분해하는 일련의 효소를 의미하는 알파 글루코시다제를 억제함으로써 소장에서 당 흡수를 지연시키는 작용을 한다. 주로 식후 고혈당이 문제가 되는 당뇨병 환자에게 적용이 되며 설폰요소제나 비구아나이드 단독요법으로 잘 조절되지 않는 환자에게 병합요법으로 사용한다. 부작용으로는 방귀, 묽은 변, 설사, 복부 팽만감 등의 위장관계 부작용이 대부분이며 이는 약제의 용량이나 탄수화물의 흡수 정도에 비례하고 4-8주정도 지나면 완화된다. 이 약제는 임신 및 수유, 신기능 장애(혈청 크레아티닌 >2.0 mg/dL), 염증성 장질환, 대장 궤양, 간경병증 등을 동반한 환자에서는 금기이다.
Peroxisome proliferators-activated receptor gamma 길항제로 주요 작용기전은 간, 근육, 지방세포에서 인슐린감수성을 증가시켜 당 흡수를 증가시키고 당신생을 억제한다. 지질대사에도 작용을 하여 중성지방의 생성을 감소시키고 당독성(glucose toxicity) 완화, 항산화 작용도 있다. 하지만 베타세포의 인슐린 분비 기능이 저하된 환자에서는 효과가 작다. 인슐린 분비를 증가시키지 않기 때문에 저혈당이 없으며 약물의 이차성 실패가 없다. 티아졸리딘디온 약제 중 로시글리타존은 메타 분석결과 심혈관계 부작용 때문에 현재는 사용하지 않고[45], 피오글리타존은 The Prospective Pioglitazone Clinical Trial in Macrovascular Event 연구에서 심혈관계 질환에 대한 안전성이 증명되어 현재까지 사용 중이지만[6], 최근 메타분석 결과에서는 당뇨병 환자에서 피오글리타존을 장기간 사용하는 경우 방광암 위험이 높아질 수 있다는 결과도 발표되어[7] 아직까지 논란이 되고 있다.
최근에 많은 장점을 가지고 있는 약제로 소개되어 당뇨병 환자의 혈당조절에 단독 또는 병합요법에 널리 사용되고 있다. 주된 작용은 식사 후 장에 서 분비되는 인크레틴 호르몬을 빠르게 분해하는 효소인 DPP4를 억제하여 인크레틴의 작용시간을 연장시킴으로써 인크레틴에 의한 효과로써 고혈당에 의한 인슐린 분비를 증가시키고 글루카곤의 분비를 감소시켜 혈당을 강하시키는 작용을 한다. 또한 베타세포에서 PDX-1 증가, caspase-3 억제, Foxo1 억제를 유도하여 베타세포의 분화를 촉진시키고 베타세포의 소멸을 억제하는 작용도 있다. 이러한 특성 때문에 최근에 대두된 8가지 고혈당 유발 요인에 대해 직접 또는 간접적으로 작용하여 생리적인 혈당조절 효과를 볼 수 있을 것으로 알려졌다[8].
신장은 배설된 포도당을 재흡수 하기도 하지만 포도당 생합성을 할 수도 있다. 신장에서 포도당을 재흡수 하는 기전에는 SGLT2가 관여하는데 이를 억제함으로써 소변으로 배설되는 포도당을 증가시켜 결과적으로 혈당을 낮추고 체중을 감소시키며 혈압도 낮출 수 있다. 최근에 다파글리플로진과 카나글리플로진 두 가지 약제가 소개되어 사용되고 있다. 하지만 요로 감염이 현저히 증가되고 저밀도콜레스테롤 농도가 증가되는 부작용이 관찰되어 주의를 요한다 (Table 1).
당뇨병의 합병증을 예방하기 위해서는 United Kingdom Prospective Diabetes Study나 The Diabetes Control and Complication Trial 등에서 증명된 바와 같이 철저한 혈당조절이 중요하다. 비교적 최근에 발표된 Action to Control Cardiovascular Risk in Diabetes trial, Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation trial, Veterans Affairs Diabetes Trial에서는 당뇨병환자마다 개별화된 혈당조절 목표를 세우고 혈당조절을 하는 것이 중요하다는 결과를 얻었지만 혈당조절의 이득에 대한 결과는 크게 변하지 않았다. 그러므로 당뇨병환자의 합병증 발생을 예방하고 진행을 지연시키기 위해서는 성공적인 혈당조절이 필수적이다. 성공적인 혈당조절을 위하여 세계적으로 많은 당뇨병 환자의 치료지침이 발표되었고 대부분의 권고안에서 생활습관개선과 메트포르민 단독요법을 초기 치료로 권장하고 있지만 이와 같은 기본 치료만으로는 많은 당뇨병 환자들에서 혈당조절 목표에 도달하기가 쉽지 않고 목표 혈당에 도달하는데 오랜 시간이 소요되고 혈당조절에 성공한 이후에도 당뇨병이 진행함에 따라 목표 혈당의 유지에 실패하게 된다. 목표 혈당에 도달하는데 오랜 시간이 소요되는 것은 임상적인 관성(clinical inertia)이라고 하는 현상 때문으로 혈당이 높아진 후에 단계적으로 강화하는 약물치료는 혈당조절에 성공하기 보다는 혈당조절에 실패하고 계속 뒤처지는 결과를 나타낸다는 것이다[131415]. 이는 여러 임상연구에서 확인된 것으로 Brown과 Nichols [16]에 의한 임상연구에서는 당화혈색소가 9% 이상으로 상승된 당뇨병 환자들에서 약물치료를 강화하여도 30개월 이상 당화혈색소가 8% 이상으로 유지되었다고 보고하였다. 또한 당뇨병은 진단 받기 9-12년 전부터 베타세포의 기능악화가 진행되어[1718] 당뇨병 진단 당시 이미 베타세포 기능의 80-85%가 소실되었다고 추정되고 있기 때문에 초기 혈당조절 치료로 혈당조절 목표에 도달한 이후에도 장기간 목표 혈당을 유지하기 위해서는 병합요법을 시작할 수 있다. 특히 최근 소개된 DPP4 억제제는 베타세포 보존효과도 기대할 수 있어 베타세포의 기능 개선을 기대할 수 있다.
경구 혈당강하제의 병합요법으로 혈당조절을 하는 경우에는 각기 다른 기전으로 작용하는 약제를 선택하는 것이 더 큰 효과를 기대할 수 있고 한 가지 약제 용량을 최대한으로 증량할 필요가 없기 때문에 약제에 의한 부작용도 감소시킬 수 있다는 장점이 있다.
경구 혈당강하제의 병합요법이 단독요법을 비교한 임상 연구가 각각의 약제 별로 많기 때문에 모두 나열하여 설명을 하기에는 너무나 방대한 분량이라 대표적인 병합요법에 대하여 단독요법으로 혈당조절에 실패한 후 병합요법으로 강화하여 얻은 혈당조절 효과를 Table 2에 정리하였다.
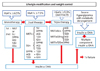
대부분의 당뇨병 치료지침에서 당뇨병환자가 생활습관 개선과 더불어 경구 혈당강하제 단독요법으로 3-6개월 이내에 혈당조절 목표에 도달하지 못하면 단독요법의 실패로 규정하고 적극적인 병합요법을 시작해야 한다고 권고하고 있다. 하지만 제2형 당뇨병은 다양한 병태생리학적 기전으로 정상적인 혈당을 유지할 수 없는 상태에 이르는 질환으로 당뇨병 환자의 고혈당은 인슐린저항성, 인슐린 분비 감소, 인크레틴 호르몬 기능 부전, 유리 지방산의 증가, 염증반응, 당독성(glucotoxicity), 지방독성(lipotoxicity) 등 여러 가지 기전이 관여하고 당뇨병환자가 당뇨병을 진단 받은 당시에 이런 병태생리학적 특징이 모두 같을 수 없기 때문에 생활습관 개선과 경구 혈당강하제의 단독요법만으로는 혈당조절에 한계가 있다. 따라서 환자의 혈당 수준과 앞에서 언급한 여러 가지 요인들을 고려하여 병합요법을 처음부터 시작할 수도 있다(Figure 1) [9]. 고혈당 치료지침마다 병합요법을 처음 시작하는 기준은 조금씩 다르지만 진단 당시 당화혈색소를 기준으로 (HbA1c; ≥7.5% 대한당뇨병학회, >9.0% 미국당뇨병학회/유럽당뇨병학회, ≥7.5% 미국임상내분비학회) 처음부 터 경구약물의 병합요법의 시작을 고려하도록 권고하고 있다. 당뇨병의 합병증을 예방하기 위해서는 당뇨병 진단 초기부터 혈당조절을 잘 하는 것이 중요하기 때문에 빠른 당화혈색소 감소효과, 단계적 치료 강화의 한계성, 베타세포의 보존 효과, 단일 약제의 고용량 사용으로 인한 부작용, 혈당강하제간의 상호보완적인 작용 등을 고려하여 최근에는 병합요법의 조기적용이 권고되고 있다.
이론적으로는 모든 경구 혈당강하제의 병합요법이 가능하겠지만 단독요법으로 혈당조절 목표에 도달하지 못할 경우 작용기전이 다른 경구 혈당강하제를 추가하여 성공적으로 혈당을 조절할 수 있다는 것이 병합요법의 근거이다. 또한 처음부터 병합요법을 시작할 때에도 제2형 당뇨병의 근본적인 병리기전인 인슐린저항성과 인슐린분비능 저하, 당화혈색소로 평가되는 혈당조절 수준, 공복고혈당, 식후 고혈당 등을 고려하여 치료를 시작하는 당뇨병 환자의 특성을 파악한 후에 사용하는 두 가지 약제의 상승작용이 기대되고 혈당조절의 초점을 공복고혈당에 맞출 것인지 식후 고혈당에 더 비중을 둘 것인지를 고려하여 선택한다.
이 두 가지 약제의 조합은 오랜 기간 동안 가장 널리 사용되어온 병합요법으로 메트포르민이 인슐린저항성을 개선하고 설폰요소제가 인슐린 분비능을 향상시키는 상승작용으로 단독요법으로 혈당조절에 실패한 환자들에서 병합요법으로 전환한 후에 효과를 평가한 여러 임상연구 결과에서 1-2.0%의 당화혈색소의 감소효과가 관찰되었고 부작용의 발현은 증가되지 않았다.
두 약제들이 모두 인슐린저항성을 개선시키는 기전을 가진 약제이지만 메트포르민은 주로 간의 당 생합성을 억제하고 티아졸리딘디온은 근육이나 지방에서 당 흡수를 증가시키는 결과는 나타내기 때문에 두 약제의 병합요법도 단독요법으로 사용할 때 보다 0.8-1.5% 정도의 당화혈색소 감소효과가 임상연구에서 관찰되었다. 특히 기저 혈당치가 높거나 비만한 제2형 당뇨병 환자에서는 처음부터 인슐린저항성 개선제인 메트포르민과 티아졸리딘디온의 강력한 병합요법이 효과적이라는 연구결과도 많다[1920]. 다른 병합요법에 비해 지질대사의 개선효과도 있어 대사증후군을 동반하고 과체중 또는 비만한 제2형 당뇨병 환자에서는 메트포르민과 설폰요소제의 병합요법보다는 티아졸리딘디온의 병합요법이 선호된다.
설폰요소제와 메트포르민의 병합요법과 비슷한 효과를 기대할 수 있으나 글리나이드제제가 설폰요소제보가 작용 발현이 빠르고 지속시간이 짧기 때문에 식후 고혈당이 문제가 되면서 저혈당의 위험이 있는 당뇨병 환자에서 적절하다[21].
단독요법으로 실패한 환자에서 DPP4 억제제를 추가했을 때 0.7-1.5%의 당화혈색소 감소효과가 관찰 되었다. DPP4 억제제는 인크레틴의 효과를 지속시켜 다양한 효과를 나타내지만 저혈당 발생의 위험이 낮고 주로 식후 고혈당을 감소시키는 작용이 있어 메트포르민 단독요법으로 식후 고혈당조절이 불충분할 때 시작할 수 있다.
DPP4 억제제는 비교적 최근에 사용되기 시작한 경구 혈당강하제로 장기간 사용하여 관찰 된 데이터는 많지 않다. Garber 등[24]의 연구에서 설폰요소제로 혈당조절이 불충분한 당뇨병환자에서 DPP4 억제제를 추가하여 저혈당의 발생은 증가하지 않았지만 1.0%의 추가적인 당화혈색소 감소효과를 보고하였다.
설폰요소제와 병합하였을 때와 마찬가지로 추가적으로 0.7-1.9%의 당화혈색소 감소 효과가 관찰되었지만 저혈당의 빈도가 증가하지 않았고 체중도 티아졸리딘디온 단독요법과 비교하여 유의하게 증가하지 않았다. 또한 티아졸리딘디온의 부작용 중에 하나인 부종도 고용량의 티아졸리딘디온 단독요법보다 적게 발생하였다.
제2형 당뇨병환자에서 식후 고혈당을 감소시킴으로써 주기성 인슐린 분비를 억제시킬 수 있다. 많은 임상연구에서 설폰요소제 단독으로 혈당조절에 실패한 환자들에서 알파 글루코시다제 억제제를 추가하였을 때 0.5-1.0% 정도의 당화혈색소 감소효과가 관찰되어[25] 이 병합요법은 설폰요소제 단독요법으로 혈당조절이 안 되는 환자들 중 고령이거나 설폰요소제 용량 증량으로 저혈당의 발생이 많은 환자에서 고려해 볼 수 있고 우리나라와 같이 탄수화물이 근간이 되는 식사를 주식으로 하는 당뇨병 환자에서 좋은 효과를 기대할 수 있다.
설폰요소제로 혈당조절이 안되는 환자에서 티아졸리딘디온을 추가하였을 때 0.9-1.2% 정도의 당화혈색소 감소효과가 관찰되었다[20]. 이전의 연구결과에서 설폰요소제 최대 용량을 사용하는 것보다 설폰요소제의 최대용량의 절반과 티아졸리딘디온의 병합요법이 혈당조절에 더 좋은 것으로 관찰되어 병합요법을 시작할 때 설폰요소제를 최대 용량으로 증량하기 전에 병합요법을 시작하는 것이 적절하다.
생활습관 개선과 2제 경구 혈당강하제 병합요법으로도 혈당조절 목표에 도달하지 못하는 경우 인슐린 치료를 시작하거나 3제 병합용법으로 넘어가게 된다. 대한당뇨병학회에서 발표한 제2형 당뇨병 환자의 진료지침에서는 보험 적용 등의 이유로 3제 요법을 처음부터 시작하는 경우는 기술하지 않았으나 미국 및 유럽 당뇨병학회의 진료지침이나 미국 임상내분비학회의 치료 알고리즘에 따르면 당화혈색소가 9%를 초과하는 환자에서 고혈당으로 인한 증상을 동반하지 않는 경우에는 처음부터 3제 병합요법을 시작할 수 있다고 권고하였다. 삼제요법의 경우에는 전통적으로 설폰요소제와 메트포르민의 병합요법이 많이 사용되어 왔기 때문에 이 조합에 티아졸리딘디온, 알파 글루코시다제 억제제, DPP4 억제제 등을 추가하여 3제 병합요법을 시행하는 경우가 많으며 특히 티아졸리딘디온을 추가한 3제요법과 DPP4 억제제를 추가한 3제 요법에 대해서는 2제 병합요법에 실패한 환자들을 대상으로 진행한 임상연구에서 좋은 결과를 얻었다[26]. 최근에는 메트포르민과 DPP4 억제제의 병합요법이 많이 사용되고 있어서 이 조합에 티아졸리딘디온을 추가한 3제 요법도 많이 이용되고 있다. 3제 병합요법은 약제의 복용 순응도의 감소 및 비용의 증가 등의 이유로 논란의 여지가 있지만 작용기전이 서로 다른 3가지 약물을 병합하여 사용하는 것은 타당성이 있고 아직까지 많이 사용되고 있다.
앞서 언급한 것처럼 2제 경구 혈당강하제 병합요법을 시행하던 환자가 혈당이 다시 상승하게 되면 한가지 약제를 더 추가하여 3제 병합요법을 시작하기도 하지만 환자의 순응도, 약제 비용, 약물 부작용 등을 고려하여 경구 혈당강하제가 아닌 인슐린 주사를 추가하여 인슐린과 경구혈당강하제의 병합요법을 시작할 수 있다.
제2형 당뇨병 환자들의 병인은 주로 인슐린 저항성에 기인한 것이나 베타세포의 인슐린 분비능의 저하도 중요한 병인이며 당뇨병이 진행됨에 따라 인슐린 분비능은 더욱더 저하된다[27]. 설폰요소제는 인슐린의 분비를 증가시키고 췌장 외 효과로 인슐린 저항성을 감소시키는 작용을 하기 때문에 인슐린과 설폰요소제를 병합하는 경우에 주사하는 인슐린의 용량을 감소할 수 있고 혈당조절을 양호하게 할 것이라고 기대할 수 있다. 그러나 이런 작용이 췌장의 인슐린의 분비를 증가시켜서 온 결과인지 인슐린의 저항성이 실제로 줄어든 결과인지는 아직 논란이 많다. 글리나이드제도 인슐린 분비를 증가시키는 작용을 하기 때문에 설폰요소제와 같은 효과를 기대할 수 있고 특히 식후 고혈당이 문제가 되는 환자에서 사용해 볼 수 있다.
인슐린과 메트포르민의 병합요법은 제2형 당뇨병 환자에서 혈당조절에 현저한 효과를 보인다. 특히 인슐린 치료 시 체중증가가 관찰되는 경우 메트포르민을 병합하여 치료하면 체중증가를 줄일 수 있다.
장에서 포도당 흡수를 지연시키는 작용을 고려하면 인슐린 주사 단독치료 시 식후 고혈당이 문제가 되는 환자에서 알파 글루코시다제 억제제를 병합하는 경우 식후 고혈당 개선을 기대할 수 있다.
당뇨병환자를 관리하는데 있어서 혈당조절, 혈압조절, 혈중지질농도의 조절은 가장 기본이 되는 치료이며 특히 혈당조절은 가장 핵심이 되는 치료이다. 대부분의 당뇨병 환자들은 혈당조절 목표에 도달하기 위해서 생활습관 개선을 통하여 건강한 식습관과 적당한 신체활동 수준을 유지하여 체중을 관리하면서 경구 혈당강하제를 병행하게 되는데 혈당조절에 실패한 후에 후속 조치로 약물치료를 강화하는 방법보다는 적극적으로 혈당조절을 하는 것이 중요하다. 경구 혈당강하제의 병합요법은 단독요법으로 혈당조절에 실패한 경우에 시작하는 치료의 선택이 될 수도 있지만 혈당이 높은 당뇨병환자에서는 초기부터 적극적인 병합요법을 시작하는 것이 단기간 내에 혈당조절 목표에 도달할 수 있으며 약제의 부작용을 적게 경험하면서 성공적인 혈당조절을 유지할 수 있는 치료의 선택이 될 수 있다. 최근에 발표된 미국 및 유럽 당뇨병학회의 당뇨병 관리지침이나 미국 임상 내분비학회의 알고리즘에서도 당뇨병 환자의 치료에 있어서 환자의 선호도, 체중, 생활방식, 동반질환, 저혈당, 약제의 안전성, 치료비용 등을 기본적으로 고려하여 환자 개개인에 맞는 혈당조절 목표를 정하고 개별화된 치료를 하도록 권고하고 있다[28].
본 논문은 국내에서 빠른 속도로 증가하고 있는 제2형 당뇨병 환자의 관리를 위하여 객관적인 연구와 자료를 토대로 기술 되었으며 국내 임상자료의 유무와 경제적인 측면을 고려하여 혈당조절의 가이드라인을 제시하였다는 점에 의의가 있을 것으로 생각한다. 최근 미국과 유럽 및 일본을 위시해서 국내에서도 대한 당뇨병학회가 당뇨병진료지침을 발표하고 있다. 이러한 진료지침을 통하여 치료가 표준화되고 모든 의료인이 비슷한 치료지침을 따른다면 환자에게도 큰 도움이 될 것으로 기대한다. 본 논문에서도 이러한 진료지침들에 기초하여 당뇨병의 조기치료와 병합요법의 당위성을 설득력 있게 기술하여 독자들이 당뇨병 진료에 큰 도움이 될 것으로 생각된다.
[정리: 편집위원회]
Figures and Tables
Figure 1
Treatment algorithms for glycemic control of type 2 diabetes mellitus. MET, metformin; SU, sulfonylure; DPP4i, dipepidyl peptidase inhibitor; AGi, alpha glucosidase inhibitor; TZD, thiazolidinedion; Glin, glinide; OHA, oral hypoglycemic agent; AACE/ACE, American Association of Clinical Endocrinologists/American College of Endocrinology; Tx, treatment. From Korean Diabetes Association. Treatment guideline for diabetes 2013 update. 1st ed. Seoul: Designleader Publishig; 2013 [9].
References
1. Kahn SE, Cooper ME, Del Prato S. Pathophysiology and treatment of type 2 diabetes: perspectives on the past, present, and future. Lancet. 2014; 383:1068–1083.

2. Inzucchi SE. Oral antihyperglycemic therapy for type 2 diabetes: scientific review. JAMA. 2002; 287:360–372.
3. Kahn SE, Haffner SM, Heise MA, Herman WH, Holman RR, Jones NP, Kravitz BG, Lachin JM, O'Neill MC, Zinman B, Viberti G. ADOPT Study Group. Glycemic durability of rosigli-tazone, metformin, or glyburide monotherapy. N Engl J Med. 2006; 355:2427–2443.

4. Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med. 2007; 356:2457–2471.

5. Erdmann E, Charbonnel B, Wilcox R. Thiazolidinediones and cardiovascular risk: a question of balance. Curr Cardiol Rev. 2009; 5:155–165.
6. Dormandy J, Bhattacharya M, van Troostenburg de Bruyn AR. PROactive investigators. Safety and tolerability of pioglitazone in high-risk patients with type 2 diabetes: an overview of data from PROactive. Drug Saf. 2009; 32:187–202.

7. Turner RM, Kwok CS, Chen-Turner C, Maduakor CA, Singh S, Loke YK. Thiazolidinediones and associated risk of bladder cancer: a systematic review and meta-analysis. Br J Clin Pharmacol. 2013; 12. 10. [Epub]. DOI: 10.1111/bcp.12306.

8. Defronzo RA. Banting Lecture. From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus. Diabetes. 2009; 58:773–795.

9. Korean Diabetes Association. Treatment guideline for diabetes 2013 update. 1st ed. Seoul: Designleader Publishig;2013.
10. American Diabetes Association. Standards of medical care in diabetes: 2014. Diabetes Care. 2014; 37:Suppl 1. S14–S80.
11. Nathan DM, Buse JB, Davidson MB, Ferrannini E, Holman RR, Sherwin R, Zinman B. American Diabetes Association. European Association for the Study of Diabetes. Medical management of hyperglycaemia in type 2 diabetes mellitus: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetologia. 2009; 52:17–30.

12. Rodbard HW, Blonde L, Braithwaite SS, Brett EM, Cobin RH, Handelsman Y, Hellman R, Jellinger PS, Jovanovic LG, Levy P, Mechanick JI, Zangeneh F. AACE Diabetes Mellitus Clinical Practice Guidelines Task Force. American Association of Clinical Endocrinologists medical guidelines for clinical practice for the management of diabetes mellitus. Endocr Pract. 2007; 13:Suppl 1. 1–68.
13. Zinman B. Initial combination therapy for type 2 diabetes mellitus: is it ready for prime time? Am J Med. 2011; 124:1 Suppl. S19–S34.

14. Shah BR, Hux JE, Laupacis A, Zinman B, van Walraven C. Clinical inertia in response to inadequate glycemic control: do specialists differ from primary care physicians? Diabetes Care. 2005; 28:600–606.
15. Ziemer DC, Miller CD, Rhee MK, Doyle JP, Watkins C Jr, Cook CB, Gallina DL, El-Kebbi IM, Barnes CS, Dunbar VG, Branch WT Jr, Phillips LS. Clinical inertia contributes to poor diabetes control in a primary care setting. Diabetes Educ. 2005; 31:564–571.

16. Brown JB, Nichols GA. Slow response to loss of glycemic control in type 2 diabetes mellitus. Am J Manag Care. 2003; 9:213–217.
17. Harris MI, Klein R, Welborn TA, Knuiman MW. Onset of NIDDM occurs at least 4-7 yr before clinical diagnosis. Diabetes Care. 1992; 15:815–819.

18. Bagust A, Beale S. Deteriorating beta-cell function in type 2 diabetes: a long-term model. QJM. 2003; 96:281–288.

19. Dailey GE 3rd, Noor MA, Park JS, Bruce S, Fiedorek FT. Glycemic control with glyburide/metformin tablets in combination with rosiglitazone in patients with type 2 diabetes: a randomized, double-blind trial. Am J Med. 2004; 116:223–229.

20. Orbay E, Sargin M, Sargin H, Gozu H, Bayramiçli OU, Yayla A. Addition of rosiglitazone to glimepirid and metformin combination therapy in type 2 diabetes. Endocr J. 2004; 51:521–527.

21. Raskin P, Klaff L, McGill J, South SA, Hollander P, Khutoryansky N, Hale PM. Repaglinide vs. Nateglinide Metformin Combination Study Group. Nateglinide Metformin Combination Study Group. Efficacy and safety of combination therapy: repaglinide plus metformin versus nateglinide plus metformin. Diabetes Care. 2003; 26:2063–2068.
22. Rosenstock J, Brown A, Fischer J, Jain A, Littlejohn T, Nadeau D, Sussman A, Taylor T, Krol A, Magner J. Efficacy and safety of acarbose in metformin-treated patients with type 2 diabetes. Diabetes Care. 1998; 21:2050–2055.

23. Phillips P, Karrasch J, Scott R, Wilson D, Moses R. Acarbose improves glycemic control in overweight type 2 diabetic patients insufficiently treated with metformin. Diabetes Care. 2003; 26:269–273.

24. Garber AJ, Schweizer A, Baron MA, Rochotte E, Dejager S. Vildagliptin in combination with pioglitazone improves glycaemic control in patients with type 2 diabetes failing thiazolidinedione monotherapy: a randomized, placebo-controlled study. Diabetes Obes Metab. 2007; 9:166–174.

26. Arai K, Maeda H, Sirabe S, Yamamoto R, Yamauchi M, Hirao T, Hirao S, Hirao K. Glimepiride strongly enhances the glucose-lowering effect in triple oral antidiabetes therapy with sitagliptin and metformin for Japanese patients with type 2 diabetes mellitus. Diabetes Technol Ther. 2013; 15:335–341.





 PDF
PDF ePub
ePub Citation
Citation Print
Print





 XML Download
XML Download