Abstract
While Korea had the highest rate of increase in per capita health expenditures from 1997 to 2007 among The Organization for Economic Cooperation and Development (OECD) countries, it is necessary in all countries to establish sustainable health care systems that efficiently use the existing effective treatment methods. For dealing with the overwhelming health care crisis, the European Union and the United States (US) have launched Health Technology Assessment (HTA) and Comparative Effectiveness Research (CER) programs, respectively. Further, the Federal Coordinating Council for Comparative Effectiveness Research in US has considered the development of the CER data infrastructure to be the primary investment needed in order to reform the national health care system. The main reason is that investment in data infrastructure can potentially generate significant additional investment in CER. In addition, the Council stressed the need for coordination between CER and health information technology through a distributed network of electronic health records. These directions and decisions on driving CER in the US may provide an invaluable lesson on solving some healthcare problems in Korea. However, barriers to the potential contribution of the existing databases to CER must be overcome, including interoperability, privacy protection and confidentiality, and active participation of the holders of the related databases.
2011년 국제연합(United Nations, UN)은 심장질환, 뇌졸중, 당뇨병, 악성종양, 만성호흡기질환 등의 비감염성질환 (non-communicable diseases, NCD)의 국제적인 심각성을 경고하면서, 이를 'The NCD crisis'라 지적하였다[1]. 우리 나라도 악성종양, 심혈관계질환, 소화기계질환, 당뇨병, 호흡기계질환 순으로 질병부담이 높은 것으로 나와서[2], 우리 국민들도 UN의 NCD crisis 경고를 귀담아 듣고 대응전략을 적극 마련해야 하는 상황이다.
세계보건기구는 NCD에 의한 사망을 줄이기 위해 'GOAL 25 by 25'란 대응전략을 제시하고 있는데, 금연, 저염, 절주, 신체활동 향상 등의 1, 2차예방에 집중되어 있다[3]. 이는 NCD 질환이 일단 발병하면 완치가 없고, 감염병의 항생제처럼 효과적인 치료수단이 미흡하기 때문이다[4]. 이런 NCD의 특징들로 인하여 고령화 사회에 있어, 일단 발병한 환자는 사망 시까지 장기간 의료서비스를 받게 되며, 결국 국민의 의료비용이 기하급수적으로 증가하는 문제에, 보건의료체계와 무관하게 모든 국가가 'health care crisis'로 표현되는 보건의료 문제에 직면하고 있는 것이다[5]. 우리나라도 경제협력개발기구 국가 중 일인당 의료비 연평균 실질 증가율이 1위인 나라로서 결코 예외가 아니다[6].
이렇듯 선진국들은 당면한 보건의료 문제를 타결하기 위한 대응책 중의 하나가 바로 NCD 진료서비스의 실제적인 효과를 검토하는 것이다. 다시 말해서, NCD 진료에 있어 효과적인 치료수단이 미흡하다는 특성을 감안할 때, 진료현장에서 제공하는 의료서비스들의 직접적인 효과를 확인한 다음, 그 근거에 따라 의료서비스를 제공여부를 결정하자는 근거중심진료가 강조되고 있다[7]. 이런 배경을 갖고 추진하는 보건의료 정책적 활동을, 유럽에서는 보건의료기술분석(Healthcare Technology Assessment), 북미에서는 비교효과연구(Comparative Effective Research, CER)라 부르고 있다[891011]. 이를 추진하는 기구로 영국의 National Institute for Health and Clinical Excellence (NICE), 프랑스의 Haute Autorité de Santé (HAS), 독일의 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG), 덴마크의 Danish Centre for Health Technology Assessment (DACEHTA), 유럽연합의 European Network for Health Technology Assessment (EUnetHTA), 호주의 Pharmacy Benefits Advisory Committee (PBAC), 캐나다의 The Canadian Agency for Drugs and Technologies in Health Care (CADTH), 미국의 Patient-Centered Outcomes Research Institute (PCORI) 등을 설립하여 운영하고 있다[91011]. 그리고 이들 기관들의 2가지 주된 활동 (비용대비 효과평가와 관련 근거생성)을 이루기 위해서는, 국민 대상의 보건의료 서비스 관련 전산자료의 활용이 필요함을 강조하고 있다[11].
이상의 선진국들의 움직임 중에 있어, 미국은 우리나라의 행위별 수가제도와 유사한 의료보험 체제를 가지고 있으면서, 1999-2009년간 136%란 의료비 상승 추세를 억제하고[5], 분절화된 의료제공 체제를 개혁하려는 오바마 정권의 최근 움직임은 우리에게 시사하는 바가 크다. 이런 점들을 감안하여 미국의 CER 관련 동향을 집중적으로 살펴보고자 한다.
미국에서 CER을 통해 보건의료 문제를 해결하려는 초창기 생각들은 Federal Coordinating Council for Com-parative Effectiveness Research(이하 합동위원회)가 2009년 6월 30일 대통령과 의회에 제출한 "Report to the Present and the Congress" (RPC) 보고서에 잘 제시되어 있다[12]. 이 보고서는 2009년 2월 17일 오바마 대통령이 서명한 The American Recovery and Reinvestment Act (ARRA) 법률에 따라, CER 추진을 위해 배정한 11억 달러 기금을 어떻게 배분할 것인가를 검토할 목적으로 작성한 것이다. 이런 배경 때문에, 우리가 가진 보건의료 문제에 대한 대응전략을 수립하는데 중요한 검토 자료인 것이다.
RPC 보고서는 '심장질환과 퇴행성 관절염을 가진 흑인 할머니에게 통증조절로 가장 적합한 치료가 무엇인가?'란 질문을 던지면서 '오늘날 보건의료 현장은 적절한 정보가 없이 흘러가고 있다'는 문장으로 서문을 시작하고 있다. 이렇듯 개별 환자의 특성을 고려한 최상의 치료를 결정하기에는 근거가 부족하다는 오늘날의 보건의료 현실은, 환자 및 그 가족뿐만 아니라, 서비스 제공의 의료진, 의료보험회사, 보건당국 모두가 불만을 가진 불행한 상황인 것이다. 다시 말해서, 해당 보고서 제출 당해 년도에 국민 의료비지출이 국민총생산의 17.6%를 차지한다는 미국의 상황을 넘어서[11], 오늘날 모든 국가가 당면하는 보건의료 문제의 실상인 것이다. 이를 극복하기 위하여 추진하려는 CER은 환자의 개별 특성을 감안하여 의료진과 환자가 최선의 결정을 할 수 있도록 관련 정보를 제공하는 것을 목표로 삼고 있다.
합동위원회는 CER 추진에 관하여 이해당사자들의 다양한 의견을 공개적으로 수렴하는 과정을 거쳤는데, 이 때 도출한 의견 중에는 질 높은 객관적인 정보가 있어야만 올바른 의사결정을 할 수 있다는 발언이 있었다. 이상의 다양한 의견들을 근거하여, 합동위원회는 CER 추진을 위한 운영기금을 4가지 영역(관련 연구, 인력양성, 자료인프라 구축, 정보확산)에 투입하되, 이중 자료인프라 구축을 최우선적으로 추진해야 한다고 결론을 내었다(Figure 1). 여기서 CER 관련 자료인프라 구축을 위해서는, 1) 기존의 구축된 자료들 간의 네트워크를 개발하고, 2) 행정기관 및 의료기관의 자료를 개별 환자 중심으로 연결시킨 데이터베이스를 구축하며, 3) 환자 등록사업을 펼치는 것 등을 추진하는 것으로 명시하고 있다.
RPC 보고서에 따라 예산을 배분 받은 3 곳의 연방정부 산하기관(National Institutes of Health [NIH], Agency for Health Research and Quality [AHRQ], Office of the Secretary of the US Department of Health and Human Services)의 하나인 AHRQ는 이후 미국 연방정부 산하기관이 관리하고 있는 각종 보건의료 데이터베이스를 중심으로 DARTnet (Distributed Ambulatory Research in Therapeutics Network)을 구축하였다[13]. 또한 AHRQ의 지원을 받은 AcademyHealth는 Electronic Data Methods Forum을 통해 전자임상자료의 수집, 합성, 분배를 위한 HMO Research Network을 구축하고 있다[14]. 또 하나의 지원기관인 NIH는 지역사회 개원의사들을 연결시키는 Practice-based Research Networks을 구축하였으며[15], 이를 이용하여 환자 중심의 진료에 필요한 연구에 사용하고 있다[16].
앞서 언급한 ARRA 법안에 따라 2009년 6월에 제출된 또 하나의 보고서가 있는데, 미국의학한림원(Institute of Medicine, IOM)이 작성한 'Initial national priorities for comparative effectiveness research' 보고서이다[17]. 여기에는 CER 목적 달성을 위해 수행할 연구의 우선순위 목록을 제시하는 것이 주된 내용이지만, CER 추진을 위한 10가지 권장사항도 같이 제시하고 있다. 이 중 하나로, 대규모의 임상 및 행정 자료의 네트워크 개발이 필요함을 강조하고 있다. 이후 IOM은 2010년 6월 The Community Health Data Forum, 2011년 6월 The Health Data Initiatives Forum을 주최하여 다양한 이해당사자들의 의견을 수렴하는 토론회를 가졌다[18]. 또한 CER 연구에 필요한 하부체계에 있어 전자의무기록지(electronic health records, EHRs)를 포함한 임상정보체계들(clinical information systems) 구축에 대한 워크샵 도출 내용을 정리하여 2011년도에 보고서를 제출하였다[19]. 그리고 2014년도에는 임상시험 자료들을 상호활용하는 운영체계에 대하여 보고서를 작성하였다[20].
이상의 CER 활성화를 위한 방향과 기초적인 인프라가 정해지면서, CER 추진을 본격화하기 위하여 비영리, 비정부 단체인 PCORI 기구를 2010년 출범하였다. 이 기구의 설립을 위하여 오바마 대통령은 2010년 3월 23일 The Affordable Care Act에 서명하였다[11].
이상의 미국 동향을 정리해 보면, 보건의료 개혁을 위해 CER이 원하는 성과를 내려면 대규모 임상진료 자료들을 활용하는 것을 최우선 전략임으로 결정한 다음, 연방 행정당국은 하드웨어적인 체계를 구축하고, 비영리 학술단체인 IOM은 소프트웨어적인 내용들을 만들어 내고 있으며, PCORI란 비영리, 비정부단체가 이것들을 조율토록 진행하고 있음을 확인하였다.
특히 미국에서 네트워크 구축이 유달리 활발하게 이루어진 배경에는 미국의료 개혁의 핵심 요소로 건강정보기술(health information technology)을 선정하였기 때문이다. 즉, ARRA 법을 통해 EHR 활용을 위한 논의가 촉발된 것이다[21]. 이에 따라, 지역 소속의 의료기관이 구축하는 EHR을 연계하는 조직체(Regional Hospital Information Organizations)를 구성하고[22], 지역주민의 보건의료 정보를 교환하는 체계를 갖추어, 지역주민의 질병치료와 보건증진에 기여하고 있다. 또한 이러한 정보연계는 임상연구의 활성화와 보건의료 인력양성에도 활용하고 있다[23]. 이렇게 EHR을 진료에 필요한 근거를 생성하는데 적극 활용하려는 시도는 캐나다[24], 영국[25] 등 다른 선진국들에서도 활발히 이루어지고 있다. 국내에서도 EHR을 이용하여 임상진료에 필요한 근거들을 알아내려는 시도들이 진행 중이다[26].
그러나 보건의료 문제해결을 목적으로 기존의 데이터 자료를 CER에 활용하려면, 다음 3가지 주요 장애물을 넘어야 한다[17]. 첫째로 다른 용도로 만든 여러 자료들을 서로 연결시킬 구조로 탈바꿈시켜야 한다. 이는 전산체계상의 문제로써, 정보처리 기술발전과 함께 극복할 수 있을 것으로 본다[27]. 둘째로 환자 개인정보의 보호를 확보하는 것이다. 이는 사회윤리에 관한 문제로써, 보건행정 당국의 법적 장치 확보 및 개선 등의 노력이 필요하다[28]. 그러나, 각종 정보들을 연계해야만 CER의 목적을 달성할 수 있기 때문에[13], 연계를 행하는 연구자가 관련 연구윤리를 능동적으로 준수해야 한다[29]. 셋째로 각각의 자료관리자들이 적극 참여토록 유도하는 것이다. 이는 선진국의 예에서 보듯이, 공익을 우선한다는 차원에서 보건행정 당국의 전향적인 자세 변화가 있어야 극복할 수 있을 것이다.
앞서 미국을 중심으로 보건의료 문제해결을 위한 동향을 살펴보았다. 선진국들의 움직임은 한정된 의료자원을 효율적으로 분배하려는 고민이라고 달리 해석할 수 있다. 이런 이유 때문에, 전세계적으로도 CER을 적극 수용하는 추세를 보이고 있다[30]. 가속도가 붙은 고령화와 NCD 질병부담이 증가하고 있는 우리나라도 예외는 아니며, 우리가 가진 장점들을 최대한 살려야 한다. 다행히 우리나라는 전국민 의료보험 단일 체계를 가지고 전산망 확보에서 우위를 점하고 있어, CER을 통해 우리가 가진 보건의료 문제를 해결함을 보여줄 모범적 국가의 핵심 인프라를 이미 갖추고 있다는 점에서, 보건의료 관련자들의 현명한 결단과 적극적 실행만이 남아 있을 뿐이다.
진료현장을 반영하는 의학적 근거를 생성하는 연구가 선진국을 중심으로 활성화되고 있다. 한 예로, 약품이 품목허가를 받기 위해 수행된 임상시험은 선택된 환자를 대상으로 수행된 것이 대부분이어서, 다양한 특성을 가진 환자들이 존재하는 진료현장을 제대로 반영하지 못한다. 따라서, 일상적인 의료서비스에 적용될 수 있는 근거를 제공할 수 있는 연구방법의 하나로 빅데이터의 활용이 관심을 끌고 있다. 우리나라는 병원의 의무기록, 건강보험청구기록, 통계청자료 등 많은 자료가 이미 전산화되어 있어, 이런 빅데이터를 활용하여 보건의료문제를 해결하는 것이 가능하다. 본 논문은 선진국의 보건의료분야 빅데이터 활용 정책을 소개한 것으로, 향후 이 분야 연구에 방향성을 제시하고 있다.
[정리: 편집위원회]
Figures and Tables
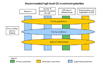 | Figure 1The high level office setting (OS) investment priorities recommended by the Congress of USA. CER, Comparative Effective Research. From Figure 3 in Federal Coordinating Council for Comparative Effectiveness Research. Report to the president and the congress [Internet]. Washington, DC: Department of Health and Human Services; 2009 [12]. |
References
1. Beaglehole R, Bonita R, Horton R, Adams C, Alleyne G, Asaria P, Baugh V, Bekedam H, Billo N, Casswell S, Cecchini M, Colagiuri R, Colagiuri S, Collins T, Ebrahim S, Engelgau M, Galea G, Gaziano T, Geneau R, Haines A, Hospedales J, Jha P, Keeling A, Leeder S, Lincoln P, McKee M, Mackay J, Magnusson R, Moodie R, Mwatsama M, Nishtar S, Norrving B, Patterson D, Piot P, Ralston J, Rani M, Reddy KS, Sassi F, Sheron N, Stuckler D, Suh I, Torode J, Varghese C, Watt J. Lancet NCD Action Group. NCD Alliance. Priority actions for the non-communicable disease crisis. Lancet. 2011; 377:1438–1447.

3. Beaglehole R, Bonita R, Horton R, Ezzati M, Bhala N, Amuyunzu-Nyamongo M, Mwatsama M, Reddy KS. Measuring progress on NCDs: one goal and five targets. Lancet. 2012; 380:1283–1285.

4. Ahn YO. Concepts and necessity of preventive medical services for the 21st century. J Korean Med Assoc. 2011; 54:246–249.

5. Manchikanti L, Falco FJ, Boswell MV, Hirsch JA. Facts, fallacies, and politics of comparative effectiveness research: Part I. Basic considerations. Pain Physician. 2010; 13:E23–E54.
6. Organization for Economic Cooperation and Development. Health at a glance 2009: OECD indicators (Korean version). Seoul: OECD/Korea Policy Centre, Korea;2010. cited 2014 Mar 3. Available from: http://www.oecd-ilibrary.org/social-issues-migration-health/health-at-a-glance-2009_9789264105133-ko;jsessionid=6qp8q6ndek529.x-oecd-live-02.
7. Bae JM, Park BJ, Ahn YO. Perspectives of clinical epidemiology in Korea. J Korean Med Assoc. 2013; 56:718–723.

8. Congress of the United States Congressional Budget Office. Research on the comparative effectiveness of medical treatments. Washington, DC: The National Academies Press;2007.
9. National Evidence-based Healthcare Collaborating Agency. Strategies and direction of comparative effectiveness research in Korea [Internet]. Seoul: National Evidence-based Healthcare Collaborating Agency;2012. cited 2014 Mar 3. Available from: http://www.neca.re.kr/center/researcher/report_view.jsp?boardNo=GA&seq=69&q=63706167653d3226626f6172644e6f3d474126736561726368436f6c3d2673656172636856616c3d2673656172636853596561723d2673656172636845596561723d.
10. Chalkidou K, Tunis S, Lopert R, Rochaix L, Sawicki PT, Nasser M, Xerri B. Comparative effectiveness research and evidence-based health policy: experience from four countries. Milbank Q. 2009; 87:339–367.

11. Keckley PH, Coughlin S, Gupta S, Vasquez C. Comparative effectiveness research in the United States: update and implications [Internet]. Washington, DC: Deloitte Center for Health Solutions;2011. cited 2014 Mar 3. Available from: https://www.deloitte.com/assets/Dcom-UnitedStates/Local%20Assets/Documents/Health%20Reform%20Issues%20Briefs/US_CHS_ComparativeEffectivenessResearchintheUS_062711.pdf.
12. Federal Coordinating Council for Comparative Effectiveness Research. Report to the president and the congress [Internet]. Washington, DC: Department of Health and Human Services;2009. cited 2014 Mar 3. Available from: http://www.tuftsctsi.org/~/media/Files/CTSI/Library%20Files/FCC%20for%20CER%20Rpt%20to%20Pres%20and%20Congress_063009.ashx.
13. Pace WD, Cifuentes M, Valuck RJ, Staton EW, Brandt EC, West DR. An electronic practice-based network for observational comparative effectiveness research. Ann Intern Med. 2009; 151:338–340.

14. Holve E, Segal C, Lopez MH, Rein A, Johnson BH. The Electronic Data Methods (EDM) forum for comparative effectiveness research (CER). Med Care. 2012; 50:Suppl. S7–S10.

15. Williams RL, Shelley BM, Sussman AL. RIOS Net clinicians. The marriage of community-based participatory research and practice-based research networks: can it work? A Research Involving Outpatient Settings Network (RIOS Net) study. J Am Board Fam Med. 2009; 22:428–435.

16. Brown AE, Pavlik VN. Patient-centered research happens in practice-based research networks. J Am Board Fam Med. 2013; 26:481–483.

17. Committee on Comparative Effectiveness Research. Initial national priorities for comparative effective research. Washington, DC: National Academies Press;2009.
18. Institute of Medicine. The Health Data Initiative [Internet]. Washington, DC: Institute of Medicine;c2014. cited 2014 Mar 3. Available from: http://www.iom.edu/Activities/PublicHealth/HealthData/.
19. Olsen LA, Grossman C, McGinnis JM. Institute of Medicine (U.S.) Roundtable on Value & Science-Driven Health Care. Learning what works: infrastructure required for comparative effectiveness research: workshop summary. Washington, DC: National Academies Press;2011.
20. Institute of Medicine. Discussion framework for clinical trial data sharing: guiding principles, elements, and activities. Washington, DC: National Academies Press;2014.
21. Gluck ME. Is health information technology associated with patient safety in the United States? Find Brief. 2009; 12:1–3.
22. Hollar DW. Progress along developmental tracks for electronic health records implementation in the United States. Health Res Policy Syst. 2009; 7:3.

23. Williams RL, McPherson L, Kong A, Skipper B, Weller N. PRIME Net clinicians. Internet-based training in a practice-based research network consortium: a report from the Primary Care Multiethnic Network (PRIME Net). J Am Board Fam Med. 2009; 22:446–452.

24. Sicotte C, Pare G, Moreault MP, Lemay A, Valiquette L, Barkun J. Replacing an inpatient electronic medical record. Lessons learned from user satisfaction with the former system. Methods Inf Med. 2009; 48:92–100.
25. Boddy D, King G, Clark JS, Heaney D, Mair F. The influence of context and process when implementing e-health. BMC Med Inform Decis Mak. 2009; 9:9.

26. Song MH, Park DK, Lee YH. Medical informatics methods for the clinical evidence extraction. J Korean Med Assoc. 2012; 55:741–747.

27. Park RW. A clinical research strategy using longitudinal observational data in the post-electronic health records era. J Korean Med Assoc. 2012; 55:711–719.

28. Lee LM, Gostin LO. Ethical collection, storage, and use of public health data: a proposal for a national privacy protection. JAMA. 2009; 302:82–84.

29. Yoo SH, Lee J, Lee K, Lee I, Bae JM. Ethical principles and practice guidelines concerning the usage of public database for medical researches. J Korean Med Assoc. 2013; 56:1031–1038.

30. Balkrishnan R, Chang J, Patel I, Yang F, Merajver SD. Global comparative healthcare effectiveness research: evaluating sustainable programmes in low & middle resource settings. Indian J Med Res. 2013; 137:494–501.




 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download