Abstract
Aging is an universal phenomenon and irreversible syndrome, and its damage occurs to molecules (DNA, proteins, and lipids), to cells, and to organs. Hematopoietic tissue intrinsically has a very high turnover rate; nonetheless, it is not protected from age-related insults. Aging results in the overproduction of myeloid cells, which leads to a pro-inflammatory environment. The selective expansion of a clonal subtype of intrinsically myeloid-biased hematopoietic stem cells (HSCs) is a central component of hematopoietic aging. In the present study, the stress-response and inflammatory genes were up-regulated with age whereas chromatin remodeling and DNA repair genes were down-regulated. Accumulated DNA damage, loss of DNA repair, and epigenetic deregulation are the main molecular mechanisms underlying age-dependent HSC decline. The most profound effect is seen in the adaptive immune system with a marked decline of lymphoid function in the elderly. Mitochondrial dysfunction and mitochondrial DNA mutation are another important contributor to the aging of HSCs, which have been regarded as a part of the mitochondrial theory of aging. Generation of reactive oxygen species during mitochondrial adenosine triphosphate generation, results in damage to mitochondria and mitochondrial DNA, the latter leading to deleterious mutations that directly caused the functional decline of human. Studies have pointed toward intrinsic deficits in HSC function, and epigenetic deregulation as the important contributing factors behind hematopoietic decline and malignancy during aging. Aging-related changes such as hematopoiesis are reflected by a decline in marrow cellularity, increased risk of anemia, marrow failure syndrome, and myeloproliferative neoplasms as well as a decline of adaptive immunity.
노화는 시간의 흐름에 따라 세포, 조직, 기관계 및 개체에 축적되는 변화이다[123]. 노화는 불량하고, 진행적이며, 전반적으로 나타나는 비가역적인 증후군이다. 노화에 의한 손상은 DNA, 단백질 및 지질 같은 분자수준에서 세포 및 장기(기관)까지 광범위하게 발생한다. 고령자에서 흔히 발생하는 질병인 관절염, 골다공증, 심장병, 암 및 알츠하이머병 등은 노화에 의한 변화 자체와는 구별되어야 한다. 그러나 노화 자체로 인해 질병의 유병률이 증가하는 것은 주지의 사실이다[4]. 노화이론은 두 가지로 구분할 수 있는데 그 중 하나는 예정된 노화(programmed aging)이다. 이는 그 개체를 조정하는 어떤 기작에 의해 발생하는 것으로 성적 성숙과 배아발달단계 동안의 세포분화와 같은 생의 단계에서 나타나는 기능이상과 같은 것이다. 이와 반대로 마모(wear and tear)에 의한 노화는 어떤 특정한 운영프로그램의 결과가 아니고 방사선, 화학물질, 중금속, 유리기(free radicals), 가수분해, 당화반응 및 이황화결합 등 다양한 환경유해요인에 의한 결과로 나타난다. 이러한 손상은 유전자, 단백질, 세포막, 효소기능 및 혈관 등에 영향을 준다.
조혈기능을 갖는 골수도 나이를 먹으면서 변화를 겪는다. 조혈줄기세포는 분열이 매우 빠른 조직이나, 노화 관련 손상을 피할 수는 없다. 조혈계의 노화는 골수이형성증후군과 같은 골수구계 질환 및 종양의 증가 등으로 나타나며, 아울러 적응면역계(adaptive immune system) 기능저하를 야기한다. 이는 주로 림프구 기능저하와 관련이 있고 아울러 골수구계 세포의 과증식과도 연관이 있다. 조혈줄기세포는 일생 동안 혈관계에 존재하지만 노화와 관련된 기능저하가 발생한다[5].
골수 내 조혈조직의 비율은 생후에는 대략 90%였던 것이, 30세경에는 50%, 70세경에는 30%로 감소한다. 흉선에서도 역시 비슷한 경향을 보이는데, 단 흉선에서의 퇴화는 더욱 조기에 시작되며 이는 림프조직의 감소로 인한 해부학적 변화와 더불어 새로운 T 세포의 지속적인 생성 감소라는 기능적인 변화가 동반된다. 골수와 흉선에서의 지방 침윤은 조혈조직의 감소를 초래한다[6]. 비록 노화에 따른 골수의 변화에 대해서는 명확한 설명이 되어도, 이러한 변화를 조절하는 정확한 기전은 아직 알려지지 않았다. 예를 들어, 나이에 따라 골수지방이 증가하는 것이 노화의 원인인지 혹은 노화의 결과인지는 명확하지 않다. 마찬가지로 흉선에서도 골수와 조직학적으로 유사한 변화가 일어나는데 이러한 변화가 골수와 관련이 있는지 역시 아직 밝혀지지 않았다.
나이가 듦에 따라 조혈계에도 임상적으로 의미 있는 변화들이 나타나는데, 적응면역계(adaptive immune sys-tem)의 기능저하, 자가면역질환의 발생 증가, 혈액종양의 증가, 노화관련 빈혈의 증가 등이 그 예이다[78]. 다른 조직과 마찬가지로 조혈계도 노화에 따라 스트레스 및 손상으로부터 정상 항상성으로 복귀하는 능력 및 재생능력이 감소한다. 조혈계 노화의 기저 기전은 다양하고, 내적 및 외적 요인뿐만 아니라 주변환경 노화도 같이 동반되어 조혈조직의 기능저하와 세포형성의 장애를 초래하게 된다. 한편 가장 초기 조혈줄기세포 분획에서 노화 의존적 세포 및 분자수준의 이상은 노화에 따른 조혈기능이상을 가져온다[910].
조혈모세포의 개체 발생에 대해 살펴보면, 태아 시기에는 다양한 기관에서 조혈작용이 일어나지만, 출생 후에는 골수가 유일한 혈구생성기관이 된다. 현재까지 밝혀진 바에 따르면 초기 조혈모세포는 대동맥-생식선-종신과 난황주머니에 있음을 알 수 있다. 재태 5-6주 동안에는 난황주머니에서 유래한 전구세포들이 태아의 간에 정착하여 나머지 재태 기간 동안 조혈작용을 담당하게 된다. 재태 7주부터는 비장에서 전구세포들이 정착하여 재태 12-14주부터는 태아순환 내 다능줄기세포가 관찰된다. 재태 8-9주에는 난황주머니 내 조혈모세포는 소멸되고 흉선에서 T 세포 생산이 시작된다. 태아의 간에서 유래된 T 전구세포들이 흉선으로 이동하여 성숙과 분화 단계를 걸친다. 재태 14주
부터 골수강 내에 조혈모세포가 출현하며 출생 시까지 골수가 가장 주요한 조혈기관이 된다[11]. 노화에 따라 줄기세포가 양적 및 질적으로 쇠퇴하여 결국 항상성을 충족시키지 못한다는 통념과 달리, 적어도 쥐과 동물의 조혈모세포의 노화에 따른 변화는 예외적이다. 초기실험 결과, 연속적으로 이식된 골수가 15-20년간 조혈기능을 복원할 수 있음이 입증되었으며, 특히 재생된 기존 골수 능력은 신생 골수보다 뛰어나다고 밝혀졌다. 그 이후로 연구자들은 다양한 방법을 통해 어린 쥐보다 늙은 쥐에서 조혈모세포 빈도가 대략 2배 높다고 결론 내렸다[12]. 일부 연구들은 조혈모세포가 노화함에 따라 림프구계보다는 골수구계로 분화하는 경향이 높아짐을 보여주었다. 이는 연령대가 높아지면서 상대적으로 호중구 수가 증가하고 림프구는 감소하는 것과 연관된다[13].
노화에 따른 골수의 변화 중 가장 명확한 것은 세포질이 감소하는 것이다. 일반적인 상황에서는 골수가 조혈의 유일한 장소이지만, 병적인 상태에서는 골수의 보상기전에 의한 조혈보다 더 빠른 속도의 조혈 작용이 필요하기 때문에 간, 지라, 림프절에서도 조혈이 일어난다. 사춘기 이전에는 뼈 전체에서 조혈이 활발하게 일어나지만, 18세경에는 척추, 늑골, 흉골, 두개골, 골반, 상완골 및 대퇴골의 전단부만이 조혈기능을 하며, 다른 조직의 골수는 지방성분으로 대체 된다. 40세경이면 흉골, 갈비뼈, 골반과 척추뼈의 골수는 동일한 비율의 조혈조직과 지방조직으로 이루어지며 세포질의 양은 점차적으로 감소한다. 65세경에는 골수세포질의 양은 30%로 감소하며, 이와 함께 골수의 지방 성분이 늘어난다. 노화와 관련하여 불균형적 뼈의 재구성과 골다공증은 조혈에 부정적인 영향을 끼치는 지주골 손실을 유발한다. 골수 지방 자체는 노년층에서 흔히 발견되는 골다공증의 빈도와 강도와 관련성이 있다. 편향된 X염색체의 비활성화, 텔로미어의 단축, 미토콘드리아 DNA 변이 및 미소핵 형성 등의 여러 질적인 변화가 노화와 관련하여 조혈모세포에서 나타남이 밝혀졌다. 또한 성장호르몬의 생산이 나이에 따라 감소하는 것은 골수 지방 침윤과 관련이 있는 것으로 보이는데, 이는 늙은 쥐에게 성장 호르몬을 투여했을 때 골수 지방이 감소하고 조혈조직이 증가함으로 알 수 있다.
빈혈은 노년층에서 중요한 건강문제 중의 하나이다. 이는 높은 발병률뿐만 아니라 삶의 질 감소, 우울증, 넘어짐, 다기관 기능장애 등과 관련하여 발생하는 높은 사망률 때문이다. 세계보건기구(World Health Organization, WHO)의 빈혈기준(남자, 13 g/dL 이하의 헤모글로빈 수치; 여자, 12 g/dL 이하의 헤모글로빈 수치)에 해당되는 노년층은 사망률이 증가하는 경향이 있다. 하지만 WHO의 기준은 인종적인 변인은 고려하지 않는다. 특히 아프리카계 미국인들은 원래 낮은 헤모글로빈 수치를 가지고 있으며, 이는 어떠한 악영향도 끼치지 않는다. 이와 관련되어 71-82살인 아프리카계 미국인들과 1,583명의 유럽계 미국인들을 분석한 실험결과, WHO기준에 의하여 분류된 빈혈증으로 정의된 사람들 중 사망률과 연관성이 있어 보이는 사람들은 전자가 아닌 후자 집단에 포함되어 있었다[14]. 이와 같은 인종 간 차이가 발생하는 원인은 밝혀지지 않았지만 이러한 차이는 결코 무시할 수 없다. 일반적으로 아프리카계 미국인들이 빈혈에 의하여 기능적인 상태와 사망률에 악영향을 받기 시작하는 헤모글로빈 수치는 유럽계 미국인보다 1 g/dL 정도 낮다. 빈혈증 진단의 기준을 세울 때 고려해야 할 요인 중에는 나이도 포함된다. 예를 들어 노년층의 여자는 헤모글로빈 수치가 12-12.9 g/dL일 때보다 13-15 g/dL일 때 더 좋은 육체적 활동과 기능을 갖는다[15]. 이는 빈혈증 진단기준인 12 g/dL가 노년층 여자에게는 너무 낮음을 시사하고 있다. 그럼에도 불구하고 WHO의 빈혈기준은 최근까지 유행병학적 설문조사와 많은 임상 연구실에서 가장 많이 쓰이는 기준으로 남아있다.
정상적인 노화과정에서 혈중 백혈구 수나 분획의 차이는 관찰되지 않지만, 노인에서는 호중구 수가 증가되기도 한다. 더욱이, 몇몇 호중구의 질적 결함이 나타나기도 하는데, 예를 들어 용해성 신호, 불완전한 식균작용, 그리고 자극부위로 호중구 이동의 감소는 노화와 연관 있다. 이에 대한 정확한 기전은 밝혀지지 않았지만, 이는 노화에 따른 액틴 세포골격과 백혈구 수용체의 반응성 변화와 관련 있다[16]. 40세 초기부터 소량의 혈중 림프구 감소가 관찰되며, 남은 수명 동안 점차적으로 감소한다. 노인에서는 T 세포 기능의 질적인 변화 역시 증명되었다[17].
현재까지는 노화가 혈소판 수에 미치는 영향에 대한 분석은 선택된 집단에서 단면 자료를 이용한 결과들로만 제한되었다. 이 자료에 따르면 노화에 따른 혈소판 수 변화는 관찰되지 않았다[18].
Rossi 등[8]과 Rossi 등[21]은 젊은 조혈줄기세포와 늙은 조혈줄기세포에서 노화와 연관된 907개의 유전자 발현 차이를 발견하였으며 이들 유전자는 대부분 혈구세포의 분화와 관련된 것이었다. 림프구로 분화를 유도하는 유전자의 발현은 노화에 따라 감소되는 반면 골수구계 분화와 관련된 유전자 발현은 증가한다. 이러한 현상은 골수구계 백혈병에서 이상 발현되는 유전자 변이와 연관성이 있다. 생쥐 실험에서 2개월, 6개월, 12개월 및 21개월 생쥐 유래 조혈줄기세포를 분석한 결과 약 1,500개의 유전자가 노화와 관련하여 증가됨이 관찰되었고, 아울러 비슷한 수의 유전자가 감소되었다. 이들 유전자를 기능별로 묶어 분석하여 보면 증가된 유전자는 대부분 스트레스 및 염증 반응 관련 유전자들이었고, 감소된 유전자들은 기능적으로 염색질(chromatin) 수복 및 DNA 복구와 관련된 유전자들이었다.
미토콘드리아는 adenosine triphosphate (ATP)를 생성하는 발전소인데, ATP를 생성하는 과정에서 필연적으로 활성산소 같은 폐기물이 발생한다. 미토콘드리아 유전체는 인트론이 없고 복구기능이 매우 미약하여 ATP 생성 때 발생하는 활성산소에 의해 유전변이가 쉽게 발생한다(Figure 2). 이러한 유전변이는 미토콘드리아 기능저하 및 이상을 초래하여 결국 세포나 조직이 원래 기능을 상실하게 된다. 이것이 미토콘드리아 변이에 의한 노화의 핵심 기전이다(Figure 1). 최근의 연구에 의하면 미토콘드리아 유전체의 유전변이는 조기노화를 유발함이 동물실험에서 증명되어 미토콘드리아 기능이상이 노화의 중요 인자로 자리잡게 되었다[11]. 이러한 미토콘드리아 유전체의 유전변이는 더 이상 분열하지 않는 유사분열 후의 세포(뇌, 신경, 근육세포 등)에서 ATP 생성과 동시에 발생하는 활성산소의 지속적인 자극으로 유전변이가 발생하고 이들 유전변이가 축적되어 쉽게 미토콘드리아 기능이상이 초래되어, 세포 및 조직 기능 상실의 주요 원인이 된다고 알려져 있다[12]. 그러나 본 저자의 연구결과에 의하면 조혈줄기세포와 같은 빠르게 분화하는 세포 및 조직에서도 이러한 미토콘드리아 유전변이가 축적되고 이들 유전변이가 자가복제 및 분화과정에서도 전달됨을, 다양한 연령의 공여자 조혈줄기세포 연구를 통하여 규명하였다[2324]. 이러한 연구는 잘 계획하여 실험된 단일세포 수준 연구를 통하여 밝혀졌는데, 제대혈 유래 조혈줄기세포는 미토콘드리아 유전체 변이를 갖는 세포의 비율이 2% 이하로 매우 낮았으나 성인 골수유래 조혈줄기세포는 전체 세포 중 약 25%에서 이미 미토콘드리아 유전체 변이가 발생하여 노화에 따른 조혈줄기세포 기능저하에 미토콘드리아 유전체 변이가 큰 요인으로 작용하고 있음을 보고한 바 있다[2324].
조혈줄기세포가 기능을 유지하기 위해서는 골형성세포나 파골세포 등의 주변 세포군(niche)의 지원이 매우 중요하다. 노화 등에 의해 조혈줄기세포 주변 환경 변화가 초래되면 줄기세포는 그 본래의 기능을 유지하기 힘들게 된다. 노화에 의한 줄기세포 주변 환경이 변화하면 줄기세포 homing 능력저하 및 분열·분화능이 저하된다. 뿐만 아니라 조혈줄기세포를 특정 세포군으로만 분화시키게 되는데, 특히 주변환경의 노화는 조혈줄기세포를 보다 많은 골수구계 세포로 분화시키게 된다[25].
응고계 인자중 von Willebrand 인자, 섬유소원(fibrinogen), fibrinopeptide A 및 tissue plasminogen activator antigen 등은 나이가 듦에 따라 증가한다. 항트롬빈 III는 남성에서는 노화에 따라 감소하고 여성의 경우 폐경기 이후에 증가한다. 노년층의 환자는 와파린에 대하여 지나친 항응고 반응을 보인다. 항응고제 치료에 의한 출혈합병증도 노년층에서 쉽게 일어난다[26].
흉선은 노화에 의한 외부적인 변화가 일어나기 전에 특징적인 퇴화를 겪는다. 그 중 하나가 신생 T 림프구 발생의 감소이다. 그럼에도 불구하고, 전체 림프구수는 크게 감소하지 않는데, 이는 순환하는 T 림프구가 신생 T 림프구의 감소에 의한 부족함을 보충해주기 때문이다. 흉선 퇴화의 원인으로는 T 줄기세포의 노화, T 림프구 수용체의 베타 유전자의 재배열 과정 중의 결함, 자기펩타이드 제시 흉선상피세포의 감소 및 흉선 자극 사이토카인의 감소 때문이다[27]. 흉선위축과 흉선생성 감소는 흉선억제 사이토카인에 의하여 상향조절되는 활발한 과정이라고 추측되며 이는 주변부의 T 림프구 기능변형을 초래한다. 흉선 주변부에서 감소하는 신생 T 세포와 노화된 기억 T 세포의 증가로 인하여 노인은 새로운 항원에 대하여 반응이 더디며, 백신에 대한 반응도 결함이 있다. 노화에 따른 림프구 기능 변화에 대해 간단히 말하자면 T 세포 집단의 비중이 기억 T 세포로 편중되는 경향이 있다. 기억 T 세포는 항원 노출에 의하여 복제 노화가 발생한다. 신생 T 세포의 상대적, 그리고 절대적 감소와 기능적 결함이 있는 노화된 기억 T 세포의 축적에 의해 노인의 일차, 이차 면역반응은 감소한다. 한편 혈중 사이토카인 중 IL-6 및 TNF-α는 대표적으로 나이가 듦에 따라 증가한다.
결론적으로 조혈모세포 및 조혈계 노화는 다른 조직이나 장기와 마찬가지로 항상성 유지 기능저하 및 손상 복구기능 미비를 동반하게 되어 세포손실과 세포재생 사이의 불균형을 초래하게 된다. 따라서 조혈계 노화는 림프구 계열 세포의 감소에 의한 면역능 저하, 골수구계열 세포의 과도한 분화에 의한 골수증식성질환의 증가 및 조혈줄기세포 자체의 기능저하에 의한 골수부전 등으로 인하여 감염, 염증 및 종양 발생 증가의 원인이 된다(Figure 3).
본 종설은 노화에 따른 조혈 기능의 변화를 조혈줄기세포로부터 혈구세포, 흉선 기능, 응고계에 이르기까지 다각적으로 분석함과 동시에 유전자 및 미토콘드리아 DNA 수준에서도 고찰하고 있다. 또한 분열속도가 빠르고, 노화 측면에서 많이 인지되지 않고 있던 조혈계 세포도 다른 장기, 세포와 마찬가지로 노화 현상이 있음을 제시하고, 조혈계 각 성분의 노화현상을 종합적으로 기술하고 있으며, 조혈계의 노화가 종양이나, 염증 등 다양한 질환을 야기시키는 원인임을 설명하고 있다. 특히, 빠르게 분화하는 조혈줄기세포에서의 미토콘드리아 유전변이의 축적이 조혈기능저하에 미치는 영향을 심도 있게 기술하였다. 노인 인구의 현격한 증가로 노화에 대한 다각적인 연구가 진행되고 있는 현 상황에서 조혈계 노화의 원인과 그에 따른 결과를 조혈줄기세포를 중심으로 과학적으로 접근하여 기술하였다는 점에서 의의가 있는 논문이며, 노인에서의 각종 질환의 발생과 조혈계 노화를 연결지어 관련성을 제시한 의미있는 논문이라고 생각한다.
[정리: 편집위원회]
Figures and Tables
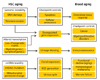 | Figure 1Mechanisms of aging hematopoietic stem cell (HSC) and disease phenotypes. Instability of nuclear and mitochondrial genomes, and their altered transcriptions including epigenetic changes plays an essential role in HSC aging, resulting in the development of aging-related diseases. ROS, reactive oxygen species. |
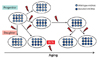 | Figure 2Mitochondrial DNA mutation in hematopoietic stem cells mainly caused by reactive oxygen species during mitochondrial adenosine triphosphate generation. Due to the aging of hematopoietic tissue, clonal expansion of mtDNA mutations was frequently occurred in hematopoietic tissues and blood cells. ROS, reactive oxygen species. |
Acknowledgements
This study was supported by the Leading Foreign Research Institute Recruitment Program through the National Research Foundation of Korea funded by the Ministry of Education, Science and Technology (no. 2011-0030034), and a grant from the National R&D Program for Cancer Control, Ministry of Health & Welfare, Republic of Korea (no. 2013-1320070).
References
1. Beghe C, Wilson A, Ershler WB. Prevalence and outcomes of anemia in geriatrics: a systematic review of the literature. Am J Med. 2004; 116:3S–10S.

2. Hakim FT, Gress RE. Immunosenescence: deficits in adaptive immunity in the elderly. Tissue Antigens. 2007; 70:179–189.

3. Lichtman MA, Rowe JM. The relationship of patient age to the pathobiology of the clonal myeloid diseases. Semin Oncol. 2004; 31:185–197.

4. Bowen RL, Atwood CS. Living and dying for sex. A theory of aging based on the modulation of cell cycle signaling by reproductive hormones. Gerontology. 2004; 50:265–290.
5. Ergen AV, Goodell MA. Mechanisms of hematopoietic stem cell aging. Exp Gerontol. 2010; 45:286–290.

6. Haynes BF, Sempowski GD, Wells AF, Hale LP. The human thymus during aging. Immunol Res. 2000; 22:253–261.

7. Edwards BK, Howe HL, Ries LA, Thun MJ, Rosenberg HM, Yancik R, Wingo PA, Jemal A, Feigal EG. Annual report to the nation on the status of cancer, 1973-1999, featuring implications of age and aging on U.S. cancer burden. Cancer. 2002; 94:2766–2792.

8. Rossi DJ, Jamieson CH, Weissman IL. Stems cells and the pathways to aging and cancer. Cell. 2008; 132:681–696.

9. Beerman I, Maloney WJ, Weissmann IL, Rossi DJ. Stem cells and the aging hematopoietic system. Curr Opin Immunol. 2010; 22:500–506.

11. Charbord P, Tavian M, Humeau L, Peault B. Early ontogeny of the human marrow from long bones: an immunohistochemical study of hematopoiesis and its microenvironment. Blood. 1996; 87:4109–4119.

12. Liang Y, Van Zant G, Szilvassy SJ. Effects of aging on the homing and engraftment of murine hematopoietic stem and progenitor cells. Blood. 2005; 106:1479–1487.

13. Leng SX, Hung W, Cappola AR, Yu Q, Xue QL, Fried LP. White blood cell counts, insulin-like growth factor-1 levels, and frailty in community-dwelling older women. J Gerontol A Biol Sci Med Sci. 2009; 64:499–502.

14. Patel KV, Harris TB, Faulhaber M, Angleman SB, Connelly S, Bauer DC, Kuller LH, Newman AB, Guralnik JM. Racial variation in the relationship of anemia with mortality and mobility disability among older adults. Blood. 2007; 109:4663–4670.

15. Chaves PH, Xue QL, Guralnik JM, Ferrucci L, Volpato S, Fried LP. What constitutes normal hemoglobin concentration in community-dwelling disabled older women? J Am Geriatr Soc. 2004; 52:1811–1816.

16. Rao KM, Currie MS, Padmanabhan J, Cohen HJ. Age-related alterations in actin cytoskeleton and receptor expression in human leukocytes. J Gerontol. 1992; 47:B37–B44.

17. Pawelec G, Akbar A, Caruso C, Solana R, Grubeck-Loebenstein B, Wikby A. Human immunosenescence: is it infectious? Immunol Rev. 2005; 205:257–268.

18. Nilsson-Ehle H, Jagenburg R, Landahl S, Svanborg A, Westin J. Haematological abnormalities and reference intervals in the elderly. A cross-sectional comparative study of three urban Swedish population samples aged 70, 75 and 81 years. Acta Med Scand. 1988; 224:595–604.
19. Taraldsrud E, Grogaard HK, Solheim S, Lunde K, Floisand Y, Arnesen H, Seljeflot I, Egeland T. Age and stress related phenotypical changes in bone marrow CD34+ cells. Scand J Clin Lab Invest. 2009; 69:79–84.
20. Beerman I, Bhattacharya D, Zandi S, Sigvardsson M, Weiss-man IL, Bryder D, Rossi DJ. Functionally distinct hema-topoietic stem cells modulate hematopoietic lineage potential during aging by a mechanism of clonal expansion. Proc Natl Acad Sci U S A. 2010; 107:5465–5470.

21. Rossi DJ, Bryder D, Weissman IL. Hematopoietic stem cell aging: mechanism and consequence. Exp Gerontol. 2007; 42:385–390.

22. Kamminga LM, Bystrykh LV, de Boer A, Houwer S, Douma J, Weersing E, Dontje B, de Haan G. The Polycomb group gene Ezh2 prevents hematopoietic stem cell exhaustion. Blood. 2006; 107:2170–2179.

23. Shin MG, Kajigaya S, McCoy JP Jr, Levin BC, Young NS. Marked mitochondrial DNA sequence heterogeneity in single CD34+ cell clones from normal adult bone marrow. Blood. 2004; 103:553–561.

24. Shin MG, Kajigaya S, Tarnowka M, McCoy JP Jr, Levin BC, Young NS. Mitochondrial DNA sequence heterogeneity in circulating normal human CD34 cells and granulocytes. Blood. 2004; 103:4466–4477.





 PDF
PDF ePub
ePub Citation
Citation Print
Print




 XML Download
XML Download