Abstract
Local ablation has been accepted in many treatment guidelines as a good alternative to curative resection or transplantation for patients with unresectable hepatocellular carcinoma (HCC). The main advantage of local ablative therapy is minimal invasiveness, guaranteeing low morbidity even for the patient with poor hepatic reserve. Furthermore, the therapeutic efficacy of local ablation, especially radiofrequency ablation (RFA), has been shown to be as effective as surgical resection for early-stage (smaller than 3 cm, less than 4 in number) HCC. The long-term outcome after radiofrequency ablation for HCC reported in large series studies were overall survival of 50% to 60% at 5 years and 27 to 32% at 10 years. Major complication rates are 0% to 2.4%. However, controversy remains regarding whether local ablation can replace surgical resection because many retrospective comparative studies have produced conflicting results. Only a well-designed randomized study will be able to clearly answer this long-standing question. During the past decade, many technical advancements in local ablation have been reported, including novel electrodes, thermal protection (i.e., artificial ascites), fusion image guidance, Sonazoid-enhanced ultrasound guidance, and emerging energy sources (i.e., microwaves, High internsity focused ultrasound, Irreversible electroporation). Local ablation is still an evolving technique in the era of minimally invasive treatment for HCC. Many more technical advances are ongoing to enhance the therapeutic efficacy of local ablation. In summary, local ablation will remain a mainstay of non-surgical treatment early stage HCC and play an important role in multidisciplinary approach for HCC management.
간세포암은 세계적으로 여섯 번째로 흔한 악성종양이며 세 번째로 높은 암 사망률을 보이는 종양이다. 대부분 선행된 B형이나 C형간염이 만성간염이나 간경화로 진행된 상태에서 발견된 간세포암에 대해서는 치료전략의 수립이 그리 간단치 않다[1]. 간세포암의 근치적 치료는 수술적 절제나 간이식술로 알려져 있으나, 2/3 이상의 환자에서는 잔여간기능이 나쁘거나 종양의 위치가 좋지 않아 수술적 절제가 쉽지 않고, 간공여자의 부족으로 인해 간이식술도 제한을 받는다. 이런 환자들에 대한 비수술적 치료법들 중 경동맥 간동맥 색전술이나 경피적 국소 소작술이 가장 널리 이용되고 있는데[2345], 이 장에서는 대표적 국소 소작술인 고주파열치료(radiofrequency ablation)의 최신 현황과 전망에 대해 간략히 소개하고자 한다.
간세포암의 국소 소작술에는 고주파(radiofrequency), 에타놀(ethanol), 마이크로웨이브(microwave), 레이저(laser), 냉동요법(cryo) 등 다양한 물리화학적 에너지가 이용되고 있으나, 현재 고주파가 가장 보편적인 에너지원으로 널리 사용되고 있다. 고주파 치료의 원리는 영상유도 하에 간세포암 종괴에 15-17 gauge 바늘형태의 고주파 전극을 삽입한 뒤 고주파 에너지를 가하여 종양 내 온도를 상승시켜 종양을 괴사시키는 방법이다. 고주파 전류(약 480 kHz)는 전극 끝 주위의 조직 내의 이온들을 진동시켜 마찰열을 유발시키며 50-55℃ 정도에서 4-6분 정도 지속하면 비가역적인 조직변성이 초래되고, 60℃ 이상에서는 즉각적인 응고괴사가 일어난다[346].
대부분 경피적으로 간단한 정맥 마취 하에서 10-20분 정도의 소작시간만 소요되므로 수술적 치료가 어려운 대부분의 환자에서도 큰 합병증 없이 시술이 가능하고, 언제든 반복치료가 가능하다. 또한, 에타놀에 비해 치료효과 우수하고, 다른 열 에너지원들에 비해 효과대비 비교적 경제적이며 시술도 비교적 간단하다는 점이 장점이다. 하지만, 현재 개발된 고주파 기기로는 소작 범위에 제한이 있어 종양의 장경이 3 cm 이상인 종양의 경우 국소 재발률이 높다는 것이 가장 큰 단점이며, 혈관이나 담도주위 종양의 치료 시 각각 열씻김 현상(heat sink effect)으로 치료효과가 낮고 담도협착 가능성이 높다는 점도 단점으로 지적된다[2345] .
간세포암에 대한 고주파 열치료의 적응증은 전세계적으로 아직 합의된 바는 없으니 여러 지역 학회별 진료 가이드라인에 따르면 비교적 유사한 기준이 제시되고 있다. 2009년 대한간암연구학회의 가이드라인에서는 단발성 종양은 장경 5 cm 이하, 다발성 종양은 3개 이하이고 장경이 3 cm 이하인 경우를 국소 소작술의 적정한 대상으로 인정하고 있다[6]. 대부분의 아시아 및 구미 가이드라인에서도 3 cm 이하 3개 이하의 종양에 대해 국소 소작술을 권유하고 있으며 이는 1회 소작으로 괴사시킬 수 있는 용적에 아직 제약점이 많기 때문이다[789]. 특히 구미의 가이드라인에서는 일차적으로 수술이 불가능한 환자에 대한 권고사항이었지만, 최근 Barcelona Clinic Liver Cancer (BCLC) 가이드라인에서는 간이식을 고려하지 않는 very early hepatocellular carcinoma(HCC, 2 cm 이하 단일결절)의 경우 수술적 치료에 앞서 국소 소작술을 일차치료로 고려할 수 있다고 새로운 지침을 제안하고 있어 국소 치료의 역할이 더 확대될 가능성이 있다[1]. 한편 경피적 에타놀 주입술(percutaneous ethanol injection)은 이전에 비해 고주파열치료술로 많이 대체된 실정이나 아직도 2 cm 이하의 단일결절이나 고주파열치료술을 시행하기 어려운 부위의 종양에 한해 제한적으로 시행되고 있다[10111213].
대신 3 cm 이상의 간세포암은 미세 혈관 침습과 미세 위성 결절의 개수가 증가해서 고주파열치료 후 국소재발의 위험이 높아 최근에는 3-5 cm 크기의 간세포암에 대하여 경동맥 화학색전술(transarterial chemoembolization, TACE)과 고주파열치료의 병합요법이 권장되고 있다. TACE에 고주파열치료을 추가하면 온열효과에 의해 항암제의 세포막투과성이 향상되어 항암효과가 증진되고 고주파 소작범위에 포함되지 않는 미세 위성 결절을 TACE로 치료할 수 있는 장점이 있다. 또한 TACE에 의한 혈류 차단 효과에 의해 고주파열치료 시 같은 시간에 보다 큰 괴사 영역이 형성된다[14].
시술이 기본적으로 바늘형태의 전극을 간에 삽입하는 과정이 필수적이므로 출혈소인이 높은 환자들의 경우에는 비 적응증이 된다. 모든 시술과정에서 종양과 전극을 잘 관찰가능한 영상유도가 필요하므로 종양 자체가 영상소견에서 잘 보이지 않을 경우도 국소 소작술의 비적응증이다. 마지막으로, 종양이 혈관이나 간문부의 담도에 넓게 닿아 있는 경우에는 각각 열씻김 현상에 의해 종양소작이 덜 되거나, 굵은 간내 담관의 협착을 가져올 수 있어 피하는 게 좋다[234].
그러나 고주파열치료의 절대 적응증은 물론 절대 비적응증을 쉽게 정의하기는 어렵다. 따라서, 종양의 특성에 따른 득과 실을 잘 비교 평가하여 적정한 인공복수나 융합영상 등의 보완기법의 적용여부나 대체치료나 접근 방법 등에 대한 종합적인 고려가 필요하며 이를 위해 다학제적 협동이 필수적이다.
고주파열치료는 전극의 삽입을 위해 경피적, 복강경하, 또는 개복하의 세 가지 경로를 통해 시술이 가능하다. 대부분 최소침습적인 측면을 고려할 때 경피적 경로가 선호되나, 다른 경로를 이용하기도 한다. 그 중 간피막하에 위치하며 복강경 시야가 좋을 경우에는 복강경하 경로를 이용하는 것도 도움이 된다. 한편, 간의 양엽에 종양이 있어 수술적 치료가 어려운 경우에도 개복 하에 큰 종양 부위를 포함한 간은 절제한 후 작은 종양은 개복하 고주파열치료를 시행하는 병합치료도 시행되고 있다[2345].
시술 전 기존의 Computed tomography(CT)나 Magnetic resornance imaginge (MRI)상 발견된 간세포암에 대해 계획초음파(planning ultrasound)를 시행하여 고주파치료가 가능할지를 결정하며, 대부분의 병원에서는 2박 3일 입원한 상태에서 시행한다[15]. 시술 당일 금식 하에 대부분 아시아에서는 초음파 유도 하에 시술하며, 환자체형이 비만하여 초음파유도가 용이하지 않은 구미에서는 CT나 MRI 유도하의 시술을 시행하기도 한다. 초음파 유도 하에 고주파 전극을 종양의 계획된 위치에 삽입하고 고주파 generator의 전원을 켜서 고주파 에너지를 가하면 전극의 끝을 중심으로 고주파에너지가 전달되면서 종양이 치료된다. 종양이 가온되게 됨에 따라 소작부위에 미세기포가 발생하고 이를 초음파상 모니터 하면서 치료를 진행한다[34].
대개 1회 소작은 6-12분 정도 지속하며 종양의 크기에 따라 2-3회 전극을 이동해가면서 소작을 마치게 된다. 대부분의 간세포암종괴 주위에는 크기가 커질수록 작은 위성결절이 동반되는 경향이 있으므로 소작용적의 기준은 종양주위로 5-10 mm의 영상검사상 정상으로 보이는 정상 간실질까지 소작하는 것을 목표로 한다. 치료 후 전극을 제거할 때는 출혈이나 전극경로를 통한 종양파종(seeding)을 예방하기 위해 전극 경로도 소작하면서 전극을 제거한다. 치료 중 환자는 어느 정도의 동통의 호소가 있는데, 대부분 fentanyl이나 midazolam을 이용한 정맥마취로 동통의 조절이 필요하다[234].
시술 후 출혈 등의 조기 합병증이 없는지 vital sign을 포함한 면밀한 임상경과 관찰을 하게 되며 특별한 합병증이 없는한 시술 다음날 퇴원하게 된다. 또한, 대부분의 병원에서는 시술 즉시나 1개월 이내에 CT나 MRI을 시행하여 국소 치료효과를 평가한다. 시술 후 적어도 1개월 이내에 CT 등의 영상진단을 시행하여 충분히 치료되지 못한 잔여 종괴의 유무를 평가하여 만약 잔류종양이 보이면 적절한 추가 치료를 한다. 이후에는 약 3-4개월 주기로 대부분 CT를 이용하여 추적한다.
CT에서 완전치료의 기준은 소작에 의한 균질성의 조영증강을 보이지 않는 저음영부가 치료 전 종양부를 적어도 포함시켰을 때로 정의한다. 일부 기관에서는 시술 직후 조영증강 초음파검사나 MRI를 이용하여 치료효과를 평가하기도 한다. 조영증강 초음파검사의 경우 검사자의 숙련도와 최첨단 초음파기기가 필요하다는 제약점이 따르고, MRI의 경우에도 고가의 기기를 시술 중 장시간 점유해야 한다는 단점이 있어 CT에 비해 보편화되지는 못하고 있다. 그러나, 조영증강 초음파검사는 잔여종괴의 평가에 있어 CT와 유사하다는 보고도 있으며, 특히 추적 중 CT나 MRI에서 매우 작은 국소종양진전(local tumor progression)부위를 정확히 유도하
여 추가치료를 하는 데 매우 유용하다[2345].
고주파열치료에 대한 임상 성적은 최근 2편의 10년 생존율에 대한 연구를 포함하여 많은 코호트연구들이 보고를 통해 비교적 안전하고 효과적인 비수술적 치료법으로 인정받게 되었다[1617181920212223] (Table 1). 대부분의 연구에서 5년 생존율이 50-60%를 상회하며, 주요 합병증률도 2-3% 이내로 수술적 치료에 비해 훨씬 안전한 것으로 여겨진다. 2012년 Shiina 등[17]은 5 cm 이하, 3개 이하의 간세포암 환자 1,170 명에 대해 고주파열치료를 시행한 결과 1, 3, 5, 7, 10년 생존율이 각각 96.6%, 80.5%, 60.2%, 45.1%, 27.3%였으며, 장기생존율에 관한 예후 인자로는 종양의 크기, 종양의 개수, 그리고 Child 분류가 의미가 있는 것으로 보고하였다. 2013년 Kim 등[18]은 비슷한 환자군에 1,305명 대하여 고주파열치료를 시행하여 1, 3, 5, 7, 10년 생존율을 각각 95.5%, 77.9%, 59.7%, 43.2%, 32.3%로 보고하였다. 장기생존율에 관해서는 환자의 연령, Child 분류, 간염에 대한 항바이러스제의 치료 유무, 원격전이 유무가 통계적으로 유의한 예후인자로 나타났다.
고주파열치료의 안전성은 그간 대규모 공동연구와 메타 분석을 통해 인정받고 있다[17182425]. Mulier 등[25]의 발표한 83개 임상논문들의 사망률도 0.2%로서 수술에 비해서 월등히 안전한 시술임을 알 수 있다. 2002년, 2003년 각각 이태리와 한국에서 보고한 2개의 대규모 공동연구에 따르면 고주파치료와 관련된 사망률은 0.3% 이하, 주요합병증 발생률도 2.4% 미만이었고, 최근 10년 생존율을 보고한 대규모 후향적 연구들에서의 주요합병증 발생률도 2% 내외였다[1718] (Table 2). 다만, 주요합병증들 중 출혈, 농양, 장천공 등은 자칫 사망에 이르게 할수 있는 합병증이므로 시술자는 이들의 조기 진단과 적절한 치료에 대해서는 충분히 숙지하고 있어야 하겠다.
수술적 절제와의 비교연구들도 상당수 있기는 하나 대부분 후향적 연구들이며 각각의 연구결과들마저도 상충되는 실정이다 [20212223]. 더구나, 무작위 전향적 비교연구는 극히 제한적이며 그조차 연구대상수가 충분치 않고 연구방법상 적잖은 한계점이 지적되어 두 치료법간의 우위를 논하는 것은 현재로서는 쉽지 않다. 다만, 현재까지의 경향은 2 cm 이하의 단일 간세포암의 경우 disease free survival은 수술적 절제가 우수하나, overall survival은 두 군간에 유의한 차이는 없다는 연구들이 많은 경향이 있다. 최근 일본에서 진행되는 대규모 600명을 대상으로 한 전향적 무작위 비교연구를 통해 좀더 정확한 치료법간의 효과차이를 알아 볼 수 있을 것으로 기대한다.
여러 간세포암치료 가이드라인에서도 고주파 치료의 효용성은 인정받고 있어 3 cm 이하 3개 이하의 조기 간세포암에 대해서는 근치적 치료법 중 하나로 적용이 가능한 것으로 제시되고 있다. 특히 최근 BCLC 가이드라인의 개정안에는 간이식을 고려하지 않는 very early HCC(즉, 2 cm 이하 단일결절)의 경우 수술적 치료에 앞서 국소 소작술을 우선 고려할 수 있다고 전향적 제안을 제시한바 있다[116]. 그러나 간세포암을 지닌 환자는 간세포암이라는 악성종양과 간기능 보존이라는 두 마리 토끼를 동시에 잡아야 하는 다른 종양에서는 찾기 어려운 특성이 있음을 깊이 인지하고, 단순히 어느 치료가 우선이어야 한다는 낡은 프레임을 너머, 단순한 경쟁이 아닌 진정한 협력이라는 새로운 패러다임으로의 전향이 필요한 시점이 아닌가 생각한다.
1990년대 고주파 치료가 처음 도입된 이래로 다양한 기술적 발전이 꾸준히 있어 왔다. 우선 고주파 전극의 발전을 들 수 있는데 다발성 또는 양극성 전극의 사용으로 보다 큰종양에 대한 효과적인 치료가 가능해지기 시작했으며, 3 cm 이상의 비교적 큰 종양에 대해서는 TACE와 병합요법의 효과가 인정되어 널리 활성화되고 있다. 한편, 최근에는 보다 강력한 소작효과를 단시간 내에 얻을 수 있는 마이크로웨이브기기가 개발되어 구미를 중심으로 점차 활성화되고 있으며 주로 큰 종양과 안전한 위치의 종양에 대해 고주파열치료를 대체해갈 것으로 예상된다[28].
고주파열치료의 주요한 합병증 중 하나인 주변 장기의 열손상을 예방하기 위한 다양한 기법들이 이제는 기본적인 술기로 자리잡게 되었다. 즉, 인공복수나 흉수기법을 이용하여 주변장기를 분리시킨 상태에서 안전하게 시술이 가능하게 되었다. 이는 특히 간의 꼭대기에 위치한 종양에 대해서는 초음파 음창을 개선하는 또 다른 효과를 얻을 수 있는 장점이 있다.
가돌리니움-EOB-Gadoxate 조영제를 이용한 MRI가 활성화됨에 따라 자주 발견되는 1 cm 전후의 작은 종양들에 대한 초음파유도하 치료가 점점 어려워지게 되었다. 그러나, 최근 소개된 융합영상(fusion images) 유도하의 치료가 가능해짐에 따라, CT나 MRI의 기존영상을 실시간 초음파와 센서를 통해 연동시켜 매우 작고 희미한 종양에까지 정확히 전극을 삽입하여 소작이 가능해지게 되었다. 한편, 최근 국내에도 도입되어 사용이 가능해진 간세포특이적 초음파 조영제(Sonazoid)로 인해 1 cm 전후의 작은 간세포암까지 영상진단이 더 용이해지게 되었으며, 10분 후 지연기 Kupffer phase를 영상을 이용하여 보다 정확한 소작이 가능해져 조기진단-조기치료라는 국면에 한층 가까이 다가서고 있다[2930] (Figure 1).
마지막으로는 고주파열치료 전에 리포조옴에 코팅된 항암제를 정맥주사하여 소작부위 주위에서 약물을 방출시킴으로써 국소항암효과를 증진시키는 온도감응 항암제 병합 요법도 임상연구가 진행중이며, 향후에도 이 같은 국소 소작술의 효과를 증진시키는 다양한 연구와 임상적용이 활발해질 것으로 기대된다.
간세포암에 대한 국소 소작술은 탁월한 국소치료효과와 미세침습적 치료로 인한 안전성으로 인해 수술적 절제가 용이하지 않은 만성 간질환을 보유한 간세포암 환자에게 유익한 치료법으로 이용될 것으로 예상된다. 이는 최근 발전된 융합영상이나 Sonazoid 조영제를 이용한 초음파유도하의 시술이나 TACE와의 병합치료 등의 활성화로 인해 very early HCC뿐 아니라 intermediate HCC에까지 그 역할을 확대해 갈 것으로 기대한다. 더구나, 최근 주목 받고 있는 마이크로웨이브를 이용해 보다 빠른 시간 내에 큰 종양의 치료가 가능해질 것으로 예상되며, Irreversible electroporation이나 High internsity focused ultrasound 등의 아직 초기 단계인 새 에너지원의 가세로 향후 미세침습적 치료의 가능성은 무궁무진해질 것으로 생각한다[3132].
간세포암에 대한 국소 소작술은 수술적 절제가 불가한 조기 간세포암(3 cm이하, 3개 이하)에 대한 대표적인 비수술적 치료법으로 국제적인 치료가이드라인에서 인정받고 있고, 그중 대표적 시술이 고주파 열치료다. 최근 다양한 기술적 발전과 다른 치료법과의 병합요법으로 간세포암 치료에 있어 국소 소작술의 역할은 꾸준히 증가될 것으로 예상된다.
본 논문은 간세포암의 근치적 치료법중 하나인 고주파열치료의 원리 및 임상적용의 가이드라인에 대한 설명과 더불어 현재까지 발표된 치료 성적과, 이를 바탕으로 한 향후 전망을 체계적으로 기술하였다. 논문에 언급된 바와 같이, 고주파열치료는 조기간세포암의 간절제술에 버금가는 치료성적을 내고 있으며, 간단한 정맥마취와 경피적 접근이 가능한 최소침습치료라는 강력한 이점을 무기로 간종양 국소 치료의 대표주자로 자리매김하고 있다. 간암 치료의 실제 현장에서는 관련 의료진간의 협력을 통한 다학제적 접근이 중요해지고 있는 시점으로, 본 논문은 고주파 열치료 비전공 의사에게도 고주파 열치료의 개념을 정확하게 전달할 수 있을 것이며, 향후 전망을 공유하여 차후 고주파열치료술에 관심있는 의료진들에게 큰 도움이 되어 이 치료법이 더 많이 이용될 수 있도록 길잡이 역할을 할 수 있을 것으로 기대된다.
[정리: 편집위원회]
Figures and Tables
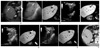 | Figure 1Radiofrequency ablation with assistance of Sonazoid enhanced ultrasound (US) and fusion image guidance with magnetic resonance (MR) imaging. (A) MR scan obtained during hepatic arterial phase shows 1.1 cm-sized-hypervascular mass (arrow) in segment V before radiofrequency ablation. (B) Planning ultrasonography (US, left image) with fusion image (MR, right image) guidance before radiofrequency ablation shows a very inconspicuous tumor (arrow) on gray scale image. Sonazoid enhanced US demonstrates arterial hypervascular mass (C, arrow) on vascular phase and hypoechoic lesion (D) in the corresponding area on Kupffer phase (10 minutes delay) representing hepatocellular carcinoma. It helps to insert radiofreqeuncy electrode into target lesion confidently due to enhancement of tumor conspicuity. (E) During RF ablation, the hypoechoic index tumor changes into hyperechoic area (arrowhead) due to microbubbles from vaporization of tumors. (F) Axial computed tomography scan obtained during portal phase obtained immediately after radiofrequency ablation shows complete ablation with an enough ablative margin (arrow). |
References
2. Dodd GD 3rd, Soulen MC, Kane RA, Livraghi T, Lees WR, Yamashita Y, Gillams AR, Karahan OI, Rhim H. Minimally invasive treatment of malignant hepatic tumors: at the threshold of a major breakthrough. Radiographics. 2000; 20:9–27.

3. Gazelle GS, Goldberg SN, Solbiati L, Livraghi T. Tumor ablation with radio-frequency energy. Radiology. 2000; 217:633–646.

4. McGhana JP, Dodd GD 3rd. Radiofrequency ablation of the liver: current status. AJR Am J Roentgenol. 2001; 176:3–16.
5. Rhim H, Goldberg SN, Dodd GD 3rd, Solbiati L, Lim HK, Tonolini M, Cho OK. Essential techniques for successful radio-frequency thermal ablation of malignant hepatic tumors. Radiographics. 2001; 21 Spec No:S17–S35.

6. Korean Liver Cancer Study Group and National Cancer Center, Korea. Practice guidelines for management of hepatocellular carcinoma 2009. Korean J Hepatol. 2009; 15:391–423.
7. European Association For The Study Of The Liver. European Organisation For Research And Treatment Of Cancer. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol. 2012; 56:908–943.
8. Omata M, Lesmana LA, Tateishi R, Chen PJ, Lin SM, Yoshida H, Kudo M, Lee JM, Choi BI, Poon RT, Shiina S, Cheng AL, Jia JD, Obi S, Han KH, Jafri W, Chow P, Lim SG, Chawla YK, Budihusodo U, Gani RA, Lesmana CR, Putranto TA, Liaw YF, Sarin SK. Asian Pacific Association for the Study of the Liver consensus recommendations on hepatocellular carcinoma. Hepatol Int. 2010; 4:439–474.

9. Kudo M, Izumi N, Kokudo N, Matsui O, Sakamoto M, Nakashima O, Kojiro M, Makuuchi M. HCC Expert Panel of Japan Society of Hepatology. Management of hepatocellular carcinoma in Japan: Consensus-Based Clinical Practice Guidelines proposed by the Japan Society of Hepatology (JSH) 2010 updated version. Dig Dis. 2011; 29:339–364.

10. Shiina S, Teratani T, Obi S, Sato S, Tateishi R, Fujishima T, Ishikawa T, Koike Y, Yoshida H, Kawabe T, Omata M. A randomized controlled trial of radiofrequency ablation with ethanol injection for small hepatocellular carcinoma. Gastroenterology. 2005; 129:122–130.

11. Lencioni RA, Allgaier HP, Cioni D, Olschewski M, Deibert P, Crocetti L, Frings H, Laubenberger J, Zuber I, Blum HE, Bartolozzi C. Small hepatocellular carcinoma in cirrhosis: randomized comparison of radio-frequency thermal ablation versus percutaneous ethanol injection. Radiology. 2003; 228:235–240.

12. Lin SM, Lin CJ, Lin CC, Hsu CW, Chen YC. Randomised controlled trial comparing percutaneous radiofrequency thermal ablation, percutaneous ethanol injection, and percutaneous acetic acid injection to treat hepatocellular carcinoma of 3 cm or less. Gut. 2005; 54:1151–1156.

13. Cha DI, Lee MW, Rhim H, Choi D, Kim YS, Lim HK. Therapeutic efficacy and safety of percutaneous ethanol injection with or without combined radiofrequency ablation for hepatocellular carcinomas in high risk locations. Korean J Radiol. 2013; 14:240–247.

14. Takaki H, Yamakado K, Nakatsuka A, Fuke H, Murata K, Shiraki K, Takeda K. Radiofrequency ablation combined with chemoembolization for the treatment of hepatocellular carcinomas 5 cm or smaller: risk factors for local tumor progression. J Vasc Interv Radiol. 2007; 18:856–861.

15. Rhim H, Lee MH, Kim YS, Choi D, Lee WJ, Lim HK. Planning sonography to assess the feasibility of percutaneous radiofrequency ablation of hepatocellular carcinomas. AJR Am J Roentgenol. 2008; 190:1324–1330.

16. Livraghi T, Meloni F, Di Stasi M, Rolle E, Solbiati L, Tinelli C, Rossi S. Sustained complete response and complications rates after radiofrequency ablation of very early hepatocellular carcinoma in cirrhosis: is resection still the treatment of choice? Hepatology. 2008; 47:82–89.

17. Shiina S, Tateishi R, Arano T, Uchino K, Enooku K, Nakagawa H, Asaoka Y, Sato T, Masuzaki R, Kondo Y, Goto T, Yoshida H, Omata M, Koike K. Radiofrequency ablation for hepatocellular carcinoma: 10-year outcome and prognostic factors. Am J Gastroenterol. 2012; 107:569–577.

18. Kim YS, Lim HK, Rhim H, Lee MW, Choi D, Lee WJ, Paik SW, Koh KC, Lee JH, Choi MS, Gwak GY, Yoo BC. Ten-year outcomes of percutaneous radiofrequency ablation as first-line therapy of early hepatocellular carcinoma: analysis of prognostic factors. J Hepatol. 2013; 58:89–97.

19. Waki K, Aikata H, Katamura Y, Kawaoka T, Takaki S, Hiramatsu A, Takahashi S, Toyota N, Ito K, Chayama K. Percutaneous radiofrequency ablation as first-line treatment for small hepatocellular carcinoma: results and prognostic factors on long-term follow up. J Gastroenterol Hepatol. 2010; 25:597–604.

20. Chen MS, Li JQ, Zheng Y, Guo RP, Liang HH, Zhang YQ, Lin XJ, Lau WY. A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma. Ann Surg. 2006; 243:321–328.

21. Huang J, Yan L, Cheng Z, Wu H, Du L, Wang J, Xu Y, Zeng Y. A randomized trial comparing radiofrequency ablation and surgical resection for HCC conforming to the Milan criteria. Ann Surg. 2010; 252:903–912.

22. Feng K, Yan J, Li X, Xia F, Ma K, Wang S, Bie P, Dong J. A randomized controlled trial of radiofrequency ablation and surgical resection in the treatment of small hepatocellular carcinoma. J Hepatol. 2012; 57:794–802.

23. Hasegawa K, Kokudo N, Makuuchi M, Izumi N, Ichida T, Kudo M, Ku Y, Sakamoto M, Nakashima O, Matsui O, Matsuyama Y. Comparison of resection and ablation for hepatocellular carcinoma: a cohort study based on a Japanese nationwide survey. J Hepatol. 2013; 58:724–729.

24. Livraghi T, Solbiati L, Meloni MF, Gazelle GS, Halpern EF, Goldberg SN. Treatment of focal liver tumors with percutaneous radio-frequency ablation: complications encountered in a multicenter study. Radiology. 2003; 226:441–451.

25. Mulier S, Mulier P, Ni Y, Miao Y, Dupas B, Marchal G, De Wever I, Michel L. Complications of radiofrequency coagulation of liver tumours. Br J Surg. 2002; 89:1206–1222.

26. N'Kontchou G, Aout M, Laurent A, Nahon P, Ganne-Carrie N, Grando V, Baghad I, Roulot D, Trinchet JC, Sellier N, Cherqui D, Vicaut E, Beaugrand M, Seror O. Survival after radiofrequency ablation and salvage transplantation in patients with hepatocellular carcinoma and Child-Pugh A cirrhosis. J Hepatol. 2012; 56:160–166.
27. Choi D, Lim HK, Rhim H, Kim YS, Lee WJ, Paik SW, Koh KC, Lee JH, Choi MS, Yoo BC. Percutaneous radiofrequency ablation for early-stage hepatocellular carcinoma as a first-line treatment: long-term results and prognostic factors in a large single-institution series. Eur Radiol. 2007; 17:684–692.

28. Lubner MG, Brace CL, Hinshaw JL, Lee FT Jr. Microwave tumor ablation: mechanism of action, clinical results, and devices. J Vasc Interv Radiol. 2010; 21:8 Suppl. S192–S203.

29. Dohmen T, Kataoka E, Yamada I, Miura K, Ohshima S, Shibuya T, Segawa D, Sato W, Anezaki Y, Ishii H, Kamada K, Goto T, Ohnishi H. Efficacy of contrast-enhanced ultrasonography in radiofrequency ablation for hepatocellular carcinoma. Intern Med. 2012; 51:1–7.

30. Lee MW, Rhim H, Cha DI, Kim YJ, Choi D, Kim YS, Lim HK. Percutaneous radiofrequency ablation of hepatocellular carcinoma: fusion imaging guidance for management of lesions with poor conspicuity at conventional sonography. AJR Am J Roentgenol. 2012; 198:1438–1444.





 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download