Abstract
Advances in deep brain stimulation (DBS) in relation to neuroimaging techniques and with intraoperative electrophysiological microrecordings and stimulations have replaced ablative procedures for medication-refractory movement disorders such as Parkinson's disease, dystonia, and essential tremor. DBS is an effective surgical treatment for these conditions and is now being extended to psychiatric diseases such as obsessive-compulsive disorder, depression, and addiction. Despite the proven clinical improvement by DBS, its precise mechanism of action remains unclear. Clinical improvement depends on the selection of the appropriate patients and the precise implantation of the stimulation electrodes, which is based on careful stereotactic targeting and extensive electrophysiological monitoring of the target area. Further studies are being performed to better understand the mechanism of action and identify new anatomical targets and clinical applications of DBS. We briefly introduce the surgical procedure and current clinical applications of DBS in this review.
1963년 100-200 Hz의 고주파 자극에 의해 파킨슨병(Parkinson disease) 환자의 진전이 호전되었다는 보고[1] 이래 현재까지 뇌심부자극술은 파킨슨병, 본태성 진전(essential tremor), 근긴장이상증(dystonia) 등의 이상운동 질환에서 안전하고, 효과적인 치료법으로 알려져 있다. 비록 뇌심부자극술의 명확한 기전은 아직까지 밝혀지지 않은 상태이나, 다양한 난치성 신경계질환 및 정신과질환에 대해서도 뇌심부자극술이 시도되고 있다. 미국 식약청은 1997년 진전에 대한 뇌심부자극술을 승인하였고, 이후 파킨슨병(2002년)과 근긴장이상증(2003년), 강박증(2009년)에 대한 뇌심부자극술을 차례로 승인하였다. 국내에서는 2005년 1월 뇌심부자극술이 보험 적용 대상이 되었으며, 현재 진전, 파킨슨병, 근긴장이상증, 강박증, 만성통증, 간질 등 다양한 질환에서 뇌심부자극술이 시행되고 있다.
이에 대하여 지금까지 알려진 뇌심부자극술의 기전을 살펴보고, 뇌심부자극술의 수술방법과 본태성 진전, 파킨슨병, 근긴장이상증, 강박증을 중심으로 뇌심부자극술의 임상 적응증 및 치료성적에 관하여 약술하고자 한다.
뇌심부자극술 기전에 대한 초기 가설은 임상결과와 관련지어 설명하고자 하였다. 파괴술에 이용되는 뇌심부핵을 고주파로 자극을 하면 뇌심부핵의 기능이 억제되어 파괴술과 동일한 효과를 얻을 수 있다는 것을 근거로 뇌심부자극술의 기전을 이해하였다. 고주파자극에 의한 신경억제는 쥐를 대상으로 한 시상하핵 뇌심부자극술에서 관찰되었으며, 이후 영장류와 인간을 대상으로 시행한 뇌심부자극술에서도 비슷한 결과가 보고되었다[2].
한편 뇌심부핵의 자극에 의해 뇌심부핵의 출력이 증가하고, 하위 신경핵의 신경 활성도가 증가한다는 여러 문헌이 보고되기도 하였다. Hashimoto 등[3]은 파킨슨병 원숭이를 대상으로 하시상핵에 자극을 가하였을 때 내측 및 외측 담창구에서의 활성도가 증가하는 것을 관찰하였다. 또한 양전자방출 단층촬영(positron emission tomography) 연구에서 하시상핵 뇌심부자극술 후 내측 담창구의 혈류가 증가되는 것이 관찰되었고[4], 기능적 뇌자기공명영상(functional magnetic resonance imaging) 연구에서도 하시상핵 자극 후 내측 담창구의 혈중 산소치 의존 신호(blood oxygen level-dependent signal)가 증가됨이 관찰되었다[5].
뇌심부자극술의 기전에 대한 초기의 연구들이 자극 목표점에 대한 직접적인 효과에 초점을 맞추었다면, 최근 연구는 자극이 주어진 뇌심부핵뿐만 아니라 뇌심부핵 주변에 걸친 신경경로들의 활성에 주안점을 두었다. 하시상핵에 대한 자극은 흑질선조체(nigrostriatal), 담창구핵시상(pallidothalmic), 소뇌시상(cerebellothalamic), 담창구핵흑질(pallidonigral) 신경섬유를 활성화시키며, 이 모든 신경섬유들의 조화가 뇌심부자극술에 의한 증상완화에 기여하는 것으로 받아들여 지고 있다[6].
결국 뇌심부자극술은 자극이 가해진 뇌심부핵의 출력을 증가시키고, 흥분성과 억제성의 동시 복합적인 효과를 통해 주위 신경섬유를 활성화시켜 기저핵-시상피질 네트워크(basal ganglia-thalamocortical network) 전반을 조절(neuromodulation)하는 것으로 이해되고 있다[1].
환자는 뇌의 해부학적 구조물들의 공간적 위치를 파악하기 위하여 수술 전 각성 상태에서 뇌정위틀을 고정한다. 촬영된 영상은 치료계획 프로그램(예: Surgiplan 또는 Frame-link)을 통해 전교련-후교련 연결선(anterior commis-sure-posterior commissure line)을 기준으로 정렬하여 재구성한다. 기존의 뇌도감(brain atlas)에서 알려져 있는 뇌심부핵의 좌표를 이용하여 목표점을 정한다. 뇌심부핵 전극의 가상 궤적(trajectory)이 대뇌 고랑과 주변 혈관을 피하고, 뇌실을 통과하지 않도록 주의하여 전극 삽입점(entry point)을 선택한다(Figure 1A). 국소 마취 혹은 전신 마취 후 미리 정한 전극 삽입점에 두개골 천공(burr hole trephination)을 시행하고 경막을 절개한다. 뇌정위틀을 이용하여 미리 정한 목표점을 향하여 전기 신호 기록용 미세전극(microelectrode)을 삽입한다. 한 개 혹은 5개의 미세전극을 이용하여 전기생리신호를 기록하여 전기생리신호들 중 목표점과 가장 일치하는 궤적을 확인한다(Figure 1B). 전기자극(test stimulation)을 주어 환자의 증상완화 정도와 부작용을 면밀히 관찰한다. 미세전극 전기생리신호 기록(microelectrode recording)과 전기자극을 통하여 최적의 목표점을 확인한 후 영구자극전극(permanent electrode; 예: active 3387, 또는 3389)을 동일 위치에 삽입하고 X-선 투시(fluoroscopy)나 C-arm을 촬영하여 이를 확인한다. 14 mm 크기의 천공덮개를 이용하여 영구자극전극선을 두개골에 고정한다. 쇄골 아래 부위에 약 5 cm 정도의 피부 절개를 하고 자극기(pulse generator)를 삽입할 부위를 만든다. 두피와 쇄골 하 부위를 연결하는 피하통로를 만든 후 전기자극기 연결선(lead extension)을 통과시켜 쇄골 하 전기자극기와 두피 내 영구자극전극을 각각 전기자극기 연결선에 연결한 후 쇄골 하 절개 부위와 두피 절개 부위를 봉합한다(Figure 2). 수술 후 뇌전산화단층촬영을 시행하여 뇌 내 출혈 여부와 전극의 위치를 확인한다(Figures 3,4). 환자상태를 고려하여 자극기를 켜서 낮은 자극 세기부터 뇌심부핵 자극을 시작하며, 자극기 프로그래머(N’ Vision; Medtronic, Minnea-polis, MN, USA)를 이용하여 환자의 증상을 완화시키기 위한 최적의 자극기 자극조건(programming parameters)을 설정한다.
뇌심부자극술은 본태성 진전, 파킨슨병, 근긴장이상증에 대한 안전하고 효과적인 치료법으로 알려져 있다. 또한 약물에 불응하거나 부작용을 보이는 다양한 신경계 질환 및 정신과 질환에서도 뇌심부자극술이 시도되고 있으며, 현재 여러 뇌심부 자극 목표점에 대한 연구가 진행 중이다(Table 1). 여기서는 본태성 진전, 파킨슨병, 근긴장이상증, 강박증을 중심으로 뇌심부자극술의 임상 적응증 및 치료성적에 대하여 살펴보겠다.
본태성 진전은 가장 흔한 형태의 진전으로 손에서 가장 흔하게 발생하나 머리, 목소리, 혀, 체부 혹은 하지에서도 발생할 수 있다. 나이가 증가할수록 빈도가 증가하지만 소아에서도 나타날 수 있다. 멘델유전 우성으로 가족력이 있다. 프로프라놀롤(propranolol)과 같은 베타차단제로 효과적으로 치료할 수 있으며, 알코올에 의해 진전이 감소되는 경우도 있다. 약물치료에 실패하거나 내성이 생긴 환자들에 대해서 수술적 치료를 고려할 수 있다. 1950년대에는 시상의 중간배쪽핵(ventral intermedius nucleus) 파괴술이 본태성 진전의 효과적인 치료로 이용되었으나 말하기과 삼킴의 장애 등 영구적인 신경학적 부작용이 보고되었다. 1987년 Benabid 등[7]은 양측 시상 중간배쪽핵에 시행하는 뇌심부자극술이 시상파괴술과 동등한 효과를 보이는 것으로 보고하였고, 뇌심부자극술을 통해 파킨슨병 진전과 본태성 진전을 효과적으로 억제할 수 있었다고 보고하였다[8]. 뇌심부자극술에 의해 감각이상, 두통, 구음장애, 불완전마비, 보행장애, 실조 등의 신경학적 부작용이 관찰되었으나, 이런 증상은 경미하여 수용 가능한 수준이며 자극조건의 조정으로 이들 부작용은 효과적으로 조절되었다. 2000년대에 다기관 임상시험 결과와 장기간의 경과관찰 결과들이 문헌 보고되었고, 양측 시상 중간배쪽핵에 대한 뇌심부자극술이 본태성 진전에 대한 지속적인 증상 완화 효과를 나타내는 것으로 일관되게 보고하였다[910]. 약 60-90%에서 진전이 조절 가능한 것으로 보고되고 있으며, 일반적으로 머리와 목소리의 진전은 그 효과가 적은 것으로 알려져 있다[911].
파킨슨병은 뇌의 흑질 치밀층(substantia nigra pars compacta)에 분포하는 도파민 신경세포가 점차 소실됨에 따라 진전, 경직(rigidity), 운동느림(bradykinesia) 및 자세 불안정성(postural instability)이 특징적으로 나타나는 만성 진행성 퇴행성질환이다. 파킨슨병의 증상 완화를 위해 레보도파(levodopa)로 대표되는 약물치료가 시행되나, 약 50%의 환자에서 병이 진행함에 따라 약물에 의한 이상운동증(dyskineisia), 운동 기복(motor fluctuation) 및 장기간 과다복용에 따른 합병증(위장장애, 정신장애)을 경험하게 된다. 1994년 Benabid 등[12]에 의해 하시상핵 뇌심부자극술이 파킨슨병의 수술적 치료로 소개된 이래 뇌심부자극술은 레보도파에 좋은 반응성을 보이며, 장기간 약물복용에 의한 이상운동증과 운동기복을 보이는 난치성 파킨슨병에 대한 표준 수술요법으로 자리매김되었다. 오늘날 파킨슨병에서의 자극 목표점은 하시상핵과 내측 담창구가 가장 일반적으로 사용되고 있다. 시상하핵에 대한 자극술은 운동증상을 완화시키고, 항파킨슨제제의 투여용량을 줄일 수 있을 뿐만 아니라 파킨슨병 진전에도 좋은 효과를 나타내어 내측 담창구에 대한 자극술보다 더 선호된다[13]. 하지만 내측 담창구자극술과 하시상핵 뇌심부자극술에 대한 운동증상의 호전 정도를 비교하였을 때 통계적으로 유의한 차이는 없는 것으로 보고되었고, 수술 후 인지기능 및 정서기능에 대한 호전 정도 또한 차이가 없는 것으로 알려져 있다[1415]. 뇌심부자극술 후 대부분의 이상운동 증상은 호전되나, 수술 전 레보도파에 반응 없는 이상운동 증상, 기립성 저혈압, 수면장애, 의식장애 등의 증상은 대체로 호전되지 않는 것으로 알려져 있다.
근긴장이상증은 이상운동질환 중 본태성 진전, 파킨슨병 다음으로 흔한 질환이지만, 발생 원인과 역학적 특성에 대해서는 자세히 알려진 바가 없다. 지속적인 근육수축으로 반복적이고 비틀리는 운동양상과 비정상적인 자세에 대해 항콜린제의 약물치료가 시도되고 있으나 증상의 조절이 어렵고, 약물의 부작용으로 약물을 지속할 수 없는 경우가 발생한다. 1990년대 초 담창구파괴술을 시행한 파킨슨병 환자에서 근긴장이상(dystonic symptom) 증상이 좋아지는 것이 관찰된 이래 원발성 전신성 근긴장이상증에 대한 담창구파괴술이 시도되었다[1617]. 양측성 내측 담창구파괴술은 말하기와 인지기능의 영구적인 손상에 대한 우려로 내측 담창구 뇌심부자극술이 근긴장이상증에 대한 수술적 치료로 대체되었다. Coubes 등[18]과 Coubes 등[19]은 최초로 내측 담창구 뇌심부자극술로 근긴장이상증을 치료하였고, 내측 담창구 뇌심부자극술이 DYT1-양성 전신성 근긴장이상증에 대한 효과적인 치료법임을 보고하였다. 내측 담창구 뇌심부자극술은 원발성 전신성 근긴장이상증뿐만 아니라 원발성 분절성 근긴장이상증에서도 치료효과를 보이며[20], DYT1 유전자의 유무와 상관없이 동등한 치료효과를 보이는 것으로 알려져 있다[21]. 진전이나 파킨슨병과는 다르게 근긴장이상증에서의 치료효과는 수 주 혹은 수 개월에 걸쳐 점진적으로 나타난다.
강박장애(obsessive-compulsive disorder)는 불안장애의 하나로서, 반복적이고 원하지 않는 강박적 사고(obsession)와 강박적 행동(compulsion)을 특징으로 하는 정신질환이다. 과거 강박장애의 원인을 심리학적 요인에 근거하여 설명하려는 노력이 많았으나 최근의 뇌영상 연구의 결과는 생물학적 요인이 강박장애 발생과 연관성이 있음을 보여주었고, 특정 신경회로 영역(cortico-striato-thalamocortical circuitry)에 문제가 있다는 것이 알려졌다[22]. 강박장애의 효과적 치료는 약물치료와 인지행동치료이다. 현재 대표적인 약물은 선택적 세로토닌재흡수억제제(serotonin-specific reuptake inhibitor)로 약물에 호전을 보이는 경우가 50-75% 정도가 되며, 약물치료와 더불어 행동요법 등의 정신치료를 병행하는 것이 치료에 도움이 된다. 하지만 대략 25-40%의 환자에서는 약물과 행동요법에 불응하는 것으로 보고되고 있다[23]. 과거 약물에 불응하는 강박장애에 대한 수술적 치료로 띠이랑절제술(cingulotomy)와 수정체전낭절개술(anterior capsulotomy) 등의 신경파괴술이 시행되었으며, 대략 30-70%의 환자에서 호전을 보이는 것으로 보고되었다[2425]. 최근 치료에 불응하는 강박장애 환자에서는 뇌심부자극술이 시행되고 있으나, 명확한 병태생리 기전이 밝혀지지 않은 이유로 다양한 자극 목표점들에서 뇌심부자극술이 시도되고 있다. Mallet 등[26]은 하시상핵을 목표로 자극하였을 때 좋은 효과를 얻을 수 있었다고 보고하였고, 속섬유막앞다리(internal capsule의 anterior limb), nucleus accumbens를 포함한 ventral capsule/ventral striatum, 아래시상다리(inferior thalamic peduncle) 또한 강박장애에 대한 자극 목표점으로 제시되고 있다[27282930].
뇌심부자극술은 다양한 질환에서 유용한 치료효과를 보여주고 있다. 그 동안 뇌심부자극술의 치료기전에 대한 이해가 깊어졌으나 근본적인 기전은 아직 밝혀지지 않았다. 향후 뇌신경영상 연구와 전기생리학적 연구 등 다양한 기초연구와 임상시험들은 뇌심부자극술의 명확한 기전을 이해하는데 큰 도움을 줄 것으로 기대된다. 약물 불응성 신경계질환 및 정신과질환을 대상으로 효과적인 뇌심부자극술을 시행하기 위해서는 신경외과, 신경과, 정신과, 임상신경생리학, 의공학, 영상의학 등의 다학제적 접근이 요구되며, 이를 통해 새로운 자극 목표점과 보다 폭넓은 임상 적응증을 대상으로 뇌심부자극술이 시행될 수 있을 것이다. 뇌심부자극술의 정확성 및 안전성을 보장하기 위한 더욱 정밀하고 향상된 하드웨어의 개발 또한 함께 이루어져야 할 것이다.
Figures and Tables
Figure 1
Anatomical targeting (A) and microelectrode recordings (B) of the ventrointermedius (Vim) nucleus. Vci, ventrocaudalis internus; Vop, ventrooralis posterior.
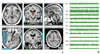
Figure 4
Postoperative magnetic resonance imaging showing implantation of the electrodes. (A) Essential tremor (ventrolateral intermedius), (B) Parkinson disease (subthalamic nucleus), (C) dystonia (globus pallidus internus), and (D) obsessive-compulsive disorder (nucleus accumbens).
Table 1
Targets of deep brain stimulation for the treatment of various disorders
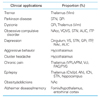
Vim, ventrolateral intermedius; STN, subthalamic nucleus; GPi, globus pallidus internus; NAc, nucleus accumbens; VC/VS, ventral capsule/ventral striatum; ALIC, anterior limb internal capsule; ITP, inferior thalamic peduncle; VPL/VPM, ventral posterolateral/ventroposteromedial; Vc, ventralis caudalis; PAG/PVG, periaqueductal gray/periventricular gray; CM/pf, centromedian/parafascicularis; AN, anterior nucleus; ICN, inferior caudate nucleus.
Acknowledgement
This study was supported by a grant of the Korea Institute of Planning & Evaluation for Technology in Food, Agriculture, Forestry, and Fisheries, Republic of Korea (311011-05-1-SB010).
References
1. Miocinovic S, Somayajula S, Chitnis S, Vitek JL. History, applications, and mechanisms of deep brain stimulation. JAMA Neurol. 2013; 70:163–171.

2. Benazzouz A, Gao DM, Ni ZG, Piallat B, Bouali-Benazzouz R, Benabid AL. Effect of high-frequency stimulation of the subthalamic nucleus on the neuronal activities of the substantia nigra pars reticulata and ventrolateral nucleus of the thalamus in the rat. Neuroscience. 2000; 99:289–295.

3. Hashimoto T, Elder CM, Okun MS, Patrick SK, Vitek JL. Stimulation of the subthalamic nucleus changes the firing pattern of pallidal neurons. J Neurosci. 2003; 23:1916–1923.

4. Hershey T, Revilla FJ, Wernle AR, McGee-Minnich L, Antenor JV, Videen TO, Dowling JL, Mink JW, Perlmutter JS. Cortical and subcortical blood flow effects of subthalamic nucleus stimulation in PD. Neurology. 2003; 61:816–821.

5. Jech R, Urgosik D, Tintera J, Nebuzelsky A, Krasensky J, Liscak R, Roth J, Ruzicka E. Functional magnetic resonance imaging during deep brain stimulation: a pilot study in four patients with Parkinson's disease. Mov Disord. 2001; 16:1126–1132.

6. Johnson MD, Miocinovic S, McIntyre CC, Vitek JL. Mechanisms and targets of deep brain stimulation in movement disorders. Neurotherapeutics. 2008; 5:294–308.

7. Benabid AL, Pollak P, Louveau A, Henry S, de Rougemont J. Combined (thalamotomy and stimulation) stereotactic surgery of the VIM thalamic nucleus for bilateral Parkinson disease. Appl Neurophysiol. 1987; 50:344–346.

8. Benabid AL, Pollak P, Gervason C, Hoffmann D, Gao DM, Hommel M, Perret JE, de Rougemont J. Long-term suppression of tremor by chronic stimulation of the ventral intermediate thalamic nucleus. Lancet. 1991; 337:403–406.

9. Sydow O, Thobois S, Alesch F, Speelman JD. Multicentre European study of thalamic stimulation in essential tremor: a six year follow up. J Neurol Neurosurg Psychiatry. 2003; 74:1387–1391.

10. Blomstedt P, Hariz GM, Hariz MI, Koskinen LO. Thalamic deep brain stimulation in the treatment of essential tremor: a long-term follow-up. Br J Neurosurg. 2007; 21:504–509.

11. Schuurman PR, Bosch DA, Bossuyt PM, Bonsel GJ, van Someren EJ, de Bie RM, Merkus MP, Speelman JD. A comparison of continuous thalamic stimulation and thalamotomy for suppression of severe tremor. N Engl J Med. 2000; 342:461–468.

12. Benabid AL, Pollak P, Gross C, Hoffmann D, Benazzouz A, Gao DM, Laurent A, Gentil M, Perret J. Acute and long-term effects of subthalamic nucleus stimulation in Parkinson's disease. Stereotact Funct Neurosurg. 1994; 62:76–84.

13. Deep-Brain Stimulation for Parkinson's Disease Study Group. Deep-brain stimulation of the subthalamic nucleus or the pars interna of the globus pallidus in Parkinson's disease. N Engl J Med. 2001; 345:956–963.
14. Follett KA, Weaver FM, Stern M, Hur K, Harris CL, Luo P, Marks WJ Jr, Rothlind J, Sagher O, Moy C, Pahwa R, Burchiel K, Hogarth P, Lai EC, Duda JE, Holloway K, Samii A, Horn S, Bronstein JM, Stoner G, Starr PA, Simpson R, Baltuch G, De Salles A, Huang GD, Reda DJ. CSP 468 Study Group. Pallidal versus subthalamic deep-brain stimulation for Parkinson's disease. N Engl J Med. 2010; 362:2077–2091.

15. Okun MS, Fernandez HH, Wu SS, Kirsch-Darrow L, Bowers D, Bova F, Suelter M, Jacobson CE 4th, Wang X, Gordon CW Jr, Zeilman P, Romrell J, Martin P, Ward H, Rodriguez RL, Foote KD. Cognition and mood in ParkinsonXMLLink_XYZs disease in subthalamic nucleus versus globus pallidus interna deep brain stimulation: the COMPARE trial. Ann Neurol. 2009; 65:586–595.

16. Vitek JL, Zhang J, Evatt M, Mewes K, DeLong MR, Hashimoto T, Triche S, Bakay RA. GPi pallidotomy for dystonia: clinical outcome and neuronal activity. Adv Neurol. 1998; 78:211–219.
17. Lozano AM, Kumar R, Gross RE, Giladi N, Hutchison WD, Dostrovsky JO, Lang AE. Globus pallidus internus pallidotomy for generalized dystonia. Mov Disord. 1997; 12:865–870.

18. Coubes P, Echenne B, Roubertie A, Vayssiere N, Tuffery S, Humbertclaude V, Cambonie G, Claustres M, Frerebeau P. Treatment of early-onset generalized dystonia by chronic bilateral stimulation of the internal globus pallidus. Apropos of a case. Neurochirurgie. 1999; 45:139–144.
19. Coubes P, Roubertie A, Vayssiere N, Hemm S, Echenne B. Treatment of DYT1-generalised dystonia by stimulation of the internal globus pallidus. Lancet. 2000; 355:2220–2221.

20. Kupsch A, Benecke R, Muller J, Trottenberg T, Schneider GH, Poewe W, Eisner W, Wolters A, Muller JU, Deuschl G, Pinsker MO, Skogseid IM, Roeste GK, Vollmer-Haase J, Brentrup A, Krause M, Tronnier V, Schnitzler A, Voges J, Nikkhah G, Vesper J, Naumann M, Volkmann J. Deep-Brain Stimulation for Dystonia Study Group. Pallidal deep-brain stimulation in primary generalized or segmental dystonia. N Engl J Med. 2006; 355:1978–1990.

21. Coubes P, Cif L, El Fertit H, Hemm S, Vayssiere N, Serrat S, Picot MC, Tuffery S, Claustres M, Echenne B, Frerebeau P. Electrical stimulation of the globus pallidus internus in patients with primary generalized dystonia: long-term results. J Neurosurg. 2004; 101:189–194.

22. Rauch SL, Dougherty DD, Malone D, Rezai A, Friehs G, Fischman AJ, Alpert NM, Haber SN, Stypulkowski PH, Rise MT, Rasmussen SA, Greenberg BD. A functional neuroimaging investigation of deep brain stimulation in patients with obsessive-compulsive disorder. J Neurosurg. 2006; 104:558–565.

23. Pallanti S, Quercioli L. Treatment-refractory obsessive-compulsive disorder: methodological issues, operational definitions and therapeutic lines. Prog Neuropsychopharmacol Biol Psychiatry. 2006; 30:400–412.

24. Dougherty DD, Baer L, Cosgrove GR, Cassem EH, Price BH, Nierenberg AA, Jenike MA, Rauch SL. Prospective long-term follow-up of 44 patients who received cingulotomy for treatment-refractory obsessive-compulsive disorder. Am J Psychiatry. 2002; 159:269–275.

25. Mian MK, Campos M, Sheth SA, Eskandar EN. Deep brain stimulation for obsessive-compulsive disorder: past, present, and future. Neurosurg Focus. 2010; 29:E10.

26. Mallet L, Polosan M, Jaafari N, Baup N, Welter ML, Fontaine D, du Montcel ST, Yelnik J, Chereau I, Arbus C, Raoul S, Aouizerate B, Damier P, Chabardès S, Czernecki V, Ardouin C, Krebs MO, Bardinet E, Chaynes P, Burbaud P, Cornu P, Derost P, Bougerol T, Bataille B, Mattei V, Dormont D, Devaux B, Verin M, Houeto JL, Pollak P, Benabid AL, Agid Y, Krack P, Millet B, Pelissolo A. STOC Study Group. Subthalamic nucleus stimulation in severe obsessive-compulsive disorder. N Engl J Med. 2008; 359:2121–2134.

27. Goodman WK, Foote KD, Greenberg BD, Ricciuti N, Bauer R, Ward H, Shapira NA, Wu SS, Hill CL, Rasmussen SA, Okun MS. Deep brain stimulation for intractable obsessive compulsive disorder: pilot study using a blinded, staggered-onset design. Biol Psychiatry. 2010; 67:535–542.

28. Huff W, Lenartz D, Schormann M, Lee SH, Kuhn J, Koulousakis A, Mai J, Daumann J, Maarouf M, Klosterkotter J, Sturm V. Unilateral deep brain stimulation of the nucleus accumbens in patients with treatment-resistant obsessive-compulsive disorder: outcomes after one year. Clin Neurol Neurosurg. 2010; 112:137–143.

29. Jimenez-Ponce F, Velasco-Campos F, Castro-Farfan G, Nicolini H, Velasco AL, Salin-Pascual R, Trejo D, Criales JL. Preliminary study in patients with obsessive-compulsive disorder treated with electrical stimulation in the inferior thalamic peduncle. Neurosurgery. 2009; 65:6 Suppl. 203–209.




 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download