Abstract
Adequate dialysis is essential for improving dialysis therapies and reducing all-cause mortality in end-stage renal disease (ESRD) patients. Efficient removal of the uremic toxins in the blood remains the fundamental role of dialysis therapies. Therefore, urea clearance as assessed by urea kinetic modeling (Kt/Vurea) is a surrogate marker for dialysis adequacy in ESRD patients undergoing dialysis, and the NKF-DOQI recommends a Kt/Vurea of no less than 1.2. The current status of dialysis adequacy in Korea has not been fully investigated. Our Clinical Research Center for End Stage Renal Disease revealed that the mean Kt/Vurea in maintenance hemodialysis patients was 1.49±0.28, and 91.5% of patients satisfied the target level of Kt/Vurea. In addition to Kt/Vurea, clinical parameters such as the volume status, residual renal function, blood pressure, acid-base disorders, anemia, nutrition, inflammation, mineral metabolism, and middle molecule clearance are important for determining adequate dialysis treatment. Further evaluation of clinical parameters is needed to improve dialysis adequacy.
말기신부전 환자는 신장의 기능이 저하되면서 다양한 노폐물과 대사산물이 체내에 축적되어 수분 및 전해질의 불균형과 요독증상이 발생하게 된다. 생명유지 및 연장을 위해 신장이식, 혈액투석 혹은 복막투석 등의 신대체 요법이 필요하다. 전세계적으로 말기신부전으로 투석치료를 받고 있는 환자는 백만 명이 넘으며, 미국은 40만 명이고, 우리나라는 대한신장학회의 등록사업발표에 의하면 2009년을 기준으로 혈액투석 환자가 37,391명, 복막투석 7,618명으로 총 투석환자는 45,009명이다[1]. 이는 2000년의 20,524명에 비해 약 10년간 2배 이상 증가한 것으로, 인구의 고령화와 당뇨병 및 고혈압과 같은 만성질환의 유병률 증가로 추후 지속적으로 증가할 것으로 보인다. 게다가 투석환자는 일반인구에 비해 4-10배가 넘는 심혈관질환의 유병률과 사망률을 나타내므로 의료재정의 부담뿐 아니라 사회적 문제가 되고 있다[234].
투석환자의 생존율을 높이기 위한 많은 시도가 이루어지고 있는데, 기본적으로 투석치료를 적절히 시행할 필요가 있다. 적절한 투석의 정의를 명확히 내리기는 어렵지만 투석의 적절도를 나타내는 다양한 지표들이 있으며, 혈액투석에서는 요소의 동력학모델을 이용하여 계산한 Kt/Vurea, 요소감소율(urea reduction ratio)을, 복막투석에는 주당 Kt/Vurea, 크레아티닌 청소율 등이 투석적절도의 주요한 지표로 활용되 고 있다. 이외에도 수분상태, 혈압, 산염기 균형, 빈혈, 영양상태, 염증, 칼슘·인 등의 무기질 대사, 중분자물질 청소율 등이 생존율에 영향을 미치므로 인자들을 모두 고려하여 투석의 적절도를 정해야 한다. 따라서 투석적절도의 지표들을 정리해 보고 그 효율성과 투석환자의 생존율의 관련성을 정리해 보고자 한다.
투석적절도에 대해 설명하기 앞서, 투석을 통해 제거해야 할 물질들이 무엇인지에 대한 정의가 필요하다. 흔히 말기신부전 환자에서 요독증이라는 표현을 쓰는데, 이는 신장기능의 저하로 배출되어야 할 다양한 노폐물들이 체내에 축적되어 일어나는 임상증후군을 의미한다. 말기신부전 환자는 사구체여과율이 15 mL/min/1.73 m2 이하로 떨어져도 상당기간 소변량을 정상적으로 유지한다. 따라서 환자나 환자의 가족뿐 아니라 의료진도 소변량이 정상적으로 유지되는데도 신장에서 노폐물을 배출하지 못한다는 개념을 이해하지 못하는 경우가 있다. 사구체여과율이 감소하면 신장에서 배출할 수 있는 노폐물의 양이 줄어들어 일정량의 노폐물이 체내에 축적되어 요독증을 일으키게 된다. 증상으로는 심한 피로, 불면증, 허약감, 가려움증 등이 나타날 수 있고 지속될 경우 입맛이 감소하고 체중이 줄 수 있다. 혹은 요독성 뇌병증을 일으키거나 심낭염, 흉막염을 유발할 수 있고 고칼륨혈증이나 대사성산혈증과 같은 산·염기, 전해질 이상이 발생할 수도 있다.
체내에 축적되는 이러한 다양한 증상을 유발하는 노폐물을 요독물질(uremic toxin)이라고 부르며 European Uremic Toxin Work Group에서는 2003년에 90개 이상의 요독물질을 분류하여 발표하였으며 다음과 같이 세 가지 종류로 분류하였다(Table 1) [5]. 분자량과 단백질 결합 여부에 따라, 1) 수용성의 소분자물질(small water-soluble compounds), 2) 단백질 결합 물질(protein-bound solutes), 3) 중분자물질(middle molecules)로 나누었다. 소분자물질의 대표격으로는 요소(blood urea nitrogen, BUN)와 크레아티닌이 가장 잘 알려져 있으며, 투석에 의해 제거가 용이하다. 투석적절도의 지표로 요소청소율을 많이 사용하는 반면, 크레아티닌은 근육량이나 섭취하는 음식의 영향을 많이 받아서 최근에는 잘 사용하지 않는다. 반면 단백질 결합 물질과 중분자물질은 투석에 의해 효과적으로 제거가 되지 않아 현재 투석치료에서는 한계가 존재한다. 예를 들어 중분자물질로 가장 잘 알려져 있는 β2-마이크로글로블린은 투석치료에도 불구하고 정상인에 비해 투석환자에서 유의하게 증가한다는 것은 이미 잘 알려져 있다[6].
혈액투석은 팔에 동맥과 정맥을 연결하여 만든 동정맥루에 바늘을 천자하여 투석기에 연결하여 몸 안의 노폐물을 제거하는 신대치요법이다. 혈액투석환자의 투석치료를 적절히 하는 것은 사망률과 이환율을 감소시키기 위해 필요한 기본요건이다[7]. 우선 소분자물질 청소율의 주요 지표인 Kt/Vurea에 대해 알아보겠다.
투석적절도의 지표로 흔히 사용되는 Kt/Vurea가 사망률에 미치는 영향에 대한 주요 연구들을 Table 2에 정리하였다. 1981년에 발표한 National Cooperative Dialysis Study는 혈액투석 환자를 시간평균 혈액요소질소를 50 mg/dL로 유지한 군과 100 mg/dL로 유지한 군으로 나누었는데, 3년 추적을 목표로 했으나 24주에 중간분석한 결과에서 혈액요소질소가 높은 군이 입원율이 증가하는 등 이환율이 유의하게 상승하여 조기종료 하였다[12]. 추후 이 연구를 바탕으로 1985년 Gotch와 Sargent [13]가 자료를 재분석하여 Kt/Vurea라는 요소동력학모델(urea kinetic model)을 발표하였는데, 이 연구 이후로 Kt/Vurea는 투석적절도의 임상지표로써 가능한 높게 유지하도록 권고해 왔다. 또한 Port 등[11]은 남성과 여성을 분리하여 분석하였을 때 남성은 고투석량군 투석과 저투석량군 투석이 생존율에 큰 영향을 미치지 못했으나 여성의 경우 고투석량군 투석이 생존율 향상과 유의한 관련성이 있다고 보고하였다. Netherlands Cooperative Study on the Adequacy of Dialysis에서 역시 Kt/Vurea가 상승할수록 사망가능성이 0.44 감소한다는 유사한 결과를 발표하였다.
하지만, 이러한 결론은 2002년 발표한 대규모 임상연구인 Hemodialysis (HEMO) 연구에서 고투석량 투석이 생존율에 큰 영향을 주지 않는다고 보고함으로써 Kt/Vurea 일정이상 증가시키는 것이 사망률에 큰 영향을 미치지 않는 것으로 결론이 지어졌다[810]. 따라서 말기신부전 환자에서의 투석적절도에 관한 미국신장재단(National Kidney Foundation, NKF)의 임상 실행지침(Dialysis Outcomes Quality Initiative [DOQI] Clinical Practice Guidelines)에 의하면 요소동력학모델에 의한 Kt/Vurea가 가장 추천되는 적절도의 지표이며, 주 3회 혈액투석을 받는 환자의 Kt/Vurea는 최소량인 1.2 이상 유지할 것을 권장하고 있다[14].
1985년 Gotch와 Sargent [13]가 개발한 요소청소율을 이용한 요소동력학모델인 Kt/Vurea는 요소청소율인 K와 투석시간인 t를 체내의 urea의 분포배치(volume of distribution)로 나눈 개념이다. 계산식은 다음과 같다.
Single pool Kt/V= -ln (R-0.008×t)+(4-3.5R)×UF/W
R: 투석 후 혈중요소치/투석 전 혈중요소치(post dialysis/predialysis BUN ratio)
t: 치료시간(treatment time in hour)
UF: 한외여과량(ultrafiltration volume in liters)
W: 투석 후 체중(postdialysis weight in kilograms)
이것을 더욱 간소화한 것이 요소감소율이며, 계산식은 다음과 같다.
요소감소율=1-투석 후 혈중요소치/투석 전 혈중요소치
요소감소율은 투석 전후에 요소가 감소한 정도를 알려주는 개념이다. 요소동력학모델을 이용한 투석량 측정은 요소의 농도 측정을 위해서 채혈이 필요한데, 최근 소개된 이온치환투석제거율(ionic dialysance)은 투석에 의해 제거되는 요소를 포함한 투석된 양만큼의 물질이 나트륨으로 치환된다는 이론을 기초로 한 것으로[15], 이온 확산속도 변화율에 의한 투석량을 측정함으로써 채혈 없이 투석량 측정이 가능한 새로운 시도이다.
Kt/Vurea를 늘리기 위한 시도로써 투석방법의 변화를 시도하는 연구가 많이 발표되고 있다. 투석시간을 주 3회 4시간 하는 표준치료가 아니라 야간투석을 하면서 매일 혹은 주 5-6회 투석을 하거나 시간을 6시간으로 늘리거나 혹은 혈액여과법, 혈액투석여과법 등의 다양한 시도를 시행하고 있으며 소분자물질 청소율뿐 아니라 이외의 요독물질의 제거를 늘리려는 시도가 되고 있다[16]. 그러나 현재까지 대규모 임상연구를 통해 투석환자의 생존율을 증가시킨다는 증명이 되지는 않았는데, 이는 Kt/Vurea는 주로 소분자물질 청소율을 의미하는 지표로써 중분자물질이나 단백결합물질의 제거에 대한 고려도 추후 필요할 것으로 보인다. 따라서, 환자 개개인의 상태나 임상양상에 따라 필요하면 투석치료 처방을 조절하는 시도가 필요할 것으로 사료된다.
복막투석은 환자 자신의 복막을 이용한 투석방법으로 도관을 복강으로 삽입한 후 투석액을 복강으로 투입하여 노폐물을 제거하는 방법이다. 지속성 외래 복막투석환자(continuous ambulatory peritoneal dialysis)에서 투석적절도는 환자의 생존율뿐만 아니라 삶의 질에 영향을 미치는 중요한 인자이다. 1회 투석시의 Kt/Vurea를 지표로 삼는 혈액투석과 달리 복막투석은 주당 Kt/Vurea를 기준으로 투석량을 정하고 있으며 주당 크레아티닌 청소율도 흔히 사용하고 있다.
Canada-USA Peritoneal Dialysis Study (CANUSA 연구)는 1990년대 초반에 시행된 것으로 캐나다와 미국에서 복막투석을 새롭게 시작하는 680명의 환자를 대상으로 이루어진 관찰적 연구로써, 주당 Kt/Vurea가 0.1 감소할 때마다 사망위험이 5%가량 증가한다고 발표하였다[17]. 따라서 1997년에 발표된 미국의 NKF-DOQI 진료지침에서는 복막투석환자에서 최소한 주당 Kt/Vurea가 2.0 이상 유지해야 한다고 권고를 했었다. 그러나 멕시코에서 발표한 ADEMEX 연구에 의하면 2 L X 4 회의 표준투석을 한 환자와 크레아티닌 청소율을 60 L/wk 이상으로 유지한 고투석량 투석군의 생존율의 차이를 보이지 않았다(Table 3) [18]. 또한 홍콩에서 시행한 연구도 유사한 결과를 보였는데, 주당 Kt/Vurea를 1.5-1.7, 1.7-2.0, 2.0 이상의 세 군으로 나누어 비교하였는데 사망률의 차이는 없었다[19]. 국내에서도 역시 Park 등[20]이 주당 Kt/Vurea가 2.1 이상인 군과 2.1 이하인 군을 비교했을 때 사망률의 통계학적 차이는 보이지 않는다고 보고한 바 있다. 또한 CANUSA 연구를 재분석하여 보고한 결과에 의하면 잔여신기능을 제외한 주당 Kt/Vurea가 생존율에 큰 영향을 미치지 않는다고 보고하였다[21].
이런 연구결과를 바탕으로 최근에는 미국의 NKF-DOQI와 유럽의 신장학 단체 등에서 복막투석환자에서 총 주당 Kt/Vurea를 최소한 1.7 이상은 넘도록 권고하고 있다[2223]. ADEMEX (ADEquacy of PD in MEXico) 연구에서 생존율의 차이를 보이지는 않았으나 주당 Kt/Vurea가 1.7 미만으로 유지된 군에서 심부전으로 사망한 환자가 더 많았으며, 요독증상, 고칼륨혈증 및 산혈증 등의 다양한 합병증의 비율이 더 높았기 때문이다. 또한 대조군에서 더 많은 환자가 중도 탈락하였기 때문에 주당 Kt/Vurea 의 최소량을 지키도록 권고하지만 개인별, 임상양상에 따라서 요독증상이나 다른 합병증이 발생하는 경우 Kt/Vurea의 양을 늘릴 필요가 있을 수도 있다.
복막투석환자는 혈액투석과 달리 투석 시작 후의 잔여 신기능이 더 잘 보전되는 것으로 알려져 있다. 잔여 신기능은 24시간 소변을 모아서 크레아티닌 청소율 및 요소 청소율을 구한 후 그 평균으로 계산한다. 재분석한 CANUSA 연구에 의하면 잔여 신기능이 유지되는 환자의 경우 복막투석에 의한 요독의 제거보다 잔여신기능이 환자 생존율에 더 큰 영향을 미친다[21]. 하지만 국내의 후향적 연구보고에 의하면 잔여신기능이 사망률에 미치는 영향이 크지 않다는 연구결과도 있다[25]. 따라서 잔여신기능이 가지는 의미에 대해서는 논란의 여지가 있긴 하지만, 잔여신기능이 남아 있을 경우, 체액량 조절과 혈압 조절이 더 양호하고, 수분섭취량이 늘어나므로 삶의 질을 높을 수 있어서 생존율이 향상에 도움이 될 것으로 사료된다. 특히 안지오텐신 전화효소억제제나 안지오텐신 수용체 차단제와 이뇨제는 혈압 조절과는 독립적으로 잔여신기능 유지에 도움이 된다는 연구결과가 있어 잔여신기능이 유지되는 환자에서 투약을 고려해야 한다[2627].
전국에 34개 참여병원으로 구성된 말기신부전 임상연구센터(Clinical Research Center for End Stage Renal Disease)에서 전향적 코호트를 구성하여 혈액투석환자의 적절도를 구하였다. 2012년 11월까지 등록되어 혈액투석 중인 환자를 대상으로 등록초기 3개월 이내의 Kt/Vurea를 분석한 결과를 Figure 1에 표시하였다(unpublished data). 혈액투석환자는 투석중인 구환에서 1,295명이, 투석을 처음 시작하면서 코호트에 등록된 환자 중 473명에서 Kt/Vurea를 3개월 내에 측정하였다. 구환의 평균 Kt/Vurea는 1.49±0.28이였고, NKF-DOQI 진료지침에서 제시한 최소 목표치인 1.2에 미치는 못하는 환자는 8.5%였다. 반면 신환에서는 평균 Kt/Vurea는 1.3±0.4 이였고, 최소 목표치인 1.2에 미치는 못하는 환자는 28.9%에 달했다. 투석 후 초기 환자들은 적응기간 중 투석량을 천천히 늘리는 과정이어서 목표치에 미달하지 못한 것으로 사료되며, 추후 지속적인 코호트연구를 통해 적절도에 대한 분석을 시행할 예정이다.
미국의 경우 Kt/Vurea에 대한 목표치에 95% 이상의 환자가 도달함에도 불구하고 일반인구에 비해 심혈관질환의 사망률이 10배 이상을 보인다. 따라서 투석의 지표인 Kt/Vurea만으로는 적절한 투석의 지표로 삼기는 어려울 것으로 보인다. 우선 소분자물질 청소율을 기반으로 Kt/Vurea를 적절히 유지해야 하고, 환자 개개인의 임상양상과 함께 수분상태, 혈압, 산염기 균형, 빈혈, 영양상태, 염증, 칼슘·인 등의 무기질 대사, 중분자물질 청소율 등의 여러 인자를 모두 합해서 투석적절도의 지표로 이용하여야 한다(Table 4) [28]. 이 지표들 중 특히 수분상태와 중분자물질 청소율에 대해 이야기해 보고자 한다.
복막투석 환자에서 체액과다는 흔히 관찰되는데, 특히 2006년에 발표된 International Society for Peritoneal Dialysis에서는 투석적절도와 연관된 진료지침의 제목을 용질과 수분의 제거라고 명명하였다[29]. 비록 무작위대조연구에서는 수분 조절이 이환율과 사망률를 낮추지는 못하였지만 EAPOS (European Automated Peritoneal Dialy-sis Outcomes Study European Automated Peritoneal Dialysis Outcomes Study) 연구에 의하면 무뇨의 자동복막투석환자에게 복막 초여과량은 생존의 유의한 예측인자로 초여과량이 750 mL/day 이하인 경우 사망률이 증가하였다[3031]. 복막투석환자에게서 체액과다 상태는 심박출량을 증가시키고 전신 혈관 저항성을 증가시켜 혈압을 올리고 좌심실 비대나 울혈성심부전 등의 결과를 일으킬 수 있다. 많은 염분과 수분의 제거는 적절한 수분상태를 보다 더 잘 조절할 수 있고 혈압조절을 더 용이 하게 할 수 있게 도와준다. 따라서, 모든 복막투석환자는 일정한 간격으로 수분상태를 평가해야 하며, 그 주기는 환자상태를 고려하여 정해야 하겠지만, 적어도 1-3개월에 한 번은 평가해야 한다. 혈액투석환자들은 건체중을 정해서 체중을 유지하게 되는데 투석 후 환자가 견딜 수 있는 가장 낮은 체중을 의미하게 된다[32]. 따라서 고혈압약물의 처방 없이 혈압이 정상적으로 유지되는 체중을 말하는데, HEMO 연구에 의하면 고혈압약물 치료에도 불구하고 72% 환자가 고혈압을 보인다[33]. 따라서 적절한 체액 균형 상태를 유지하는 것은 복막투석, 혈액투석환자에게 공히 필요한 것으로 환자의 혈압을 적절히 유지하고 심장기능을 유지하여 생존율을 높일 것으로 생각된다.
소분자물질 청소율만 이용하여 투석적절도를 구하면 분자량이 큰 중분자물질이나 단백결합물질에 대한 평가가 어렵다. 흔히 β2-마이크로글로블린은 중분자물질의 주요 표지자로 알려져 있다. 분자량이 크기 때문에 기존의 혈액투석으로는 중분자물질과 단백결합물질의 제거가 용이하지 않아서 투석액의 속도를 늘리거나 고유량 혈액투석 혹은 대류를 이용한 혈액여과투석법 등의 다양한 시도가 이루어지고 있다[34]. 고유량 혈액투석은 고유량 투석기를 사용하는 방법으로 분자량이 적은 요소 청소율뿐 아니라 분자량이 큰 β2-마이크로글로블린 청소율도 증가하게 된다. 고유량 투석을 이용한 Membrane Permeability Outcome 연구에서 β2-마이크로글로블린의 농도가 낮을수록 생존율의 향상을 기대할 수 있다는 결과가 있다[35]. 또한 Cystatin C 등과 같은 물질을 이용하여 중분자량 요독물질의 제거를 측정하려는 시도도 있었다[36]. 하지만 대규모 연구에서 아직까지 이런 긍정적 효과를 확인하지 못하였으므로 추가적인 연구결과를 필요로 한다.
투석치료가 필요한 말기신부전 환자의 유병률은 지속적으로 증가하고 있지만 사망률은 일반인구에 비해 의미 있게 높아 적절한 투석치료를 반드시 필요로 한다. 역사적으로 요소는 신부전증의 중요한 요독소로 여겨져 왔으며 임상적으로 요독증이라는 용어도 요소에서 유래하였다. 현재 요소는 중요한 독성 요독물질은 아니어도 측정이 용이하고 임상양상을 잘 반영하므로 말기신부전 환자에서 투석적절도의 대리지표인 Kt/Vurea를 계산하는데 주로 사용된다. 그러나 단순히 요소를 기반으로 한 Kt/Vurea로만 투석적절도를 평가할 수는 없으며 임상적인 양상과 함께 수분상태, 혈압, 산염기 균형, 빈혈, 영양상태, 염증, 칼슘·인 등의 무기질 대사, 중분자물질 청소율에 의한 종합적인 평가를 필요로 한다. 또한 복막투석환자에서는 잔여신기능을 유지하기 위한 노력이 필요할 것이며 환자의 삶의 질을 적절히 유지시켜 주는 것이 생존율을 높이고 이환율을 줄이는 중요한 요인이 될 것이다. 따라서 적절한 투석을 통해 환자의 장기 생존율과 삶의 질이 더욱 향상되기를 기대하며 투석적절도에 대한 지속적인 연구가 필요할 것으로 생각된다.
본 논문은 투석환자가 적절한 투석을 받고 있는지의 지표, 즉 투석적절도의 지표들의 개념을 정리하였고 그것의 효율성과 투석환자의 생존율과의 관련성을 기술한 논문이다. 우리가 흔히 사용하는 요소역동모델을 비롯한 여러 지표들의 계산방법, 투석환자에서의 목표치, 유용성, 제한점 등에 대해 정리하였다. 또한 투석적절도와 생존율과의 관계를 살펴본 연구들을 근거로 진료지침들에서 투석적절도의 기준치가 정해진 근거를 잘 설명하였다. 예비결과이긴 하지만 말기신부전 임상연구센터에 등록된 국내 자료들을 분석하여 우리나라 환자들의 투석적절도의 현황을 보고하였다는 점도 의의가 있다고 생각된다. 추후 지속적인 코호트연구를 통해 더 많은 국내환자들을 대상으로 한 투석적절도의 보고를 기대한다.
[정리: 편집위원회]
Figures and Tables
Figure 1
Distribution of Kt/Vurea in prevalent (A) and incident (B) hemodilalysis patients from Clinical Research Center for End Stage Renal Disease Registry (unpublished data).

Table 2
Clinical studies examining the influence of the dose of hemodialysis
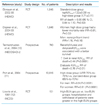
HEMO, Hemodialysis study; RCT, randomized controlled study; spKt/Vurea, single-pool Kt/Vurea; RR, relative risk; CI, confidence interval; NECOSAD, Netherlands Cooperative Study on the Adequacy of Dialysis; URR, urea reduction ratio; NCDS, National Cooperative Dialysis Study; BUN, blood urea nitrogen.
Acknowledgement
This study was supported by a grant of the Korea Healthcare Technology R&D Project, Ministry of Health and Welfare, Republic of Korea (HI10C2020).
References
2. Foley RN, Hakim RM. Why is the mortality of dialysis patients in the United States much higher than the rest of the world? J Am Soc Nephrol. 2009; 20:1432–1435.

3. Seok SJ, Kim JH, Gil HW, Yang JO, Lee EY, Hong SY. Comparison of patients starting hemodialysis with those underwent hemodialysis 15 years ago at the same dialysis center in Korea. Korean J Intern Med. 2010; 25:188–194.

5. Vanholder R, De Smet R, Glorieux G, Argiles A, Baurmeister U, Brunet P, Clark W, Cohen G, De Deyn PP, Deppisch R, Descamps-Latscha B, Henle T, Jorres A, Lemke HD, Massy ZA, Passlick-Deetjen J, Rodriguez M, Stegmayr B, Stenvinkel P, Tetta C, Wanner C, Zidek W. European Uremic Toxin Work Group (EUTox). Review on uremic toxins: classification, concentration, and interindividual variability. Kidney Int. 2003; 63:1934–1943.

6. Choe TS, Kim SS, Kwon YJ, Cho WY, Kim HK, Woo DJ. Effect of continuous ambulatory peritoneal dialysis on beta-2-microglobulin in the patients with diabetic renal failure. Korean J Intern Med. 1991; 41:406–414.
7. Kang SH, Park CW. Adequacy of dialysis: beyond Kt/V. Korean J Nephrol. 2010; 29:544–550.
8. Eknoyan G, Beck GJ, Cheung AK, Daugirdas JT, Greene T, Kusek JW, Allon M, Bailey J, Delmez JA, Depner TA, Dwyer JT, Levey AS, Levin NW, Milford E, Ornt DB, Rocco MV, Schulman G, Schwab SJ, Teehan BP, Toto R. Hemodialysis (HEMO) Study Group. Effect of dialysis dose and membrane flux in maintenance hemodialysis. N Engl J Med. 2002; 347:2010–2019.

9. Depner T, Daugirdas J, Greene T, Allon M, Beck G, Chumlea C, Delmez J, Gotch F, Kusek J, Levin N, Macon E, Milford E, Owen W, Star R, Toto R, Eknoyan G. Hemodialysis Study Group. Dialysis dose and the effect of gender and body size on outcome in the HEMO Study. Kidney Int. 2004; 65:1386–1394.

10. Termorshuizen F, Dekker FW, van Manen JG, Korevaar JC, Boeschoten EW, Krediet RT. NECOSAD Study Group. Relative contribution of residual renal function and different measures of adequacy to survival in hemodialysis patients: an analysis of the Netherlands Cooperative Study on the Adequacy of Dialysis (NECOSAD)-2. J Am Soc Nephrol. 2004; 15:1061–1070.

11. Port FK, Wolfe RA, Hulbert-Shearon TE, McCullough KP, Ashby VB, Held PJ. High dialysis dose is associated with lower mortality among women but not among men. Am J Kidney Dis. 2004; 43:1014–1023.

12. Lowrie EG, Laird NM, Parker TF, Sargent JA. Effect of the hemodialysis prescription of patient morbidity: report from the National Cooperative Dialysis Study. N Engl J Med. 1981; 305:1176–1181.

13. Gotch FA, Sargent JA. A mechanistic analysis of the National Cooperative Dialysis Study (NCDS). Kidney Int. 1985; 28:526–534.

14. Hemodialysis Adequacy 2006 Work Group. Clinical practice guidelines for hemodialysis adequacy, update 2006. Am J Kidney Dis. 2006; 48:Suppl 1. S2–S90.
15. Oh JS, Kim SM, Sin YH, Kim JK, Son YK, An WS, Kim SE, Kim KH. Reliability of hemodialysis adequacy measured by ionic dialysance. Korean J Nephrol. 2011; 30:278–284.
16. Locatelli F, Canaud B. Dialysis adequacy today: a European perspective. Nephrol Dial Transplant. 2012; 27:3043–3048.

17. Canada-USA (CANUSA) Peritoneal Dialysis Study Group. Adequacy of dialysis and nutrition in continuous peritoneal dialysis: association with clinical outcomes. J Am Soc Nephrol. 1996; 7:198–207.
18. Paniagua R, Amato D, Vonesh E, Correa-Rotter R, Ramos A, Moran J, Mujais S. Mexican Nephrology Collaborative Study Group. Effects of increased peritoneal clearances on mortality rates in peritoneal dialysis: ADEMEX, a prospective, randomized, controlled trial. J Am Soc Nephrol. 2002; 13:1307–1320.

19. Lo WK, Ho YW, Li CS, Wong KS, Chan TM, Yu AW, Ng FS, Cheng IK. Effect of Kt/V on survival and clinical outcome in CAPD patients in a randomized prospective study. Kidney Int. 2003; 64:649–656.

20. Park HC, Kang SW, Choi KH, Ha SK, Han DS, Lee HY. Clinical outcome in continuous ambulatory peritoneal dialysis patients is not influenced by high peritoneal transport status. Perit Dial Int. 2001; 21:Suppl 3. S80–S85.

21. Bargman JM, Thorpe KE, Churchill DN. CANUSA Peritoneal Dialysis Study Group. Relative contribution of residual renal function and peritoneal clearance to adequacy of dialysis: a reanalysis of the CANUSA study. J Am Soc Nephrol. 2001; 12:2158–2162.

22. Dombros N, Dratwa M, Feriani M, Gokal R, Heimbürger O, Krediet R, Plum J, Rodrigues A, Selgas R, Struijk D, Verger C. EBPG Expert Group on Peritoneal Dialysis. European best practice guidelines for peritoneal dialysis. 7 Adequacy of peritoneal dialysis. Nephrol Dial Transplant. 2005; 20:Suppl 9. ix24–ix27.
23. Clinical practice recommendations for peritoneal dialysis adequacy. Am J Kidney Dis. 2006; 48:Suppl 1. S130–S158.
24. Termorshuizen F, Korevaar JC, Dekker FW, van Manen JG, Boeschoten EW, Krediet RT. NECOSAD Study Group. The relative importance of residual renal function compared with peritoneal clearance for patient survival and quality of life: an analysis of the Netherlands Cooperative Study on the Adequacy of Dialysis (NECOSAD )-2. Am J Kidney Dis. 2003; 41:1293–1302.

25. Kim SG, Kim NH. The effect of residual renal function at the initiation of dialysis on patient survival. Korean J Intern Med. 2009; 24:55–62.

26. Medcalf JF, Harris KP, Walls J. Role of diuretics in the preservation of residual renal function in patients on continuous ambulatory peritoneal dialysis. Kidney Int. 2001; 59:1128–1133.

27. Suzuki H, Kanno Y, Sugahara S, Okada H, Nakamoto H. Effects of an angiotensin II receptor blocker, valsartan, on residual renal function in patients on CAPD. Am J Kidney Dis. 2004; 43:1056–1064.

28. Goldberg R, Yalavarthy R, Teitelbaum I. Adequacy of peritoneal dialysis: beyond small solute clearance. Contrib Nephrol. 2009; 163:147–154.

29. Lo WK, Bargman JM, Burkart J, Krediet RT, Pollock C, Kawanishi H, Blake PG. ISPD Adequacy of Peritoneal Dialysis Working Group. Guideline on targets for solute and fluid removal in adult patients on chronic peritoneal dialysis. Perit Dial Int. 2006; 26:520–522.

30. Ates K, Nergizoglu G, Keven K, Sen A, Kutlay S, Erturk S, Duman N, Karatan O, Ertug AE. Effect of fluid and sodium removal on mortality in peritoneal dialysis patients. Kidney Int. 2001; 60:767–776.

31. Brown EA, Davies SJ, Rutherford P, Meeus F, Borras M, Riegel W, Divino Filho JC, Vonesh E, van Bree M. EAPOS Group. Survival of functionally anuric patients on automated peritoneal dialysis: the European APD Outcome Study. J Am Soc Nephrol. 2003; 14:2948–2957.

32. Charra B, Laurent G, Chazot C, Calemard E, Terrat JC, Vanel T, Jean G, Ruffet M. Clinical assessment of dry weight. Nephrol Dial Transplant. 1996; 11:Suppl 2. 16–19.

33. Rocco MV, Yan G, Heyka RJ, Benz R, Cheung AK. HEMO Study Group. Risk factors for hypertension in chronic hemodialysis patients: baseline data from the HEMO study. Am J Nephrol. 2001; 21:280–288.

34. Eloot S, Van Biesen W, Vanholder R. A sad but forgotten truth: the story of slow-moving solutes in fast hemodialysis. Semin Dial. 2012; 25:505–509.





 PDF
PDF ePub
ePub Citation
Citation Print
Print





 XML Download
XML Download