Abstract
H1-antihistamines have been prescribed widely for the treatment of allergic diseases, such as rhinitis, atopic dermatitis, and urticaria besides common colds since the 1940s. H1-antihistamines are classified by chemical structures (akylamine, piperazine, piperidine, ethanolamine, ethylendiamine, and phenothiazine) or functionally by permeability through blood brain barrier (first or second generation). The first generation antihistamines have been prescribed up to now with several adverse effects such as central nervous system dysfunction, anticholinergic and antiserotonic action and cardiotoxicity with overdose. Hence second generation antihistamines are recommended for the treatment of allergic rhinitis and urticaria. Physicians should consider concomitant diseases or medications when prescribing first generation antihistamines.
항히스타민제는 임상진료에서 알레르기비염, 아토피피부염, 두드러기 등의 알레르기질환뿐만이 아니라 상기도염의 증상에 대해서 광범위하게 사용되고 있다. 현재 전세계적으로 40종 이상의 항히스타민제가 사용되고 있으며 1940년대 이후에 도입되기 시작한 1세대 H1-항히스타민제와 1980년대 새로 개발된 2세대 H1-항히스타민제가 함께 사용되고 있다. 2세대 H1-항히스타민제는 많은 연구들에 의해 약물동력학(pharmacodynamic-kinetic)이 자세하게 밝혀졌으나, 1세대 H1-항히스타민제는 50여 년 이상의 매우 긴 역사를 가졌음에도 약물동력학 연구가 많지 않다. H1-항히스타민제는 1940년대부터 임상진료에서 사용되어 왔으며 1950년대에는 이들의 항알레르기 특성이 밝혀져 알레르기질환의 치료제로 도입되었다. 1990년대 이후에는 H1 이외에 H2, H3, H4의 히스타민수용체가 발견되었고 또한 기존의 히스타민수용체의 개념에 변화가 있었다[12]. 본 글에서는 히스타민수용체에 대한 새로운 개념을 소개하고, H1-항히스타민제의 작용기전에 대한 이해를 통하여 항히스타민제의 효과적이고 안전한 처방에 도움을 제공하고자 한다.
히스타민은 인체에 기본 구성성분으로 낮은 분자량을 가지며 히스티딘 디카복실라제(histidine decarboxylase)에 의해 생성된다. 히스티딘 디카복실라제는 주로 중추신경계, 위점막의 벽세포(parietal cell), 비만세포, 호염구 등 전신에 분포한다. 혈소판, 임파구, 호중구 등의 면역세포도 히스타민을 생산하고 분비하나, 세포 내에서 생산하여 저장할 수 있는 세포는 단지 호염구와 비만세포뿐이다. 세포 외로 분비된 히스타민은 대부분 히스타민 N-메틸트렌스퍼라제(histamine N-methyltransferase)과 모노아민옥시다제(monoamine oxidase)에 의해 대사되어 소변으로 배출된다. 히스타민은 세포 증식, 분화와 혈구 생성, 염증반응, 조직 재생과 신경 전달 등에 관여한다[3].
히스타민은 조직에서 H1, H2, H3, H4의 4가지 수용체를 통하여 작용을 나타낸다. 혈관 확장, 혈관의 투과성 증가는 H1-, H2-수용체를 통하여 나타나고, 피부신경의 자극에 의한 소양증 및 기관지 평활근의 수축은 H1-수용체를 통하여 나타나며, 위산 증가는 주로 H2-수용체를 통하여 작용을 나타낸다. H3-수용체는 신경전달물질의 분비 조절에 관여하며 H4-수용체는 염증 반응 및 골수모세포 등의 분화에 관여하는 것으로 알려져 있다. 현재 H1-, H2-수용체 억제제만이 임상적으로 이용할 수 있다. 히스타민수용체는 복잡한 구조형태이며 4개의 아형 모두 G단백연결수용체(G-protein coupled receptor, GPCR)에 속한다. 세포의 분화단계나 미세환경 변화에 의해 히스타민수용체의 발현이 달라지면서 히스타민의 기능이 달라지게 된다(Table 1). Gq/11-coupled H1-수용체의 활성화는 포스포리파아제 C (phospholipase C)를 통해 inositol-1,4,5-triphosphate, diacylglycerol을 형성하고 세포 내 칼슘을 증가시킨다. 다른 작용 기전으로는 PL-D와 PL-A2, NF-κB 등을 활성화시키는 것으로 알려져 있다. H1-항히스타민제는 혈관이나 신경세포 등에 있는 H1-수용체에 대한 히스타민의 작용을 억제하여 항알레르기 염증 효과를 보이기도 하지만 세포 내의 칼슘의 증가를 통한 NF-κB를 활성화로 항원전달(antigen presentation), 염증성 사이토카인, 세포 접합물질(cell adhesion molecule), 화학주성을 감소시켜서 알레르기 염증 반응의 저하를 유도하는 것으로 알려져 있다[45] (Figure 1).
히스타민수용체를 포함하는 GPCR의 기본적인 개념에 변화가 있었다. 수용체와 결합하여 작용을 억제한다는 길항제의 개념에서 ‘기본구성 GPCR과의 역작용성(constitutive GPCR과 inverse agonism)’의 개념으로 바뀌었다. 이는 체내에서 수용체가 활성화와 비활성화의 두 상태로 존재하면서 평형을 이루는데 이들의 상태 변화가 전체적인 GPCR의 활성도에 영향을 미친다는 것이다. 즉, 어떤 작용체가 활성화 상태의 수용체에 결합한다면 이는 전체적인 활성화 상태로 진행하고, 반면에 비활성화 상태의 수용체에 대하여 우선적으로 결합한다면 정반대의 반응이 나타나는 것이다. 따라서 역작용제나 작용제의 성격에 따라서 결과적인 반응의 정도가 달라지게 된다. 변화된 개념에 근거하면 H1-항히스타민제는 H1-수용체의 역작용제로서 H1-수용체 비활성화 구조(inactive confirmation)와 결합하고 안정화시켜 수용체를 비활성화 상태의 평형상태를 유도하게 된다[124].
H1-수용체는 IL-3, IL-4, 히스타민 등에 의해 그 발현이 증가하며 기도와 혈관의 평활근을 수축시킨다. 또한 혈관내피세포 투과성의 증가시키고 prostacyclin, platelet activating factor, nitric oxide 등의 증가를 초래한다. 알레르기비염이나 아나필락시스에서 보이는 제1형 과민반응은 H1-수용체의 활성화에 의한 전형적인 반응이다[156].
히스타민을 생산하는 신경세포들은 주로 tuberomammillary 핵체에 있으며 이들의 활성화는 대뇌, 소뇌, 뇌하수체 등의 H1-수용체를 활성화시킨다. 활성화된 H1-수용체는 수면주기의 각성과 인지작용, 기억능력, 수분조절, 식욕억제, 체온조절과 심혈관계 조절, 스트레스에 의한 ACTH 분비 등을 매개한다. 중추신경계에서 아민계열신경전달물질(neurotransmitter amine)은 단독으로 작용하기보다는 통합-복합적인 작용으로 나타난다. 항히스타민은 무스카린(muscarin 수용체, M3)에 결합하여 길항제로 작용하여 항콜린 작용을 한다. 또한 1세대 항히스타민제는 항세로토닌과 항아드레너직 작용 등의 부가적인 신경반응을 나타낸다[57].
항히스타민제의 효과는 항히스타민과 결합한 히스타민수용체의 정도에 따라 결정되며 이들의 결합은 수용체 주위의 히스타민과 항히스타민제의 상대적 농도에 의하여 좌우된다. 혈중 또는 피부조직의 항히스타민제 농도는 팽진 등의 반응과는 상관관계를 보이지만 중추신경계반응과의 관련성은 낮다[7].
H1-항히스타민제는 화학구조와 기능에 따라 분류한다. 화학구조에 따라서는 akylamine, piperazine, piperidine, ethanolamine, ethylendiamine, phenothiazine의 6군으로 구분하며 기능에 따라서는 혈액뇌장벽(blood brain barrier)의 투과여부에 따라 1세대와 2세대 항히스타민으로 분류한다[12].
1세대 H1-항히스타민제의 방향족고리와 alkyl 치환체는 지질친화성(lipophilicity)를 가지며 이와 함께 작은 분자량과 양성전하(positive electrostatic charge)로 인해 중추신경계로의 유입이 쉽게 이루어진다. 또한 일부 1세대 H1-항히스타민제는 혈액뇌장벽에서 외부물질을 차단하는 P-glycoprotein efflux pump를 피하는 특성을 나타낸다. 이러한 특성들의 정도에 따라 항히스타민제의 중추신경계에 영향을 미치는 정도가 달라지게 된다. 대표적인 1세대 항히스타민제로는 chlorpheniramine, hydroxyzine, piprinhydrinate, mequitazine 등이 있고 2세대 항히스타민제와는 달리 주사제로도 사용 가능한 몇몇 약제들이 있다. 1세대 항히스타민제도 2세대 항히스타민제처럼 빨리 흡수되고 작용도 빠르다. 그러나 약효지속시간이 짧아서 여러 번 투여를 해야 하는 반면, 졸음이나 기억력 저하 등의 중추신경계에 대한 작용은 지속되는 경향이 있다[3].
2세대 항히스타민제는 혈액뇌장벽을 투과하는 특성이 매우 낮거나 없어 진정작용이 매우 낮으며 대부분이 1세대와 관련이 있는 물질이다. Acrivastine과 cetirizine은 각각 triprolidine과 hydroxyzine의 대사물이다. Levocetirizine은 cetirizine의 광학이성체(enantiomer)이며, desloratadine과 fexofenadine은 각각 loratadine과 terfenadine의 대사물이다. 대부분의 2세대 항히스타민제는 경구 복용 3시간 이내에 최대 약물 농도에 이르며 1-2시간 이내에 효과를 나타내기 시작하며 5-8시간에 최대 효과를 나타낸다. 2세대 항히스타민제는 작용시간이 24시간 이어서 대부분 하루 1회 경구 복용한다. 규칙적 복용 후에도 내성이 발생하지 않으나 복용 중단 후에는 잔존 효과가 3-4일정도 유지되기도 한다[123].
H1-항히스타민제는 광범위하게 사용되고 있다. 흔히 상기도 감염과 알레르기질환에서 처방될 뿐만 아니라, 일부에서는 진토, 진정, 진통제 역할로 사용되고 있다. 각각의 사용에서의 효과와 범위를 알아보겠다.
흔히 상기도 감염 증상에 사용하는 일반판매약은 항히스타민, 항울혈제, 진해거담제의 복합제이다. 국내에서 사용되는 일반판매약에 함유된 항히스타민제는 1세대로 chlorpheniramine, triploridine 등이 사용되고 있다. 2세 이하에서 용량은 정해져 있지 않으며 소아에서 용량은 성인에서 추론된 용량일 뿐이다. 전 연령에 사용이 가능한 hydroxyzine을 제외하고는 2세 이상에서만 사용이 허가되어 있다. 일반판매약의 안전성과 관련된 연구에서 12세 이하에서 응급실 방문과 관련이 높았고 사망과도 관련성을 보여주었다. 미국 식품의약국은 감기에 대한 일반판매약의 2세 이하에서 사용을 금하고, 6세 이하에서 약제의 사용 시에 경고를 하고 있다. 이들 약제의 위험성과 관련인자는 1) 2세 이하 연령, 2) 진정제의 사용, 3) 탁아시설, 4) 2개 이상의 동일성분 약제의 혼용, 5) 약용량 측정 도구의 부재, 6) 약제의 오인, 7) 성인용약제의 사용 등이다. 소아 감기에서 일반판매약 복용은 원칙적으로 추천되지 않으며 만약 복용 시에는 위험성관련 위험인자를 유념해야 할 것이다[89]. 1세대 항히스타민제의 콧물, 재채기에 대한 효과는 낮으며 진정효과에 의해 효과가 과장되어 보일 수 있다. 항울혈제와의 복합제도 소아감기에서는 효과개선에 특별히 뚜렷하지 않은 것으로 나타났다[1011].
알레르기질환에서는 주로 2세대 항히스타민제가 사용된다. 2세대 항히스타민제는 경구, 국소(비강, 결막)의 투여경로와 연령에 따른 사용지침이 잘 정립되어 있다. 비강분무제는 경한 작열감, 재채기, 콧물, 코피, 쓴맛의 증상이 발생할 수 있다.
항히스타민제는 콧물, 재채기, 비소양증에 대하여 항류코트리엔제나 크로몬제보다 효과적이나 코막힘 증상에 대해서는 거의 효과가 없고 전반적으로 국소스테로이드제 보다 효과가 적다. 비강 국소항히스타민제는 경구 항히스타민제보다 약효발현이 빨라서 투여 5-15분 경에 효과가 나타나며 일반적으로 하루에 2회 투여한다. 최근에는 국소스테로이드제와 결합된 항히스타민제가 준비 중이다[12]. 알레르기결막염 증상에는 2세대 경구 항히스타민제와 국소점안제가 사용될 수 있다. 국소점안제는 투여 5분 이내에 소양증을 감소시켜준다. 최근에는 항히스타민-항알레르기 복합효과 약제가 흔히 사용되고 있다[1314].
급성, 만성 두드러기에서 항히스타민은 소양증, 팽진과 발적의 감소와 삶의 질을 향상시키는 것으로 밝혀졌다. 만성 두드러기에 대한 장기 복용의 안전성이나 효과에 대한 연구는 2세대 항히스타민에 국한되어 있다. 두드러기의 치료에서 1세대 항히스타민은 부작용에서 용량-부작용 반응의 상호관련성이 확연하고, 효과의 지속시간은 짧으나 체내 반감기는 비교적 길어 더 이상 추천하지 않으며 여러 치료가이드라인에서 2세대 항히스타민을 추천한다. 2주 동안 2세대 항히스타민제의 일반적 용량을 복용하여 효과가 없을 경우 4배까지 용량을 증량하여 4주간 경과 관찰을 추천 하고 있다. 이상의 치료에 반응하지 않는 두드러기의 경우에는 항류코트리엔제, H2-항히스타민제, 경구스테로이드, cyclosporine 등의 다른 약제의 추가 사용을 고려할 수 있다. 소아에서는 성인에 비하여 항히스타민제에 대한 연구가 미흡하지만 현재는 두드러기의 치료에 1세대 히스타민을 더 이상 추천하지 않으며 2세대 항히스타민을 체중에 근거하여 처방하고, 약용량의 증량도 성인의 경우와 같이 고려할 수 있다[315].
히스타민은 아나필락시스에서 증상 발현의 주된 물질이다. H1-항히스타민제는 아나필락시스에서 두드러기, 발진과 소양증을 감소시킬 수는 있지만 치명적인 호흡기, 심혈관계 증상을 예방하거나 완화시킬 수는 없다. 아나필락시스의 치료에서 1세대 항히스타민제가 경구와 비경구로 사용되지만 경구약제의 경우 효과 발현에 1-2시간 이상 소요되며, 경구와 주사제 모두에서 졸음이나 의식저하를 유발하므로 추천하지 않는다. 때때로 관찰되는 항히스타민제 투여에 의한 아나필락시스 증상의 호전은 신체 내에서 분비되는 epinephrine이나 angiotension같은 물질에 의한 자연회복 경과이다[316]. 2세대 항히스타민제는 알레르겐 면역치료, 혈관조영제, 수액제제, morphine, protamine 등의 약제 사용과 관련된 전신 증상의 예방을 위해 사용되기도 한다[17].
아토피피부염에서 소양증은 히스타민 이외에 neuropeptide, ecosanoid, interleukin 등에 의해서도 발생한다. 그러므로 H1-항히스타민제는 소양증의 호전에 부분적인 효과가 있을 뿐이고 확연한 소양증의 감소나 국소 스테로이드 사용을 감소시키는 효과에 대해서는 아직 정립된 바가 없다. 1세대 H1-항히스타민제의 진정, 수면 효과가 아토피피부염의 소양증에 대한 효과와 관련된다고 보고 있다[18].
비알레르기성 혈관부종에서 H1-항히스타민제는 효과가 없다. 비알레르기성 비특이적 소양증 등에 H1-항히스타민제가 자주 사용되고 있으나 그 효과는 확립되어 있지 않다. 모기 등의 해충 자상 전의 항히스타민제복용은 팽진, 발진, 가려움을 감소시킬 수 있다[20]. H1-항히스타민제는 급성중이염이나 삼출성중이염에서 항울혈제와 함께 자주 사용되지만 이에 대한 효과나 안정성은 정립되어 있지 않다. 비특이적 기침의 증상 완화를 위해 성인에서 H1-항히스타민제가 사용되고 있지만 소아에서 이들의 사용은 추천되지 않으며 효과도 없다[1]. H1-항히스타민제는 안정제, 불면, 현기증이나 구역질에 대한 증상 완화를 위해 사용되기도 한다. Diphendydramine, hydroxyzine, promethazin등을 안정, 진정효과를 위해 사용하며, diphenhydrinate, meclizine, promethazine 등은 구토, 현기증, 멀미 등에 사용하고 있다. 그러나 이들 약물은 졸림, 집중저하 등의 부작용이 나타날 수 있으므로 운전자나 집중을 요하는 작업에 종사하는 사람들은 복용을 해서는 안 된다[12].
1세대 항히스타민제는 수면/각성 주기에 영향을 미친다. 주간에는 중추신경계에서 히스타민의 분비는 각성 작용을 하며 야간에는 상대적으로 감소되어 각성을 감소시킨다. 따라서 항히스타민의 복용으로 주간에 졸림, 피로감, 기억과 집중장애 등이 나타날 수 있다. 이러한 증상은 1세대 H1-항히스타민제를 복용한 환자의 40-80%에서 호소하였으며 이들 주관적인 증상이 없이도 복용자들은 운동 등의 작업 능력에서 저하된 반응을 보였다. 야간에 항히스타민은 rapid eye movement (REM)수면 시작까지의 잠재기를 증가시켜 REM수면 감소를 초래하여 다음날의 집중력감소, 감각-운동수행력의 감소, 낮잠 입면시간 감소와 작업 기억력저하 등을 일으킨다.
중추신경계에 미치는 작용은 생산업체에서 추천하는 최소량에 의해서도 나타날 수 있다. H1-항히스타민제에 의한 중추신경계의 진정효과는 술(ethanol)이나 benzodiazepine과 같은 안정제와 효과정도가 유사하다. 그러나 소아의 경우에는 일부 환자에서 반대로 중추신경을 흥분시켜 불안, 불면, 떨림이 나타날 수 있다. 1세대 항히스타민제의 반감기는 매우 길어 야간의 취침 시에 복용하더라고 다음날에도 중추신경계반응은 남아있다. 규칙적인 복용에 의한 중추신경제 부작용의 관용(tolerance)이나 항울혈제에 의한 증상의 상쇄를 기대하기도 하지만 이에 대해서는 확인된 바가 없다.
항히스타민제제의 중추신경계 부작용은 여성, 연장자, 작은 체구, 간과 신장기능의 저하, 중추신경계 이상이 있는 경우에 더 흔하므로 투여 시에는 유의해야 한다. 65세 이상의 연장자의 약 25%에서 1세대 H1-항히스타민제의 복용 후에 인지기능 저하를 호소하였고, 집중력 부족, 어눌한 말투, 의식의 변화를 보이기도 하였다[457]. 1세 이하의 소아에서 H1-항히스타민제의 중추신경계 반응에 대한 연구는 없으나 2세대 항히스타민인 cetirizine, levocetizine이나 loratadine을 1년 이상 복용한 1-3세 알레르기질환 소아를 대상으로 한 연구에서 행동, 인지기능에 대한 이상소견은 발견되지 않았다[212223].
H1-항히스타민제에 의한 심독성은 H1-수용체에 의한 것이 아니라, 심장내의 칼륨통로(potassium channel)이상으로 발생한다. 초기 2세대 항히스타민제인 terfenadine과 astemizole이 심독성 부작용으로 가장 잘 알려져 있다. 이들 약물은 심실의 재분극에 중요한 IKr을 이루는 HERG1K+통로를 차단하여 심실재분극을 지연시켜 QT간격을 연장시키며 이러한 현상의 지속은 re-entry 기전에 의해 torsades de pointes 등의 심실 부정맥의 결과를 초래한다. 칼륨 통로들뿐 아니라, 나트륨이나 칼슘 통로들도 관련이 있는 것으로 연구되고 있다. 심독성과 관련된 위험인자로는 중추신경계 증상의 관련된 인자들과 더불어, 기존의 심질환, 전해질 이상, cytochrome P450에 의한 약제 배출을 방해하는 약물이나 식품의 섭취 등이 있다. Terfenadine과 astemizole은 심독성 부작용이 보고된 이후 그 사용이 중단되었으며 현재 사용되고 있지 않다. 하지만 1세대 항히스타민제 중 diphenhydramine, cyproheptadine, hydroxyzine, doxepine 등이 용량의존적으로 심독성을 보이며 국내에서는 diphenhydramine 과용량 복용에 의한 심실부정맥이 보고되어 있다[4524].
변비, 설사, 메스꺼움, 구토 등의 소화장애가 나타날 수 있다. 항콜린작용에 의한 입, 코, 목이 건조함, 드물지만 배뇨장애, 시력장애, 빈맥 등이 나타날 수 있다. 따라서 녹내장, 전립선 비대증, 갑상선 기능항진증, 심장 질환이 있는 환자의 경우에는 투여 시 주의를 요한다. 항세로토닌 효과에 의한 식욕증가와 항아드레날린 효과에 의한 저혈압 등이 나타날 수 있다.
1세대 H1-항히스타민제의 과용량 복용은 자의적 혹은 타의적으로 나타날 수 있다. 소아에서는 성인의 중추신경계 반응과는 달리 과용량 복용 후 혼수상태에 이르기 전에 보챔, 불면, 과반응, 환시, 경련 등의 반응이 나타난다. 또한 항콜린 작용에 의한 발열, 발진, 동공산대, 장운동의 저하나 빈맥, 저혈압이 나타나기도 한다[5]. 항히스타민제의 과다 복용에 대한 특별한 해독제는 없으며 심전도 감시가 반드시 이루어져야 한다. 현재까지 2세대 항히스타민제에 의한 사망 보고는 없다. 소아에서 cetirizine과 loratadine의 20-30배에 이르는 과량의 복용 후에도 경한 증상 외의 심독성이나 중추신경계 이상반응은 없었다[3511].
모든 H1-항히스타민제는 태반을 통과한다. 미국 식품의약국에서는 chlorpheniramine, diphenhydramine, cetirizine, levocetirizine, loratadine과 국소 emedastine, epinastine, olopatadine 등이 임신안전성에서 B등급으로 분류되어 있다. 아직까지 chlorpheniramine의 태아에서 기형 유발의 위험 증가에 대한 보고는 없다. 1세대 항히스타민의 과량 복용은 oxytocin과 같은 효과를 보여 자궁수축이 초래될 수 있고 신생아에서 보챔이나 경련이 나타날 수 있다. 비교적 최근에 시행된 cetirizine과 관련된 전향적 관찰 연구들은 임신 초반기에 cetirizine에 노출된 산모들을 정상 산모들과 비교했을 때 기형, 자연유산, 조산, 저체중 신생아 등의 면에서 정상 산모와 차이가 없음을 보여주었다[1325]. H1-항히스타민제는 모체 복용량의 0.1% 정도만이 모유를 통하여 영아에게 전달되며 영유아에서는 이러한 소량에 의해서도 보챔, 의식저하, 호흡저하 등의 부작용을 보일 수 있으므로 수유 기간에는 2세대 항히스타민제를 권장한다[325].
1940년대부터 H1-항히스타민제는 알레르기비염, 아토피피부염, 두드러기 등의 알레르기질환 뿐만이 아니라 상기도염의 증상에 대해서 광범위하게 사용되어져 왔다. H1-항히스타민제는 화학구조에 따라 akylamine, piperazine, piperidine, ethanolamine, ethylendiamine, phenothiazine의 6군으로 구분하고 기능에 따라서는 혈액뇌장벽(blood brain barrier)의 투과여부에 따라 1세대와 2세대 항히스타민으로 분류한다. 1세대 항히스타민은 오랜 동안 사용되어 왔지만, 중추신경계에 대한 억제 작용과 항콜린, 항세로토닌 작용을 동반하고 과량 복용 시에 심독성을 유발 할 수 있다. 알레르기비염, 두드러기 등의 질환에서 일차적으로 2세대 항히스타민이 추천되고 있으며 1세대 항히스타민의 처방 시에는 환자의 기존 질환이나 복용약물을 고려하여 처방하여야 한다.
본 논문은 알레르기질환의 치료에 가장 많이 사용되고 있는 약물 중의 하나인 항히스타민제에 대하여 약물의 특성과 작용기전과 분류, 그리고 임상적 치료 적응 질환과 항히스타민제의 부작용에 대하여 자세히 소개하고 있다. 감기 치료에 흔히 항히스타민이 사용되고 있지만 그 효과는 확실하지 않다는 것과 두드러기 치료에 처음부터 2세대 항히스타민을 권장하고 있으며 초기 치료에 반응하지 않으면 같은 항히스타민을 4배의 용량까지 올려 사용해보는 치료 순서를 바르게 제시하고 있다. 알레르기질환 치료에 항히스타민이 중요하지만 천식에서는 별 도움이 안되고 아토피피부염에서도 장기간 치료효과가 부족하다는 것을 분명하게 적고 있으며 부작용으로 중추신경계 부작용과 심혈관계 부작용을 정확하게 설명하고 있다. 본 논문은 항히스타민제의 임상사용에 좋은 지침이 될 것으로 판단된다.
[정리: 편집위원회]
Figures and Tables
Figure 1
Anti-inflammatory effect of H1-antihistamine. H1-antihistamines directly inhibit the action of histamine through H1-receptors on neuron and small vessels. Furthermore, they show anti-inflammatory effects through NF-κB and calcuim ion channels (From Simons FE, et al. J Allergy Clin Immunol 2011;128:1139.e4-1150.e4, with permission from Elsevier) [1]. DAG, 1,2-diacylglycerol; ER, endoplasmic reticulum; GDP, guanosine diphosphate; DTP, guamosine triphosphate; IP3, inositol 1,4,5-triphosphate; PIP2, phosphatidylinositol 4,5-bisphosphate; PKC beta, protein kinase C beta; PLC beta, phospholipate C beta.
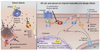
Table 1
Characteristics of the histamine receptors

Modified from Simons FE, et al. J Allergy Clin Immunol 2011;128:1139.e4-1150.e4, with permission from Elsevier [1].
Table 2
Chemical and funcational classification of H1-antihistamine

Modified from Simons FE, et al. J Allergy Clin Immunol 2011;128:1139.e4-1150.e4, with permission from Elsevier [1].
IS, systemic injection; OT, ophthalmic application; NT, nasal application; ST, dermal application.
a)H1-antihistamine current available in Korea.
References
1. Simons FE, Simons KJ. Histamine and H1-antihistamines: celebrating a century of progress. J Allergy Clin Immunol. 2011; 128:1139–1150.e4.
2. Simons FE. Advances in H1-antihistamines. N Engl J Med. 2004; 351:2203–2217.
3. Simons FE, Akdis CA. Adkinson NF, Busse WW, Bochner BS, Holgate ST, Simons FE, Lemanske RF, editors. Histamine and H1-antihistamine. Middleton's allergy: principles and practice. 2009. 7th ed. Philadelphia: Mosby;p. 1517–1548.
4. Leurs R, Church MK, Taglialatela M. H1-antihistamines: inverse agonism, anti-inflammatory actions and cardiac effects. Clin Exp Allergy. 2002; 32:489–498.

5. Church MK, Maurer M, Simons FE, Bindslev-Jensen C, van Cauwenberge P, Bousquet J, Holgate ST, Zuberbier T. Global Allergy and Asthma European Network. Risk of first-generation H(1)-antihistamines: a GA(2)LEN position paper. Allergy. 2010; 65:459–466.
6. O'Mahony L, Akdis M, Akdis CA. Regulation of the immune response and inflammation by histamine and histamine receptors. J Allergy Clin Immunol. 2011; 128:1153–1162.
7. Yanai K, Rogala B, Chugh K, Paraskakis E, Pampura AN, Boev R. Safety considerations in the management of allergic diseases: focus on antihistamines. Curr Med Res Opin. 2012; 28:623–642.

8. Goldman RD; Canadian Paediatric Society, Drug Therapy and Hazardous Substances Committee. Treating cough and cold: guidance for caregivers of children and youth. Paediatr Child Health. 2011; 16:564–569.

9. Dart RC, Paul IM, Bond GR, Winston DC, Manoguerra AS, Palmer RB, Kauffman RE, Banner W, Green JL, Rumack BH. Pediatric fatalities associated with over the counter (nonprescription) cough and cold medications. Ann Emerg Med. 2009; 53:411–417.

10. De Sutter AI, Lemiengre M, Campbell H. Antihistamines for the common cold. Cochrane Database Syst Rev. 2009; (4):CD001267.

11. Ten Eick AP, Blumer JL, Reed MD. Safety of antihistamines in children. Drug Saf. 2001; 24:119–147.

12. Sardana N, Santos C, Lehman E, Craig T. A comparison of intranasal corticosteroid, leukotriene receptor antagonist, and topical antihistamine in reducing symptoms of perennial allergic rhinitis as assessed through the Rhinitis Severity Score. Allergy Asthma Proc. 2010; 31:5–9.

13. Bielory L, Friedlaender MH. Allergic conjunctivitis. Immunol Allergy Clin North Am. 2008; 28:43–58.

14. Greiner JV, Edwards-Swanson K, Ingerman A. Evaluation of alcaftadine 0.25% ophthalmic solution in acute allergic conjunctivitis at 15 minutes and 16 hours after instillation versus placebo and olopatadine 0.1%. Clin Ophthalmol. 2011; 5:87–93.
15. Zuberbier T, Asero R, Bindslev-Jensen C, Walter Canonica G, Church MK, Gimenez-Arnau AM, Grattan CE, Kapp A, Maurer M, Merk HF, Rogala B, Saini S, Sanchez-Borges M, Schmid-Grendelmeier P, Schunemann H, Staubach P, Vena GA, Wedi B. Dermatology Section of the European Academy of Allergology and Clinical Immunology. Global Allergy and Asthma European Network. European Dermatology Forum. World Allergy Organization. EAACI/GA(2)LEN/EDF/WAO guideline: management of urticaria. Allergy. 2009; 64:1427–1443.
16. Lieberman P, Nicklas RA, Oppenheimer J, Kemp SF, Lang DM, Bernstein DI, Bernstein JA, Burks AW, Feldweg AM, Fink JN, Greenberger PA, Golden DB, James JM, Kemp SF, Ledford DK, Lieberman P, Sheffer AL, Bernstein DI, Blessing-Moore J, Cox L, Khan DA, Lang D, Nicklas RA, Oppenheimer J, Portnoy JM, Randolph C, Schuller DE, Spector SL, Tilles S, Wallace D. The diagnosis and management of anaphylaxis practice parameter: 2010 update. J Allergy Clin Immunol. 2010; 126:477–480.e1-42.

17. Schiavino D, Nucera E, Roncallo C, Pollastrini E, De Pasquale T, Lombardo C, Altomonte G, Buonomo A, Patriarca G. Multiple-drug intolerance syndrome: clinical findings and usefulness of challenge tests. Ann Allergy Asthma Immunol. 2007; 99:136–142.

18. Klein PA, Clark RA. An evidence-based review of the efficacy of antihistamines in relieving pruritus in atopic dermatitis. Arch Dermatol. 1999; 135:1522–1525.

20. Karppinen A, Brummer-Korvenkontio H, Petman L, Kautiainen H, Herve JP, Reunala T. Levocetirizine for treatment of immediate and delayed mosquito bite reactions. Acta Derm Venereol. 2006; 86:329–331.

21. Simons FE. Prospective, long-term safety evaluation of the H1-receptor antagonist cetirizine in very young children with atopic dermatitis. ETAC Study Group. Early Treatment of the Atopic Child. J Allergy Clin Immunol. 1999; 104(2 Pt 1):433–440.

22. Grimfeld A, Holgate ST, Canonica GW, Bonini S, Borres MP, Adam D, Canseco Gonzalez C, Lobaton P, Patel P, Szczeklik A, Danzig MR, Roman I, Bismut H, Czarlewski W. Prophylactic management of children at risk for recurrent upper respiratory infections: the Preventia I Study. Clin Exp Allergy. 2004; 34:1665–1672.

23. Simons FE. Early Prevention of Asthma in Atopic Children (EPAAC) Study Group. Safety of levocetirizine treatment in young atopic children: an 18-month study. Pediatr Allergy Immunol. 2007; 18:535–542.

24. Park CS, Kang IG, Ryu HS, Park SS, Lee MJ, Jeong WJ. A case of electrocardiographic and mental change in a patient with a diphenhydramine overdose. J Korean Soc Emerg Med. 2010; 21:405–411.




 PDF
PDF ePub
ePub Citation
Citation Print
Print


 XML Download
XML Download