Abstract
A variety of pharmacologic agents have been developed for the treatment of osteoarthritis. At present, however, none of them has been proven to prevent disease progression, and the medications are used only for symptomatic relief. Thus, non-pharmacologic conservative treatment such as education, weight reduction in the obese, and consistent exercise should be recommended first to maintain fitness and tolerance to physical activity. Medication is then indicated to better control symptoms provided non-pharmacologic measures prove inadequate, and a successful strategy most likely would entail a combination of these non-pharmacologic and pharmacologic approaches. Acetaminophen can be tried first because of its efficacy and relatively safe profile, especially in those with mild osteoarthritis. Nonselective non-steroidal anti-inflammatory drugs may be used in patients with moderate to severe pain, but long-term medication requires caution due to the increased risk of gastrointestinal and renal complications. Selective cyclooxygenase-2 inhibitors can be better tolerated, especially in patients with risk factors for gastrointestinal adverse events, but potential cardiac and cerebrovascular thrombotic events should be considered in those with preexisting cardiovascular disease. Tramadol and opioids are more potent analgesics. However, they are not recommended for routine use due to a high incidence of nausea, constipation, and drowsiness. These agents require close monitoring for those adverse effects, especially in a geriatric population. Lastly, the pharmacologic plan should be individualized according to the severity and duration of pain, age and gender of the patient, and concurrent comorbidities to maximize the benefit as well as to minimize the risk of adverse effects from medication.
골관절염은 임상적으로 자주 접하게 되는 흔한 질환이다. 국민건강영양조사를 토대로 시행한 국내 연구에 의하면, 2010년 현재 50세 이상 한국 성인의 37.8%(여성의 47.3%, 남성의 26.7%)가 슬관절의 Kellgren-Lawrence 2등급 이상의 방사선학적 골관절염을 보이고, 14.3%(여성의 22.1%, 남성의5.3%)에서 방사선적 이상과 함께 증상을 동반한 슬관절의 골관절염 이환자인 것으로 보고되고 있다[1]. 이 비율은 연령에 따라 더욱 증가하여 80세 이상의 성인 72.4%에서 슬관절의 방사선학적 골관절염이, 33.6%에서 증상을 동반한 슬관절의 골관절염 이환자인 것으로 추정되고 있다[2]. 골관절염은 만성질환으로, 기대여명의 증가와 함께 장기간의 치료를 요한다. 치료의 선택은 크게 비약물적 보존적 치료, 약물요법 및 수술적 치료로 대분할 수 있고, 치료계획은 증상의 정도 및 기간, 방사선학적 소견, 환자의 나이 및 동반질환, 생활양식 및 사회경제적 수준, 발병 전 활동도 등에 따라 개별적으로 수립되어야 한다[34]. 골관절염을 적절하게 관리하기 위해서는 교육, 과체중에서의 체중감량, 적절한 저충격 유산소운동 등의 비약물적 보존적 치료가 기본적으로 실시되어야 한다[5]. 비약물적 치료에 효과가 없거나, 질환이 진행함에 따라 약물요법을 고려할 수 있다. 그러나, 비약물적 보존적 치료는 골관절염 관리의 근간이므로 약물요법 혹은 수술적 치료시에도 이들 요법은 비약물적 보존적 치료와 병행하여 사용되어야 한다. 수술적 치료는 약물적 치료로는 통증의 적절한 조절이 되지 않고, 기능이 심각하게 저하되어 일상생활의 제한이 있으면서 의학적 금기사항이 없는 경우 적응증이 된다(Figure 1) [67]
경구용 진통제로, 아세트아미노펜(acetaminophen)은 비스테로이드 항염제(non-steroidal anti-inflammatory drugs, NSAIDs)와 유사한 효능 및 상대적으로 적은 부작용과 경제성으로 경증의 골관절염에서 1차 약제로 추천되고 있으나[8], 복용편의성 및 부작용을 줄인 선택적 NSAIDs(selective NSAIDs, cyclooxygenase [COX]-2 억제제)의 개발로 최근에는 약제의 선호도가 변화하는 추세이다.
골관절염에서의 염증반응은 유도성 일산화질소 합성효소의 상향조절(upregulation of inducible nitric oxide synthase) 및 이로 인한 일산화질소(NO)의 증가와 관련이 있는데, 아세트아미노펜은 척추에서 일산화질소 및 substance P를 억제하여 작용하고, 최근에는 COX 억제효과가 보고되고 있다[9].
권장량 복용 시 부작용은 드문 것으로 알려져 있으나, 일일 2,600 mg 이상 복용 시 소화불량, 구역, 복통 및 설사와 같은 위장관 부작용이 발생할 수 있다. 특히, 아세트아미노펜의 오남용은 드물지 않으며, opioid-acetaminophen 복합체를 함께 처방하는 경우 과다복용될 수 있다. 미국 식약청은 2009년 아세트아미노펜 제제가 간 손상을 초래할 수 있는 잠재적 위험에 대한 경고를 제품 라벨에 포함하도록 결정하였으며, 전문가그룹의 보고서에서 과다복용을 방지하기 위한 조처로 일반의약품에서 의사의 처방이 필요한 전문의약품으로 전환할 것, 성인 1회 섭취량을 현행 1,000 mg에서 650 mg으로 줄일 것, 하루 최다 섭취량 기준을 현행 4,000 mg에서 3,250 mg으로 강화할 것, 제품 라벨에 간부전 등 간의 부작용을 알리는 강한 경고 문구를 넣을 것 등을 권고하였다. 신장기능 저하로 NSAID 복용이 곤란한 경우, 비교적 안전하게 사용될 수 있는 약물로 인정된다. 아세트아미노펜은 항응고제인 와파린의 반감기를 증가시켜 prothrombin time을 지연시킴으로 출혈 및 응고장애가 나타날 수 있으므로, 수술적 치료가 예정된 환자에서는 주의를 요한다.
경구용 NSAID는 골관절염 치료에서 가장 흔히 쓰이는 약제로, 골관절염의 중등도 혹은 중증의 통증조절에 흔히 사용되며, 국내에서도 100여 종 이상이 다양한 상품명으로 시판되고 있다.
NSAID는 COX와 leukotriene의 기능을 저해하여, arachidonic acid가 prostaglandin으로 전환되는 것을 억제한다. COX에는 2종류의 동위효소(isoenzyme)가 있으며, COX-1은 대부분의 조직에서 항시 발현되는 반면, COX-2는 염증반응에 의해 유도된다. 따라서, NSAID와 관련된 진통효과는 COX-2 억제에 기인하는 반면, COX-1은 혈소판 응집, 위점막 보호, 신장에서의 혈류 조절 등과 관련이 있어, COX-1 억제 시 상부 위장관 출혈 및 궤양 등의 심각한 부작용을 야기할 수 있다. NSAID는 이외에도 일산화질소 및 superoxide free radical 합성 억제를 통한 항염증 작용이 보고되고 있다.
NSAID는 그 성상에 따라 propionic acid 유도체(ibuprofen, naproxen, ketoprofen, pelubiprofen 등), acetic acid 유도체(indomethacin, aceclofenac, diclofenac 등), enolic acid 유도체(piroxicam, meloxicam 등), fenamates 및 COX-2 억제제(celecoxib) 등으로 분류할 수 있다. 그러나, 약제의 다양한 종류에도 불구하고, 관절염에서 통증이 완화되는 효능은 비슷하여, 복용 편의성 및 적은 상부위장관 부작용을 가진 약제가 선호되고 있다.
메타분석에 의하면 비선택적 NSAID는 아세트아미노펜에 비해 위장관 합병증의 위험도가 35% (95% confidence interval [CI], 1.05-1.75) 증가되어 있으며[16], 미란, 궤양, 천공 및 출혈을 야기할 수 있다. 상부 위장관 출혈의 위험인자로는 65세이상의 고령, 위장관 출혈이나 위궤양의 과거력, 스테로이드나 항응고제의 병용, 동반 질환, 흡연 및 음주 등이 있다. 특히 관절염이 빈발하는 65세 이상의 고령의 환자에서는 위궤양으로 인한 입원 혹은 사망의 20-30%가 NSAID의 사용과 연관이 있다고 보고되므로 주의를 요한다[17].
NSAID는 신장에서 혈류 및 사구체 여과율, 수분 재흡수 등을 조절하는 prostaglandin I2 (prostacyclin)를 감소시키며, 장기간 사용 시 신부전, 수분저류, 고칼륨혈증, 혈압상승 등을 초래할 수 있으므로, 경증의 신기능 저하가 있는 환자에서도 주의를 요한다. 위험인자로는 이뇨제 병용으로 인한 체액량 감소, 신장질환의 과거력, 간질환 등이 있다. NSAID는 혈소판 응집을 저해하여 위장관 출혈을 악화시킬 수 있으나, 아스피린과는 달리 가역적으로 작용한다. 또한 아스피린 과민성이 있는 환자에서는 NSAID는 금기이다.
부작용의 종류는 약제마다 다양한 차이를 보인다. Ibuprofen의 경우 1,600 mg 이하의 용량에서 위장관 부작용은 상대적으로 적은 반면, sulindac이나 nabumetone의 경우 상대적으로 신독성과 혈소판에 대한 부작용이 적은 것으로 알려져 있고, diclofenac은 경도의 담즙 저류를 야기할
수 있다.
COX-2 억제제는 COX-1보다 COX-2에 최소 200-300배의 선택성을 가진다. 따라서, COX-1에 의해 매개되는 혈소판 응집이나 출혈 시간에는 유의한 영향을 미치지 않으므로, 이론적으로는 COX-2억제제는 위약에 필적하는 적은 위장관 부작용을 가지면서, 비선택적 NSAID에 상응하는 진통효과를 가지게 된다. 반면, COX-2를 억제함으로써 신혈류와 심혈관 확장을 조절하는 prostacyclin의 생성을 저하시켜, 신독성이나 심혈전증을 악화시킬 가능성이 있다. 실제 rofecoxib와 valdecoxib는 과도한 빈도의 심근경색증 발생으로 각각 2004년과 2005년 퇴출되었다. 이는 COX-1의 혈소판 응집효과는 영향을 받지 않으면서, COX-2에 의한 prostacyclin 생성이 저하되는 불균형으로 인한 것으로 추정되고 있다[18]. 그러나, 심혈관계 위험에 대한 COX-2 억제제와 전통적인 비선택적 NSAID의 비교연구는 부족한 실정으로, 비선택적 제제 역시 COX-2 선택적 제제보다는 낮지만 심혈관계 위험을 증가시킬 가능성은 있다. 따라서, 심혈관계 위험요인이 있는 환자에서는 비선택적 NSAID나 COX-2 선택적 억제제의 사용은 모두 심혈관계 위험성을 증가시킬 수 있으므로 주의를 요한다[6].
국소 NSAIDs (topical NSAIDs)는 경구용 제제와 비슷한 효능을 가지면서, 피부 흡수를 통해 위장관 부작용 및 신독성을 감소시키고자 gel이나 patch의 형태로 제조되고 있다. 그러나 피부를 통과하여 혈류에 흡수되나 직접 연골이 있는 심부조직까지 투과할 수는 없다. 경구용 제제의 보조제 혹은 경구용 제제로 인한 부작용이 예상되는 고령의 환자들에게 안전한 대체제로 사용될 수 있으나, 피부 건조 및 발적이 흔한 합병증으로 보고되고 있다[19].
비선택적 NSAID 복용 시 위장관 합병증의 예방을 위해 misoprostol, proton pump 억제제 혹은 고용량의 히스타민 수용체 길항제(H2-receptor antagonists)를 병용할 수 있다[20]. NSAID를 복용 중인 8,843명을 대상으로 한 무작위 이중맹검 대조군 연구에서 misoprostol 200 μg을 하루 4번 병용하였을 때, 위약군에 비해 위궤양의 위험도를 51% 감소시켰고, 위천공, 위출구 폐쇄 혹은 출혈과 같은 중대한 합병증도 감소시킬 수 있는 것으로 보고되고 있다. 위궤양예방은 고용량의 misoprostol에서 더욱 효과적으로 알려져 있으나, 용량 증가에 따라 설사 및 복부 팽만증의 빈도도 증가하므로 주의를 요한다[21]. Proton pump 억제제와 고용량의 히스타민 수용체 길항제의 경우 misoprostol에 비해 설사 등의 부작용은 상대적으로 적은 것으로 알려져 있으나, proton pump 억제제는 하부 위장관 합병증 예방에는 도움이 되지 않고, 히스타민 수용체 길항제는 위궤양예방에는 효과가 적다[20].
위장관 합병증은 NSAID의 용량에 비례하므로, 저용량에서 시작하되 2-4주 사용 후에도 통증이 적절히 조절되지 않는 경우 용량 증가 혹은 다른 약제로의 전환을 고려한다. 통증의 급성악화를 조절하기 위한 목적으로 가급적 단기간으로 사용하되, 2종류 이상의 NSAID의 혼용 시 진통효과 증가는 명확하지 않은 반면, 부작용은 증가할 수 있으므로, 심부전 및 뇌졸증 예방을 위해 아스피린 (81-325 mg/day)을 복용하는 경우 외에는 혼용을 피하는 것이 좋다[8]. 그러나, 저용량의 아스피린을 병용하는 경우에도 상부 위장관의 출혈위험도는 증가하므로 비선택적 NSAID보다는 COX-2 억제제의 사용이 권장되며, 이 경우 항궤양제의 추가적인 투여가 필요할 수 있으므로 주의를 요한다. 또한, 위장관 출혈의 과거력이 있는 고위험군 역시, 선택적 COX-2 억제제 복용 후에도 출혈의 재발이 약 9% 정도 보고되고 있으며, 이 경우에도 proton pump 억제제와 병용 투여 시 재발을 예방할 수 있는 것으로 보고되고 있다[22].
COX-2 억제제는 ibuprofen이나 diclofenac에 비해 고혈압의 병발률은 낮은 것으로 보고되고 있으나(각각 1.7% 및 2.3%/yr) [23], 신독성 및 승압작용은 비슷한 빈도를 보인다. 따라서, COX-2 선택성 여부에 관계없이 NSAID 장기사용 시에는 정기적인 신장기능검사와 요 및 혈액검사, 혈압과 부종에 대한 평가가 필요하다[24].
반감기의 3배가 지나면 혈소판 기능이 정상화되므로 수술이 예정된 경우, NSAID 반감기의 최소 5배의 기간 전에 중지하는 것이 바람직하며, 약제 중단 시에는 점진적으로 감량하도록 한다.
국제골관절염학회(Osteoarthritis Research Society International)의 2010년 치료지침에서는 아세트아미노펜이 1차 약제로 권고되고 있으며, 2차 약제는 위험-효용도를 평가하여, 심질환의 위험도가 없는 경우 위장관 부작용의 예방에 따른 비용-효용성으로 COX-2억제제를 2차 약제로 권고하고 있다[25]. 미국류마티스학회(American College of Rheumatology)의 2000년 지침에서는 COX-2 억제제는 아미노아세트펜으로 통증이 조절되지 않는 환자, 특히 위장관 합병증의 위험인자를 가지는 환자에서 2차 약제로 권고되고 있다[8]. 따라서, COX-2 선택성 여부는 위장관 합병증 및 심근경색의 위험도를 고려해서 신중히 선택해야 할 것이다.
Opioid는 아세트아미노펜과 NSAID 사용이 금기이거나 반응이 적은 경우 혹은 수술적 치료가 필요한 중등도 혹은 중증의 관절염에서 수술적 치료를 거부하거나 곤란한 경우, 사용이 제안되고 있다[68].
Tramadol은 약한 합성 아편양 작용제(weak synthetic opioid agonist)로 norepinephrine과 serotonin의 재흡수를 저해하여, ibuprofen이나 diclofenac과 비슷한 진통효과를 가지며[26], 매 6시간마다 50-75 mg을 복용하는 것이 효과적인 것으로 알려져 있다[8]. 메타분석에 의하면 tramadol 처방군은 위약군에 비해 중등도 이상의 통증감소가 약 37% (95% CI, 20-50%)정도 많은 것으로 보고되고 있으나[27], 구역, 변비 및 기면(drowsiness) 등의 부작용과 장기사용 시 의존성이 발생할 가능성이 있으므로 주의를 요한다[28]. 또한 발작에 대한 역치를 감소시키므로 간질 환자에서는 금기이다[8].
강한 마약성 진통제(strong opioids)는 다른 약물에 효과가 없는 매우 심한 골관절염 통증치료에 고려될 수 있으나 의존성 및 남용 우려가 있어 매우 선별적인 사용이 권고된다[6]. 3,244명의 관절염 환자를 분석한 메타분석에서는 13-18주 투여 후 통증 호전에 상당한 효과가 있고, 유의한 기능의 호전도 관찰되었다고 기술하고 있다[29]. 그러나, 위약군(7%) 대비 높은 탈락률(25%)을 보고하고 있어, 마약성 진통제의 효능을 부작용이 상쇄하는 단점이 있다. 약물중단은 oxymorphone, oxycodone, oxytrex, fentanyl 및 morphine sulphate 등 강한 마약성 진통제(31%)에서 tramadol, codeine 및 propoxyphene 등의 약한 마약성 진통제(19%)보다 높게 관찰되었고, 부작용은 구역(30%), 변비(23%), 기면(20%), 졸림(18%), 구토(13%)의 순이었다. 따라서, 사용 시 저용량에서 시작하되 의존성 혹은 중독에 대한 감시가 필요하며, 고령의 환자에서는 낙상의 위험이 증가하여 골다공증성 골절이 발생할 수 있으므로 주의를 요한다[30]. 최근에는 고령의 환자들에서 신장과 간에 영향이 적고, 편의성을 높인 patch제제가 소개되고 있다.
Capsaicin은 피부 작열감을 야기하여 unmyelinated nociceptive C fiber에서 substance P를 제거함으로써, 통증전달을 억제 혹은 조절하는 역할을 하는 것으로 추정되고 있다. 70명의 골관절염과 31명의 류마티스 관절염 환자를 대상으로 한 무작위 이중맹검 대조군 연구에서 일일 4회 0.025% topical capsaicin군에서 위약군(33%) 대비 유의한 진통효과(57%)를 보였으며[11], 일일 2회 0.075% capsaicin 역시 효과가 있는 것으로 알려져 있다. 증등도 이하의 골관절염에서 경구진통제 혹은 소염제와 함께 사용될 수 있는 보조치료 혹은 대체요법으로서 고려할 수 있으나[6], 도포 부위에 종종 나타나는 심한 작열감은 단점으로 지적되고 있다.
정상관절의 점탄성은 hyaluronic acid에 의해 유지되는데, 골관절염에서는 염증반응에서 발현되는 분해효소들에 의해 hyaluronic acid의 분해가 촉진되어 활액의 점탄성이 감소하게 된다[31]. 따라서, 관절강내 hyaluronic acid 주사를 점성보충(viscosupplementation)이라고 명명하기도 한다[32]. 효능이 활막내 반감기보다 오래 지속되므로 정확한 약리기전은 알 수 없으나, cytokine이나 prostaglandin과 같은 염증매개체의 억제, 연골기질의 생성 촉진 및 분해 저하, 통증수용체의 감작 등으로 추정되고 있다[8].
중등도 이하의 골관절염 환자 중 NSAID 사용이 금기이거나 효과가 부족한 경우 사용을 고려할 수 있다[18]. 진통효과는 시간이 지나면서 감소하여 14주를 넘지 않는 것으로 알려져 있다. 효능에 대해서는 최소 17편 이상의 systemic review가 존재할 만큼 많은 연구가 시행되었다. 가장 광범위한 연구는 2006년의 Cochrane review라 할 수 있으며, 총 76편의 연구들을 분석한 결과 최초 4주내에 유의한 진통효과(effect size, ES=0.60) 및 기능개선(ES=0.61)효과가 있다고 보고하였다[3334]. 그러나, 국제골관절염학회의 2010년 권고에서는 상기 review는 연구자간 결과의 편차가 크고(considerable heterogeneity of outcomes), Egger test로 분석 시 투고 잡지에 따른 출판편향성(publication bias)이 있다고 기술하면서, Jadad score 5를 가지는 양질의 무작위대조군연구에 한해 분석을 시행하면, 유의한 진통효과를 관찰할 수 없다고 기술하여 본 제제의 진통효과에 대해서는 아직 논란의 여지가 있는 실정이다[25].
Hyaluronic acid는 비교적 부작용이 적은 약물로 알려져 있으나, 가성화농성 관절염(pseudoseptic arthritis)이 생길 수 있고, 주사술기와 관련하여 화농성 관절염이 합병될 수 있으므로 주의를 요한다. 분자량 차이에 따른 진통 효과의 차이에는 논란이 있으나, 고분자량의 hyaluronic acid에서는 통증의 일시적 악화 및 부종이 상대적으로 호발하는 것으로 보고되고 있다[35].
최근 관절내 hyaluronic acid와 corticosteroid 주사를 비교한 무작위 대조군 연구 7편을 분석한 메타분석에서는 주사 2주째 진통 효과는 corticosteroid가 더 우수했으나, 4주째에는 차이가 없고, 8주째에는 hyaluronic acid가 우수하며, 진통효과의 차이는 12주 및 26주째에 유의하였다고 보고하였다[38]. 따라서 삼출 등을 보이는 골관절염의 급성악화 시에는 corticosteroid를, 골관절염의 만성통증에는 hyaluronic acid의 투여를 고려하는 것이 바람직할 것이다.
SYSADOA (symptomatic slow-acting drugs for osteoarthritis)는 골관절염에서 기존 약물에 비해 효과가 서서히 나타나면서 진통 등의 증상호전의 효과가 있는 약물을 통칭하며, 연골파괴를 연기 혹은 예방하여 초기 골관절염의 경과에 긍정적인 영향을 기대할 때 DMOAD (disease-modifying osteoarthritis drugs) 혹은 구조개선 골관절염 치료제(STMOAD, structure-modifying osteoarthritis drug)라 명명하나, 골관절염의 진행을 차단하는 확실한 방법은 아직까지 없다. 또한 연구용 자기공명영상을 이용하더라도 연골재생에 대한 평가는 대단히 어려워 치료효과를 증명하기 곤란하고, 일부 연구에서 확인된 방사선학적 관절 간격 감소효과와 임상적 의미와의 상관관계도 입증이 부족한 실정이다. 이러한 범주에는 glucosamine sulphate, chondroitin sulphate, diacerhein, avocado soybean unsponifiables, hyaluronan 등이 있다.
Glucosamine은 연골에서 세포외 기질을 구성하는 글리코사미노글리칸(glycosamninoglycan)의 전구체이다. 증상호전에 대한 연구로, 2005년 Cochrane review에서는 중등도의 호전(ES=0.61)을 보고하였고, 2007년 국제골관절염학회에서는 이를 근거로 증상이 있는 슬관절염 환자에서 효용이 있을 수 있다고 기술한 바 있다[39]. 그러나, 현재까지 출판된 증상호전에 관한 20여 편의 무작위 대조군 연구들을 분석하면 glucosamine hydrochloride에서는 유의한 증상 호전이 관찰되지 않았고, glucosamine sulphate의 경우 중등도의 진통 효과(ES=0.58)가 관찰되나, 연구자간의 결과의 편차가 크고(I2=87%, P<0.0001), 투고 잡지에 따른 출판편향성(P=0.009)을 보이고 있다[25]. 더욱이 Jadad score 5를 가지는 양질의 무작위 연구 7편에 한해 분석을 시행할 때, 출판편향성은 없으나(P=0.074), 연구자간 결과의 편차(I2=84%, P<0.0001)는 여전히 존재하고, 진통효과(ES=0.29)는 감소한 결과를 보이며, 최근 연구일수록 그 효과는 더욱 감소하는 경향을 보였다[25]. 2007년 15편의 무작위 대조군 연구들을 분석한 systemic review에서는 할당은닉(allocation concealment)이 적절하지 않았던 연구에서는 glucosamine sulphate의 효용이 있었으나(ES=0.42), 그렇지 않은 연구에서는 증상 호전이 없었고, 기업체의 후원을 받는 연구(ES=0.44)에 비해 후원이 없었던 연구는 그 효과가 없었다고 보고하고 있다[40]. 또한 CONSORT (consolidated standards for reporting clinical trial) statement를 충족하는 1998년 이후의 무작위 대조군 연구만 분석하였을 때 연구결과간의 편차는 적고(I2=0%), 출판편향성도 없으나, glucosamine sulphate의 진통효과(ES=0.13)는 감소함을 보고하고 있다[25].
구조개선효과(structure-modifying effect) 역시 논란의 여지가 있다. Glucosamine sulphate 단독제제를 사용한 3편의 무작위 대조군 연구들(gluconate sulphate 1,500 mg/day)를 분석하면, 내측구획의 관절 간격이 감소한 슬관절관절염에서는 적은 효과(ES=0.24)가 있는 것으로 보고하고 있으나, 3년간 복용 후에도 위약군과의 차이가 0.23 및 0.25 mm로 극히 미미한 점에 주의하여야 한다[4142]. 고관절관절염에서는 2년 복용 후에도 구조개선효과가 입증되지 않았다[43]. 또한 최소 1년간 gluconate sulphate (1,500 mg/day)를 복용한 슬관절염 환자들을 대상으로 한 무작위 대조군 연구에서 5년내 슬관절 인공관절치환술의 빈도가 위약군(14.5%)에 비해 유의하게 감소(6.3%)하였음을 보고하였다[44]. 그러나 인공관절치환술시술의 결정 인자로는 방사선학적 악화 외에도 통증의 정도, 나이와 성별, 동반 질환, 의사 및 환자의 주관적 선호도 등 다양한 요인이 작용할 수 있으므로, 해석에 주의를 요한다[45].
Chondroitin은 세포외 기질을 구성하는 중요한 glycosaminoglycan의 하나로, 정확한 작용기전은 아직 밝혀져 있지 않다. 메타분석에서 chondroitin 단독으로는 슬관절 혹은 고관절골관절염에 효과가 없고, glucosamine 복합제에서 효과가 있는 것으로 보고되어[46] 흔히 glucosamine과 함께 복합체의 형태로 시판되고 있다. 최근 메타분석에서는 비교적 큰 진통효과(ES=0.75)가 보고되고 있으나[46], 역시 출판편향성이 크고, 연구자간 결과의 편차가 심하며(I2=92%), 최근 연구일수록 효능이 감소하는 경향을 보인다[25]. 또한 Jadad score 5를 가지는 양질의 무작위 대조군 연구들에 한해 분석을 시행하면, 진통효과가 없는 것으로 보고되고 있다. Chondroitin sulfate의 구조개선효과에 관한 systemic review에서는 위약군에 비해 유의한 관절 간격 감소 억제효과를 보고하고 있으나[47], 그 정도 역시 미미하고(0.07 mm/yr), 분석에 포함된 무작위 대조군 연구들 모두가 기업 후원 하에 시행되어 해석에 주의를 요한다.
골관절염은 만성질환으로, 기대여명의 증가와 함께 장기간의 치료를 요한다. 골관절염의 진행을 차단하는 확실한 방법은 아직까지 없으며, 비약물적 보존적 치료가 약물요법에 선행하여야 한다. 대부분의 약물요법의 목표는 증상호전에 있으며, 약물의 종류는 증상의 정도 및 기간, 동반 질환 및 복용 중인 다른 약제와의 상호작용 등을 고려하여 개별적으로 신중히 선택하여야 한다. 환자 및 의사는 현실적인 목표를 가지고 치료에 임해야 하며, 무엇보다 비약물적 보존적치료는 골관절염 관리의 근간이므로 약물요법 시에도 비약물적 보존적 치료와 병행하여야 한다.
본 논문은 임상적으로 자주 접하게 되는 골관절염의 약물요법에 사용되는 약제들의 약리기전, 효능 및 부작용에 대하여 최신지견을 바탕으로 현재 약물요법의 사용상의 장단점을 기술한 논문이다. 골관절염의 약물요법에 대한 일반적인 기술 뿐 아니라, 최근까지도 논란이 되고 있는 글루코사민의 약효 및 효능에 대한 최근의 의학정보를 비롯하여, 관절 내 주사제의 효과, 효능에 대하여 기존에 보고된 연구와 자료를 근거로 체계적으로 기술하였다. 본 연구는 골관절염을 치료하는 임상의 및 관련 종사자들을 위하여 최신지견을 중심으로 자세히 기술되어, 진료영역에서 참고 자료로 바로 적용 가능하다는 점에서 의의가 있는 논문이라 판단된다.
[정리: 편집위원회]
Figures and Tables
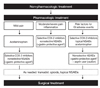 | Figure 1Schematic approach for the treatment of osteoarthritis. *Gastro-protective agent: proton pump inhibitor (not prevent lower gastrointestinal [GI] complications), misoprostol, H2-receptor antagonist (high-dose famotidine only). COX, cyclooxygenase; NSAID, non-steroidal anti-inflammatory drug (From Korean Knee Society Subcommittee on Osteoarthritis Guidelines. J Korean Knee Soc 2010;22:69-74, with permission from Korean Knee Society) [6]. |
References
1. Shin DW, Nam S, Bang YS, Lee JY. Estimation of the prevalence of Korean adults aged 50 years or more with knee osteoarthritis based on the data from fifth Korea National Health and Nutrition Examination Survey. J Korean Med Assoc. 2013; 56:431–436.

3. Lee SC, Jung KA, Nam CH, Jung SH, Hwang SH. The short-term follow-up results of open wedge high tibial osteotomy with using an Aescula open wedge plate and an allogenic bone graft: the minimum 1-year follow-up results. Clin Orthop Surg. 2010; 2:47–54.

4. Yoon JP, Oh JH, Min WK, Kim JW, Jeong WJ, Lee HJ. What do the patients want and worry in Korean patients who undergo arthroscopic rotator cuff surgery? Clin Orthop Surg. 2012; 4:278–283.

5. Park JY, Park HK, Choi JH, Moon ES, Kim BS, Kim WS, Oh KS. Prospective evaluation of the effectiveness of a home-based program of isometric strengthening exercises: 12-month follow-up. Clin Orthop Surg. 2010; 2:173–178.

6. Korean Knee Society Subcommittee on Osteoarthritis Guidelines. Guidelines for the treatment of osteoarthritis of the knee. J Korean Knee Soc. 2010; 22:69–74.
7. Han HS, Kang SB. Relations between long-term glycemic control and postoperative wound and infectious complications after total knee arthroplasty in type 2 diabetics. Clin Orthop Surg. 2013; 5:118–123.

8. American College of Rheumatology Subcommittee on Osteoarthritis Guidelines. Recommendations for the medical management of osteoarthritis of the hip and knee: 2000 update. Arthritis Rheum. 2000; 43:1905–1915.
9. Björkman R. Central antinociceptive effects of non-steroidal anti-inflammatory drugs and paracetamol. Experimental studies in the rat. Acta Anaesthesiol Scand Suppl. 1995; 103:1–44.
10. Lee C, Straus WL, Balshaw R, Barlas S, Vogel S, Schnitzer TJ. A comparison of the efficacy and safety of nonsteroidal antiinflammatory agents versus acetaminophen in the treatment of osteoarthritis: a meta-analysis. Arthritis Rheum. 2004; 51:746–754.

11. Towheed TE, Maxwell L, Judd MG, Catton M, Hochberg MC, Wells G. Acetaminophen for osteoarthritis. Cochrane Database Syst Rev. 2006; (1):CD004257.

12. Kwak YH, Roh JY, Lee KS, Park HW, Kim HW. Altered synthesis of cartilage-specific proteoglycans by mutant human cartilage oligomeric matrix protein. Clin Orthop Surg. 2009; 1:181–187.

13. Macaulay AA, Greiwe RM, Bigliani LU. Rotator cuff deficient arthritis of the glenohumeral joint. Clin Orthop Surg. 2010; 2:196–202.

14. Yang JH, Kim JH, Lim DS, Oh KJ. Effect of combined sex hormone replacement on bone/cartilage turnover in a murine model of osteoarthritis. Clin Orthop Surg. 2012; 4:234–241.

15. Mastbergen SC, Jansen NW, Bijlsma JW, Lafeber FP. Differential direct effects of cyclo-oxygenase-1/2 inhibition on proteoglycan turnover of human osteoarthritic cartilage: an in vitro study. Arthritis Res Ther. 2006; 8:R2.
16. Zhang W, Jones A, Doherty M. Does paracetamol (acetaminophen) reduce the pain of osteoarthritis? A meta-analysis of randomised controlled trials. Ann Rheum Dis. 2004; 63:901–907.

17. Smalley WE, Griffin MR. The risks and costs of upper gastrointestinal disease attributable to NSAIDs. Gastroenterol Clin North Am. 1996; 25:373–396.

19. Hochberg MC, Altman RD, April KT, Benkhalti M, Guyatt G, McGowan J, Towheed T, Welch V, Wells G, Tugwell P. American College of Rheumatology. American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee. Arthritis Care Res (Hoboken). 2012; 64:465–474.

20. Rostom A, Dube C, Wells G, Tugwell P, Welch V, Jolicoeur E, McGowan J. Prevention of NSAID-induced gastroduodenal ulcers. Cochrane Database Syst Rev. 2002; (4):CD002296.

21. Silverstein FE, Graham DY, Senior JR, Davies HW, Struthers BJ, Bittman RM, Geis GS. Misoprostol reduces serious gastrointestinal complications in patients with rheumatoid arthritis receiving nonsteroidal anti-inflammatory drugs. A randomized, double-blind, placebo-controlled trial. Ann Intern Med. 1995; 123:241–249.

22. Chan FK, Wong VW, Suen BY, Wu JC, Ching JY, Hung LC, Hui AJ, Leung VK, Lee VW, Lai LH, Wong GL, Chow DK, To KF, Leung WK, Chiu PW, Lee YT, Lau JY, Chan HL, Ng EK, Sung JJ. Combination of a cyclo-oxygenase-2 inhibitor and a protonpump inhibitor for prevention of recurrent ulcer bleeding in patients at very high risk: a double-blind, randomised trial. Lancet. 2007; 369:1621–1626.

23. Silverstein FE, Faich G, Goldstein JL, Simon LS, Pincus T, Whelton A, Makuch R, Eisen G, Agrawal NM, Stenson WF, Burr AM, Zhao WW, Kent JD, Lefkowith JB, Verburg KM, Geis GS. Gastrointestinal toxicity with celecoxib vs nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: a randomized controlled trial. Celecoxib Long-term Arthritis Safety Study. JAMA. 2000; 284:1247–1255.

24. Grainger R, Cicuttini FM. Medical management of osteoarthritis of the knee and hip joints. Med J Aust. 2004; 180:232–236.

25. Zhang W, Nuki G, Moskowitz RW, Abramson S, Altman RD, Arden NK, Bierma-Zeinstra S, Brandt KD, Croft P, Doherty M, Dougados M, Hochberg M, Hunter DJ, Kwoh K, Lohmander LS, Tugwell P. OARSI recommendations for the management of hip and knee osteoarthritis, Part III: changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis Cartilage. 2010; 18:476–499.

26. Beaulieu AD, Peloso PM, Haraoui B, Bensen W, Thomson G, Wade J, Quigley P, Eisenhoffer J, Harsanyi Z, Darke AC. Once-daily, controlled-release tramadol and sustained-release diclofenac relieve chronic pain due to osteoarthritis: a randomized controlled trial. Pain Res Manag. 2008; 13:103–110.

27. Cepeda MS, Camargo F, Zea C, Valencia L. Tramadol for osteoarthritis. Cochrane Database Syst Rev. 2006; (3):CD005522.

28. Lee KJ, Min BW, Bae KC, Cho CH, Kwon DH. Efficacy of multimodal pain control protocol in the setting of total hip arthroplasty. Clin Orthop Surg. 2009; 1:155–160.

29. Avouac J, Gossec L, Dougados M. Efficacy and safety of opioids for osteoarthritis: a meta-analysis of randomized controlled trials. Osteoarthritis Cartilage. 2007; 15:957–965.

30. Kim SR, Ha YC, Kim JR, Kim R, Kim SY, Koo KH. Incidence of hip fractures in Jeju Island, South Korea: a prospective study (2002-2006). Clin Orthop Surg. 2010; 2:64–68.

31. Oh CH, Oh JH, Kim SH, Cho JH, Yoon JP, Kim JY. Effectiveness of subacromial anti-adhesive agent injection after arthroscopic rotator cuff repair: prospective randomized comparison study. Clin Orthop Surg. 2011; 3:55–61.

32. Park JS, Lee JH, Han CS, Chung DW, Kim GY. Effect of hyaluronic acid-carboxymethylcellulose solution on perineural scar formation after sciatic nerve repair in rats. Clin Orthop Surg. 2011; 3:315–324.

33. Bellamy N, Campbell J, Robinson V, Gee T, Bourne R, Wells G. Viscosupplementation for the treatment of osteoarthritis of the knee. Cochrane Database Syst Rev. 2006; (2):CD005321.

35. Reichenbach S, Blank S, Rutjes AW, Shang A, King EA, Dieppe PA, Juni P, Trelle S. Hylan versus hyaluronic acid for osteoarthritis of the knee: a systematic review and meta-analysis. Arthritis Rheum. 2007; 57:1410–1418.

36. Dala-Ali BM, Nakhdjevani A, Lloyd MA, Schreuder FB. The efficacy of steroid injection in the treatment of trigger finger. Clin Orthop Surg. 2012; 4:263–268.

37. Noh KC, Chung KJ, Yu HS, Koh SH, Yoo JH. Arthroscopic treatment of septic arthritis of acromioclavicular joint. Clin Orthop Surg. 2010; 2:186–190.

38. Bannuru RR, Natov NS, Obadan IE, Price LL, Schmid CH, McAlindon TE. Therapeutic trajectory of hyaluronic acid versus corticosteroids in the treatment of knee osteoarthritis: a systematic review and meta-analysis. Arthritis Rheum. 2009; 61:1704–1711.

39. Towheed TE, Maxwell L, Anastassiades TP, Shea B, Houpt J, Robinson V, Hochberg MC, Wells G. Glucosamine therapy for treating osteoarthritis. Cochrane Database Syst Rev. 2005; (2):CD002946.
40. Vlad SC, LaValley MP, McAlindon TE, Felson DT. Glucosamine for pain in osteoarthritis: why do trial results differ? Arthritis Rheum. 2007; 56:2267–2277.

41. Reginster JY, Deroisy R, Rovati LC, Lee RL, Lejeune E, Bruyere O, Giacovelli G, Henrotin Y, Dacre JE, Gossett C. Longterm effects of glucosamine sulphate on osteoarthritis progression: a randomised, placebo-controlled clinical trial. Lancet. 2001; 357:251–256.

42. Pavelká K, Gatterova J, Olejarova M, Machacek S, Giacovelli G, Rovati LC. Glucosamine sulfate use and delay of progression of knee osteoarthritis: a 3-year, randomized, placebo-controlled, double-blind study. Arch Intern Med. 2002; 162:2113–2123.

43. Rozendaal RM, Koes BW, van Osch GJ, Uitterlinden EJ, Garling EH, Willemsen SP, Ginai AZ, Verhaar JA, Weinans H, Bierma-Zeinstra SM. Effect of glucosamine sulfate on hip osteoarthritis: a randomized trial. Ann Intern Med. 2008; 148:268–277.

44. Bruyere O, Pavelka K, Rovati LC, Gatterova J, Giacovelli G, Olejarova M, Deroisy R, Reginster JY. Total joint replacement after glucosamine sulphate treatment in knee osteoarthritis: results of a mean 8-year observation of patients from two previous 3-year, randomised, placebo-controlled trials. Osteoarthritis Cartilage. 2008; 16:254–260.

45. Choy WS, Kim KJ, Lee SK, Yang DS, Lee NK. Mid-term results of oxford medial unicompartmental knee arthroplasty. Clin Orthop Surg. 2011; 3:178–183.





 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download