Abstract
N-acetylcysteine (NAC) is widely recognized as the antidote of choice for acetaminophen overdose. Acetaminophen is a commonly used analgesic and antipyretic agent, and its use is one of the most common causes of poisoning worldwide. Acetaminophen toxicity may occur acutely when supratherapeutic amounts are ingested purposefully or unintentionally. Liver failure may occur in severe toxicity. However, if treated early, patients with acetaminophen poisoning generally recover uneventfully. Acetaminophen is metabolized to N-acetyl-p-benzoquinone imine (NAPQI), which is detoxified by conjugation with glutathione. In overdose, hepatic stores of glutathione are depleted and NAPQI binding to hepatocytes induces cell death and hepatic necrosis. NAC replenishes hepatic glutathione and may also act as a glutathione substitute, combining directly with the toxic metabolite. Intravenous NAC is indicated in patients who present with a history of acetaminophen overdose within the previous 8 to 10 hours, patients unable to tolerate oral NAC, and patients who present with evidence of fulminant hepatic failure. However, caution should be used in patients who have experienced previous hypersensitivity or anaphylactoid reactions to intravenous NAC, as well as in patients with asthma. The most common anaphylactoid reactions include rash, flushing, and bronchospasm. Adults should receive 150 mg/kg administered for 45 minutes, followed by 50 mg/kg administered for 4 hours, followed by 100 mg/kg administered for 16 hours. The total dose is 300 mg/kg delivered over 21 hours. Additionally, caution should always be used when intravenous NAC is prescribed and the amount of diluent is calculated. Monitoring of patients with a should include repeated neurologic and hemodynamic assessment.
아세트아미노펜은 전 세계적으로 널리 사용되고 있는 해열·진통제이지만 의사의 처방전 없이 구매가 가능하기 때문에 자살을 목적으로 과량을 복용하는 경우가 증가하고 있다[1]. 미국독극물통제센터협회(American Association of Poison Control Centers)는 2011년도 연보를 통해 성분이 밝혀진 약물 중독 환자 123만여 명 중 30.8%가 아세트아미노펜을 포함한 진통제이었으며 1,158명의 사망 환자 중 복합성분과 단일제제의 아세트아미노펜에 의한 경우가 11.2%이었다고 보고하였다[2]. 국내의 중독 환자 발생빈도에 관련된 공식자료는 없지만 최근 2개년 동안 12개 응급의료센터에 내원한 중독 환자 빈도분석에 의하면 20세 이하의 연령에서 아세트아미노펜에 중독된 경우가 가장 많았다[3]. 더불어 지난 6월 식품의약품안전처에서 소아용 해열·진통제에 규정량 이상의 아세트아미노펜이 함유되어 판매를 금지시킨 경우가 있었고, 8월에는 미국 Food and Drug Administration (FDA)에서 아세트아미노펜이 함유된 진통제가 발진, 수포 등 심각한 피부반응을 일으킬 수 있다는 조사결과를 발표하면서 관심이 재조명 되고 있다[45]. 성인에서 140 mg/kg 이상의 아세트아미노펜을 복용한 경우는 간에서 대사물질인 N-acetyl-p-benzoquinone imine (NAPQI)에 의해 간 기능 부전이 발생할 수 있다[6]. N-acetylcysteine(NAC)은 아세트아미노펜 과량 복용 후 8시간 이내에 투여하면 NAPQI의 독성을 감소시켜 간 손상을 예방할 수 있기 때문에 아세트아미노펜 중독 환자에서 효과적인 해독제로 알려져 있다[678]. 그러나 치료 용량 또는 초과 용량으로 사용한 환자에서 심각한 이상반응들이 보고되고 있기 때문에 사용에 주의를 기울일 필요가 있다. 본 특집에서는 아세트아미노펜 중독 환자의 해독제로 사용되고 있는 NAC의 작용기전과 투여방법, 이상반응, 응급처치 등에 대한 이해를 통하여 NAC의 효과적이고 안전한 처방에 도움을 제공하고자 한다.
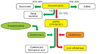
경구를 통해 체내에 들어온 아세트아미노펜은 1-2시간 후 혈중 최고 농도에 도달하며, 4시간 후 대부분 흡수되며 생체 이용률은 98%에 이른다[9]. 반감기는 2-4시간이며 신생아나 간경화환자에서 반감기는 증가한다[10]. 간에서 glucuronyl transferase와 sulfotransferase에 의해 90%가 glucuronide 또는 sulfate와 결합하여 비독성대사물 형태로 신장을 통해 배설되고, 5- 10%는 주로 cytochrome P450 (CYP) 2E1에 의해 중간 활성 대사체인 NAPQI를 생성하지만 이것의 대부분은 gluta-thione과 결합하여 비독성 대사산물인 cysteine 또는 aceta-minophenmercaptate으로 변환되어 신장을 통해 배설된다(Figure 1)[1112]. 과량 흡수된 아세트아미노펜은 간이나 신장에 독성을 미치는데 이는 NAPQI에 의한 것으로 증가된 NAPQI를 해독하기 위한 glutathione이 부족할 경우에 발생한다. 알코올 중독자, 영양결핍자, 후천성면역결핍증 환자와 같이 glutathione 저장량이 부족하거나 항경련제와 항결핵제를 동시에 투여 받아 CYP2E1 활성이 증가된 환자, 아세트아미노펜을 장기간 복용한 환자 등에서 간 손상 발생 가능성이 높다[13]. 체내에 투여된 NAC은 NAPQI가 간 단백질에 결합하는 것을 길항적으로 억제하고, 항산화제인 glutathione 생성을 증가시키며, sulfate 전구물질로 작용하여 산화 과정을 통한 NAPQI 형성을 직접 저하시켜 아세트아미노펜에 의한 간 손상을 예방하는 것으로 알려져 있다[67814].
간 손상을 제외하고 아세트아미노펜에 의한 타 장기 손상은 드물게 발생한다. 음독 초기에 간에서 젖산(lactic acid) 대사를 억제하여 대사성 산증이 동반될 수 있고 신장에 존재하는 CYP2E1와 프로스타글란딘 합성효소에 의하여 NAPQI생성, 허혈과 체액 손실 등으로 신독성이 나타날 수 있으며 전격성 간 부전(fulminant hepatic failure)을 보인 환자에서 심장 독성에 의한 심전도 변화와 췌장염이 발생한 경우도 있다[1516]. NAC 치료를 받지 않은 환자에서 심각한 간독성이 나타날 경우 사망률은 58-80%에 이른다[17]. 아세트아미노펜에 의한 전격성 간 부전의 치료는 NAC 투여, 응고 장애와 산증 교정, 뇌부종 치료 등이 포함된다. 동맥혈 pH가 7.3 미만, PT가 100초 이상, creatinine이 300 µg/L 이상, grade 3 이상의 뇌병증(encephalopathy)이 지속되는 환자는 간 이식도 치료 방법으로 고려되어야 한다[18]. 사망률을 낮추기 위해서는 아세트아미노펜에 의한 독성의 조기 진단과 치료가 중요하지만 초기 임상 증상은 비특이적으로 나타나 조기 진단에 어려움이 있다. 아세트아미노펜 중독 후 치료를 받지 않은 환자의 임상 경과는 4단계로 구분된다.
아세트아미노펜에 노출된 후 24시간 이내에는 무증상이거나 오심, 식욕부진, 구토, 권태감과 같은 소화기계 증상을 호소한다. 간독성으로 진행되는 환자에서도 이 기간 동안에는 증상이 나타나지 않을 수 있다. 혈청 간 기능 효소 검사치도 정상 범위에 있다. 그러나 과량 복용한 환자의 경우에서 간독성 징후 없이 의식 저하와 대사성 산증이 나타날 수 있다[19].
음독 후 2-3일 사이에는 간 손상 정도에 따라 임상 양상이 다양하게 나타날 수 있다. 간 손상으로 우상복부 통증과 혈청 aspartate aminotransferase (AST), alanine aminotransferase(ALT)가 증가하며 빌리루빈 상승, 혈액 응고 지연 등의 소견과 함께 신기능 저하, 췌장염 등이 동반될 수 있다. 이 단계에서 바로 4단계로 진행해 특별한 치료 없이 후유증을 남기지 않고 회복되는 경우도 있다.
간독성이 최고조에 이르는 시기로 전격성 간 부전으로 진행될 수 있으며 젖산 산증(lactic acidosis), 응고장애, 급성신부전, 뇌병증, 저혈당증, 췌장염 등이 올 수 있으며 혈청 AST, ALT가 3,000 IU/L 이상으로 증가할 수 있다. 간 부전 정도와 예후는 AST, ALT 보다 혈액 응고 지연, 저혈당, 동맥혈 pH의 정도에 의해 결정된다. 심각한 간 부전이 나타난 환자는 출혈, 급성 호흡 부전, 뇌부종, 패혈증 등으로 과량 복용 후 3-5일 사이에 사망할 수 있다[17].
아세트아미노펜에 의한 급성 중독은 노출 시간 4시간 이내로 정의하며 간독성을 유발할 수 있는 최저 용량은 보고에 따라 다르지만 성인에서 100-150 mg/kg, 소아에서 150 mg/kg이상 복용했을 경우이다[20]. 그러나 복용량을 이용한 독성발생 예측은 노출 용량을 정확히 알 수 있는 경우에 한하며 그 외 경우에는 혈중 아세트아미노펜 농도를 측정하여 간독성 발생을 예측해야 한다. 측정된 아세트아미노펜 혈중 농도는 Rumack-Matthew nomogram을 이용해 치료계획을 세울 수 있다. 미국과 유럽 등에서 주로 사용되는 normogram은 간독성 진단의 민감도를 증가시키기 위해 노출 후 4시간째의 아세트아미노펜 독성 농도 결정점을 150 µg/mL으로 하향 조정하여 Rumack-Matthew nomogram과 평행한 치료선(treatment line)을 만들었다(Figure 2) [21]. 결정점을 150 µg/mL으로 하향 조정한 후 치료선 이하의 혈중 아세트아미노펜 농도를 보인 환자에서 간독성 발생은 현저히 낮아졌으나 NAC의 투여 경우가 증가하여 NAC에 의한 이상반응 비율은 증가하였다[22]. Nomogram은 아세트아미노펜 복용 후 4시간부터 24시간까지의 혈중 농도에 근거하여 적용할 수 있으며 사망이나 임상적 간독성 발생 가능성보다 AST, ALT의 상승 가능성에 의미를 두고 만들어졌다[23]. 4시간 이내의 혈중 농도는 아세트아미노펜 음독 여부진단에 도움이 되며, 100 µg/mL 이하일 경우 심각한 음독가능성을 배제할 수 있고 시간 경과 후 추가 검사가 필요하다[24]. 24시간 이후에는 아세트아미노펜의 대사가 진행되어 측정하기 어렵기 때문에 간 기능 검사와 임상 증상을 참고하여 간 독성이 나타난 경우는 NAC 치료를 시작하거나 지속해야 한다. 노출시간을 알 수 없을 때는 노출 후 8시간 이내로 보고 혈중 농도가 결정점 이상일 경우 NAC 치료를 시작해야 한다. 노출된 지 8시간 이전에 AST와 ALT가 상승한 환자는 노출시간이 정확하지 않을 가능성과 타 질환에 의해 상승했을 가능성을 고려해야 한다. 타 약제와 병용 노출일 경우는 혈중 아세트아미노펜 농도를 측정해 NAC 치료의 기준으로 삼고, 타 약제에 의한 증상을 주의하여 관찰한다. 국내에서 생산되는 일부 아세트아미노펜 제제의 경우 diphenhydramine성분이 섞여 있기 때문에 항콜린성 증상, 환각, 환청, 진전, 경련 등의 증상이 추가로 나타날 수 있다.
아세트아미노펜 중독 시 치료는 위장관 정화, 해독제인 NAC 투여 및 대증요법 등을 시행한다. 아세트아미노펜은 신속하게 위장관에서 흡수되고 효과적인 해독제가 있기 때문에 아세트아미노펜만 음독한 경우 위세척 필요성은 크지 않다. 그러나 지속 유리형 약물이나 위장관 내 흡수를 저하시키는 약물을 병용한 경우와 음독 후 조기 내원한 경우에는 위세척을 고려할 수 있다. 아세트아미노펜에 노출된 후 2시간 이내 투여된 활성탄이 효과적이지만 금기증이 없다면 경구를 통해 복용된 아세트아미노펜은 4시간에 걸쳐 흡수되므로 음독 4시간 이내에 내원한 환자도 활성탄 투여의 대상이 될 수 있다[25]. 활성탄이 경구로 투여된 NAC을 흡수하여 NAC의 효과를 저하시킬 가능성 때문에 활성탄 사용에 논란이 있었으나 활성탄은 음독 후 4시간 이내에 투여되고 NAC은 음독 후 8시간 이내에 투여되기 때문에 병행하여 치료가 가능하다. 반복적인 활성탄 투여가 필요할 경우, 즉 다른 제제와 함께 복용했거나 지속 유리형 아세트아미노펜 제제를 음독한 환자에게는 정맥을 통해 NAC을 투여하거나, NAC은 위장관에서 신속히 흡수되기 때문에 활성탄과 동시에 투여되지 않는다면 의미 있는 상호작용을 피할 수 있기 때문에 경구를 통해 NAC을 투여할 때는 NAC과 활성탄 투여 간격을 1-2시간 정도로 유지해 줄 것을 권장하고 있다[26]. 혈액투석은 노출된 후 24 시간 이상 경과되고 간 손상이 진행된 환자에서 NAC과 병행하여 시행할 경우 효과가 있다는 보고가 있다[27].
아세트아미노펜의 독성 대사체인 NAPQI가 생성되고 이를 해독하는 glutathione이 고갈될 때 까지는 일정 시간이 소요된다. 임상적으로 아세트아미노펜 음독 후 혈중 농도 검사 등을 위해 시간이 지연되더라도 8시간 이내에 NAC이 투여 된다면 환자의 예후에 큰 영향을 미치지는 않는다고 알려져 있다. 지연 투여된 NAC의 효과에 대한 연구에서 아세트아미노펜을 음독하고 16-24시간 경과 후 내원한 환자에게 NAC을 투여하여 간 손상, 뇌부종, 사망률 등을 감소시켰다는 보고도 있다[28]. NAC의 경구 투여방법은 부하 용량으로 140 mg/kg를 투여하고 이후 매 4시간 마다 70 mg/kg씩 17차례, 총 72시간 투여한다. NAC의 불쾌한 냄새와 맛으로 구역감과 구토가 심한 환자에게는 주스에 섞어 마시거나 비위관을 통해 투여할 수 있고 진토제인 metaclopromide또는 ondansetron 등을 사용할 수 있다[8]. 경구 투여후 1시간 이내에 구토한 경우는 반드시 재투여해야 한다[29]. 정맥 투여는 150 mg/kg을 5% 포도당액 200 mL에 희석하여 처음 1시간 동안 정맥 주사 한 후, 50 mg/kg을 5% 포도당액 500 mL에 희석하여 4시간 동안 정맥 주사하고, 이후 16시간 동안 100 mg/kg을 5% 포도당액 1,000 mL에 희석해서 정맥 주사하여 총 투여량은 300 mg/kg을 초과하지 않도록 한다(Table 1). 첫 부하 용량의 속도는 1980년대 이후 15분으로 권장되었다가 부작용 발생빈도가 주입 속도와 관계된다는 임상보고들에 의해 2006년 이후부터 1시간으로 연장하여 투여할 것을 권장하고 있다[30]. 국내에서 생산되는 NAC 제제는 20% 희석액으로 4 mL 바이알 당 800 mg의 NAC을 함유하는 것이 주를 이루고 있지만 초과 용량의 NAC이 투여되어 사망한 경우를 보고한 상당수에서 용량 계산과 기록, 혼합 비율 실수가 원인이었기 때문에 NAC을 사용할 경우는 반드시 용량을 확인해야 한다[30].
NAC 투여 경로에 따른 효과에 대해서 논란은 있지만 아세트아미노펜 음독 후 간 부전이 나타나지 않은 환자를 대상으로 8시간 이내에 치료를 시작하였고, 경구 투여 후 구토를 하지 않았다면 경구와 정맥요법에 따른 간독성 발생률 차이는 없는 것으로 보고되고 있다[3132]. 경구 요법은 문맥순환에 의해 간 내 NAC 농도를 높게 유지할 수 있는 장점이 있지만 의식저하 환자에서 흡입의 위험성과 구토로 NAC 치료와 흡수가 지연될 수 있으며 치료기간이 정맥요법에 비해 길다는 단점이 있다. 또한 먹기 힘든 NAC 특유의 고약한 냄새가 있기 때문에 상태가 양호하고 협조가 잘되는 환자를 대상으로 선택할 수 있다. 이에 반해 정맥 요법은 빠른 시간 내에 혈중 최고 농도에 도달 시킬 수 있고, 높은 혈중 농도를 유지하여 간, 신장, 뇌 등 주요 장기에 쉽게 NAC이 도달할 수 있으며, 치료자가 의도한 용량을 목표 시간 내에 비교적 정확히 투여할 수 있다는 장점이 있다. 의식이 저하된 환자와 전격성 간 부전, 임신 중인 환자, 경구로 NAC 섭취를 못하는 환자가정맥 투여의 대상이 될 수 있지만 이상반응 발생 빈도와 정도가 경구요법보다 높게 보고되고 있어 주의를 요한다[33].
NAC은 경구 투여 시 위장관에서 빠르게 흡수되지만 간초회-통과 효과(liver first-pass effect) 대사량이 많기 때문에 생체이용률은 10-30%로 낮으며 분해되지 않은 NAC의 분포용적도 0.5 L/kg로 낮다. 간에서 탈아세틸화(diacetylation)된 뒤 cysteine을 생성하거나 산화되어 diacetylcysteine을 생성한다[29]. 정맥 투여된 NAC의 평균 배설 반감기는 성인과 신생아의 경우 각각 5.6시간과 11시간으로 보고되었으며 간 기능이 저하된 환자는 반감기가 더 길어질 수 있다. Amphotericin B, tetracycline, erythromycin, ampicillin sodium 등은 NAC의 효능을 불활성화 시킬 수 있기 때문에 함께 사용할 경우 주의해야 한다[34]. NAC에 의한 이상반응 발생 기전은 명확하지 않다. 치료 용량에서 발생한 이상반응은 대부분 정맥을 통해 첫 번째 용량을 투여한 후 10-45분 사이에 발생하였고, 이상반응이 발생한 환자에서 측정한 혈중 히스타민 농도가 이상반응 발생 시점과 비슷한 추이로 상승했으며, 이상반응의 정도가 심할수록 히스타민 농도가 높게 나타나 체내 히스타민 분비와 관련 있는 아나필락시스양 반응(anaphylactoid reaction)이 원인일것이라는 주장이 설득력 있어 보인다[35]. 그러나 치료를 시작하고 2-3일 경과 후 치료 용량의 10배 이상을 초과 투여 받은 환자에서도 심각한 이상반응이 발생한다고 보고되고 있어 투여 용량과도 관계가 있을 것으로 보인다. 부작용 유발 인자에 대한 연구에서 다른 약제에 아나필락시스양 반응이 있었거나 천식의 과거력, 혈중 아세트아미노펜 농도가 낮을수록 이상반응 발생 빈도는 높게 나타났다[36]. 혈중 아세트아미노펜 농도가 NAC의 이상반응 발생에 관여하는 기전에 대해서는 아세트아미노펜이 아나필락시스양 반응을 억제시키는 역할을 할 것이라는 가설만 제기되고 있어 추가 연구가 필요한 부분이다.
NAC을 경구 및 정맥으로 투여하였을 경우에 이상반응 발생 빈도는 10-60%까지 보고되고 있다[35]. 경구 투여는 주로 오심, 구토, 설사 등 소화기계 증상이 주로 발생하며 심각한 합병증은 초래하지 않는 것으로 알려져 있다. 이에 반해 정맥 투여는 아나필락시스양 반응을 일으킬 수 있는데 대부분 홍반(erythema), 발진(rash), 구토 등 경한 증상을 보이지만 드물게 기관지 수축에 의한 호흡곤란, 경련, 부정맥, 저혈압, 쇼크 등 생명을 위협하는 독성 반응을 일으킬 수 있다. 27세 남성이 6시간 간격으로 5 g의 NAC을 3일 동안 경구복용 후 고열과 발진, 관절부종 등 혈청병(serum sickness)이 발생하여 투약 중단 후 회복되었으며, 8,480 mg/kg의 NAC을 3일 동안 경구와 정맥으로 투여 받은 3세 남아에서전격성 간염이 발생하였다[37]. 17세 여아는 아세트아미노펜 음독 후 경구를 통해 치료 용량의 NAC을 투여 받고 sulfhemoglobinemia가 발생하였고, 천식 환자에서 경구 치료용량의 NAC을 투여 후 기관지 수축이 발생했다는 보고도 있다[3839]. 의료진의 용량 계산 실수로 초과 용량의 NAC을 투여 받고 사망한 증례 보고들도 있다. 만성폐쇄성폐질환(chronic obstructive pulmonary disease)과 C형 간염을 가진 53세 남자는 계획된 용량의 10배인 126,000 mg의 NAC을 정맥 투여 받은 후 급성심근경색이 발생해 사망하였으며, 30개월 여아는 2,450 mg/kg의 NAC을 정맥 투여 받은 지 5시간 후부터 중첩성 간질(status epilepticus)이 발생하여 뇌부종(cerebral edema)과 저산소뇌증(hypoxic encephalopathy)으로 사망하였다[4041]. 또한 21세 여성은 아세트아미노펜을 음독 후 NAC을 투여 받던 중, NAC 100 mg/kg/hr 용량으로 27시간 동안 총 150 g을 정맥으로 투여 받고 경련과 뇌부종으로 사망하였다[42].
선택적인 해독제는 없다. 다량의 NAC 중독 환자는 기도와 호흡, 순환기계 안정이 필요하며 심전도와 활력징후를 주의 깊게 관찰해야 한다. 활성탄은 소화관에서 NAC의 흡수를 지연시키기 때문에 경구를 통해 과량 복용한 환자에게 투여해야 한다. 구역감이나 구토가 심한 경우에는 metoclopramide, ondansetron 등의 항구토제를 투여할 수 있다. 삼킬 수 있는 환자에게는 5 mL/kg에서 최대 200 mL까지 물을 마시게 하여 희석시킬 수 있으며 경련 발생 시 benzodiazepine과 phenytoin, propofol 등으로 조절한다[8]. 체액을 보충하고 저혈압으로 인한 쇼크가 동반된 경우는 승압제를 투여해야 하고 호흡기계 증상과 신경계 증상이 심할 경우 기도확보와 호흡보조 치료를 하며 필요 시 기관내 삽관을 시행한다. 아나필락시스양 반응으로 저혈압이 지속될 경우는 epinephrine과 항히스타민제, 스테로이드 등을 사용할 수 있다[35]. 고열과 젖산산증(lactic acidosis), 횡문근융해증(rhabdomyolysis) 등이 지속될 경우 뇌파 검사를 시행하면서 신경근 차단제(neuromuscular blocking drugs) 사용을 고려해 볼 수 있다. 정맥 투여 시 이상반응이 발생하면 NAC 투여를 중단하고 대증적 치료를 시행하며, 증상이 호전될 경우는 혈역학과 신경학적 증상을 주의 깊게 관찰하면서 NAC의 재투여를 시도해야 한다[43].
가능하다면 이상반응이 적은 경구 요법을 선택하고 정맥 요법을 선택했을 경우는 이상반응을 예방하기 위해 노력해야 한다. 정맥 요법의 첫 번째 투여량에 의한 이상반응을 줄이기 위해서는 주입 속도를 1시간 동안 서서히 투입하면서 투입 후 지속적인 모니터링을 시행하고, 예방적 항히스타민제와 분무형 베타차단제를 투여할 수 있으며, NAC의 피부반응 검사도 고려될 수 있다. 과량 투여에 의한 이상반응을 줄이기 위해서는 환자 체중을 고려한 정확한 용량 계산과 정확한 기록, 정확한 배합이 필요하다[35].
임산부의 아세트아미노펜 중독에 의한 간독성 발생 예측은 비임산부와 동일하며 임산부에 대해 NAC의 유해성이 증명되지 않았기에 NAC 치료가 필요한 경우에는 임신 여부와 관계없이 일반 성인과 같은 치료 지침에 따라 투여해야 한다. NAC의 FDA 임산부 안전성 등급은 B이다[44].
간독성을 일으킬 수 있는 아세트아미노펜 중독에 대해서는
비교적 잘 알려진 반면 선택적 해독제로 사용되는 NAC의 유
해성은 잘 알려지지 않았다. 아세트아미노펜 중독의 해독제
로 사용되고 있는 NAC이지만, NAC이 직접적으로 인체에 유
해한 이상반응을 일으킬 수 있기 때문에 사용에 주의를 기울
여야 할 것으로 본다. 특히 아세트아미노펜 중독 환자에게
NAC을 정맥 용법으로 투여할 경우, 치료 용량과 초과 용량 모
두에서 생명을 위협할 수 있는 심각한 이상반응이 발생할 수
있기 때문에 첫 번째 용량이 투여되는 동안 집중 관찰을 시행
하고, 투여해야 할 용량의 정확한 계산과 반복 확인을 거쳐서
의도하지 않은 상황을 미연에 방지해야 할 것으로 생각된다.
아세트아미노펜은 해열·진통제로서 널리 사용되고 있으며, 의사의 처방전 없이도 약국에서 쉽게 구매할 수 있어 치료목적외의 과량섭취로 인하여 중독환자가 늘어나고 있는 실정이다. 최근에는 일반인뿐만 아니라 청소년들 사이에서도 정서적으로 불안한 상태에서 과량의 아세트아미노펜을 복용하고 응급실에 내원하는 경우가 많고, 이로 인하여 간 손상까지 보일 수 있어서 사회적으로 염려되는 바가 크다. 본 논문은 아세트아미노펜의 대사과정 및 중독에 의한 간 손상의 기전과 NAC의 해독기전에 대하여 간결하면서도 쉽게 이해할 수 있도록 기술하였다. 아세트아미노펜 중독을 진료하는 것이 부담스러울 수 있는 일선 진료현장에서 아세트아미노펜 중독의 치료를 위하여 NAC의 투여용량, 투여경로, 부작용 및 기타 주의점 등에 대한 핵심적인 내용을 자세히 기술함으로 NAC의 사용에 좀 더 친숙해지고, 일선 진료에서 아세트아미노펜 중독환자 치료의 지침이 될 수 있을 것으로 생각된다.
[정리: 편집위원회]
Figures and Tables
 | Figure 2The Rumack-Matthew nomogram (from Wikipedia. Rumack-Matthew nomogram [Internet]. San Francisco: Wikimedia foundation, according to the Creative Commons Attribution License) [21]. |
References
1. Lee WM. Acetaminophen and the U.S. Acute Liver Failure Study Group: lowering the risks of hepatic failure. Hepatology. 2004; 40:6–9.

2. Bronstein AC, Spyker DA, Cantilena LR Jr, Rumack BH, Dart RC. 2011 Annual report of the American Association of Poison Control Centers' National Poison Data System (NPDS): 29th annual report. Clin Toxicol (Phila). 2012; 50:911–1164.

3. Kim HJ, Kim YW, Kim H, Park CB, So BH, Lee KR, Lee KW, Lee KW, Lee SW, Lee JY, Cho GC, Cho J, Chung SP. Comparison between emergency patient poisoning cases and the Tox-Info System Database. J Korean Soc Clin Toxicol. 2012; 10:8–14.
4. Kim J. Tylenol syrups for children recalled. The Korea Times. 2013. 04. 23.
5. US Food and Drug Administration. FDA warns of rare acetaminophen risk [Internet]. Silver Spring: US Food and Drug Administration;2013. cited 2013 Nov 12. Available from: http://www.fda.gov/forconsumers/consumerupdates/ucm363010.htm.
6. Mitchell JR, Jollow DJ, Potter WZ, Gillette JR, Brodie BB. Acetaminophen-induced hepatic necrosis. IV. Protective role of glutathione. J Pharmacol Exp Ther. 1973; 187:211–217.
7. Prescott LF, Park J, Ballantyne A, Adriaenssens P, Proudfoot AT. Treatment of paracetamol (acetaminophen) poisoning with N-acetylcysteine. Lancet. 1977; 2:432–434.

8. Chung SP, Kim SH, Lee HS. Acetaminophen poisoning. J Korean Soc Clin Toxicol. 2008; 6:1–8.
9. McGilveray IJ, Mattok GL, Fooks JR, Jordan N, Cook D. Acetaminophen II. A comparison of the physiological availabilities of different commercial dosage forms. Can J Pharm Sci. 1971; 6:38–42.
10. Bannwarth B, Netter P, Lapicque F, Gillet P, Pere P, Boccard E, Royer RJ, Gaucher A. Plasma and cerebrospinal fluid concentrations of paracetamol after a single intravenous dose of propacetamol. Br J Clin Pharmacol. 1992; 34:79–81.

11. Xu JJ, Hendriks BS, Zhao J, de Graaf D. Multiple effects of acetaminophen and p38 inhibitors: towards pathway toxicology. FEBS Lett. 2008; 582:1276–1282.

12. Patten CJ, Thomas PE, Guy RL, Lee M, Gonzalez FJ, Guengerich FP, Yang CS. Cytochrome P450 enzymes involved in acetaminophen activation by rat and human liver microsomes and their kinetics. Chem Res Toxicol. 1993; 6:511–518.

13. Mitchell JR, Jollow DJ, Potter WZ, Davis DC, Gillette JR, Brodie BB. Acetaminophen-induced hepatic necrosis: I. role of drug metabolism. J Pharmacol Exp Ther. 1973; 187:185–194.
14. Ekins BR, Ford DC, Thompson MI, Bridges RR, Rollins DE, Jenkins RD. The effect of activated charcoal on N-acetylcysteine absorption in normal subjects. Am J Emerg Med. 1987; 5:483–487.

15. Mazer M, Perrone J. Acetaminophen-induced nephrotoxicity: pathophysiology, clinical manifestations, and management. J Med Toxicol. 2008; 4:2–6.

16. Lee JY, Gil HW, Yang JO, Lee EY, Hong SY. A case of acute renal failure induced by acetaminophen intoxication. Korean J Med. 2011; 80:348–351.
17. Makin A, Williams R. The current management of paracetamol overdosage. Br J Clin Pract. 1994; 48:144–148.
18. Lee WM. Acute liver failure. Dallas: Cambridge University Press;2000.
19. Flanagan RJ, Mant TG. Coma and metabolic acidosis early in severe acute paracetamol poisoning. Hum Toxicol. 1986; 5:179–182.

21. Wikipedia. Rumack-Matthew nomogram [Internet]. San Francisco: Wikimedia Foundation;cited 2013 Nov 12. Available from: http://en.wikipedia.org/wiki/Rumack-Matthew_nomogram.
22. Smilkstein MJ, Douglas DR, Daya MR. Acetaminophen poisoning and liver function. N Engl J Med. 1994; 331:1310–1311.

23. Prescott LF, Illingworth RN, Critchley JA, Proudfoot AT. Intravenous N-acetylcysteine: still the treatment of choice for paracetamol poisoning. Br Med J. 1980; 280:46–47.

24. Rumack BH, Peterson RC, Koch GG, Amara IA. Acetaminophen overdose: 662 cases with evaluation of oral acetylcysteine treatment. Arch Intern Med. 1981; 141(3 Spec No):380–385.

25. Dart RC, Erdman AR, Olson KR, Christianson G, Manoguerra AS, Chyka PA, Caravati EM, Wax PM, Keyes DC, Woolf AD, Scharman EJ, Booze LL, Troutman WG. American Association of Poison Control Centers. Acetaminophen poisoning: an evidence-based consensus guideline for out-of-hospital management. Clin Toxicol (Phila). 2006; 44:1–18.

26. Buckley NA, Whyte IM, O'Connell DL, Dawson AH. Activated charcoal reduces the need for N-acetylcysteine treatment after acetaminophen (paracetamol) overdose. J Toxicol Clin Toxicol. 1999; 37:753–757.

27. Daly FF, Fountain JS, Murray L, Graudins A, Buckley NA. Panel of Australian and New Zealand clinical toxicologists. Guidelines for the management of paracetamol poisoning in Australia and New Zealand: explanation and elaboration: a consensus statement from clinical toxicologists consulting to the Australasian poisons information centres. Med J Aust. 2008; 188:296–301.
28. Prescott LF. Paracetamol: past, present, and future. Am J Ther. 2000; 7:143–147.
30. Hayes BD, Klein-Schwartz W, Doyon S. Frequency of medication errors with intravenous acetylcysteine for acetaminophen overdose. Ann Pharmacother. 2008; 42:766–770.

31. Chae HJ, Rhee NG, Kim HJ, You JS, Chung SP, Lee HS. Oral vs. Intravenous administration of N-acetylcysteine in the acetaminophen poisoning. J Korean Soc Clin Toxicol. 2012; 10:97–102.
32. Perry HE, Shannon MW. Efficacy of oral versus intravenous N-acetylcysteine in acetaminophen overdose: results of an open-label, clinical trial. J Pediatr. 1998; 132:149–152.

33. Bebarta VS, Kao L, Froberg B, Clark RF, Lavonas E, Qi M, Delgado J, McDonagh J, Arnold T, Odujebe O, O'Malley G, Lares C, Aguilera E, Dart R, Heard K, Stanford C, Kokko J, Bogdan G, Mendoza C, Mlynarchek S, Rhyee S, Hoppe J, Haur W, Tan HH, Tran NN, Varney S, Zosel A, Buchanan J, Al-Helial M. A multicenter comparison of the safety of oral versus intravenous acetylcysteine for treatment of acetaminophen overdose. Clin Toxicol (Phila). 2010; 48:424–430.

34. Zyoud SH, Awang R, Syed Sulaiman SA, Sweileh WM, Al-Jabi SW. Incidence of adverse drug reactions induced by N-acetylcysteine in patients with acetaminophen overdose. Hum Exp Toxicol. 2010; 29:153–160.

35. Pakravan N, Waring WS, Sharma S, Ludlam C, Megson I, Bateman DN. Risk factors and mechanisms of anaphylactoid reactions to acetylcysteine in acetaminophen overdose. Clin Toxicol (Phila). 2008; 46:697–702.

36. Sandilands EA, Bateman DN. Adverse reactions associated with acetylcysteine. Clin Toxicol (Phila). 2009; 47:81–88.

37. Mohammed S, Jamal AZ, Robison LR. Serum sickness-like illness associated with N-acetylcysteine therapy. Ann Pharmacother. 1994; 28:285.

38. Lu HC, Shih RD, Marcus S, Ruck B, Jennis T. Pseudomethemoglobinemia: a case report and review of sulfhemoglobinemia. Arch Pediatr Adolesc Med. 1998; 152:803–805.
39. Bailey B, McGuigan MA. Management of anaphylactoid reactions to intravenous N-acetylcysteine. Ann Emerg Med. 1998; 31:710–715.

40. Elms AR, Owen KP, Albertson TE, Sutter ME. Fatal myocardial infarction associated with intravenous N-acetylcysteine error. Int J Emerg Med. 2011; 4:54.

41. Bailey B, Blais R, Letarte A. Status epilepticus after a massive intravenous N-acetylcysteine overdose leading to intracranial hypertension and death. Ann Emerg Med. 2004; 44:401–406.

42. Heard K, Schaeffer TH. Massive acetylcysteine overdose associated with cerebral edema and seizures. Clin Toxicol (Phila). 2011; 49:423–425.





 PDF
PDF ePub
ePub Citation
Citation Print
Print




 XML Download
XML Download