Abstract
Ultrasonography is mandatory for the evaluation of thyroid nodules. Although B-mode and Doppler ultrasonography are both sensitive for the diagnosis of thyroid lesions, they lack specificity in differentiating benign from malignant nodules. Elastography has been described as an accurate predictor of malignancy by determining tissue elasticity. There are several methods utilized to evaluate the stiffness of normal tissue and the thyroid nodule, such as strain elastography, acoustic radiation force impulse, and shear wave elastography. Many studies show that elastography has both high sensitivity and specificity that approaches 100% for the determination of thyroid carcinoma. In addition, elastography also has a very high negative predictive value and thus, may also be helpful in the identification of thyroid nodules that do not need further diagnostic evaluation, including fine needle aspiration cytology. However, in the light of current evidence, there is a need for standardization and consensus on the most optimum elastography acquisition process. The purpose of this review is to provide a comprehensive summary of the use of elastography in the evaluation of thyroid nodules.
갑상선 결절은 매우 흔한 질환으로 전체 인구의 약 15–68%에서 발견되며 여성과 노인에서 더욱 높은 유병률을 보인다.(1) 갑상선 결절 중 갑상선암의 유병률은 나이, 성별, 방사선 노출 과거력, 가족력 등의 인자에 따라 다양하지만 전체 갑상선 결절 중 7–10%가 갑상선암으로 알려져 있다.(2) 갑상선암은 전 세계적으로 여성에서 발생하는 암 중 발생률 5위를 차지하는 흔한 암으로 국내에서도 2018년 한 해 약 28,650명의 새로운 환자가 발생해 위암(12.0%)에 이어 발생률 2위(11.8%)를 차지하였다.(3,4) 국내 갑상선암 발생률은 2015년 이후 해가 갈수록 증가하고 있으며, 그 이유를 확실히 규명하기는 어렵지만 건강에 대한 관심 증가에 따른 검진의 활성화와 영상학적 진단 기술의 발전을 원인으로 생각할 수 있다.
초음파(ultrasonography)는 갑상선 결절을 포함한 다양한 갑상선 병변을 진단하는데 가장 유용한 검사로 알려져 있다. B-mode 초음파는 악성 결절을 감별하는데 매우 높은 민감도(sensitivity)를 가지고 있으며, 저에코(hypoechogenicity), 미세석회화(micro-calcification), halo의 부재(absence of halo), 과혈관성(hyper-vascularity), 불규칙한 경계(irregular borders)와 위-아래가 넓이보다 긴(taller than wide) 양상이 악성을 시사하는 특징적인 소견이다.(5) 또한 Doppler 초음파에서 변연부보다 중심부에서 더 많은 혈액 분포를 보이는 결절의 경우 악성 가능성이 높다.(6) 최근에 유방의 Breast Imaging Reporting and Data System 분류에서 착안한 Thyroid Imaging Reporting and Data System 분류가 초음파의 특징에 따른 갑상선 결절의 악성 위험도를 제시하였다(Table 1).(7) 초음파는 갑상선 결절에 대한 악성 위험도를 평가하는데 매우 높은 민감도를 가지지만 특이도(specificity)는 낮아 정확한 악성 종양의 진단을 위해 세침흡인세포검사(fine needle aspiration cytology; FNAC) 등의 추가 검사를 요한다.
이러한 초음파의 제한점을 극복하기 위해 새로운 영상 기술인 탄성초음파(elastography)의 개념이 도입되었다. 탄성초음파는 비침습적으로 조직의 단단한 정도를 실시간으로 측정하고 영상화할 수 있는 방법으로 악성 종양이 정상 조직 또는 양성 종양보다 더 단단하다는 특성을 이용하여 초음파로 종양의 단단한 정도(stiffness)와 탄성도(elasticity)를 측정한다.(8) 간, 유방, 전립선 등 다른 기관들(organs)의 질환에서도 탄성초음파에 관한 연구가 활발히 이루어지고 있지만 갑상선 결절의 악성 여부를 감별하는 도구로서 최근에 갑상선암 환자에서 탄성초음파의 유용성에 관한 연구 결과들이 많이 보고되고 있다.(9-11) 또한 탄성초음파는 고식적 초음파(conven-tional ultrasonography)와 함께 시행하였을 때 갑상선암 진단의 특이도를 높일 수 있는 것으로 알려져 있다.(5)
이에 저자들은 문헌 고찰을 통해 탄성초음파의 원리를 살펴보고 갑상선 결절 특히 갑상선암 환자에서 탄성초음파의 임상적 적용과 그 유용성에 관하여 살펴보고자 한다.
1991년에 Ophir 등(12)이 탄성초음파의 개념을 처음으로 소개한 이후, 2000년대 중반부터 갑상선 결절의 진단을 위한 탄성초음파의 적용에 관한 연구 결과가 보고되었다. 탄성초음파를 이용해 FNAC와 같은 조직학적 진단 전에 갑상선 결절의 악성 여부를 구별함으로써 수술을 받아야 하는 환자 수를 감소시켜 그에 따른 합병증과 의료 비용의 감소 효과를 보일 수 있다. 탄성초음파는 외부에서 가해진 힘에 의해 유도된 이동(movement) 정도에 따라 조직의 탄성도를 측정한다. 외부에서 적용된 힘, 측정된 양 그리고 결과의 도출 방법에 따라 탄성초음파는 정적(static)인 strain elastography (SE)와 동적(dynamic)인 acoustic radiation force impulse (ARFI) 그리고 shear wave elastography (SWE)로 나눌 수 있다.
SE는 초음파 탐촉자(probe)로 피부 표면에 압력을 일정하게 가해 조직 변형을 영상화하는 방식으로 관심 영역(region of interest; ROI)내에서 조직의 상대적인 변형률(relative strain)을 질적으로(qualitatively) 계산한다(Fig. 1A). 조직의 변형 정도는 단단함에 반비례해 단단할수록 덜 변형되며 악성을 시사하는 소견이다. SE는 갑상선 진단을 위해 사용된 첫 탄성초음파로 시행자가 초음파 탐촉자를 통해 가한 외부 압력을 이용한 방법과 갑상선 운동을 유도하는 생리학적 자극인 경동맥의 맥박(pulsation)을 이용한 두 가지 방법으로 나눌 수 있다.(13)
결절의 탄성도는 변형률(strain ratio)이나 탄성 점수(elasticity score)로 기술된다. 잘 알려진 탄성 점수로는 Asteria score와 Rago score가 있는데 Asteria score는 1 (soft nodule)부터 4 (stiff nodule)의 범위를 사용하며,(14) Rago score는 1 (same elasticity throughout)부터 5 (without elasticity in the nodule or in the area showing posterior shadowing)로 탄성도를 분류한다.(15)
SE를 이용한 갑상선 결절의 평가에 관해 다양한 결과들이 보고되고 있다. 639개의 갑상선 결절을 포함한 메타 분석(meta-analysis)에서 SE는 92%의 민감도와 90%의 특이도를 보인 반면,(16) 또 다른 보고에서는 15.7–65.4%의 민감도를 보여 고식적 B-mode 초음파의 91.7%보다 낮았다는 보고도 있다.(17) 최근에 발표된 전향적 연구에서는 SE가 80.2%의 민감도와 70.3%의 특이도를 보여 악성 갑상선 결절의 진단에 있어 B-mode 초음파보다 좋은 결과를 보였다.(18) 이러한 다양한 결과들은 사용된 기법, 장비의 조정(calibration), 통계학적 분석을 위한 점수 시스템 표준화의 부재, 제외 기준의 상이함 등이 그 원인이 될 수 있다.(19)
ARFI는 조직에서 국소화된 이동을 만드는 단기간의 음향 파동(short-duration acoustic pulse)을 이용한 병변의 자극에 의해 탄성도를 측정한다(Fig. 1B). ROI의 shear wave velocity가 등록된 후 정량적 측정(quantitative measurement)으로 전환되는데, 악성 종양의 경우 양성 종양보다 높은 shear wave velocity를 보인다.(20-22) Bojunga 등(23)에 따르면 정상 갑상선 조직과 양성 종양 그리고 악성 종양의 shear wave velocity가 각각 1.76 m/s, 1.90 m/s, 2.69 m/s로 통계학적으로 의미있는 차이를 보였으며, cutoff를 2.55 m/s로 하였을 때 갑상선 악성 종양 감별의 민감도 83%, 특이도 93%로 좋은 결과를 보였다는 보고가 있었다.(24) 또한 최근에 보고된 1,617개의 갑상선 결절을 대상으로 한 메타 분석에 따르면 86.3%의 민감도와 89.5%의 특이도를 보였다.(25)
ARFI는 SE와 비교해 시행자에 덜 의존적이고 진보된 영상으로 여겨지지만, ARFI에 의해 얻어지는 탄성도 자료가 다른 탄성초음파에서처럼 색-코드 영상(color-coded image)으로 변환되지 않아 ARFI는 SE에서 SWE로 넘어가는 과도기적인 영상 기술로 판단된다. 다수의 초점 영역(focal zones)을 가지고 ARFI를 적용하여 준-원통형(quasi-cylindrical)의 shear wave를 만들어 냄으로써 실시간 2-dimensional (2D) monitoring을 가능하게 한 영상 방법을 SWE라 일컫는다(Fig. 1C).
SWE는 점탄성 매체의 한 지점에 초음파를 집속시켜 집속된 지점을 판원으로 하여 발생하는 shear wave를 이용하여 매체 내의 탄성 변형 상태를 영상화하는 것으로 ARFI와 마찬가지로 shear wave velocity는 조직의 단단한 정도를 반영하여 속도가 빠를수록 악성의 가능성을 시사한다. 이렇게 측정된 속도로부터 조직의 탄성 계수(Young’s modulus)를 kilopascal (kPa) 단위로 계산해서 영상화한다.(26)
SWE는 외부 압력이 아닌 탄성도를 측정하는 변환기(transducer)에 의해 생성된 음향 파동을 이용하기 때문에 SE에 비해 시행자에 덜 의존적이다.(20,21) 또한 정성적, 정량적 측정을 통해 넓은 지역 안에 탄성도의 분포와 이질성(heterogeneity)의 평가가 가능하고 오류(bias)가 적으며 재현성(reproducibility)이 좋은 장점이 있다.
탄성초음파의 갑상선 결절 진단에 관한 그 동안의 보고들은 연구마다 다른 점수 체계나 cutoff 값을 사용해 매우 다양한 민감도를 보인다는 점 외에도 몇 가지 제한점들을 가지고 있다. 첫째, 연구마다 대상군이 다양하고 갑상선 결절의 이질적인 특성이 있어 교란 인자(confounding factor)가 될 수 있다. 많은 연구들에서 낭성 결절과 석회화를 동반한 결절은 대상에서 제외하였으며, 포함하더라도 낭성 정도 또는 석회화의 양상 등을 고려하지 않은 연구들이 많았다. 둘째, 조직 압박의 정도가 다르고 시행자의 결절 분류가 주관적이기 때문에 시행자 내 그리고 시행자 간 다양성(intra and interobserver variabilities)이 존재한다. 셋째, 탄성초음파의 갑상선 악성 종양 판정은 전신 또는 갑상선 질환의 여부에 따라 영향을 받는다. 예를 들자면, 하시모토 갑상선염(Hashimoto’s thyroiditis)이 있는 경우 갑상선 실질에 림프구 침윤을 동반하고 다양한 섬유화가 있을 수 있기 때문에 탄성초음파의 진단에 영향을 미친다. 넷째, FNAC에서 미결정(indeterminate)으로 진단받은 종양의 경우 탄성초음파의 진단 정확도가 감소하는 것으로 알려져 있다. 마지막으로 여포 종양(follicular neoplasm)은 탄성초음파의 위음성(false negative) 결과의 주된 요인이 된다. 유사하게 갑상선 수질암의 50% 이상은 부드러운 형태를 갖고 있어 탄성초음파의 악성 종양의 진단 정확도가 감소한다고 보고된다.(33)
지금까지 보고된 갑상선 결절의 진단을 위한 탄성초음파에 관한 연구들을 종합하면 탄성초음파는 기존의 B-mode와 Doppler 초음파를 대체하기보다는 보조적인 수단으로 함께 사용함으로써 진단의 정확도를 높인다고 할 수 있다. 즉, 기존의 고식적 초음파는 갑상선 악성 종양에 대해 매우 높은 민감도를 가지고 있는 데 탄성초음파 특히 SWE를 함께 사용하면 특이도를 증진시켜 더욱 높은 정확도를 보인다.(9,34)
탄성초음파는 갑상선 수술 후 중앙 구획(central compartment)에 남은 잔여 조직이나 갑상선염에서 보일 수 있는 가성 종양(pseudo-nodule) 또는 저에코성 결절들과 같은 특정 구조물들을 감별하는데 유용한 장점이 있다. 또한 경부 림프절 종대를 탐색하는데도 매우 유용해 갑상선암의 림프절 전이 여부를 진단하는 데 큰 도움이 될 수 있다.(35)
갑상선 결절 환자에서 탄성초음파의 임상적 유용성에 대해 많은 연구 결과들이 보고되었지만 실제 임상에서 보편적인 시행을 위해서는 고화질의 영상 획득, 전문 용어(terminology)의 통일, 참고 변수(reference parameter)의 명확한 설정, 점수 체계의 표준화(standardization) 등을 위한 노력이 필요하다. 향후 부피 측정을 포함하여 여러 장의 영상 단면을 제공함으로써 정확하고 구체적인 정보를 제공하는 3D SWE 등의 진보된 탄성초음파 기법을 활발히 시행한다면 갑상선암의 조기 진단에 도움이 될 것으로 전망한다.(36)
REFERENCES
1. Guth S, Theune U, Aberle J, Galach A, Bamberger CM. 2009; Very high prevalence of thyroid nodules detected by high frequency (13 MHz) ultrasound examination. Eur J Clin Invest. 39:699–706. DOI: 10.1111/j.1365-2362.2009.02162.x. PMID: 19601965.

2. Hegedus L. 2004; Clinical practice. The thyroid nodule. N Engl J Med. 351:1764–71. DOI: 10.1056/NEJMcp031436. PMID: 15496625.
3. Cancer today: data visualization tools for exploring the global cancer burden in 2020 [Internet]. International Agency for Research on Cancer;Lyon: Available from: http://gco.iarc.fr/today/home. cited 2021 Mar 22.
4. National Cancer Information Center [Internet]. National Cancer Information Center;Goyang: Available from: https://www.cancer.go.kr. cited 2021 Mar 22.
5. Carneiro-Pla D. 2013; Ultrasound elastography in the evaluation of thyroid nodules for thyroid cancer. Curr Opin Oncol. 25:1–5. DOI: 10.1097/CCO.0b013e32835a87c8. PMID: 23211839.

6. Chammas MC, Gerhard R, de Oliveira IR, Widman A, de Barros N, Durazzo M, et al. 2005; Thyroid nodules: evaluation with power Doppler and duplex Doppler ultrasound. Otolaryngol Head Neck Surg. 132:874–82. DOI: 10.1016/j.otohns.2005.02.003. PMID: 15944558.

7. Russ G, Bigorgne C, Royer B, Rouxel A, Bienvenu-Perrard M. 2011; [The Thyroid Imaging Reporting and Data System (TIRADS) for ultrasound of the thyroid]. J Radiol. 92:701–13. French. DOI: 10.1016/j.jradio.2011.03.022. PMID: 21819912.
8. Monpeyssen H, Tramalloni J, Poirée S, Hélénon O, Correas JM. 2013; Elastography of the thyroid. Diagn Interv Imaging. 94:535–44. DOI: 10.1016/j.diii.2013.01.023. PMID: 23623210.

9. Shuzhen C. 2012; Comparison analysis between conventional ultrasonography and ultrasound elastography of thyroid nodules. Eur J Radiol. 81:1806–11. DOI: 10.1016/j.ejrad.2011.02.070. PMID: 21962937.

10. Merino S, Arrazola J, Cárdenas A, Mendoza M, De Miguel P, Fernández C, et al. 2011; Utility and interobserver agreement of ultrasound elastography in the detection of malignant thyroid nodules in clinical care. AJNR Am J Neuroradiol. 32:2142–8. DOI: 10.3174/ajnr.A2716. PMID: 22051809. PMCID: PMC7964425.

11. Ragazzoni F, Deandrea M, Mormile A, Ramunni MJ, Garino F, Magliona G, et al. 2012; High diagnostic accuracy and interobserver reliability of real-time elastography in the evaluation of thyroid nodules. Ultrasound Med Biol. 38:1154–62. DOI: 10.1016/j.ultrasmedbio.2012.02.025. PMID: 22542262.

12. Ophir J, Céspedes I, Ponnekanti H, Yazdi Y, Li X. 1991; Elastography: a quantitative method for imaging the elasticity of biological tissues. Ultrason Imaging. 13:111–34. DOI: 10.1177/016173469101300201. PMID: 1858217.

13. Magri F, Chytiris S, Chiovato L. 2016; The role of elastography in thyroid ultrasonography. Curr Opin Endocrinol Diabetes Obes. 23:416–22. DOI: 10.1097/MED.0000000000000274. PMID: 27428520.

14. Asteria C, Giovanardi A, Pizzocaro A, Cozzaglio L, Morabito A, Somalvico F, et al. 2008; US-elastography in the differential diagnosis of benign and malignant thyroid nodules. Thyroid. 18:523–31. DOI: 10.1089/thy.2007.0323. PMID: 18466077.

15. Rago T, Vitti P, Chiovato L, Mazzeo S, De Liperi A, Miccoli P, et al. 1998; Role of conventional ultrasonography and color flow-doppler sonography in predicting malignancy in 'cold' thyroid nodules. Eur J Endocrinol. 138:41–6. DOI: 10.1530/eje.0.1380041. PMID: 9461314.

16. Bojunga J, Herrmann E, Meyer G, Weber S, Zeuzem S, Friedrich-Rust M. 2010; Real-time elastography for the differentia-tion of benign and malignant thyroid nodules: a meta-analysis. Thyroid. 20:1145–50. DOI: 10.1089/thy.2010.0079. PMID: 20860422.

17. Moon HJ, Sung JM, Kim EK, Yoon JH, Youk JH, Kwak JY. 2012; Diagnostic performance of gray-scale US and elastography in solid thyroid nodules. Radiology. 262:1002–13. DOI: 10.1148/radiol.11110839. PMID: 22357900.

18. Azizi G, Keller JM, Mayo ML, Piper K, Puett D, Earp KM, et al. 2015; Thyroid nodules and shear wave elastography: a new tool in thyroid cancer detection. Ultrasound Med Biol. 41:2855–65. DOI: 10.1016/j.ultrasmedbio.2015.06.021. PMID: 26277203.

19. Moraes PHM, Sigrist R, Takahashi MS, Schelini M, Chammas MC. 2019; Ultrasound elastography in the evaluation of thyroid nodules: evolution of a promising diagnostic tool for predicting the risk of malignancy. Radiol Bras. 52:247–53. DOI: 10.1590/0100-3984.2018.0084. PMID: 31435087. PMCID: PMC6696751.

20. Bamber J, Cosgrove D, Dietrich CF, Fromageau J, Bojunga J, Calliada F, et al. 2013; EFSUMB guidelines and recommendations on the clinical use of ultrasound elastography. Part 1: basic principles and technology. Ultraschall Med. 34:169–84. DOI: 10.1055/s-0033-1335205. PMID: 23558397.

21. Cosgrove D, Piscaglia F, Bamber J, Bojunga J, Correas JM, Gilja OH, et al. 2013; EFSUMB guidelines and recommendations on the clinical use of ultrasound elastography. Part 2: clinical applications. Ultraschall Med. 34:238–53. DOI: 10.1055/s-0033-1335375. PMID: 23605169.
22. Friedrich-Rust M, Romenski O, Meyer G, Dauth N, Holzer K, Grünwald F, et al. 2012; Acoustic radiation force impulse-imaging for the evaluation of the thyroid gland: a limited patient feasibility study. Ultrasonics. 52:69–74. DOI: 10.1016/j.ultras.2011.06.012. PMID: 21788057.

23. Bojunga J, Dauth N, Berner C, Meyer G, Holzer K, Voelkl L, et al. 2012; Acoustic radiation force impulse imaging for differentiation of thyroid nodules. PLoS One. 7:e42735. DOI: 10.1371/journal.pone.0042735. PMID: 22952609. PMCID: PMC3430659.

24. Gu J, Du L, Bai M, Chen H, Jia X, Zhao J, et al. 2012; Preliminary study on the diagnostic value of acoustic radiation force impulse technology for differentiating between benign and malignant thyroid nodules. J Ultrasound Med. 31:763–71. DOI: 10.7863/jum.2012.31.5.763. PMID: 22535724.

25. Dong FJ, Li M, Jiao Y, Xu JF, Xiong Y, Zhang L, et al. 2015; Acoustic radiation force impulse imaging for detecting thyroid nodules: a systematic review and pooled meta-analysis. Med Ultrason. 17:192–9. DOI: 10.11152/mu.2013.2066.172.hyr. PMID: 26052570.

26. Zhao CK, Xu HX. 2019; Ultrasound elastography of the thyroid: principles and current status. Ultrasonography. 38:106–24. DOI: 10.14366/usg.18037. PMID: 30690960. PMCID: PMC6443591.

27. Sebag F, Vaillant-Lombard J, Berbis J, Griset V, Henry JF, Petit P, et al. 2010; Shear wave elastography: a new ultrasound imaging mode for the differential diagnosis of benign and malignant thyroid nodules. J Clin Endocrinol Metab. 95:5281–8. DOI: 10.1210/jc.2010-0766. PMID: 20881263.

28. Veyrieres JB, Albarel F, Lombard JV, Berbis J, Sebag F, Oliver C, et al. 2012; A threshold value in Shear Wave elastography to rule out malignant thyroid nodules: a reality? Eur J Radiol. 81:3965–72. DOI: 10.1016/j.ejrad.2012.09.002. PMID: 23031543.

29. Kim H, Kim JA, Son EJ, Youk JH. 2013; Quantitative assessment of shear-wave ultrasound elastography in thyroid nodules: diagnostic performance for predicting malignancy. Eur Radiol. 23:2532–7. DOI: 10.1007/s00330-013-2847-5. PMID: 23604801.

30. Kim HJ, Kwak MK, Choi IH, Jin SY, Park HK, Byun DW, et al. 2019; Utility of shear wave elastography to detect papillary thyroid carcinoma in thyroid nodules: efficacy of the standard deviation elasticity. Korean J Intern Med. 34:850–7. DOI: 10.3904/kjim.2016.326. PMID: 29466846. PMCID: PMC6610177.

31. Liu Z, Jing H, Han X, Shao H, Sun YX, Wang QC, et al. 2017; Shear wave elastography combined with the thyroid imaging reporting and data system for malignancy risk stratification in thyroid nodules. Oncotarget. 8:43406–16. DOI: 10.18632/oncotarget.15018. PMID: 28160573. PMCID: PMC5522156.

32. Duan SB, Yu J, Li X, Han ZY, Zhai HY, Liang P. 2016; Diagnostic value of two-dimensional shear wave elastography in papillary thyroid microcarcinoma. Onco Targets Ther. 9:1311–7. DOI: 10.2147/OTT.S98583. PMID: 27022286. PMCID: PMC4790519.
33. Dobruch-Sobczak K, Guminska A, Bakuła-Zalewska E, Mlosek K, Słapa RZ, Wareluk P, et al. 2015; Shear wave elastography in medullary thyroid carcinoma diagnostics. J Ultrason. 15:358–67. DOI: 10.15557/JoU.2015.0033. PMID: 26807293. PMCID: PMC4710687.
34. Xu HX, Yan K, Liu BJ, Liu WY, Tang LN, Zhou Q, et al. 2019; Guidelines and recommendations on the clinical use of shear wave elastography for evaluating thyroid nodule1. Clin Hemorheol Microcirc. 72:39–60. DOI: 10.3233/CH-180452. PMID: 30320562.

35. Kanagaraju V, Rakshith AVB, Devanand B, Rajakumar R. 2019; Utility of ultrasound elastography to differentiate benign from malignant cervical lymph nodes. J Med Ultrasound. 28:92–8. DOI: 10.4103/JMU.JMU_72_19. PMID: 32874867. PMCID: PMC7446693.

36. Han RJ, Du J, Li FH, Zong HR, Wang JD, Shen YL, et al. 2019; Comparisons and combined application of two-dimensional and three-dimensional real-time shear wave elastography in diagnosis of thyroid nodules. J Cancer. 10:1975–84. DOI: 10.7150/jca.30135. PMID: 31205557. PMCID: PMC6548166.

Fig. 1
Ultrasound elastography techniques. (A) Strain elastography. (B) Acoustic radiation force impulse. (C) Shear wave elastography.
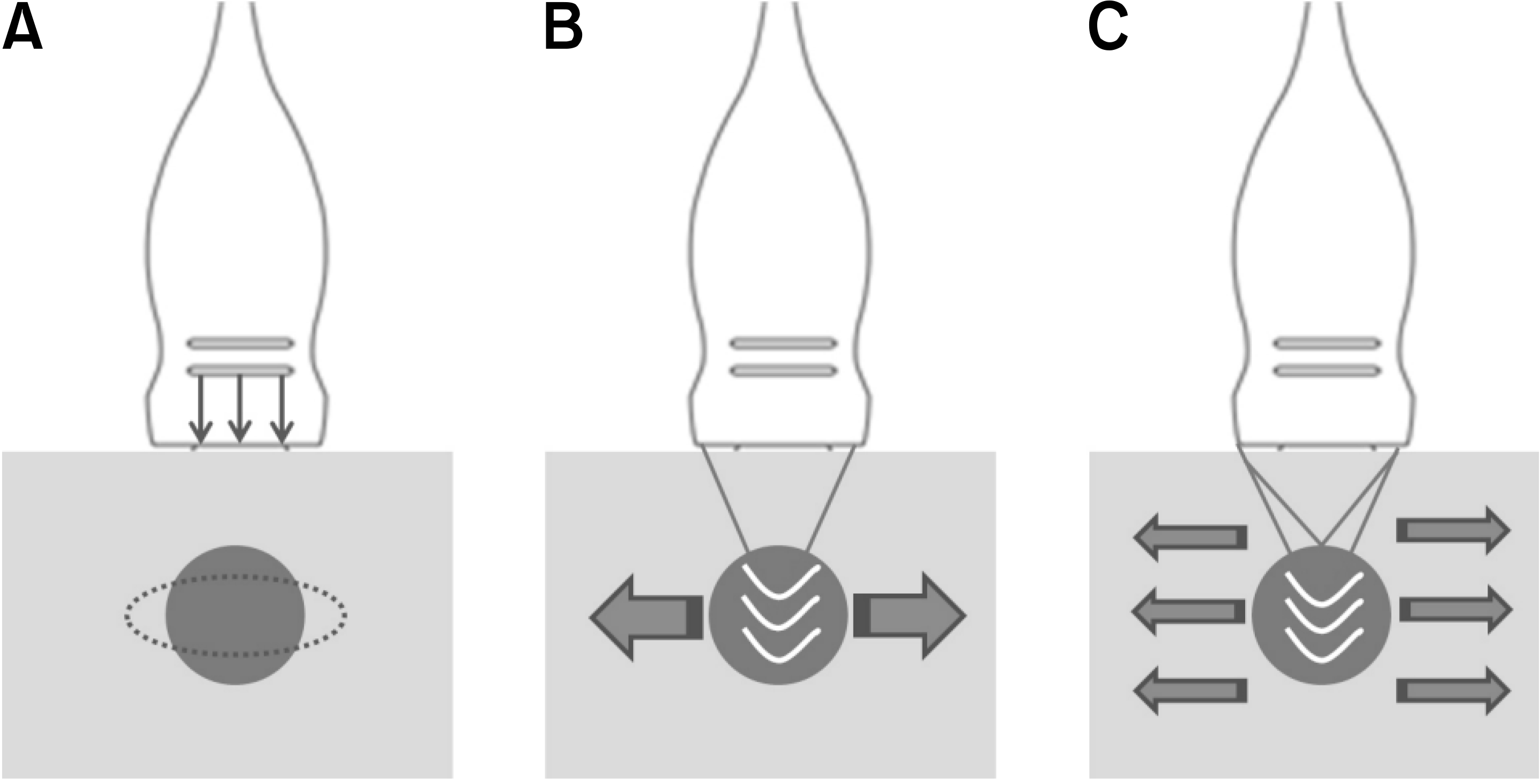
Table 1
Thyroid Imaging Reporting and Data System Classification




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download