Abstract
An inflammatory myofibroblastic tumor (IMT) is a rare tumor that is currently classified as an intermediate cancer according to the World Health Organization classification system. The pathophysiology of its occurrence is still unknown. Imaging tests, such as CT or MRI, can be helpful in diagnosis, but the final diagnosis is confirmed by a pathological examination through a biopsy and immunohistochemistry stain. The patient, in this case, presented an asymptomatic intrahepatic mass discovered incidentally on an imaging examination. Initially, intrahepatic cholangiocarcinoma was suspected, but she was finally diagnosed with IMT through a histological examination after a liver resection.
염증성 근섬유모세포종양(inflammatory myofibroblastic tumor, IMT)은 전 세계적으로 보기 드문 종양 중 하나로 일반적으로 양성의 임상 경과를 가지는 것으로 알려져 있다. 하지만, 아주 드물게 원격 전이를 유발하거나 적절한 치료 후에도 재발하는 경우도 있어, 세계보건기구(World Health Organization) 분류법에 따라 현재는 중간암으로 분류되고 있다.1,2 아직까지도 발생의 원인이 명확하게 밝혀지지는 않았으며, 노인보다는 젊은 성인 혹은 유아에서 많이 발생하는 것으로 알려져 있고, 발생 부위로는 폐나 복강내 장기에서의 발생이 가장 많고, 드물게 피하조직, 뼈, 중추신경계, 생식기, 구강 등에서도 발생할 수 있는 것으로 보고되고 있다. 진단에 있어서는 전산화단층촬영(CT)이나 자기공명영상(MRI) 장치와 같은 영상학적 검사가 도움이 될 수 있으나, 조직 검사를 통한 병리학적 검사, 면역화학염색을 이용해 최종적으로 진단할 수 있다.
본 증례는 무증상의 환자로 영상학적 검사상 우연히 발견된 간내 종괴가 간내담관암으로 의심되어 수술적 치료를 받았고, 술 후 조직 검사를 통해 최종적으로 IMT로 진단된 증례로, 국내에서도 몇 안되는 IMT를 경험하였기에 보고하고자 한다.
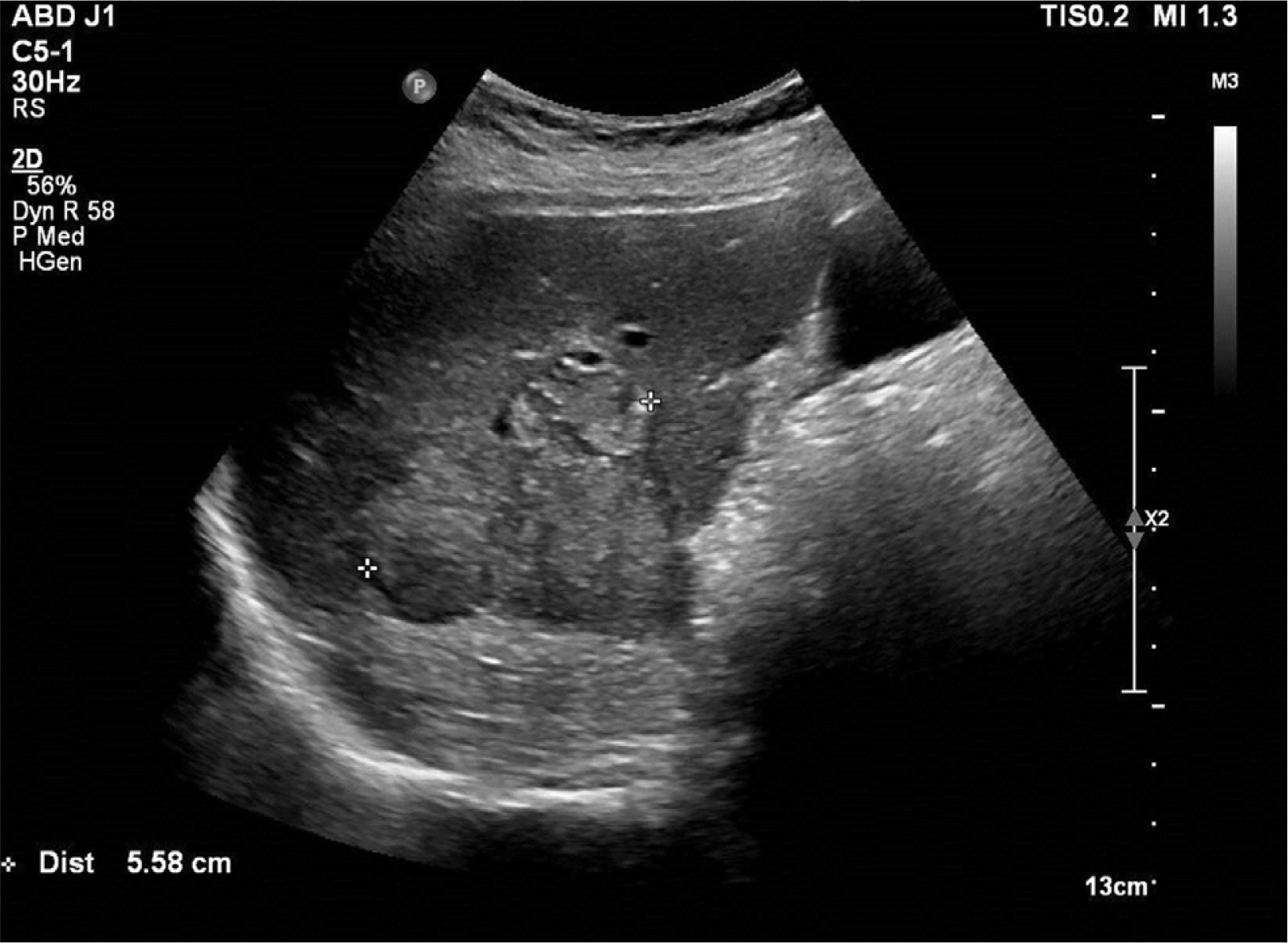
72세의 여자 환자가 당뇨병으로 진료 중이던 내분비내과 외래에서 시행한 복부 초음파에서 5.6 cm 크기의 담도암(S6) 의심 소견을 보이는 간내 종괴(Fig. 1)를 주소로 소화기내과로 의뢰되었다. 환자는 당뇨병, 고지혈증, 부갑상선기능항진증, 골다공증으로 약물 복용을 하고 있었고, 하지정맥류와 안과 수술력이 있었다. 흡연력, 음주력 및 가족력에서는 특이 소견이 없었다.
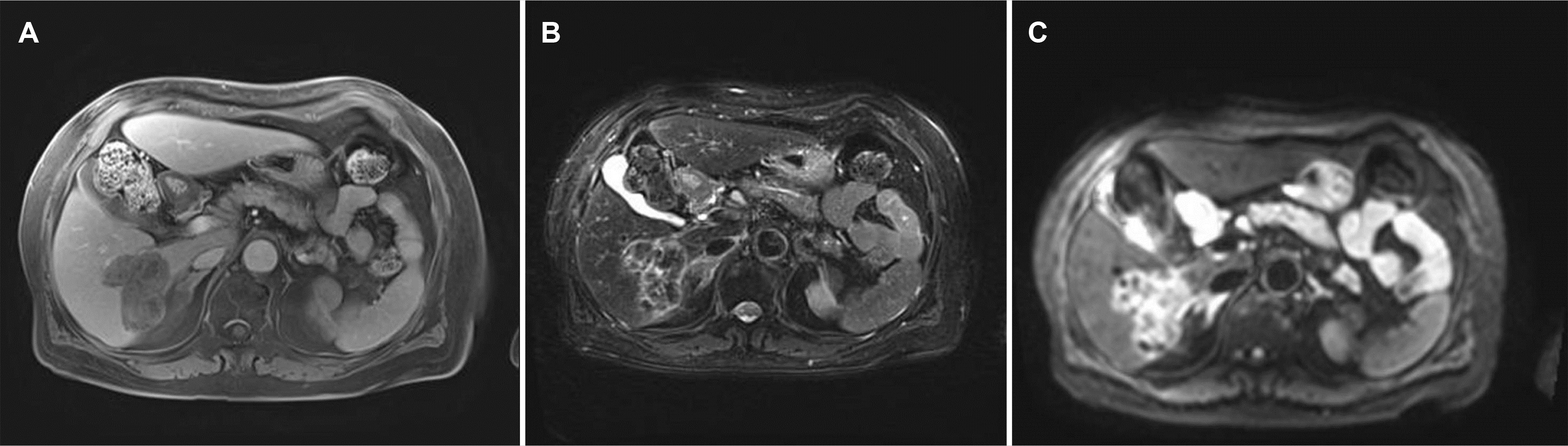
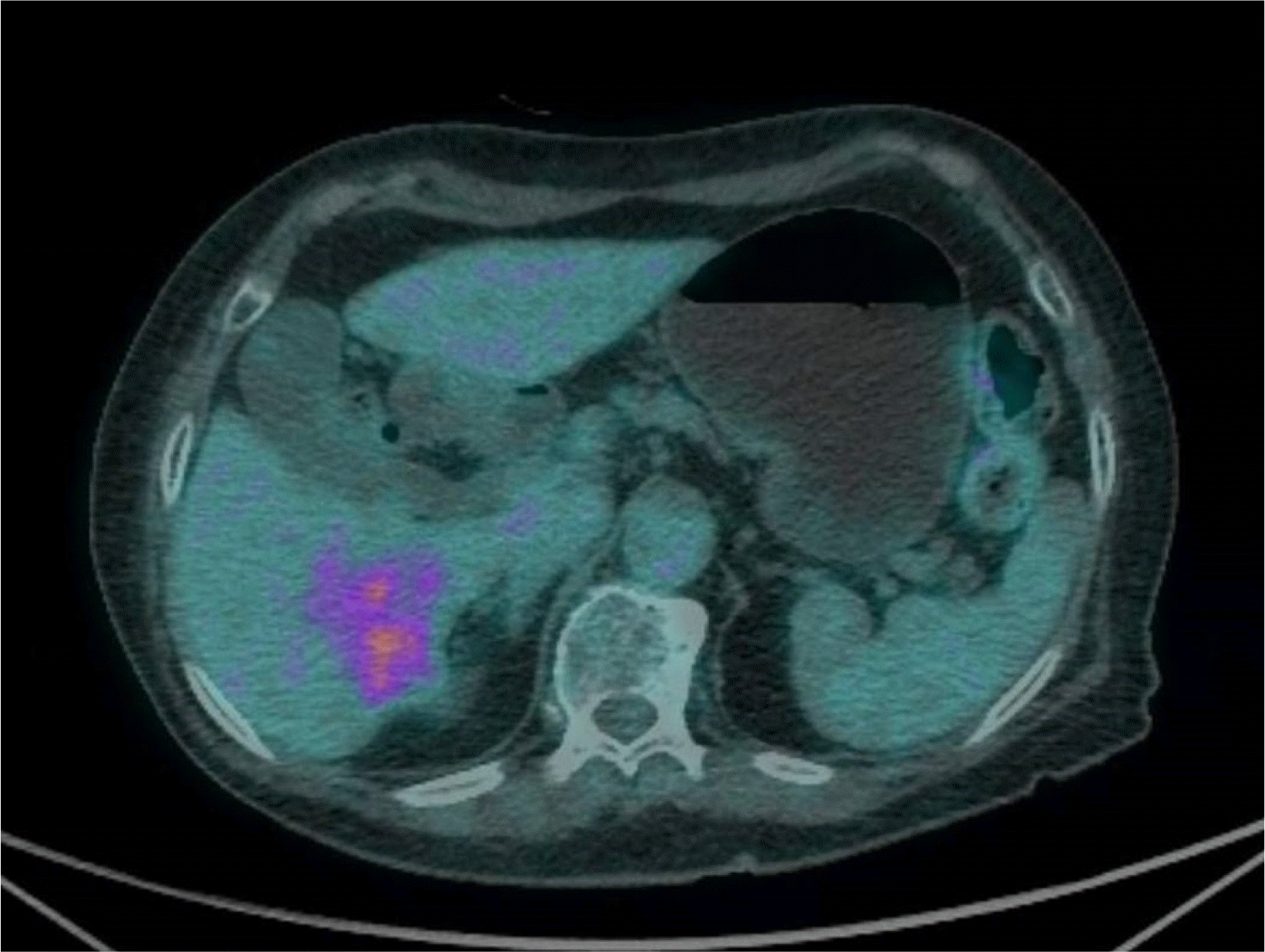
입원 당시 간내 종괴와 관련된 것으로 의심되는 증상은 없었다. 혈액 검사에서 glucose, uric acid 수치가 113 mg/dL, 6.5 mg/dL로 증가되어 있었고, 알파태아단백(AFP)이 55 ng/mL로 상승하고 CA19-9는 21.3 U/mL, 암배아항원(CEA)은 3.19 ng/mL로 정상이었다. 간기능 검사 소견 역시 특이 이상 소견을 보이지 않았다. 복부 CT (Fig. 2), 자기공명담췌관조영술(MRCP)에서(Fig. 3) S6 subcapsular area에서 5.8 cm의 불규칙한 모양을 가진 간내담도암이 의심되었고, atypical hep-atocellular carcinoma, inflammatory pseudotumor와의 감별이 필요한 것으로 판단되었다. 외과와의 협진 후 추가적인 영상 소견을 얻기 위해 진행한 양전자 컴퓨터단층촬영(PET-CT) 상에서는 CT, MRI에서와 같은 Liver S6 부위에 대사 증가를 보이는(SUVmax 5.17) 악성 종괴를 의심하였고, 원격 전이를 의심할 만한 소견은 없었다(Fig. 4).
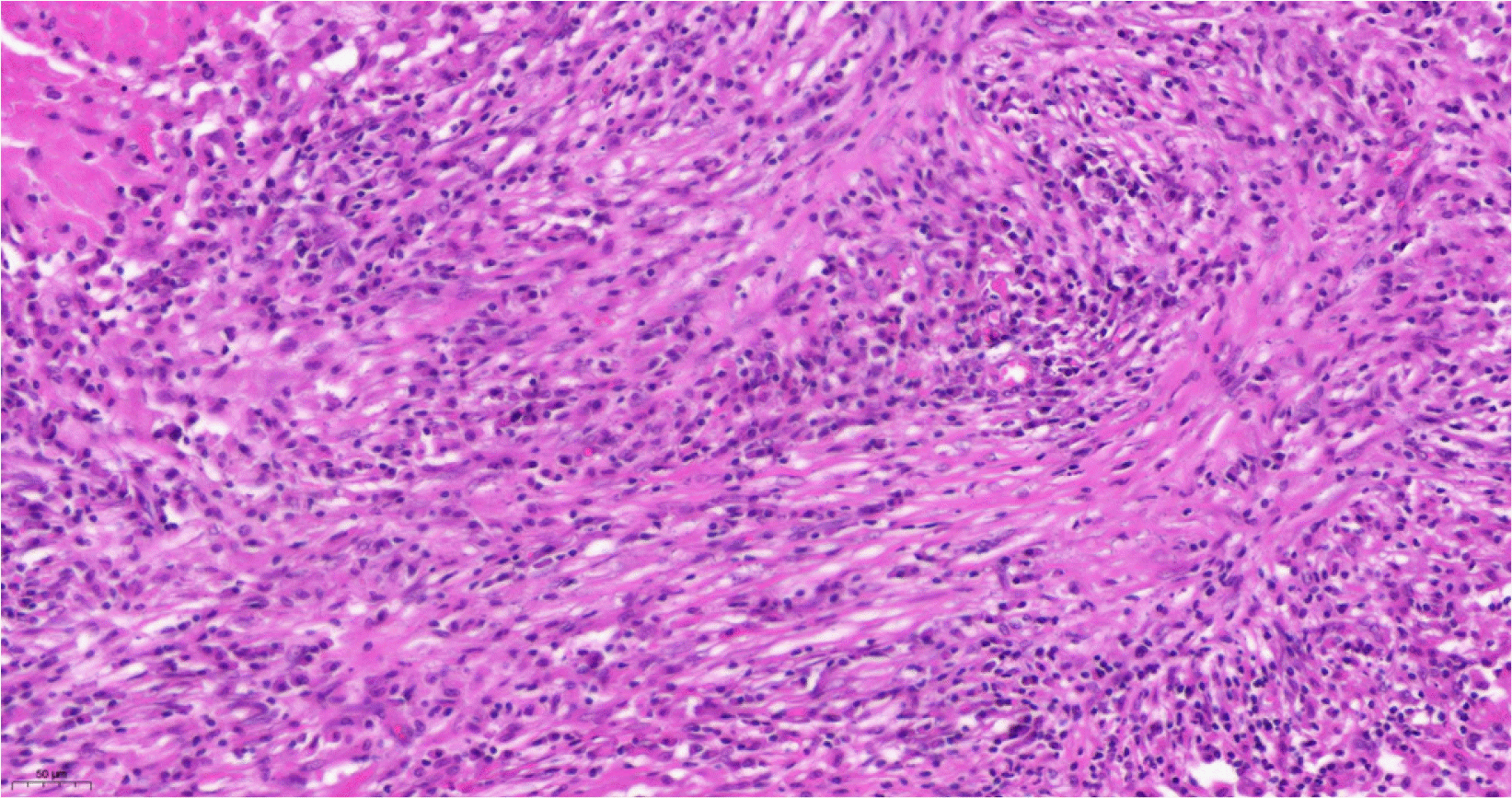
영상 검사에서는 악성 병변일 가능성이 높은 상황에서 간내담도암과 atypical HCC, inflammatory pseudotumor 등의 감별을 위해 조직 검사가 필요함을 환자에게 설명하였으나, 조직 검사에서 간내담도암 소견이 나오지 않을 경우 지속적으로 추적 관찰이 필요함에 대해 환자가 많은 부담감을 가지는 상태였고 최종적으로 환자와 보호자와의 상의 및 외과 협진을 거쳐 복강경하 우측간절제술을 시행하였다. 병변은 4.7×4.3 cm 크기의 불규칙한 모양을 가졌고 수술절제부 안전역(safety margin)이 확보되었다. 병리조직 검사 결과 염증세포의 침윤 및 괴사와 함께 방추형세포의 증식이 관찰되었다(Fig. 5). 면역조직화학염색 결과 vimentin과 smooth muscle actin (SMA)에서 양성을 보였고 CD246 (ALK-1), CD117 (C-kit), IgG4, CD34, DOG-1에서 음성을 보여, 최종적으로 IMT로 진단하였다.
수술 후 환자의 전신 상태는 양호하였고 수술 관련한 기타 합병증도 없어, 퇴원 후 현재는 외래에서 특별한 이상 소견 없이 경과 관찰 중이며, 수술 한 달 뒤 시행한 복부 CT 검사 상 재발 및 전이 의심 소견은 없는 상태이다.
IMT는 전 세계적으로 보기 드문 종양 중 하나로, 1939년 Bunn에 의해 폐조직에서 처음으로 확인된 사례가 보고되었다.3 Ebstein-Barr virus, Human herpes virus-3 (HHV-3), HHV-8, Escherichia coli (E. coli), Klebsiella 등에 의한 감염이나, 면역학적 요인, 외상 등이 발병 요인이 될 수 있고, 일부 사례에서 2p23 염색체 재배열과 anaplastic lymphoma kinase 1 (ALK1)과 p80의 발현도 확인이 되었으나 아직까지도 명확한 병인은 밝혀지지 않은 상태이다.4-6
임상 증상은 IMT가 발병한 장기에 따라서 달라지나, 간에 발생한 경우 복통과 고열, 체중감소, 황달이 관찰될 수 있고, 본 증례와 같이 무증상으로 발견되는 경우도 드물게 있다. 일반적으로 간에 IMT가 발생하는 경우 담도계나 담낭에 가깝게 위치하고 주로 우측 간에 호발하는 것으로 알려져 있다.7,8 혈액 검사에서는 주로 백혈구 상승, C 반응성 단백질(CRP), 적혈구침강속도(erythrocyte sedimentation rate) 등의 상승과 같이 염증성 반응을 보이고,9,10 알파태아단백(AFP)이나 암배아항원(CEA)과 같은 종양 표지자들은 정상인 경우가 대부분이나 경우에 따라 CA 19-9은 상승할 수 있다.11 본 증례의 경우에는 혈액 검사 및 임상 양상에서 염증성 반응을 시사하는 소견은 없었고, 종양표지자 중에서도 AFP 수치의 경한 상승만 있었다.
IMT를 영상학적으로 확실히 진단하는 것은 다소 한계가 있지만, 몇 가지 영상학적 검사의 특징이 진단에 도움이 될 수는 있다. 앞서 보고된 증례들을 통해 IMT는 초음파에서 주로 저에코를 보이고, 비조영증강 CT에서는 경계가 불분명한 저음영의 병변을, 조영증강 CT에서는 경계가 불분명한 테두리 조영증강이 동맥기에서 관찰되고, 평형기에서는 내부의 저음영을 가진 고음영 병변으로 관찰됨이 보고된 바 있다. MRI에서는 T1 강조 영상에서 저신호, T2 강조 영상에서는 고신호를 보일 수 있다.12 본 증례에서는 MRI 결과 T1 강조 영상에서 저신호, T2 강조 영상에서는 다소 고신호를 보였으나, 초음파에서 비균질 고에코를 보이고 CT에서는 비조영기, 동맥기, 지연기 모두에서 조영이 되지 않는 특징을 보였다. 마지막으로 PET-CT 상으로는 대사 증가를 보이는 병변이 확인되었다. 결과적으로 MRI와 비조영기에서의 영상학적 특징은 부합하였으나 초음파와 동맥기, 지연기의 CT에서는 차이점을 보였다.
결국, IMT의 확진은 조직 검사를 통해 할 수 있고, 병리 조직 검사를 통해 점액성/혈관성 양상, 밀집된 방추형 세포 양상, 저세포 섬유질 양상 등의 병리학적 특징을 확인하여 진단할 수 있다.1 본 증례에서는 SMA에 양성을 보이는 방추형 세포의 증식과 함께 주변에 많은 형질세포와 림프구 그리고 약간의 호중구가 침윤된 것을 확인할 수 있었고, 면역조직화학염색에서 CD117 (C-kit), IgG4, CD34의 음성과 vimentin, SMA 양성을 통해 IMT를 진단할 수 있었다.13,14
IMT는 일반적으로 양성의 경과를 가지는 경우가 대부분이라 수술적 치료의 금기가 아니라면 병변을 수술적 절제하는 것이 조금 더 선호되는 것으로 보인다.8,10,15,16 하지만 경과 관찰 중 저절로 호전이 된 경우나, 병리학적 진단 후 고용량 스테로이드나 NSAIDs의 사용 혹은 방사선 치료를 통해 성공적으로 치료하였다는 일부 증례 보고가 있고, ALK 유전자 발현 IMT에서 ALK 억제제가 치료 효과가 있었다는 연구도 있다.17-19 원격전이나 재발하는 경우에서는 메토트렉세이트(methotrexate), 카보플라틴(carboplatin), 이포스파미드(ifosfamide) 등의 항암제를 사용하였다는 증례 보고는 있었으나 각각의 항암제에 대한 반응이나 효능은 불확실하여 IMT의 이상적인 치료법에 대해서는 아직도 많은 연구가 필요할 것으로 보인다.20-22
본 증례는 영상학적 검사에서 간내담도암으로 추정되어 우측 간절제술을 시행한 후 시행된 병리 조직 검사를 통해 최종적으로 IMT가 진단된 경우로, 일반적인 영상학적 검사에서 악성 종양과의 감별이 어려울 수 있고, 영상학적 검사만으로는 IMT의 확진이 쉽지 않음을 알 수 있었다. 본 증례와 비슷한 간 종괴가 의심될 경우 수술적 치료를 포함한 치료를 고려함과 동시에, 수술적 위험도가 크거나 환자가 수술을 원하지 않을 경우에는 적극적으로 조직 검사를 통해 병리학적 소견을 확인하고, 경우에 따라 짧은 주기의 추적 검사를 시행하는 것도 충분히 고려할 수 있을 것으로 사료된다.
REFERENCES
1. Fletcher CDM, Unni KK, Mertens F. Pathology and genetics of tumours of soft tissue and bone. IARC Press;Lyon:
2. Poh CF, Priddy RW, Dahlman DM. 2005; Intramandibular inflammatory myofibroblastic tumor--a true neoplasm or reactive lesion? Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 100:460–466. DOI: 10.1016/j.tripleo.2004.07.005. PMID: 16182167.

3. Gómez-Román JJ, Sánchez-Velasco P, Ocejo-Vinyals G, Hernández-Nieto E, Leyva-Cobián F, Val-Bernal JF. 2001; Human herpesvirus-8 genes are expressed in pulmonary inflammatory myofibroblastic tumor (inflammatory pseudotumor). Am J Surg Pathol. 25:624–629. DOI: 10.1097/00000478-200105000-00009. PMID: 11342774.

4. Coffin CM, Patel A, Perkins S, Elenitoba-Johnson KS, Perlman E, Griffin CA. 2001; ALK1 and p80 expression and chromosomal rearrangements involving 2p23 in inflammatory myofibroblastic tumor. Mod Pathol. 14:569–576. DOI: 10.1038/modpathol.3880352. PMID: 11406658.

5. Lewis JT, Gaffney RL, Casey MB, Farrell MA, Morice WG, Macon WR. 2003; Inflammatory pseudotumor of the spleen associated with a clonal Epstein-Barr virus genome. Case report and review of the literature. Am J Clin Pathol. 120:56–61. DOI: 10.1309/BUWNMG5RV4D09YYH. PMID: 12866373.

6. Sürer E, Bozova S, Gökhan GA, Gürkan A, Elpek GO. 2009; Inflammatory myofibroblastic tumor of the liver: a case report. Turk J Gastroenterol. 20:129–134. PMID: 19530046.
7. Park JY, Choi MS, Lim YS, et al. 2014; Clinical features, image findings, and prognosis of inflammatory pseudotumor of the liver: a multicenter experience of 45 cases. Gut Liver. 8:58–63. DOI: 10.5009/gnl.2014.8.1.58. PMID: 24516702. PMCID: PMC3916688.

8. Ueda M, Yukihide Y, Ogawa K, et al. 2003; A case of inflammatory pseudotumor of the liver hilum successfully treated with aggressive hepatectomy. J Pediatr Surg. 38:E9–E11. DOI: 10.1016/j.jpedsurg.2003.08.004. PMID: 14614735.

9. Nagarajan S, Jayabose S, McBride W, et al. 2013; Inflammatory myofibroblastic tumor of the liver in children. J Pediatr Gastroenterol Nutr. 57:277–280. DOI: 10.1097/MPG.0b013e31829e0b3b. PMID: 23974058.

10. Ogawa T, Yokoi H, Kawarada Y. 1998; A case of inflammatory pseudotumor of the liver causing elevated serum CA19-9 levels. Am J Gastroenterol. 93:2551–2555. DOI: 10.1111/j.1572-0241.1998.00717.x. PMID: 9860425.

11. Miettinen M, Sobin LH, Sarlomo-Rikala M. 2000; Immunohistochemical spectrum of GISTs at different sites and their differential diagnosis with a reference to CD117 (KIT). Mod Pathol. 13:1134–1142. DOI: 10.1038/modpathol.3880210. PMID: 11048809.

12. Goldsmith PJ, Loganathan A, Jacob M, et al. 2009; Inflammatory pseudotumours of the liver: a spectrum of presentation and management options. Eur J Surg Oncol. 35:1295–1298. DOI: 10.1016/j.ejso.2009.04.003. PMID: 19515527.

13. Cook JR, Dehner LP, Collins MH, et al. 2001; Anaplastic lymphoma kinase (ALK) expression in the inflammatory myofibroblastic tumor: a comparative immunohistochemical study. Am J Surg Pathol. 25:1364–1371. DOI: 10.1097/00000478-200111000-00003. PMID: 11684952.

14. Pack GT, Baker HW. 1953; Total right hepatic lobectomy; report of a case. Ann Surg. 138:253–258. DOI: 10.1097/00000658-195308000-00012. PMID: 13066016. PMCID: PMC1609266.
15. Tang L, Lai EC, Cong WM, et al. 2010; Inflammatory myofibroblastic tumor of the liver: a cohort study. World J Surg. 34:309–313. DOI: 10.1007/s00268-009-0330-x. PMID: 20033408.

16. Yamaguchi J, Sakamoto Y, Sano T, Shimada K, Kosuge T. 2007; Spontaneous regression of inflammatory pseudotumor of the liver: report of three cases. Surg Today. 37:525–529. DOI: 10.1007/s00595-006-3433-0. PMID: 17522777.

17. Butrynski JE, D'Adamo DR, Hornick JL, et al. 2010; Crizotinib in ALK-rearranged inflammatory myofibroblastic tumor. N Engl J Med. 363:1727–1733. DOI: 10.1056/NEJMoa1007056. PMID: 20979472. PMCID: PMC3014292.

18. Xiang J, Liu X, Wu S, Lv Y, Wang H. 2012; Multiple inflammatory myofibroblastic tumor of the duodenum: case report and literature review. J Gastrointest Surg. 16:1442–1445. DOI: 10.1007/s11605-012-1883-9. PMID: 22528570.

19. Koea JB, Broadhurst GW, Rodgers MS, McCall JL. 2003; Inflammatory pseudotumor of the liver: demographics, diagnosis, and the case for nonoperative management. J Am Coll Surg. 196:226–235. DOI: 10.1016/S1072-7515(02)01495-3. PMID: 12595051.

20. Bertocchini A, Lo Zupone C, Callea F, et al. 2011; Unresectable multifocal omental and peritoneal inflammatory myofibroblastic tumor in a child: revisiting the role of adjuvant therapy. J Pediatr Surg. 46:e17–e21. DOI: 10.1016/j.jpedsurg.2011.01.007. PMID: 21496520.

21. Johnson K, Notrica DM, Carpentieri D, Jaroszewski D, Henry MM. 2013; Successful treatment of recurrent pediatric inflammatory myofibroblastic tumor in a single patient with a novel chemotherapeutic regimen containing celecoxib. J Pediatr Hematol Oncol. 35:414–416. DOI: 10.1097/MPH.0b013e3182915cef. PMID: 23669730.

22. Kovach SJ, Fischer AC, Katzman PJ, et al. 2006; Inflammatory myofibroblastic tumors. J Surg Oncol. 94:385–391. DOI: 10.1002/jso.20516. PMID: 16967468.

Fig. 2
Computed tomography scan, 5.8 cm sized irregular hypodense mass in the (A) pre-phase, (B) arterial phase, and (C) portal phase.
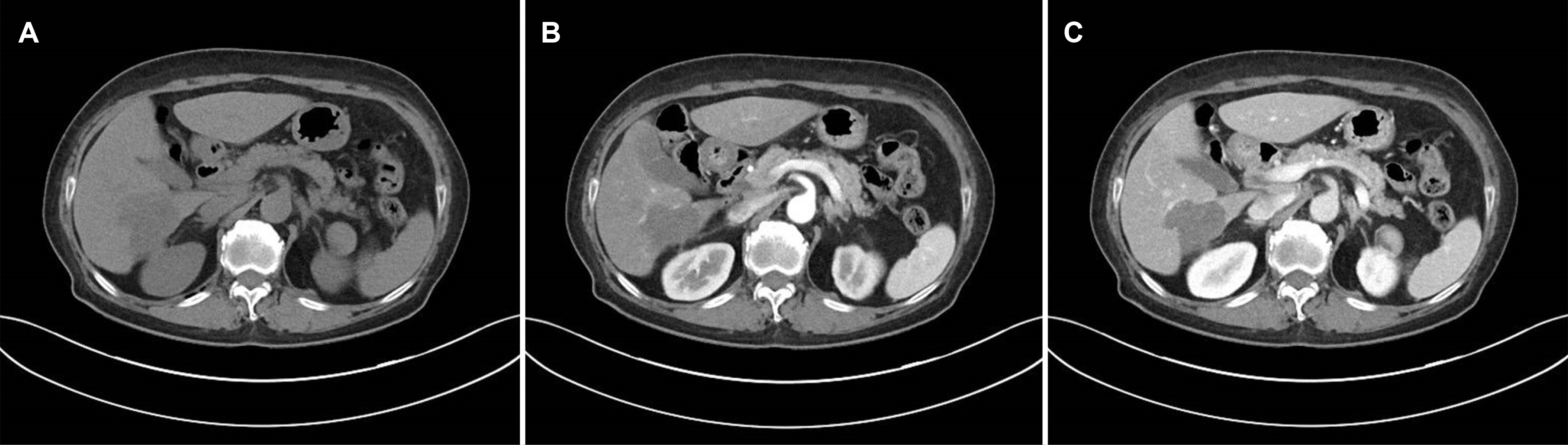
Fig. 3
Magnetic resonance imaging. An approximately 5.8 cm irregular-shaped mass in the S6 subcapsular area. (A) T1 weighted image shows low signal intensity, (B) T2 weighted image shows slight high signal intensity, (C) diffusion-weighted image shows restricted diffusion.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download