This article has been
cited by other articles in ScienceCentral.
Abstract
Background:
Maintenance of tracheal intubation is associated with use of sedatives, stress due to mechanical ventilation, or respiratory complications. The aim of this study is to compare the incidence of delirium between early and late extubation groups after liver transplantation (LT).
Methods:
Medical records from 247 patients who received LT from January 2010 to July 2017 in a single university hospital were retrospectively reviewed. Patients were divided with 2 groups: Those who underwent early extubation after LT (E group, n = 52) and those who underwent extubation within few hours of intensive care unit (ICU) admission after surgery (C group, n = 195). The patients’ demographic data, perioperative managements and postoperative complications were collected. Early extubation was defined as performing extubation in the operating room after LT. A propensity score matching analysis was performed to reduce the effects of selection bias.
Results:
Among them, 4/52 (7.69%) in E group and 30/195 (15.38%) in C group occurred postoperative delirium after LT, respectively (P = 0.180). After propensity score matching, there was no difference of the period of hospitalization in ICU (P = 0.961), time to discharge after surgery (P = 0.117) and incidence of delirium between groups (P = 1.000).
Conclusions:
Although this study is a retrospective study and limited by the small number of subjects, early extubation does not affect the incidence of delirium after LT. Therefore, further prospective studies on this were needed.
Keywords: Airway extubation, Delirium, Liver transplantation, Postoperative complication
서 론
간이식 수술 후 발생하는 섬망 등 신경학적 합병증은 대략 13%에서 42% 정도로 빈번하게 발생하는데[
1,
2] 수술 후 사망률과 합병증의 이환율과의 연관성이 높고 중환자실 체류기간과 재원 기간이 연장되어 의료비 또한 증가하게 된다[
3]. 술 후 섬망에 영향을 주는 요인으로 술 후 신체 억제대, 대사 및 전해질 이상, 마취제, anticholinergics, benzodiazepine, 마약성 진통제 및 항파킨슨 약과 같은 약물 사용, 부적절한 술 후 통증 조절, 술 중 실혈량이나 수혈량, 술 후 낮은 알부민 수치나, 헤마토크리트 30% 미만, 산소 결핍증 등이 알려져 있다[
4–
8].
간이식 수술 후 적절한 시기에 기관 발관을 하는 것은 수술 후 집중 관리의 매우 중요한 부분이며 적절한 기관 발관은 간이식 후 관리에서 심폐 혈역학적 개선을 유도할 수 있고 이식간의 혈류 공급과 전신의 산소화를 개선시킴으로써 중환자실 체류 기간을 줄이고 환자의 예후에 긍정적이라는 의견이 있다[
9]. 반면 무리한 발관 시도는 오히려 부적절한 환기를 야기하여 저산소증 등 합병증과 기관 재삽관과 같은 문제를 야기할 수 있다. 하지만, 장기간 기관 삽관을 유지하게 되면 그로 인해 감염 등 문제를 야기할 수 있고[
10] 환자에게 불편함을 줄 수 있어 적절한 시기에 발관하는 것이 선호 된다. 통상적으로 간이식 수술 후 12–48시간 정도 기계 환기를 유지하는 것으로 보고되며 간이식 후 호흡 관리의 통상적인 지침으로 알려져 있다[
11–
13]. 그런데 최근 보고에 따르면, 적절한 발관 시기에 관련하여 간이식 수술 후 수술 실에서의 발관의 경우 19%, 수술 후 약 5시간 시점에서는 70% 까지 성공적 발관을 보고하고 있다[
11,
12,
14,
15]. 이처럼 조기 발관을 시행하는 경우 중환자실에서의 진정제 사용의 기회를 줄 일 수 있고 환자에게 기관 삽관으로 인한 불편함과 스트레스, 또 이로 인한 혈역학적 변화 등을 줄일 수 있다.
이에 본 연구는 조기 발관이 간이식 수술을 받은 환자에서 술 후 섬망 발생률에 미치는 영향에 관하여 조사하고자 한다. 이 때 조기 발관은 수술장에서 발관을 시행하고 중환자실로 나가는 경 우로 정의한다.
대상 및 방법
본 연구는 병원 임상연구위원회의 승인(no. 2017-156)을 얻 었으며 2010년 1월 1일부터 2017년 7월 31일까지 간이식을 시 행 받은 환자의 의무기록을 전산으로 검색하여 360명의 간이식 환자를 대상으로 자료를 수집하였다(
Fig. 1).
Fig. 1
The flow diagram of this study.
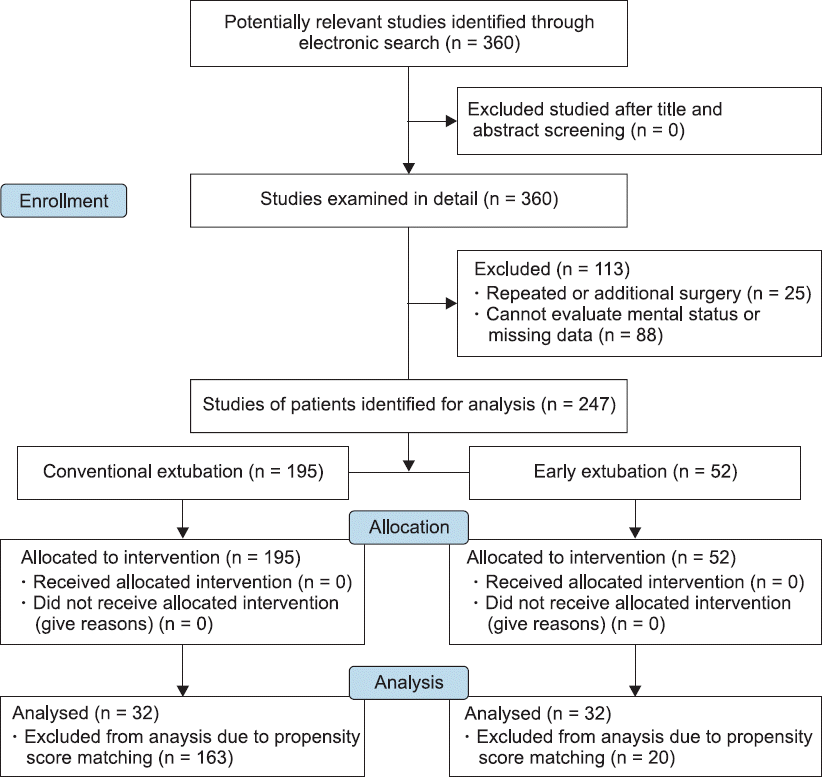
재이식이나 추가 수술을 받은 환자, 기저의 의식 상태에 심각한 영향을 주는 뇌질환이 있거나 간이식 수술 후 의식 상태를 확 인할 수 없는 등 자료가 분실된 환자 등 113명을 제외한 247명 이 본 연구에 포함이 되었다. 대상 환자의 입원 기록지, 술 전 평 가지, 마취 기록지, 중환자실 기록지, 경과 기록지, 병실 간호 기록지, 협진 기록지, 퇴원 기록지 등의 의무 기록을 후향적으로 검 토하였다. 자료는 환자의 기본 정보, 수술 전 중 후 검사와 처치 등으로 나누어 수집을 하였다. 술 전 검사는 수술 전 1일 이내 시 행한 검사를 수집하였고 술 후 검사는 수술이 끝난 후 중환자실 로 이동하여 1일 이내 시행한 검사를 수집하였다.
섬망이 발생한 환자는, 환자와 의무 기록지에서 Diagnostic and Statistical Manual of Mental Disorders-IV (DSM-IV) 진단 기준에 증상과 증후가 합당한 환자로 주치의의 판단에 따라 환자가 섬망 치료가 필요한 상태로 판단되어 haloperidol 등 의 약제를 사용한 경우, 혹은 협력진료를 시행하여 증상과 증후 가 DSM-IV 진단 기준에 합당한 환자로 Mini-Mental Status Examination와 Confusion Assessment Method 등을 이용하여 섬망 진단을 받은 경우로 하였다.
술 후 합병증은 수술 시행 후 퇴원하기까지 발생한 합병증을 퇴원 기록지를 참고하여 수집하였다. 심장 합병증의 경우 부정맥, 협심증 등 심장 관련 질환이 발생하여 치료를 시행한 경우이며 호흡기계 합병증은 폐렴 등, 술 후 호흡기계 감염 등이 발생하여 치료를 시행한 경우로 정하였다. 신경학적 합병증은 뇌출혈 등 신경학적 합병증이 발생하여 치료한 경우이며 감염의 경우 수술 부위 등에 감염이 발생하여 치료를 시행한 경우로 정하였다. 사망은 수술 후 퇴원에 이르지 못하고 입원 기간 중 사망이 발생한 경우로 하였다. 간이식 후 급성거부반응의 경우 이식 후 6개월 이내 병리조직검사를 통해 급성거부반응으로 확인된 경우로 하였다.
전신 마취는 propofol, rocuronium 또는 cisatracurium을 사용하여 유도를 진행하였으며 흡입 마취 가스는 sevoflurane 또는 desflurane를 사용하여 흡입산소분율 40–50%인 산소/공기 혼합으로 진행되었으며 remifentanil (0.5–10 μg/kg/h) 및 근이완제(rocuronium, 0.3–0.6 mg/kg/h 또는 cisatracurium: 0.1–0.2 mg/kg/h)를 지속 주입하였다. 수혈은 헤마토크리트가 25–30%를 유지할 수 있도록 환자의 상태에 따라 진행하였다. 수술 중 적절한 혈압을 유지하기 위해서(수축기 혈압을 90 mmHg 이상 유지하면서 평균동맥압이 60 mmHg 이상 유 지) norepinephrine (0.01–0.4 μg/kg/min)을 사용하였으며 norepinephrine이 효과가 없다면 환자의 상태를 고려하여 dobutamine, vasopressin, epinephrine이 고려되었다. 모든 환자에게 심전도, 호기말 이산화탄소 농도(end-tidal carbon dioxide concentration), 마취심도(bispectral index), 말초 산 소포화도(peripheral oxygen saturation), 대뇌 산소포화도(cerebral blood oxygenation) 및 요골 및 대퇴 동맥에서의 침습성 동맥 모니터링을 포함한 표준 모니터링이 적용되었다. 심 박출량(cardiac output), 심박출량 지수(cardiac index), 일회박출량(stroke volume), 일회발출량 변동(stroke volume variation), 중심 정맥 산소 포화도(central venous oxygen saturation), 전신혈관저항지수(systemic vascular resistance index)를 모니터하기 위해 산소 측정 중심 정맥 카테터(PreSep, Edwards Lifesciences, USA)를 삽입하여 EV1000 모니터링 플랫폼(Edwards Lifesciences)을 사용하여 순환 관리를 평가하는데 사용되었다. 근이완제로 로큐로니움을 사용한 경우 술 후 수술장에서 기관발관을 결정하여(E group) 길항제(reversal agents)로 슈가마덱스(sugammadex) 2–4 mg/kg를 사용하였다.
면역 억제제는 칼시뉴린 억제제(cyclosporine 또는 tacrolimus)와 코르티코스테로이드가 일차 면역 억제 요법으로 사용되었다. 수술 후에는 프로스타글란딘 E1 (0.01 μg/kg/ min), 메틸 프레드니솔론(125 mg/d), cyclophosphamide (2 mg/kg/d), mycophenolate mofetil (시작 용량 500 mg/d, 유지 관리 1,000 mg/d)를 사용하였다.
수혜자 간 절제술는 담낭 절제술과 간 전체 절제술을 시행 후 기증 간을 넣고 간정맥과 문맥 문합을 시행한 후 혈액을 관류시 킨 다음, 간동맥 문합을 시행하였고 관류시켰다. 담도재건술을 시행하고 출혈을 다시 한 번 더 확인한 후 폐복하였다.
수술이 끝난 후 출혈 소견을 보이지 않고, 승압제 등의 요구량이 많지 않으며, 술 전 폐기능에 이상이 없고 조기 발관에 장애가 없을 것으로 판단되는 경우, 외과 의사와 마취통증의학과 의사의 판단에 따라 조기 발관을 결정하였다. 조기 발관 시에는 수술 실 안에서 기관 발관 후 중환자실로 이동하였고 지연 발관의 경우 중환자실로 이동 후 기관 삽관을 유지하여 인공 호흡을 시행하고 필요 시 진정제를 투여 하에 기계환기를 유지하였다. 환자의 활력 징후가 안정되고 출혈 소견이 없는 상태로 의식 회복과 자발호흡이 가능하다고 판단되면 발관을 시행하였다.
통계는 SAS (Statistical Analysis System version 9.3, SAS Institute, USA)와 R software version 3.3.2 (R Project for Statistical Computing, Austria)를 사용하여 자료를 분석하였다. 모든 관측치는 평균 ± 표준편차, 중간값(25–75백분위수), 또는 환자의 수(%)로 표시하였다. Normality test는 Shapiro– Wilk W test 또는 Kolmogorov–Smirnov을 시행하였으며 두 군 간의 비교를 위하여 연속 변수의 경우 independent t-test 또는 Wilcoxon rank-sum test를 시행하였다. 범주형 변수의 경우 chi-square test 또는 Fisher’s exact test를 적용하였다. P < 0.05인 경우에 통계적으로 유의한 것으로 간주하였다. 조기 발관이 술 후 섬망 발생률에 미치는 영향을 알아보기 위하여 성향점수(propensity score)을 이용한 nearest neighbor matching 방법 이용하여 1 : 1 매칭을 시행하였다. 군간 차이 를 보인(P < 0.05) 간이식 원인, Child–Pugh score 등 술 전 기저 질환과 신체 활동(physical activity), American Society of Anesthesiologists physical status, 술 전 검사, 출혈량을 포함한 술 중 처치, 술 후 검사, 중환자실 체류 기간 등을 보정하였다. 성향점수 1 : 1 매칭 후에 연속 변수는 paired t-test 또는 Wilcoxon signed rank test로, 범주형 변수는 McNemar test로 두 군을 비교하였다. 이 때 성향점수 매칭 분석에서 caliper size는 0.15였다.
일변량 분석과 다변량 분석을 통하여 조기 발관이 섬망 발생에 미치는 영향을 분석하였다. 통상적으로 술 후 섬망과 관련된 인자들을 일변량 분석을 시행하였고 P < 0.1인 13개의 인자와 조기 발관을 선택하여 다변량 분석을 시행하였다. 다변량 분석 은 다중 로지스틱 회귀분석을 시행하여 오즈비를 산출하였다.
결 과
총 247명의 자료를 분석하였다(
Table 1). 남자는 180명, 여자는 67명이었다. 조기 발관군(E group)은 52명, 대조군(C group)은 195명이 수집되었다. 본원에서 간이식을 시행한 환자에서 술 후 섬망으로 진단받은 환자는 34/247명(13.77%)으로 나타났다. 수술장에서 조기 발관을 시행한 환자는 52/247명(21.05%)이었다. 간이식을 시행한 후 C group은 30명(15.38%)에서 술 후 섬망이 발생하였고, E group은 4명(7.69%)에서 술 후 섬망이 발생하여 두 군 간의 차이는 없었다(P = 0.180). 또한, 중환자실 재원 기간(P < 0.001)과 수술 후 퇴원까지 기간(P < 0.001)이 E group에 비하여 C group이 더 오래 걸렸다. 그러나, 이는 두 군 간에 차이를 보이는 술 전 기저 질환과 인구통계학적 자료(
Table 1), 술 전 검사(
Table 2), 수술 중 처치(
Table 3), 술 후 검사(
Table 4)를 보정한 후에는 C group은 3명(9.38%)에서 술 후 섬망이 발생하였고, E group은 4명(12.5%)에서 술 후 섬망이 발생하여 두 군 사이 발생률의 차이는 없었다(P = 1.000). 성향점수 매칭 후 중환자실 재원 기간과 수술 후 퇴원까지 기간은 두 군 간 차이가 없었다. 또한, 술 후 합병증에 있어서도 통계학적인 차이를 보이지 않았다(
Table 4).
Table 1
|
Variable |
Before propensity score matching |
After propensity score matching |
|
|
|
C group (n = 195) |
E group (n = 52) |
SMD |
P value |
C group (n = 32) |
E group (n = 32) |
SMD |
P value†
|
|
Age (yr) |
53.51 ± 8.31 |
54.25 ± 7.93 |
0.09 |
0.181 |
52.94 ± 5.79 |
55.31 ± 8.05 |
0.23 |
0.144 |
|
Sex (F/M) |
139 (71.28)/56 (28.72) |
41 (78.85)/11 (21.15) |
0.18 |
0.276 |
27 (84.38)/5 (15.63) |
24 (75)/8 (25) |
0.23 |
0.357 |
|
BMI (kg/m2) |
22.12 ± 2.97 |
22.36 ± 3.14 |
0.08 |
0.610 |
21.88 ± 3.11 |
22.21 ±3.44 |
0.10 |
0.679 |
|
Cause of LT |
|
|
0.41 |
0.037*
|
|
|
0.26 |
0.260 |
|
Alcoholic cirrhosis |
44 (22.56) |
9 (17.31) |
|
|
2 (6.25) |
5 (15.63) |
|
|
|
HBV and HCV |
121 (62.05) |
42 (80.77) |
|
|
25 (78.13) |
26 (81.25) |
|
|
|
NBNC LC |
15 (7.69) |
0 (0.00) |
|
|
3 (9.38) |
0 (0.00) |
|
|
|
Toxic hepatitis |
10 (5.13) |
0 (0.00) |
|
|
1 (3.13) |
0 (0.00) |
|
|
|
Primary biliary cirrhosis |
5 (2.56) |
1(1.92) |
|
|
1 (3.13) |
1 (3.13) |
|
|
|
Child-Pugh score |
|
|
0.86 |
< 0.001*
|
|
|
0.09 |
0.719 |
|
A |
60 (30.77) |
27 (51.92) |
|
|
16 (50) |
16 (50) |
|
|
|
B |
42 (21.54) |
19 (36.54) |
|
|
9 (28.13) |
10 (31.25) |
|
|
|
C |
93 (47.69) |
6 (11.54) |
|
|
7 (21.88) |
6 (18.75) |
|
|
|
MELD score |
17.00 (9.00, 28.00) |
9.00 (8.00,13.50) |
1.00 |
< 0.001 |
9.50 (8.00,17.00) |
9.00 (8.00,13.50) |
0.16 |
0.416 |
|
HTN |
37 (18.97) |
13 (25.00) |
0.15 |
0.337 |
7 (21.88) |
9 (28.13) |
0.15 |
0.789 |
|
DM |
49 (25.13) |
13 (25.00) |
0.00 |
0.985 |
7 (21.88) |
6 (18.75) |
0.08 |
1.000 |
|
IHD |
1 (0.51) |
1(1.92) |
0.13 |
0.377 |
0 (0.00) |
1 (3.13) |
0.25 |
1.000 |
|
CHF |
1 (0.51) |
0 (0.00) |
0.10 |
1.000 |
0 (0.00) |
0 (0.00) |
- |
- |
|
Diuretics |
35 (17.95) |
11 (21.15) |
0.08 |
0.598 |
7 (21.88) |
6 (18.75) |
0.08 |
1.000 |
|
Insulin |
7 (3.59) |
1(1.92) |
0.10 |
1.000 |
0 (0.00) |
0 (0.00) |
- |
- |
|
Psychiatric medication |
8 (4.10) |
0 (0.00) |
0.29 |
0.210 |
1 (3.13) |
0 (0.00) |
0.25 |
1.000 |
|
Sleep disorder |
25 (12.82) |
1(1.92) |
0.43 |
0.021*
|
1 (3.13) |
1 (3.13) |
0.00 |
1.000 |
|
Previous delirium |
7 (3.59) |
0 (0.00) |
0.27 |
0.351 |
1 (3.13) |
0 (0.00) |
0.25 |
1.000 |
|
ASA PS classification |
|
|
0.47 |
0.047*
|
|
|
0.07 |
1.000 |
|
2 |
31 (15.90) |
16 (30.77) |
|
|
9 (28.13) |
10 (31.25) |
|
|
|
3 |
124 (63.59) |
27 (51.92) |
|
|
20 (62.5) |
19 (59.38) |
|
|
|
4 |
35 (17.95) |
8 (15.38) |
|
|
3 (9.38) |
3 (9.38) |
|
|
|
5 |
5 (2.56) |
0 |
|
|
0 |
0 |
|
|
Table 2
Preoperative Laboratory Data in Patients undergoing Liver Transplantation
|
Variable |
Before propensity score matching |
After propensity score matching |
|
|
|
C group (n = 195) |
E group (n = 52) |
SMD |
P value |
C group (n = 32) |
E group (n = 32) |
SMD |
P value†
|
|
Hb (g/dl) |
10.56 ± 2.20 |
11.63 ± 2.18 |
0.49 |
0.002*
|
11.50 ± 2.22 |
11.55 ± 2.06 |
0.02 |
0.928 |
|
Bilirubin (|imol/L) |
3.70 (1.50,15.00) |
1.25 (1.00, 2.30) |
0.87 |
< 0.006 |
1.50 (1.15, 3.20) |
1.30 (1.00, 2.60) |
0.01 |
0.075 |
|
Albumin (g/dl) |
3.07 ± 0.55 |
3.33 ± 0.57 |
0.43 |
0.002 |
3.35 ± 0.39 |
3.24 ± 0.50 |
0.17 |
0.266 |
|
Creatinine (mg/dl) |
0.72 (0.61,0.89) |
0.82 (0.70, 0.93) |
0.36 |
0.042 |
0.72 (0.61,0.84) |
0.82 (0.70,0.93) |
0.24 |
0.106 |
|
Na (mEq/L) |
136.69 ± 5.74 |
138.12 ± 3.56 |
0.30 |
0.028*
|
137.75 ± 3.79 |
138.44 ± 3.11 |
0.20 |
0.373 |
|
K (mEq/L) |
3.97 ± 0.52 |
3.91 ± 0.37 |
0.13 |
0.339 |
3.82 ± 0.40 |
3.88 ± 0.41 |
0.16 |
0.511 |
Table 3
Patients’ Perioperative Factors
|
Variable |
Before propensity score matching |
After propensity score matching |
|
|
|
C group (n = 195) |
E group (n = 52) |
SMD |
P value |
C group (n = 32) |
E group (n = 32) |
SMD |
P value†
|
|
Anesthetic duration (h) |
10.79 ± 2.29 |
10.70 ± 1.76 |
0.04 |
0.778 |
10.87 ± 2.09 |
10.69 ± 1.97 |
0.08 |
0.714 |
|
EBL(L) |
4.08 ± 2.98 |
2.04 ± 1.40 |
0.88 |
< 0.001*
|
2.13 ± 1.58 |
2.23 ± 1.65 |
0.07 |
0.352 |
|
Total fluid intake (L) |
7.40 (5.70,10.60) |
6.14 (4.80, 7.79) |
0.55 |
0.001*
|
5.70 (4.25, 7.10) |
6.00 (4.43, 7.90) |
0.22 |
0.488 |
|
pRBC (unit) |
5.00 (0,10.00) |
0.50 (0, 4.00) |
0.79 |
< 0.001*
|
0 (0, 2.50) |
0 (0, 4.50) |
0.15 |
0.320 |
Table 4
Postoperative Data of Patients Undergoing Liver Transplantation
|
Variable |
Before propensity score matching |
After propensity score matching |
|
|
|
C group (n = 195) |
E group (n = 52) |
SMD |
P value |
C group (n = 32) |
E group (n = 32) |
SMD |
P value†
|
|
Hb (g/dl) |
9.03 ±1.46 |
8.59 ± 1.40 |
0.30 |
0.056 |
8.81 ± 1.27 |
8.75 ± 1.18 |
0.05 |
0.821 |
|
Creatinine (mg/dl) |
1.09 ± 0.51 |
0.88 ± 0.33 |
0.48 |
0.001*
|
0.88 ± 0.24 |
0.88 ± 0.30 |
0.01 |
1.000 |
|
Na (mEq/L) |
139.57 ± 4.11 |
139.88 ± 2.71 |
0.09 |
0.517 |
138.88 ± 2.85 |
139.75 ± 2.54 |
0.20 |
0.179 |
|
K (mEq/L) |
4.03 ± 0.44 |
3.91 ± 0.33 |
0.31 |
0.032 |
3.98 ± 0.33 |
3.92 ± 0.33 |
0.18 |
0.476 |
|
ICU stay (d) |
9.00 (6.00,14.00) |
5.00 (3.00, 6.00) |
1.03 |
< 0.001*
|
5.00 (4.00, 6.00) |
5.00 (4.00, 6.50) |
0.03 |
0.961 |
|
Time from surgery to discharge (d) |
29.00 (23.00, 47.00) |
22.00 (20.50, 28.00) |
0.45 |
< 0.001*
|
23.00 (20.00, 28.00) |
23.00 (21.00,33.50) |
0.24 |
0.117 |
|
Postoperative complication |
|
Cardiac complication |
4 (2.05) |
0 |
0.21 |
0.582 |
0 |
0 |
- |
- |
|
Respiratory complication |
20 (10.26) |
2 (3.85) |
0.25 |
0.180 |
0 |
2 (6.25) |
0.37 |
0.480 |
|
Neurologic complication |
2 (1.03) |
0 |
0.04 |
1.000 |
0 |
0 |
- |
- |
|
Infection |
4 (2.05) |
0 |
0.10 |
0.582 |
0 |
0 |
- |
- |
|
Death |
10 (5.13) |
0 |
0.10 |
0.127 |
0 |
0 |
- |
- |
|
Sepsis |
5 (2.56) |
0 |
0.14 |
0.587 |
0 |
0 |
- |
- |
|
Acute rejection |
5 (2.56) |
1 (1.92) |
0.21 |
1.000 |
0 |
1 (3.13) |
- |
1.00 |
로지스틱 회귀분석을 시행하였고 일변량 분석에서 P값이 0.1 이하를 보이는 체질량지수, Child–Pugh score, 이뇨제 사용, 술 복용, 술 전 헤모글로빈 수치, 술 전 크레아티닌 수치, 술 중 출혈 량, 수술 중 총 수액량, 농축 적혈구, 술 후 크레아티닌 수치, 술 후 소디움 수치, 중환자실 체류 기간과 조기 발관을 포함하여 다변량 분석을 시행하였다. 그러나 조기 발관은 일변량 분석(P = 0.161)과 다변량 분석(P = 0.760)에서 술 후 섬망과의 관련이 없었다(
Table 5). 체질량지수만 술 후 섬망의 독립적인 위험 인자로 판명되었다.
Table 5
Logistic Regression Analysis with Crude Data
|
Variable |
OR |
95% CI |
p value *
|
OR |
95% CI |
P value†
|
|
|
|
Lower |
Upper |
Lower |
Upper |
|
Early extubation |
0.46 |
0.15 |
1.37 |
0.161 |
0.81 |
0.21 |
3.18 |
0.760 |
|
Age |
1.02 |
0.98 |
1.07 |
0.318 |
|
|
|
|
|
Sex |
0.88 |
0.40 |
1.95 |
0.747 |
|
|
|
|
|
BMI |
0.83 |
0.73 |
0.95 |
0.008 |
0.82 |
0.70 |
0.96 |
0.014 |
|
Child-Pugh score |
2.84 |
0.90 |
8.94 |
0.075 |
0.96 |
0.23 |
4.04 |
0.953 |
|
Diuretics |
2.43 |
1.09 |
5.44 |
0.030 |
2.63 |
0.98 |
7.07 |
0.055 |
|
Insulin |
2.16 |
0.42 |
11.15 |
0.359 |
|
|
|
|
|
Psychiatric medication |
2.16 |
0.42 |
11.15 |
0.359 |
|
|
|
|
|
Sleep disorder |
2.07 |
0.77 |
5.59 |
0.152 |
|
|
|
|
|
Alcohol |
2.21 |
0.91 |
5.40 |
0.081 |
1.87 |
0.65 |
5.37 |
0.243 |
|
Previous delirium |
1.05 |
0.12 |
8.96 |
0.967 |
|
|
|
|
|
Hb before surgery |
0.76 |
0.62 |
0.92 |
0.004 |
0.94 |
0.73 |
1.21 |
0.638 |
|
Cr before surgery |
1.44 |
0.96 |
2.17 |
0.080 |
0.70 |
0.33 |
1.52 |
0.370 |
|
Anesthetic duration |
0.92 |
0.78 |
1.10 |
0.352 |
|
|
|
|
|
Intraoperative EBL |
1.15 |
1.03 |
1.28 |
0.013 |
1.07 |
0.76 |
1.49 |
0.702 |
|
Total fluid |
1.06 |
0.99 |
1.12 |
0.059 |
0.88 |
0.75 |
1.03 |
0.099 |
|
pRBC |
1.09 |
1.04 |
1.15 |
0.001 |
1.11 |
0.97 |
1.26 |
0.129 |
|
Hb after surgery |
0.86 |
0.66 |
1.12 |
0.266 |
|
|
|
|
|
Cr after surgery |
2.06 |
1.08 |
3.91 |
0.027 |
2.76 |
0.77 |
9.88 |
0.120 |
|
Na after surgery |
0.99 |
0.91 |
1.10 |
0.027 |
1.08 |
0.97 |
1.21 |
0.177 |
|
K after surgery |
1.42 |
0.62 |
3.27 |
0.408 |
|
|
|
|
|
ICU stay |
1.03 |
0.99 |
1.07 |
0.062 |
1.01 |
0.97 |
1.06 |
0.596 |
고 찰
본 연구는 조기 발관이 간이식 수술을 받은 환자에서 술 후 섬망 발생률에 미치는 영향에 관하여 조사하였고 성향점수 매칭 후 간이식 환자에서 조기 발관은 섬망 발생률과 관련이 없었으며 일변량 분석과 다변량 분석에서도 연관이 없었다.
수술 환자에게 발생하는 섬망은 술 후 합병증 발생과 회복 지연, 재수술, 재원 기간의 연장 등과 같은 부정적 결과에 영향을 미친다. 그러므로, 섬망 발생 위험요인을 분석하고 조절하는 것이 필요하며, 섬망 발생 위험군을 예측하고 조기 발견과 대처하는 것이 중요하다. 섬망은 인지 변화와 의식 장애를 주요 특징으로 하는 급성 의학적 상황을 의미하며, 환자가 가진 기저 질환이 나 진통제, 항생제, 항콜린성 제제 등의 투약 및 약물오남용 등으로 인해 발생할 수 있으며, 그 원인이 되는 요소를 제거하면, 섬망 증상의 호전이 가능한 장애이다[
4,
8,
16,
17]. 외과 환자의 30–41%, 인공호흡기를 사용하는 환자의 83.3%, 그리고 심장 수술 후 중환자실에 입원하는 환자의 90%가 섬망을 경험한다고 하며 간이식 수술 후에는 대략 13–42% 정도의 발생률이 보고되고 있다[
1,
2,
18–
20]. 본원에서 후향적으로 분석한 결과에 따르면 술 후 섬망이 의심되는 환자가 13.77%로 조금 낮게 나타났다. 이는 후향적 연구이기 때문에 자료의 누락이나 섬망이 발생해도 증상이 경미하거나 과소활동형이 과다활동형보다 흔하기 때문에 주치의에 의해 간과되거나 진단을 받지 않아 실제 발생률이 저평가되었을 가능성이 있으며 술 후 첫날 발생한 섬망이 중환자실에서 시행하는 진정이나 기관 내 삽관 등으로 인해 확인이 불가능하는 등의 이유가 있을 수 있다.
간이식의 경우 수술 종료 후 평균적인 발관 시기는 수술실에서 수술 종료 후 발관, 수술 후 중환자실로 이동하여 5–6시간 이후 발관, 수술 후 중환자실에서 평균 24시간 전후 유지 후 발관 등 다양하게 보고되고 있다[
11,
12,
14]. 적절한 시기에 기관 발관을 하는 것은 술 후 관리의 중요한 부분이다. 간이식 환자들에서 적절한 시기에 발관을 시행하는 것은 심폐 혈역학적 개선을 유도할 수 있고 이식간의 혈류를 개선하는 효과를 얻을 수 있으나 성급한 조기 발관은 부적절한 환기를 야기할 수 있고 기관 재삽관 등의 문제를 야기할 수 있다. 그렇다고 기관 내 삽관을 장기간 유지하게 되면 그 자체가 환자에게 스트레스를 야기하고 호흡기 계에 손상 등을 야기할 수 있으며 폐렴, 무기폐 등 호흡기계 합병증과 감염을 야기할 수 있다. 그러므로 적절한 시기에 발관을 시행하기 위해서는 술 전 입원상태, Model For End-Stage Liver Disease score, 수술 중 투여된 수혈량, 신기능 저하, 감염 유무 등을 고려하여[
15,
21], 발관 적응증을 정하여 의식상태, 호흡수, 일회호흡량, 호흡양상, 흉부 사진 소견과 폐기능을 고려하여 발관을 고려하게 된다[
21–
24]. 본원에서도 수술실에서 수술 종료 후 기관 발관을 시행하는 경우가 21.05% 정도로 나타났다. 하지만 수술실에서의 조기 발관은 섬망 발생률과 관련이 없었다. 이는 술 후 기관 삽관을 유지함으로써 발생하는 스트레스와 그로 인한 진정제/진통제 투여, 강박, 기계호흡 등의 상황과 발관을 시행하는 경우 발생하는 스트레스, 통증, 그로 인한 진통제 투여 등이 술 후 섬망을 야기하는 위험인자로서 복합적으로 작용한 것으로 보인다.
본 논문의 분석에서는 체질량지수가 관련이 있는 것으로 나타 났다. 이는 섬망이 술 후 전신상태와 관련이 있으므로 연관이 있 는 것으로 보인다[
4,
6,
8]. 일반적으로 알려진 술 후 섬망의 위험 인자는 고령, 기저질환[
6,
7], 수면 장애, 활동 장애, 시각 장애, 청각 장애, 탈수, 전해질 이상(sodium, potassium 등), 낮은 혈장 알부민 수치, 알코올 남용, 혈당조절 불량, 우울증 약 사용, 인슐린 사용 등이 있다[
4,
6,
8]. 그러나 이런 인자들이 본 분석에서 유의하지 않은 결과를 보인 것은 술 후 섬망이 하나의 주요 요인이 있다기보다 여러 가지 요인이 복합적으로 작용하므로 발생하는 것이 때문일 수 있다. 그리고 본 연구는 후향적 연구설계이기 때문에 술 후 섬망의 진단이 온전히 의무 기록에 의존하여 결정되어 발생률이 저평가될 가능성이 있으며 분석을 시행함에 있어서도 전체 샘플수가 적고 특히 성향점수 매칭 후에는 샘플수가 더 욱 줄어들어 결과의 적절성에 미흡한 면이 있다. 또한, 성향점수 매칭 분석을 시행하고 나서 standardized mean difference 값 이 0.2 미만일 때 두 그룹 간의 균형이 효과적으로 맞추어졌다고 여기는데 반해 본 논문에서는 standardized mean difference 이 0.2 이상인 변수들이 남아있는 등 분석을 시행함에 미흡한 점이 있다.
본 연구결과 간이식 환자에서 조기 발관은 섬망 발생 감소에 영향을 주지 않는 것을 나타났다. 그러나 본 연구는 후향적 연구 로 제한점이 있으므로 전향적 임상 연구를 통해 조기 발관의 영향을 다시 한번 확인할 필요가 있다.
ACKNOWLEDGMENTS
This work was supported by Department of Biostatistics, Clinical Trial Center, Biomedical Research Institute, Pusan National University Hospital.
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
REFERENCES
2. Mueller AR, Platz KP, Krause P, Kahl A, Rayes N, Glanemann M, et al. Perioperative factors influencing patient outcome after liver transplantation. Transpl Int. 2000; 13(Suppl 1):S158–61. DOI:
10.1111/j.1432-2277.2000.tb02010.x. PMID:
11111987.
3. Bronster DJ, Emre S, Mor E, Sheiner P, Miller CM, Schwartz ME. Neurologic complications of orthotopic liver transplantation. Mt Sinai J Med. 1994; 61:63–9. PMID:
8183296.
4. Algahtani HA, Abdu AP. Delirium. A comprehensive review. Neurosciences (Riyadh). 2012; 17:205–12.
5. Mody K, Kaur S, Mauer EA, Gerber LM, Greenwald BM, Silver G, et al. Benzodiazepines and development of delirium in critically ill children:estimating the causal effect. Crit Care Med. 2018; 46:1486–91. DOI:
10.1097/CCM.0000000000003194. PMID:
29727363.
6. Haugen CE, Mountford A, Warsame F, Berkowitz R, Bae S, Thomas AG, et al. Incidence, risk factors, and sequelae of post- kidney transplant delirium. J Am Soc Nephrol. 2018; 29:1752–9. DOI:
10.1681/ASN.2018010064. PMID:
29685884. PMCID:
PMC6054339.
7. Clegg A, Siddiqi N, Heaven A, Young J, Holt R. Interventions for preventing delirium in older people in institutional long-term care. Cochrane Database Syst Rev. 2014; 1:CD009537. DOI:
10.1002/14651858.CD009537.pub2. PMID:
24488526.
9. Mandell MS, Lezotte D, Kam I, Zamudio S. Reduced use of intensive care after liver transplantation:influence of early extubation. Liver Transpl. 2002; 8:676–81. DOI:
10.1053/jlts.2002.34379. PMID:
12149759.
10. Cuervas-Mons V, Julio Martinez A, Dekker A, Starzl TE, Van Thiel DH. Adult liver transplantation:an analysis of the early causes of death in 40 consecutive cases. Hepatology. 1986; 6:495–501. DOI:
10.1002/hep.1840060329. PMID:
3519418. PMCID:
PMC2964136.
11. Plevak DJ, Southorn PA, Narr BJ, Peters SG. Intensive-care unit experience in the Mayo liver transplantation program:the first 100 cases. Mayo Clin Proc. 1989; 64:433–45. DOI:
10.1016/S0025-6196(12)65734-6. PMID:
2654500.
13. Muralidhar V, Jayalaxmi TS. Anaesthesia for liver transplantation:perioperative problems and management. Trop Gastroenterol. 1994; 15:191–203. PMID:
7618200.
14. Carton EG, Plevak DJ, Kranner PW, Rettke SR, Geiger HJ, Coursin DB. Perioperative care of the liver transplant patient:part 2. Anesth Analg. 1994; 78:382–99. DOI:
10.1213/00000539-199402000-00031. PMID:
8311294.
15. Choi JH, Kim TH, Lee JM. Evaluation of usefulness of perioperative risk factors which affect early or delayed extubation after liver transplantation. Korean J Anesthesiol. 2003; 44:847–52. DOI:
10.4097/kjae.2003.44.6.847.
17. Tilouche N, Hassen MF, Ali HBS, Jaoued O, Gharbi R, El Atrous SS. Delirium in the intensive care unit:incidence, risk factors, and impact on outcome. Indian J Crit Care Med. 2018; 22:144–9. DOI:
10.4103/ijccm.IJCCM_244_17. PMID:
29657370. PMCID:
PMC5879855.
18. Kolkka R, Hilberman M. Neurologic dysfunction following cardiac operation with low-flow, low-pressure cardiopulmonary bypass. J Thorac Cardiovasc Surg. 1980; 79:432–7. PMID:
6965513.
19. Sadler PD. Incidence, degree, and duration of postcardiotomy delirium. Heart Lung. 1981; 10:1084–92. PMID:
6913574.
20. Ely EW, Shintani A, Truman B, Speroff T, Gordon SM, Harrell FE Jr, et al. Delirium as a predictor of mortality in mechanically ventilated patients in the intensive care unit. JAMA. 2004; 291:1753–62. DOI:
10.1001/jama.291.14.1753. PMID:
15082703.
21. Baliga P, Merion RM, Turcotte JG, Ham JM, Henley KS, Lucey MR, et al. Preoperative risk factor assessment in liver transplantation. Surgery. 1992; 112:704–10. PMID:
1411941.
22. Lee JM, Choi JH, Kim BS, Kim YG. Evaluation of clinical factors associated with early tracheal extubation after liver transplantation. Korean J Anesthesiol. 1999; 36:645–52. DOI:
10.4097/kjae.1999.36.4.645.
23. Shaw BW Jr, Wood RP, Gordon RD, Iwatsuki S, Gillquist WP, Starzl TE. Influence of selected patient variables and operative blood loss on six-month survival following liver transplantation. Semin Liver Dis. 1985; 5:385–93. DOI:
10.1055/s-2008-1040637. PMID:
3909433. PMCID:
PMC3022507.
24. Michard B, Artzner T, Lebas B, Besch C, Guillot M, Faitot F, et al. Liver transplantation in critically ill patients:preoperative predictive factors of post-transplant mortality to avoid futility. Clin Transplant. 2017; 31:e13115. DOI:
10.1111/ctr.13115. PMID:
28895204.




 PDF
PDF Citation
Citation Print
Print




 XML Download
XML Download