Abstract
Neurocritically ill patients are at an increased risk of other organ dysfunctions, especially
lung injury. Major pulmonary complications, including acute respiratory distress syndrome,
ventilator-associated pneumonia, and neurogenic pulmonary edema, are frequently
caused by brain injury, and are associated with poor outcome. Brain and lung have strong
interactions via complex pathways from the brain to the lung, and vice versa. Excessive
release of catecholamines and systemic inflammatory responses play an integral role in
the development of pulmonary dysfunction after brain injuries. Mechanical ventilation is
commonly used to manage pulmonary dysfunctions associated with brain injury, and lung
protective ventilation strategies reduce injuries to the lung and brain. This review focuses on
the current knowledge regarding the epidemiology and pathophysiology of lung injuries in
patients with neurocritical illness, and the various strategies of mechanical ventilation used
to reduce lung injury.
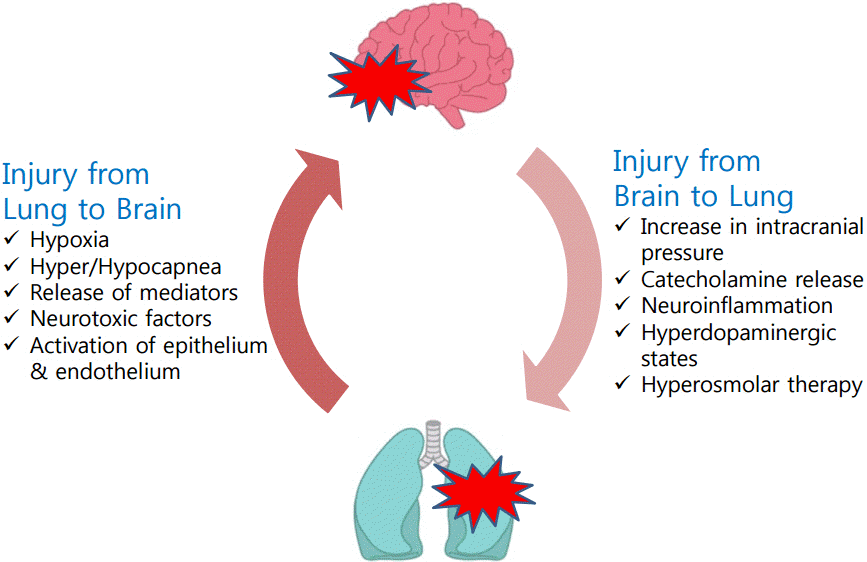
뇌와 폐의 기능은 서로 밀접하게 연관되어 있다(Fig. 1) [1-4]. 중증 신경계 질환을 가진 환자들은 급성호흡 곤란 증후군(acute respiratory distress syndrome), 인공호흡기 연관 폐렴(ventilator-associated pneumonia), 신경성 폐부종(neurogenic pulmonary edema) 등 호흡기계 부작용이 흔히 발생하며, 중증 신경계 질환에 동반된 호흡부전은 사망률을 증가시키고 신경학적 예후를 악화시킨다[5-17]. 따라서 신경계 중환자실에서는 중증 신경계 질환에 동반된 호흡기계 부작용을 치료하고 이로 인한 이차적 뇌손상을 예방하는 것이 중요하다. 본 리뷰에서는 중증 신경계 질환에서 동반되는 호흡기계 부작용의 역학, 발생 기전 및 이를 예방하기 위한 인공호흡기 치료 원칙들을 중심으로 살펴보고자 한다.
중증 신경계 질환으로 신경계 중환자실에 입원한 환자들은 여러 장기 부전이 동반될 수 있으며, 특히 호흡기계 합병증이 흔히 발생한다. 외상뇌손상(traumatic brain injury)을 대상으로 한 코호트 연구 결과를 보면 209명의 외상뇌손상 환자 중 81%에서 호흡기계 문제가 동반되어 있었고 23%에서는 심한 호흡부전이 발생하여, 전신부작용 중에서 호흡기계 부작용이 가장 많이 발생하였다[10]. 인공호흡기 치료를 받고 있는 신경계 중환자실 환자 552명을 대상으로 한 관찰연구에서도 허혈성 뇌졸중 환자의 33%, 출혈성 뇌졸중 환자의 25%에서 호흡부전이 발생하여 가장 흔한 합병증이었으며, 외상뇌손상 환자의 17%에서 호흡부전이 발생하여 심혈관질환 다음으로 흔한 합병증이었다[15]. 중증 신경계 질환에서 호흡기계 부작용이 발생한 경우 사망률을 증가시키고 신경학적 예후를 악화시킨다[6,8,10,11]. 457명의 거미막밑출혈(subarachnoid hemorrhage) 환자를 대상으로 한 연구에서 호흡기계 부작용은 신경학적 요인 이외의 가장 중요한 사망 원인이었다[18]. 또한 호흡기계 합병증은 인공호흡기 사용 기간, 중환자실 및 병원 재원 기간을 증가시킨다[14].
중증 신경계 질환을 가진 환자들은 급성호흡곤란증후군이 잘 발생하며 이는 호흡부전의 중요한 원인이다[19]. 급성호흡곤란증후군이란 심장이 아닌 원인에 의해 급성으로 폐부종이 발생하여 이로 인해 저산소증이 동반된 상태를 의미한다[20,21]. 이전 연구에서는 급성 폐손상(acute lung injury)이란 용어를 급성호흡곤란증후군과 혼용하였으나, 현재는 급성호흡곤란증후군으로 통일해서 사용하고 있다[21]. 급성호흡곤란증후군은 외상뇌손상 환자의 5-30%에서 발생하며[6-8,10,14], 거미막밑출혈(14-27%) [11,12]과 뇌내출혈(27%) [16]에서도 비슷한 정도의 발생률을 보인다. 허혈성 뇌졸중 환자에서는 이보다 낮은 4%의 환자에서 발생한다[17]. 연구마다 급성호흡곤란증후군을 정의하는 것이 달라 정확한 발생률을 알기는 어려우나, 중증도가 높은 환자에서 급성호흡곤란증후군의 발생이 증가하는 경향을 보여준다[6,11]. 급성호흡곤란증후군 발생의 위험인자에 대한 연구에서는 초기 뇌 컴퓨터단층촬영술(computed tomography)에서 병변이 뚜렷한 경우, 입원시 글래스고 혼수척도(Glasgow coma scale)가 낮은 경우 등 신경계 손상의 정도와의 연관성이 보고되었다[6,7]. 그 외에도 혈압상승제(vasopressor) 사용, 고혈압, 당뇨병, 만성 폐쇄성 폐질환의 병력, 수혈 등도 위험인자로 알려져 있다[7,11]. 인공호흡기와 관련하여 일회 호흡량 설정이 높은 경우 급성호흡곤란증후군의 발생률이 높아졌고 이는 신경학적 예후를 악화시켰다[14,16].
폐렴은 중환자실에서 발생하는 감염 중 두 번째로 흔한 원인이며, 신경계 중환자실에서는 인공호흡기 연관 폐렴의 발생률이 높다[22]. 신경계 중환자실에서 인공호흡기 연관 폐렴의 발생률은 환자군에 따라 다양하게 보고되고 있으며, 외상뇌손상 환자에서 뇌졸중 환자에 비해 인공호흡기 연관 폐렴이 더 많이 발생하는 것으로 알려져 있다[15]. 중증 외상뇌손상 환자에서 인공호흡기 연관 폐렴의 발생률은 21-60%이며[23-25], 거미막밑출혈 환자에서는 20-50%에서 발생한다[26,27]. 인공호흡기 연관 폐렴 발생의 위험인자로는 나이, 비만, 당뇨병, 흡인의 병력, 바르비투르산염(barbiturate)의 사용, 신경계 질환에 동반된 면역억제(immunosuppression) 등이 알려져 있다[24,28].
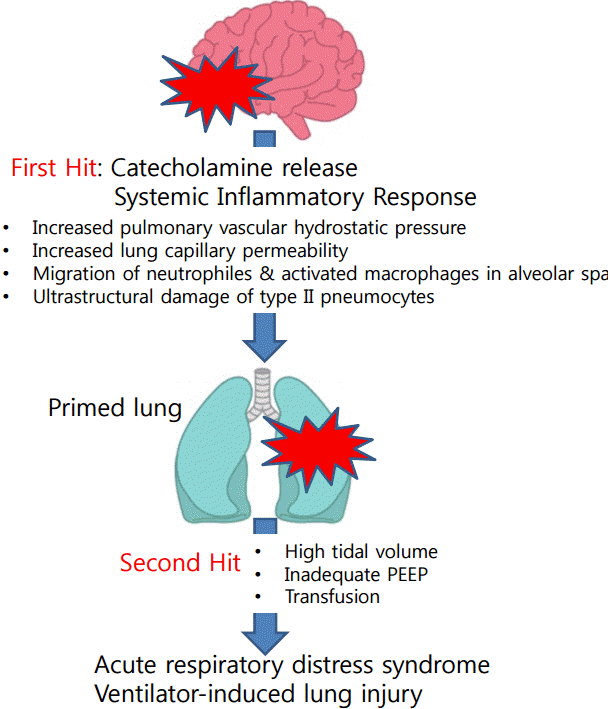
신경계 질환에 의한 호흡기계 부작용의 발생 기전에 대해 여러 가설들이 제시되고 있으며, 최근에는 “더블 히트 모델(Double Hit Model)”에 의해 설명되고 있다(Fig. 2) [1]. 급성 뇌손상이 발생하면 다양한 기전에 의해 “첫 번째 히트” 즉 폐손상을 유발하게 된다. 중증 신경계 질환에서 두개내압이 상승하면 이에 대한 반응으로 교감신경계가 흥분하여 카테콜라민(catecholamine)이 분비된다[29,30]. 카테콜라민은 혈관 수축을 일으키고 이로 인해 폐혈관의 정수압(hydrostatic pressure)이 증가하여 폐부종이 발생하게 된다[34]. 또한 카테콜라민에 의해 모세혈관 투과성(permeability)이 증가하여 단백질이 풍부한 혈장이 폐포 내로 이동하고 이를 따라 수분이 폐포 내로 이동하여 폐부종을 악화시킨다[35]. 뇌손상으로 인한 폐손상의 발생에 있어 전신염증반응(systemic inflammatory response)도 중요한 역할을 한다[36-38]. 뇌손상은 두개내 염증반응을 일으키고 이로 인해 인터루킨(interleukin)-1, 인터루킨-6, 종양괴사인자(tumor necrosis factor) 등과 같은 시토카인(cytokine)이 두개내에 증가한다. 혈액뇌장벽(blood-brain barrier)은 두개내의 항상성(homeostasis)를 유지하기 위해 머리 안과 밖의 물질 교환을 막고 있는데, 뇌손상으로 인해 혈액뇌장벽의 투과성이 증가하면 두개내의 시토카인이 혈중으로 들어가 전신염증반응을 유발한다. 전신염증반응에 의해 활성화된 대식세포와 호중구가 폐포 안으로 이동하고 이는 폐포의 미세 구조 손상을 일으킨다.
“두번째 히트”는 치료를 위해 사용하는 인공호흡기, 수혈, 수술적인 처치 등이며, 이는 정상적인 폐에는 폐손상을 유발하지 않으나 첫번째 히트에 의해 취약해진 폐에서는 폐손상을 악화시킬 수 있다[1]. 첫 번째 히트에 의해 정상적인 폐는 취약한 상태로 바뀌게 되고, 두번째 히트는 취약해진 폐에 이차적인 손상을 가하게 된다. 동물실험 모델에서 같은 설정의 인공호흡기를 적용하더라도 뇌손상이 있는 그룹에서 폐손상이 증가하였으며[39], 다른 동물 실험에서는 두개내압 상승과 급성호흡곤란증후군이 동반된 경우 폐손상이 가장 심하게 발생하는 결과를 보여주었다[34]. 급성호흡곤란증후군 환자에서 일회호흡량이 늘어나면 인공호흡기유도 폐손상(ventilator-induced lung injury)이 증가하는데, 여기에는 폐 및 전신염증반응이 주요 기전으로 작용하였다[40,41]. 두 번째 히트는 폐포 공간내 호중구 증가, 시토카인 생산을 유발하여 염증반응을 통해 폐손상을 악화시킨다[1,39].
인공호흡기는 호흡기계 합병증이 동반된 경우 사용할 수 있는 중요한 치료 방법이다. 중환자실에서 기계환기는 동맥혈 산소화 개선, 폐포환기 공급 및 호흡일(work of breathing) 감소 등의 목적으로 시행되며, 신경계 중환자실에서는 그 외에도 이차적 뇌손상을 예방하는 것이 중요하다. 인공호흡기유도 폐손상을 최소화하기 위해서는 폐보호 환기(lung protective ventilation) 전략이 필요하다(Table 1). 폐보호 환기 전략에서 제일 중요한 것은 일회 호흡량(tidal volume)을 적게 공급하는 저일회 호흡량(low tidal volume) 전략이다. 저일회 호흡량은 급성호흡곤란증후군 환자에서 사망률을 유의하게 낮춰주었다[42]. 이런 결과는 급성호흡곤란증후군 환자 뿐만 아니라 다른 중환자실 환자에서도 비슷한 결과를 보여주었다[43].
저일회 호흡량 전략은 신경계 중환자실에서 인공호흡기 치료를 할 때 지켜야하는 중요한 원칙이다. 일회 호흡량을 높게 설정하는 경우 폐 및 전신염증반응을 유발하여 폐손상이 증가하게 된다. 동물실험 결과를 보면 뇌손상이 있는 그룹에서 뇌손상이 없는 그룹에 비해 기계환기와 연관된 폐손상이 더 심하게 발생하였다[39]. 또한 임상연구에서도 외상뇌손상 환자에서 일회호흡량을 높게 설정한 경우 이에 비례하여 급성호흡곤란증후군의 발생이 증가하고 이는 신경학적 예후를 악화시키는 결과를 보여주었다[14]. 하지만 적절한 환기가 유지되지 못하면 저일회 호흡량 전략은 혈액내 이산화탄소 분압을 증가시키고 이로 인해 두개내압을 상승시킬 수 있어 이에 대한 주의가 필요하다. 인공호흡기 관련 폐손상을 줄이기 위한 폐보호 환기 전략은 신경계 중환자실 환자들에게도 도움이 되지만, 급성호흡곤란증후군 환자들에게 적용하는 고탄산혈증 허용(permissive hypercapnia)의 개념은 뇌손상 환자들에게는 이차적인 뇌손상을 악화시킬 수 있다. 뇌손상이 심하지 않은 경우 폐를 우선시 하는 저일회 호흡량 전략을 보편적으로 적용 가능하나, 두개내압 상승이 동반된 심한 뇌손상의 경우 이차 뇌손상을 줄이기 위한 치료 원칙이 우선이 되어야 한다[44]. 따라서 두개내압 상승이 동반된 뇌손상 환자들은 정상탄산상태(normocapnia) 유지를 위해 이산화탄소의 엄격한 조절이 필요하다.
저산소증은 대뇌 산소 전달을 감소시킬 뿐만 아니라 뇌혈관 확장을 유발하고 두개내압을 증가시킨다. 중증 외상뇌손상 환자의 20% 이상이 저산소증과 연관된 이차 뇌손상을 경험하고 이는 예후를 악화시킬 수 있다[5]. 따라서 저산소증은 반드시 교정해야 한다. 기계환기에서 산소화와 연관된 인자들은 흡입산소농도(fraction of inspired oxygen)와 호기말양압(positive end expiratory pressure)이다. 호기말양압은 뇌손상 환자에서는 양날의 검처럼 작용한다. 호기말양압은 짜부러진 폐포를 동원하여 무기폐(atelectasis)를 방지하고 산소 공급을 향상시켜주나, 정맥 순환량 감소를 통해 동맥압과 대뇌 혈류를 감소시키고 두개내압을 증가시킬 수 있다[45]. 환자의 상태에 따라 적절한 호기말양압을 설정하기 위해 짜부러진 폐포를 동원하여 산소화가 개선되는지 혹은 과다 팽창을 일으키는지에 대한 감시가 필요하며, 뇌순환에 대한 영향을 최소화하기 위해 두개내압보다 낮게 설정하는 것이 좋다[46]. 이전 연구결과를 보면 일반적으로 사용하는 호기말양압의 범위(4-10 cmH2O) 내에서 호기말양압으로 인한 두개내압의 큰 변화는 없으나[47,48] 두개내압 상승이 동반된 경우 주의가 필요하며, 이는 환자 상태에 따라 다르게 적용되어야 할 것이다.
REFERENCES
1. Mascia L. Acute lung injury in patients with severe brain injury: a double hit model. Neurocrit Care. 2009; 11:417–26.

3. Mrozek S, Constantin JM, Geeraerts T. Brain-lung crosstalk: implications for neurocritical care patients. World J Crit Care Med. 2015; 4:163–78.

4. Blanch L, Quintel M. Lung-brain cross talk in the critically ill. Intensive Care Med. 2017; 43:557–9.

5. Stocchetti N, Furlan A, Volta F. Hypoxemia and arterial hypotension at the accident scene in head injury. J Trauma. 1996; 40:764–7.

6. Bratton SL, Davis RL. Acute lung injury in isolated traumatic brain injury. Neurosurgery. 1997; 40:707–12. ; discussion 12.

7. Contant CF, Valadka AB, Gopinath SP, Hannay HJ, Robertson CS. Adult respiratory distress syndrome: a complication of induced hypertension after severe head injury. J Neurosurg. 2001; 95:560–8.

8. Holland MC, Mackersie RC, Morabito D, Campbell AR, Kivett VA, Patel R, et al. The development of acute lung injury is associated with worse neurologic outcome in patients with severe traumatic brain injury. J Trauma. 2003; 55:106–11.

9. Roch A, Michelet P, Jullien AC, Thirion X, Bregeon F, Papazian L, et al. Long-term outcome in intensive care unit survivors after mechanical ventilation for intracerebral hemorrhage. Crit Care Med. 2003; 31:2651–6.

10. Zygun DA, Kortbeek JB, Fick GH, Laupland KB, Doig CJ. Nonneurologic organ dysfunction in severe traumatic brain injury. Crit Care Med. 2005; 33:654–60.

11. Kahn JM, Caldwell EC, Deem S, Newell DW, Heckbert SR, Rubenfeld GD. Acute lung injury in patients with subarachnoid hemorrhage: incidence, risk factors, and outcome. Crit Care Med. 2006; 34:196–202.

12. Wartenberg KE, Schmidt JM, Claassen J, Temes RE, Frontera JA, Ostapkovich N, et al. Impact of medical complications on outcome after subarachnoid hemorrhage. Crit Care Med. 2006; 34:617–23. ; quiz 624.

13. Maramattom BV, Weigand S, Reinalda M, Wijdicks EF, Manno EM. Pulmonary complications after intracerebral hemorrhage. Neurocrit Care. 2006; 5:115–9.

14. Mascia L, Zavala E, Bosma K, Pasero D, Decaroli D, Andrews P, et al. High tidal volume is associated with the development of acute lung injury after severe brain injury: an international observational study. Crit Care Med. 2007; 35:1815–20.

15. Pelosi P, Ferguson ND, Frutos-Vivar F, Anzueto A, Putensen C, Raymondos K, et al. Management and outcome of mechanically ventilated neurologic patients. Crit Care Med. 2011; 39:1482–92.

16. Elmer J, Hou P, Wilcox SR, Chang Y, Schreiber H, Okechukwu I, et al. Acute respiratory distress syndrome after spontaneous intracerebral hemorrhage*. Crit Care Med. 2013; 41:1992–2001.

17. Rincon F, Maltenfort M, Dey S, Ghosh S, Vibbert M, Urtecho J, et al. The prevalence and impact of mortality of the acute respiratory distress syndrome on admissions of patients with ischemic stroke in the United States. J Intensive Care Med. 2014; 29:357–64.

18. Solenski NJ, Haley EC Jr, Kassell NF, Kongable G, Germanson T, Truskowski L, et al. Medical complications of aneurysmal subarachnoid hemorrhage: a report of the multicenter, cooperative aneurysm study. Participants of the Multicenter Cooperative Aneurysm Study. Crit Care Med. 1995; 23:1007–17.
19. Hoesch RE, Lin E, Young M, Gottesman RF, Altaweel L, Nyquist PA, et al. Acute lung injury in critical neurological illness. Crit Care Med. 2012; 40:587–93.

20. Bernard GR, Artigas A, Brigham KL, Carlet J, Falke K, Hudson L, et al. The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med. 1994; 149(3 Pt 1):818–24.

21. ARDS Definition Task Force, Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, et al. Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012; 307:2526–33.
22. Kollef MH, Morrow LE, Niederman MS, Leeper KV, Anzueto A, Benz-Scott L, et al. Clinical characteristics and treatment patterns among patients with ventilator-associated pneumonia. Chest. 2006; 129:1210–8.

23. Woratyla SP, Morgan AS, Mackay L, Bernstein B, Barba C. Factors associated with early onset pneumonia in the severely brain-injured patient. Conn Med. 1995; 59:643–7.
24. Bronchard R, Albaladejo P, Brezac G, Geffroy A, Seince PF, Morris W, et al. Early onset pneumonia: risk factors and consequences in head trauma patients. Anesthesiology. 2004; 100:234–9.
25. Lepelletier D, Roquilly A, Demeure dit latte D, Mahe PJ, Loutrel O, Champin P, et al. Retrospective analysis of the risk factors and pathogens associated with early-onset ventilator- associated pneumonia in surgical-ICU head-trauma patients. J Neurosurg Anesthesiol. 2010; 22:32–7.
26. Frontera JA, Fernandez A, Schmidt JM, Claassen J, Wartenberg KE, Badjatia N, et al. Impact of nosocomial infectious complications after subarachnoid hemorrhage. Neurosurgery. 2008; 62:80–7. ; discussion 87.

27. Cinotti R, Dordonnat-Moynard A, Feuillet F, Roquilly A, Rondeau N, Lepelletier D, et al. Risk factors and pathogens involved in early ventilator-acquired pneumonia in patients with severe subarachnoid hemorrhage. Eur J Clin Microbiol Infect Dis. 2014; 33:823–30.

28. Dziedzic T, Slowik A, Szczudlik A. Nosocomial infections and immunity: lesson from brain-injured patients. Crit Care. 2004; 8:266–70.
31. Ochiai H, Yamakawa Y, Kubota E. Deformation of the ventrolateral medulla oblongata by subarachnoid hemorrhage from ruptured vertebral artery aneurysms causes neurogenic pulmonary edema. Neurol Med Chir (Tokyo). 2001; 41:529–34. ; discussion 534-5.

32. Friedman JA, Pichelmann MA, Piepgras DG, McIver JI, Toussaint LG 3rd, McClelland RL, et al. Pulmonary complications of aneurysmal subarachnoid hemorrhage. Neurosurgery. 2003; 52:1025–31. ; discussion 1031-2.

33. Rogers FB, Shackford SR, Trevisani GT, Davis JW, Mackersie RC, Hoyt DB. Neurogenic pulmonary edema in fatal and nonfatal head injuries. J Trauma. 1995; 39:860–6. ; discussion 866-8.

34. Heuer JF, Pelosi P, Hermann P, Perske C, Crozier TA, Bruck W, et al. Acute effects of intracranial hypertension and ARDS on pulmonary and neuronal damage: a randomized experimental study in pigs. Intensive Care Med. 2011; 37:1182–91.

35. Inamasu J, Sugimoto K, Yamada Y, Ganaha T, Ito K, Watabe T, et al. The role of catecholamines in the pathogenesis of neurogenic pulmonary edema associated with subarachnoid hemorrhage. Acta Neurochir (Wien). 2012; 154:2179–84. ; discussion 2184-5.

36. Avlonitis VS, Fisher AJ, Kirby JA, Dark JH. Pulmonary transplantation: the role of brain death in donor lung injury. Transplantation. 2003; 75:1928–33.

37. Lucas SM, Rothwell NJ, Gibson RM. The role of inflammation in CNS injury and disease. Br J Pharmacol. 2006; 147 Suppl 1:S232–40.

38. Scholz M, Cinatl J, Schadel-Hopfner M, Windolf J. Neutrophils and the blood-brain barrier dysfunction after trauma. Med Res Rev. 2007; 27:401–16.

39. Lopez-Aguilar J, Villagra A, Bernabe F, Murias G, Piacentini E, Real J, et al. Massive brain injury enhances lung damage in an isolated lung model of ventilator-induced lung injury. Crit Care Med. 2005; 33:1077–83.
40. Ranieri VM, Suter PM, Tortorella C, De Tullio R, Dayer JM, Brienza A, et al. Effect of mechanical ventilation on inflammatory mediators in patients with acute respiratory distress syndrome: a randomized controlled trial. JAMA. 1999; 282:54–61.

41. Ranieri VM, Giunta F, Suter PM, Slutsky AS. Mechanical ventilation as a mediator of multisystem organ failure in acute respiratory distress syndrome. JAMA. 2000; 284:43–4.

42. Acute Respiratory Distress Syndrome Network, Brower RG, Matthay MA, Morris A, Schoenfeld D, Thompson BT, et al. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med. 2000; 342:1301–8.

43. Serpa Neto A, Cardoso SO, Manetta JA, Pereira VG, Esposito DC, Pasqualucci Mde O, et al. Association between use of lung-protective ventilation with lower tidal volumes and clinical outcomes among patients without acute respiratory distress syndrome: a meta-analysis. JAMA. 2012; 308:1651–9.
44. Lopez-Aguilar J, Fernandez-Gonzalo MS, Turon M, Quilez ME, Gomez-Simon V, Jodar MM, et al. [Lung-brain interaction in the mechanically ventilated patient]. Med Intensiva. 2013; 37:485–92.
45. Huseby JS, Luce JM, Cary JM, Pavlin EG, Butler J. Effects of positive end-expiratory pressure on intracranial pressure in dogs with intracranial hypertension. J Neurosurg. 1981; 55:704–5.

46. McGuire G, Crossley D, Richards J, Wong D. Effects of varying levels of positive end-expiratory pressure on intracranial pressure and cerebral perfusion pressure. Crit Care Med. 1997; 25:1059–62.

Table 1.
Mechanical ventilation strategies in patients with brain injury




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download