Abstract
Cholera is an acute secretory form of diarrhea caused by a potent enterotoxin (cholera toxin) after ingestion of toxigenic Vibrio cholerae of the O1 or O139 serogroups. Although cholera is very common in Africa and Asia as a whole, the incidence of cholera has been very low in recent years in Korea. Dehydration and electrolyte abnormalities due to massive watery diarrhea can lead to death, and the mortality rates in untreated patients with severe cholera can exceed 70%. Effective rehydration therapy is the cornerstone of the management of patients with cholera and can reduce the mortality rate to less than 0.2%. Antibiotics reduce the volume and duration of diarrhea, but are recommended for patients with severe disease because of the rapid emergence and spread of multidrug-resistant V. cholerae across the globe. Two oral cholera vaccines are available, and the World Health Organization recommends that these oral vaccines be considered in integrated prevention programs in endemic countries at risk for outbreaks.
콜레라는 콜레라균(Vibrio cholerae)이 분비하는 독소에 의해 설사와 구토를 일으키는 대표적인 수인성 식품매개질환으로 공중보건학적인 측면에서 매우 중요한 전염병이다. 공중위생은 인류가 의학에서 이룬 위대한 진보 중에 하나로 청결한 수돗물을 제공하고 분뇨를 안전하게 처분하는 등 여러 가지 위생적 행위를 통해 건강한 환경을 조성하는 것으로서, 공중위생이 의학적으로 매우 중요하다는 것을 알려 준 것이 바로 콜레라이다.
콜레라는 기원전 5세기에 인도 산스크리트에 그 기록에 남아 있는 오래된 질병으로, 인도의 갠지스 강 하류의 지역에서 고대부터 풍토병으로 다발하였던 질병이었다[1]. 그러다가 1817년에 교역로를 통해 러시아로 질병이 전파된 것이 계기가 되어 유럽, 북아메리카를 거치면서 약 200년간 7차례에 걸친 대유행이 발생하였다. 1961년 인도네시아에서 시작한 마지막 7차 대유행은 아시아를 거쳐 아프리카, 유럽, 라틴 아메리카로 퍼져 여전히 지속이 되고 있는데, 이 7차대유행에서는 기존의 6차례 대유행을 일으켰던 균주(V.cholerae O1 고전형)와는 특성이 다른 균주(V. cholerae O1 El Tor형)가 출현하여 현재까지도 개발도상국을 중심으로 여전히 발병을 일으키고 있다[2].
아시아와 아프리카를 중심으로 전 세계적으로 매년 3–5백만 명의 콜레라 환자가 발생하고, 2010년 한 해에만 10–13만명의 사망자가 발생하고 있다[3]. 선진국에서는 그 발생빈도가 낮지만 병원체 자체가 갖고 있는 잠재적 위험성으로 콜레라균을 고위험 병원체로 분류하여 균의 분리, 이동 및 보관까지 정부 차원에서 관리를 하고 있으며, 국내에서도 제1군 법정감염병으로 지정하여 관리하고 있다.
콜레라균은 Vibrionaceae과에 속하는 굽은 그람음성 막대균으로, 염분이 있는 환경에서 잘 성장해서 주로 해안과 강하구의 물에서 발견된다. 콜레라균의 세포벽에 있는 지질다당질의 O 항원에 따라 200가지 이상의 혈청군으로 구분되는데, 이 중에서 O1, O27, O37, O139 혈청군만 콜레라 독소를 발현하는 것으로 알려져 있는데, 오직 O1과 O139 혈청군만 유행성 콜레라를 일으키고 나머지 혈청군(V. cholerae non-01 and non-O139)은 아직까지 집단발생을 일으킨 사례가 없고 주로 산발적으로 발생하는 경미한 위장관장염을 일으키나 드물게 창상감염, 중이염, 균혈증, 간농양 등의 장외 감염을 일으킨다[4]. V. cholerae O1은 생물형에 따라 고전형과 El Tor형의 두 가지로 나누어지고[1], 혈청형에 따라 Ogawa주와 Inaba주로 분류한다[5]. El Tor형에 의한 콜레라는 고전형에 비해 임상증상이 심하지 않아 감염자 50명 중 1명 이하에서만 임상증상이 나타날 정도로 무증상 보균자가 흔하고, 환경에서 더 오래 생존할 수 있는 특징을 갖고 있다. 이런 El Tor형의 특성과 1960대 이후 증가한 국제교류가 병원체의 전파를 쉽게 하여 7차 대유행의 원인으로 추정하고 있다. V. cholerae O139는 1992년 인도 지역에서 처음 발견되었는데, V. cholerae O1 El Tor형의 변이주로 여겨지고 있다[6].
콜레라는 독소에 의한 질환이다. 콜레라균에 오염된 식수나 음식물을 섭취하더라도 대부분의 콜레라균은 위산에 의해 사멸한다. 그러나 생존한 콜레라균은 작은 창자에 집락화되고 주요 병독인자인 콜레라 독소를 분비한다. 콜레라 독소는 외독소로서 1개의 A 아단위와 5개의 B 아단위로 구성되어 있는데, B 아단위는 장 상피세포의 GM1 ganglioside와 결합하여 A 아단위가 장 상피세포의 세포질 내로 잘 침투하게 한다. 장 상피세포 내로 침투한 콜레라 독소 A 아단위는 adenylatecyclase를 활성화시켜 세포 내 cyclic AMP를 증가시킴으로써, Na+과 Cl-의 흡수를 억제하고 Cl-와 수분 분비를 촉진하여 분비성 설사를 유발한다[7]. 두 번째 병독인자는 toxin-coregulated philus로 그 발현이 콜레라 독소와 평행하게 조절되며 균주가 작은 창자 내에 집락화하는데 필수적이다[8].
콜레라균은 콜레라균으로 오염된 수생 병원소(음용수, 해산물)에 의한 전파(1차 전파)되거나, 감염된 환자의 분비물(대변)에 의해서 오염된 환경용수에 의해 전파(2차 전파)된다. 1차 전파에 의해 콜레라의 돌발유행이 발생되고, 토착화된 지역에서는 2차 전파에 의해 대규모 유행이 유발된다[11]. 콜레라가 토착화되어 있는 나라에서는 콜레라 환자의 분변처리가 제대로 되지 않아 수로, 지하수 및 음용수 등이 오염되어 이 오염된 물을 먹고 주로 발생하지만, 선진국에서는 오염된 해산물을 덜 익히거나 날 것으로 먹고 발생한다.
콜레라는 수양성 설사와 이에 따른 탈수 증상이 주된 증상이다. 콜레라균을 섭취한 후 6시간에서 5일(보통 2–3일)의 잠복기 후에 갑자기 나타나는 수양성 설사로 시작하여 급속하게 설사 양이 증가하고, 초기에 흔히 구토가 동반된다. 설사는 처음에는 대변 덩어리이나 담즙, 점액 등이 포함된 약간 혼탁한 양상이나 점차 진행이 되면 쌀뜨물과 같은 형태를 띤다. 설사시 혈변이나 복통은 거의 발생하지 않으며, 발열도 드물어서 만약 발열이 동반되면 2차적 감염을 의심해야 한다.
다량의 수양성 설사가 지속이 되면 탈수와 전해질 불균형에 의한 증상과 징후가 나타난다. 환자는 눈이 퀭해지고, 입이 마르며, 피부가 차갑고 축축하고, 피부 탄력이 감소하여 손과 발에 주름이 잡힌다. 심한 설사로 중탄산염이 손실과 탈수로 혈액 관류 상태가 나빠 생긴 젖산산증으로 인해 Kussmaul 호흡이 나타날 수 있다. 말초동맥 맥박이 빠르고 약해지며 혈압이 떨어짐에 따라 맥박을 촉진하기 어렵게 된다. 전해질 손실과 이동으로 근육 경련과 위약이 흔히 나타난다. 수양성 설사가 매우 심한(시간 당 1 L 이상) 경우에는 증상 발생 후 수시간 내에 저혈압성 쇼크와 사망을 일으킬 수 있어, 중증 콜레라 환자가 제대로 치료받지 못하면 사망률이 70%에 이른다[15]. 소아에서는 글리코젠의 손실과 포도당신합성이 제대로 되지 않아 심한 저혈당이 발생하여 의식저하, 경련, 혼수상태가 생길 수 있다.
검사실 소견은 빈혈이 없는 환자에서는 탈수로 혈액이 농축되어 헤마토크리트의 증가와 경한 호중성 백혈구 증가증이 나타나고, 콩팥전질소혈증에 합당한 혈중 요소질소와 크레아티닌 농도의 상승, 혈청 전해질의 이상(저칼륨혈증, 저나트륨혈증, 저칼슘혈증)과 대사성 산증 등이 나타난다.
WHO에서는 콜레라가 없는 지역에서는 5세 이상의 환자에서 급성 수양성 설사로 심한 탈수 또는 사망한 경우에, 콜레라가 있는 지역에서는 2세 이상의 환자에서 급성 수양성 설사가 있을 때 콜레라를 의심하라고 권고하고 있다[16]. 콜레라의 진단은 대변에서 콜레라균을 분리하여 확진을 한다. 환자의 신선한 대변의 습식표본에서 400배 암시야 현미경으로 빠르게 움직이는 vibrio형태의 세포를 관찰할 수 있는데, 배양에서 양성인 환자의 약 반절 정도에서 암시야 현미경으로 콜레라균을 관찰할 수 있다. 콜레라균의 동정은 선택배지에 나타난 집락을 색상으로 균종을 감별한 후, 균종의 확인동정을 위해 생화학적 검사를 시행하고 특이 항체를 사용하여 혈청군과 혈청형 검사를 시행한다. 배양과 생화학적 검사에서 콜레라균으로 확인되더라도 콜레라 독소를 발현하지 않는 경우에는 콜레라의 원인 병원체로 인정하지 않으므로, 혈청군 검사를 통해 유행성 콜레라를 유발하는 O1과 O139 혈청군으로 확인된 균주에 대해서만 콜레라 독소 발현 또는 독소 유전자 존재 여부를 확인한다.
콜레라 환자의 치료에서 가장 중요한 것은 설사로 인한 탈수에 대한 수분 보충이다. 환자의 탈수 정도, 연령, 몸무게 등을 고려하여 정상 체액 상태로 회복시키는 것이 신속하게 이루어져야 한다. 효과적인 수액 보충을 통하여 중증 환자의 치사율을 0.2% 이하로 낮출 수 있다.
탈수가 심하지 않은 환자에게는 경구수액보충액을 투여한다. 경구수액보충액은 나트륨 75 mEq/L, 칼륨 20 mEq/L, 염화물 65 mEq/L, 중탄산염 10 mEq/L, 탄수화물 75 g으로 구성되어 있는데, 포도당과 같이 능동적으로 이동하는 물질과 더불어 나트륨을 장점막을 가로질러 이동시키는 hexose-Na 공동 이동기전을 이용할 수 있는 장점이 있다. 경구수액보충액은 상품으로 만들어져 나온 것들이 있어 환자에 사용할 수 있고, 가정에서 간단히 경구수액보충액을 만들어 사용할 수 있다. 가정에서는 안전한 물 1 L에 찻숟가락 절반 분량의 소금(약 75 mEq의 나트륨과 75 mEq의 염화물)과 찻숟가락 6개 분량의 설탕(탄수화물 약 75 g)을 섞어서 만든다[19]. 여기에 바나나 또는 녹색 코코넛 즙을 이용하여 칼륨 보충이 권장된다.
탈수가 심한 환자에게는 정맥을 통해 등장성 수액을 주사하여 수분과 전해질을 공급하는 것이 적절하다. 이런 환자에서는 심한 산증(PH <7.2)이 흔하므로 링거젖산용액이 가장 적절하다. 여기에 추가로 칼륨의 보충이 필요하고 일반적으로 경구로 주는 것이 좋다. 매우 심하게 탈수가 된 환자에서는 치료 첫 3–4시간 내에 총 수분 부족분을 보충해야 하며, 보통 첫 24시간 이내에 평균 200 mL/kg 정도의 수액이 필요하다.
콜레라의 치료에서 항생제의 사용이 설사의 기간과 설사 양을 50%까지 단축시킬 뿐만 아니라 대변으로 균이 배출되는 기간을 수일에서 1–2일 정도로 단축시킬 수 있지만, 항생제 내성을 유발할 수 있어서 주의를 요한다. 항생제는 중등도 병증을 갖고 있는 콜레라 환자에서 보조적인 치료로 사용되는데, 일반적으로 초기 수분 결핍과 구토 증상이 호전된 후에 되도록이면 치료 시작 후 4시간 이내에 투여되는 것이 좋다[20]. 항생제 선택은 각 지역의 항생제 내성 양상을 고려하여 선택을 해야 하는데, tetracycline계, ciprofloxacin, macrolide 계 항생제가 사용된다(Table 2). 국내에서는 최근 발생한 해외유입 콜레라균의 항생제 감수성 검사에서 대부분의 균주가 ciprofloxacin에 내성이어서 초 치료제로 ciprofloxacin을 사용하는 것은 적절하지 않다[21]. 장운동을 경감시키는 loperamide나 기타 흡수를 촉진시키는 지사제들은 질환의 치료에 도움이 되지 못하며 오히려 위험할 수 있다.
콜레라의 예방을 위해서는 안전한 식수를 공급하고, 분뇨의 위생적인 처리를 위한 시설을 확보하고, 손씻기를 철저하게 하며, 콜레라 환자의 신속한 발견과 효과적인 치료가 중요하다. 그러나 이런 조치들이 수십 년동안 콜레라 위험지역에서 이루어졌지만 여전히 콜레라가 꾸준히 발생하고 있어 다른 추가적인 전략(예: 콜레라 백신)이 필요하다[22]. 콜레라 백신은 2–3년 동안 60–85% 정도의 방어 효과가 있는 것으로 알려져 있다[23].
콜레라 백신은 일반적으로 콜레라 위험지역의 난민들에게 콜레라 유행이 발생했을 때 투여한다. 콜레라 유행지역(인도, 동남아시아, 아프리카, 남아메리카)에 여행자들에게는 일반적으로 콜레라 백신 투여를 권고하지 않지만, 일부국경지역에서 예방접종 증명서를 요구하는 경우가 있으므로 콜레라 백신을 투여 후 예방접종 증명서를 지니고 다녀야 한다.
콜레라 백신은 경구용 백신과 주사용 백신이 있지만, 주사용 백신은 방어력이 낮고 중증 이상반응의 발생빈도가 높아 WHO에서는 권고하고 있지 않다. 백신을 경구로 투여 시 투여가 쉽고, 주사관련 감염의 위험성이 없으며, 자연 발생하는 질환에 의해 유도되는 면역반응과 매우 유사한 방식으로 장관 내에 국소 면역체계를 자극하는 장점이 있어 콜레라 백신은 주로 경구용 백신이 개발되었다. 경구용 백신에는 불활화 백신과 생백신이 있는데, 생백신으로 Orochol (CVD 103-HgR)이 최초로 사용 허가된 경구용 생백신이나 예방효과가 충분히 확립되지 않아 더 이상 생산되지 않고, Peru 15, VA 1.3, Bengal 15 등이 개발 중이다.
불활화 경구용 백신으로는 현재 WHO에서 권고하고 있는 것으로 Dukoral (killed whole cell vaccine with choleratoxin B subunit, WC-rBS)과 Shanchol (modified killed whole cell-only vaccine)의 두 종류가 있는데[24], 국내에서는 Dukoral (Valneva, Sweden)만 이용이 가능하며 각 지역의 국립검역소에서만 접종이 가능하고 접종 후 예방접종증명서를 발급받을 수 있다. Dukoral은 혈청군 O1의 전세포와 콜레라 B 독소로 구성이 되어 있어 혈청군 O139에 대해서는 예방효과가 없지만, 콜레라 독소가 대장균의 열 감수성 독소와 교차반응을 하여 장독소 대장균(enterotoxigenic Escherichia coli)에 교차 방어능을 갖고 있다[25]. 성인에게는 1–6주 간격으로 2회 투여하고, 콜레라에 지속적으로 노출이 되는 경우에는 예방효과가 2–3년 정도 유지되므로 성인은 2년마다, 소아는 6개월마다 추가 투약해야 한다. 백신을 투약하기 1시간 전부터 투약 후 1시간까지 금식을 해야하고, 콜레라 B 독소가 위산에 약하므로 백신을 투여할 때 완충액(찬물 150 mL [소아에서는 75 mL]에 완충용 탄산수소나트륨을 녹인 것)에 백신을 혼합하여 마시도록 한다.
콜레라는 콜레라균에 의해 오염된 식수나 해산물을 섭취하여 발생하는 감염성 질환으로, 국내에서는 근래에는 발생건수가 미미하고 대부분 해외에서 유입이 되어 발생하고 있어 일반적인 관심이 낮지만 콜레라균이 갖고 있는 잠재적 위험성으로 철저한 관리가 필요한 법정감염병이다. 콜레라 독소에 의해 발생하는 다량의 수양성 설사와 이로 인한 탈수와 전해질 불균형으로 인한 증상으로 치사율이 높으므로 조기에 적절하게 경구 또는 주사로 수액을 보충하는 것이 치료에서 가장 중요하다. 그러므로 해외 여행 후 또는 해산물을 섭취한 후에 급성으로 발생한 다량의 수양성 설사를 호소하는 환자에서는 콜레라를 의심하고 초기에 적절한 수액요법과 진단적 배양검사를 시행하고 즉각적으로 보건당국에 보고하는 것이 중요하다.
본 논문에서는 매우 드물지만 공중위생학적으로 중요한 콜레라 와 관련한 균주의 특성과 역학, 전파경로, 임상양상, 진단 및 치 료에 대한 내용을 소개하고 있다. 2016년 거제 지역에서 2명의 환자가 확정 진단되었고, 해수에서도 콜레라가 검출되어 그 지역 의 경제적 손실이 매우 컸다. 해외 유입 경로가 아닌 것으로 판단 되어, 토착형의 재유행이 아닌가 걱정이 되고 있는 바, 콜레라에 대한 시의적절한 주제라고 판단이 된다. 다만 콜레라 유행지역에 해외여행을 갈 경우에 주의할 점(백신 투여 등), 작년에 국내 발 생시 개인위생 및 의료기관이나 보건 당국의 대책 등이 좀 더 다 루어졌으면 하는 아쉬움이 있다.
[정리: 편집위원회]
Figures and Tables
Figure 1
Countries reporting cholera death and imported cases in 2015. Reproduced from Wkly Epidemiol Rec 2016;91:433-440 [9].
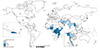
Table 1
Number of cholera cases in Korea

Reproduced from Korea Centers for Disease Control and Prevention. Prevention of cholera infection [Internet]. Cheonju: Korea Centers for Disease Control and Prevention; 2012[10].
References
2. Safa A, Nair GB, Kong RY. Evolution of new variants of Vibrio cholerae O1. Trends Microbiol. 2010; 18:46–54.

3. World Health Organization. Cholera vaccines: a brief summary of the March 2010 position paper. Geneva: World Health Organization;2010.
4. Lee JW, Kim TS, Jung JW, Park SB, Lee HJ, Lee DG, Lee JN, Lee SH. A case of liver abscess and bacteremia caused by Vibrio cholerae non-O1. Korean J Gastroenterol. 2011; 58:350–352.

5. Longini IM Jr, Yunus M, Zaman K, Siddique AK, Sack RB, Nizam A. Epidemic and endemic cholera trends over a 33-year period in Bangladesh. J Infect Dis. 2002; 186:246–251.

6. Bik EM, Bunschoten AE, Gouw RD, Mooi FR. Genesis of the novel epidemic Vibrio cholerae O139 strain: evidence for horizontal transfer of genes involved in polysaccharide synthesis. EMBO J. 1995; 14:209–216.

7. Cassel D, Pfeuffer T. Mechanism of cholera toxin action: covalent modification of the guanyl nucleotide-binding protein of the adenylate cyclase system. Proc Natl Acad Sci U S A. 1978; 75:2669–2673.

8. Matson JS, Withey JH, DiRita VJ. Regulatory networks controlling Vibrio cholerae virulence gene expression. Infect Immun. 2007; 75:5542–5549.

9. Cholera, 2015. Wkly Epidemiol Rec. 2016; 91:433–440.
10. Korea Centers for Disease Control and Prevention. Prevention of cholera infection [Internet]. Cheonju: Korea Centers for Disease Control and Prevention;2012. cited 2017 Jan 10. Available from: http://www.cdc.go.kr/CDC/health/CdcKrHealth0101.jsp?menuIds=HOME001-MNU1132-MNU1147-MNU0746-MNU2426&fid=7958&cid=68953.
11. Ruiz-Moreno D, Pascual M, Emch M, Yunus M. Spatial clustering in the spatio-temporal dynamics of endemic cholera. BMC Infect Dis. 2010; 10:51.

12. Nelson EJ, Harris JB, Morris JG Jr, Calderwood SB, Camilli A. Cholera transmission: the host, pathogen and bacteriophage dynamic. Nat Rev Microbiol. 2009; 7:693–702.

13. Faruque SM, Biswas K, Udden SM, Ahmad QS, Sack DA, Nair GB, Mekalanos JJ. Transmissibility of cholera: in vivo-formed biofilms and their relationship to infectivity and persistence in the environment. Proc Natl Acad Sci U S A. 2006; 103:6350–6355.

14. Hartley DM, Morris JG Jr, Smith DL. Hyperinfectivity: a criti-cal element in the ability of V. cholerae to cause epidemics? PLoS Med. 2006; 3:e7.

15. Lindenbaum J, Greenough WB, Islam MR. Antibiotic therapy of cholera in children. Bull World Health Organ. 1967; 37:529–538.
16. World Health Organization. The treatment of diarrhea: a manual for physicians and other senior health workers [Internet]. Geneva: World Health Organization;2005. cited 2017 Feb 10. http://whqlibdoc.who.int/publications/2005/9241593180.pdf.
17. Hasan JA, Huq A, Tamplin ML, Siebeling RJ, Colwell RR. A novel kit for rapid detection of Vibrio cholerae O1. J Clin Microbiol. 1994; 32:249–252.

18. Harris JR, Cavallaro EC, de Nobrega AA, Dos S, Bopp C, Parsons MB, Djalo D, Fonseca FG, Ba U, Semedo A, Sobel J, Mintz ED. Field evaluation of crystal VC Rapid Dipstick test for cholera during a cholera outbreak in Guinea-Bissau. Trop Med Int Health. 2009; 14:1117–1121.

19. Global Task Force on Cholera Control. First steps for managing an outbreak of acute diarrhea [Internet]. Geneva: World Health Organization;2010. cited 2017 Feb 10. Available from: http://www.who.int/cholera/publications/firststeps/en/.
20. Nelson EJ, Nelson DS, Salam MA, Sack DA. Antibiotics for both moderate and severe cholera. N Engl J Med. 2011; 364:5–7.

21. Kim H, Jeon S, Kim J, Kim S, Lee DY. Genetic characteristics and relatedness of imported Vibrio cholerae O1 biotype El tor in Korea. Ann Clin Microbiol. 2013; 16:25–32.

22. Global Task Force on Cholera Control. Prevention and control of cholera outbreaks: WHO policy and recommendations [Internet]. Geneva: World Health Organization;2011. cited 2017 Feb 10. Available from: http://www.who.int/cholera/technical/prevention/control/en/.
23. Sur D, Lopez AL, Kanungo S, Paisley A, Manna B, Ali M, Niyogi SK, Park JK, Sarkar B, Puri MK, Kim DR, Deen JL, Holmgren J, Carbis R, Rao R, Nguyen TV, Donner A, Ganguly NK, Nair GB, Bhattacharya SK, Clemens JD. Efficacy and safety of a modified killed-whole-cell oral cholera vaccine in India: an interim analysis of a cluster-randomised, double-blind, placebo-controlled trial. Lancet. 2009; 374:1694–1702.

24. Cholera vaccines: WHO position paper. Wkly Epidemiol Rec. 2010; 85:117–128.
25. Clemens JD, Sack DA, Harris JR, Chakraborty J, Khan MR, Stanton BF, Ali M, Ahmed F, Yunus M, Kay BA. Impact of B subunit killed whole-cell and killed whole-cell-only oral vaccines against cholera upon treated diarrhoeal illness and mortality in an area endemic for cholera. Lancet. 1988; 1:1375–1379.





 PDF
PDF ePub
ePub Citation
Citation Print
Print




 XML Download
XML Download