Abstract
The role of radiotherapy in practice is mainly palliative. According to the Practice Guidelines for Management of Hepatocellular Carcinoma (2009) developed by the Korean Liver Cancer Study Group and the National Cancer Center, Korea, radiotherapy can be applied for 1) refractoriness to trans-catheter hepatic arterial chemo-embolization, 2) portal vein tumor thrombosis, and 3) palliative therapy to reduce the symptoms caused by hepatocellular carcinoma. Radiotherapy is one of the most rapidly developing fields of medical research. Recent advances in intensity-modulated radiotherapy, image-guided radiotherapy, and respiratory-gated radiotherapy technologies have enabled more accurate and precise radiation delivery for the treatment of hepatocellular carcinoma. Proton therapy is also emerging as a candidate therapy for ablative measures for patients ineligible for other curative local therapies. Due to recent advances in radiotherapy technologies, radiotherapy for hepatocellular carcinoma has been evolving into stereotactic ablative radiotherapy, which delivers an ablative dose of radiation in 1 to 4 sessions. Clinical series have confirmed that it is safe in Child-Pugh A patients and local control is sustained. The possibility for performing phase 3 randomized clinical trials involving the radiotherapy modality has increased with those advances. Not merely palliative, the role of radiotherapy in the treatment of hepatocellular carcinoma will be expanded to potentially curative therapy in patients who are ineligible for other curative local therapies.
국내의 경우 단일 기관의 경험 위주로 임상에 적용되고 있던 방사선치료는 간세포암의 치료에서 임상적인 유용성에 대한 회의적인 평가를 불식하고 여러 가지 과학적인 근거를 쌓아 가면서 임상적인 적응증을 확대해 나가고 있다. 대한간암연구학회와 국립암센터에 의해 제정된 2003년 간세포암종진료 가이드라인에 방사선치료가 수술이 불가능한 간세포암의 치료에서 다른 치료법의 보완적 또는 대안적 치료로써 언급된 것이 큰 전환점이 되었다[1]. 이후 근치적 치료가 불가능한 간세포암을 대상으로 방사선치료를 경동맥화학색전술(transarterial chemoembolization), 국소치료술, 전신적 항암화학요법들과 함께 단독 또는 병합치료의 한 가지 방법으로써 활발한 임상 연구가 진행되었다[2345]. 2009년 개정된 간세포암종 진료 가이드라인에는 2003년 이후의 변화라 할 수 있는 방사선치료 기법의 발전과 방사선치료 관련 연구논문 게재수의 증가 및 과학적 근거 수준의 향상 등을 고려하여 몇 가지 구체적인 임상적 적용에 대한 언급을 할 수 있게 되었다[6].
한편 방사선치료는 의학 분야 중 가장 빠르게 발전하는 분야의 하나로 특히 치료의 정확도와 정밀도를 향상시키는 분야의 발전이 두드러지고 있다. 다양한 영상유도 기법을 활용하여 치료의 정확도를 획기적으로 개선한 영상유도방사선치료(image-guided radiotherapy)법과 통상적인 3차원입체조형치료(3-dimensional conformal radiotherapy)에 비하여 매우 높은 정밀도로 주위 정상 조직을 보호하고 적재적소에 방사선 조사선량 수준을 자유자재로 조절할 수 있는 세기조절방사선치(intensity-modulated radiotherapy)법을 대표적으로 들 수 있다[78]. 또한 호흡에 의하여 움직이는 간 부위의 방사선치료 정밀도를 높이기 위해서 호흡연동방사선치료(respiration-gated radiotherapy)의 발전 또한 이루어지고 있다[7]. 이런 방사선치료 기법의 발전과 더불어 짧은 시간에 고선량의 방사선 전달이 가능한 고선량률(high dose rate) 치료기기의 개발이 이루어짐으로써 최근 간세포암의 방사선치료의 경향은 정위절제방사선치료(stereotactic ablative radiotherapy)의 형태로 발전해 나아가고 있다. 또 한가지 주목할 방사선치료 분야의 변화는 서서히 양성자치료(proton therapy) 등 입자선치료(particle therapy)의 저변이 확대되어 가고 있다는 점이다[9].
간세포암에 있어서 방사선치료의 역할이 나날이 확대되고 있음은 주지의 사실이다. 그러나 국내의 진료 가이드라인에 방사선치료의 역할이 언급되고 있는 것과 달리 Barcelona Liver Cancer Clinic (BCLC) 가이드라인처럼 국제적으로 널리 인정받는 대부분의 국외 가이드라인에서 방사선치료의 역할에 대한 언급을 찾아볼 수 없는데, 이는 간세포암의 치료에서 방사선치료의 효과 및 유용성을 인정받기 위해 더 많은 과학적 근거를 확보하기 위한 노력이 필요함을 의미한다. 본 논문에서는 기존 국내 가이드라인의 간세포암에 대한 방사선치료의 역할을 소개하고, 방사선치료 분야의 최근 발전을 고찰함으로써 향후 방사선치료의 역할 확대 전망 및 발전 방향을 제시하고자 한다.
간세포암에 대한 방사선치료는 수술적 절제가 불가능하거나, 고주파열치료술, 에탄올주입술 등으로 근치적 치료가 되지 않는 환자에서 시행되고 있다. 주로 간기능이 Child-Pugh 등급 A 또는 상위 B인 경우에만 시행되고 있으며 40-90%의 반응률과 10-25개월의 중앙생존기간을 보고하고 있다[10]. 방사선치료는 종양의 체적이 전체 간부피의 1/3 이하가 되어야 부작용의 위험이 현저하게 낮아 안전하며, 방사선량 분포의 선량-체적분석(dose volume histogram)에서 30 Gy 이상 조사되는 정상 간조직의 부피가 전체 간의 60% 이하가 되도록 투여되는 방사선량을 제한하기도 한다[511].
방사선치료는 간문맥 종양혈전증 유무에 제한을 받지 않고 안전하게 시행할 수 있는 장점이 있다[2]. 경동맥화학색전술과 방사선치료의 병용치료가 경동맥화학색전술 단독군에 비해 3년 생존율을 10-28% 정도 향상시킨다고 보고되었다[12]. 방사선치료는 경동맥화학색전술을 포함한 각종 비수술적 치료 후 재발한 간세포암에 대하여 구제치료 목적으로 시행할 수 있다[3]. 암에 의한 통증 등 증상의 완화에도 효과적이다[1013]. 종양의 담도 폐색으로 인해 황달 증상을 보이는 간세포암의 경우 방사선치료를 시행하여 종양을 줄이고 증상의 호전 및 생존 기간의 연장을 기대할 수 있다[14]. 종양으로 인한 동정맥단락이 심하여 경동맥화학색전술이 어려웠던 경우에 방사선치료 후 약 20%의 한자에서 혈관 폐색이 유도되어 경동맥화학색전술이 가능하였다[15]. 복부 림프절 전이의 경우 방사선치료로 80% 전후의 반응률과 약 7개월의 중앙생존기간이 보고되었으며, 생존기간의 연장도 보고되었다[1617]. 통증을 동반한 간세포암 뼈전이에 대한 방사선치료는 약 75-84%에서 통증을 완화하였다[13]. 간세포암종의 뇌전이의 경우 전뇌 방사선치료가 증상완화를 위해 사용될 수 있다[18]. 척수신경 압박을 동반하는 척추 전이에 대해 30-50.7 Gy의 방사선치료를 하여 3개월, 6개월 보행 가능이 각각 83%, 63%로 보고되었다[19].
간세포암 진료 가이드라인에 방사선치료 관련 권고사항으로 지정된 내용은 다음과 같다. 첫째, 안전하게 방사선치료를 시행할 수 있는 경우로 간기능이 Child-Pugh 등급 A 또는 상위 B 등급이면서 종양이 전체 간 부피의 2/3 이하인 경우로 제한하고 있고(증거순위 II-3), 둘째, 경동맥화학색전술로 불완전한 치료가 예측되는 경우에 병용치료를 고려할 수 있고(증거순위 III), 셋째, 간문맥 종양혈전증을 동반한 간세포암에 방사선치료를 할 수 있으며(증거순위 II-1), 넷째, 간세포암의 원발암 및 전이암으로 인한 증상을 완화시키기 위해 방사선치료를 시행할 수 있다(증거순위 I-2).
방사선치료는 정확성 향상과 정밀도 향상의 두 방향으로 발전이 이루어지고 있다. 방사선치료의 정확성은 방사선치료계획(radiation treatment planning) 시점과 실제 치료를 시행하는 시점 사이의 여러 가지 불확실성에도 불구하고 매번 정확한 위치에 방사선조사가 이루어질 수 있도록 하는 것을 의미한다. 방사선치료의 정밀도는 치료의 목표로 삼고있는 종양 부위에는 처방된 방사선량을 투여하고 주변 정상장기 및 조직에는 되도록 방사선이 조사되지 않도록 방사선분포를 제어하는 능력을 의미한다.
과거에는 주로 이차원적인 투시촬영(fluoroscopy) 영상으로 치료할 부위에 대한 계획을 세우고 하나의 대표적인 인체 단면에서만 방사선의 분포를 가늠해보는 것으로 치료를 하였는데 이를 이차원 방사선치료라고 한다. 이후 컴퓨터공학과 영상 의학의 발전을 토대로 전산화단층촬영(computed tomography) 영상을 모의치료에 활용하여 종양과 주위 정상 장기의 삼차원적인 위치 관계를 고려한 계획을 세우고 방사선량 분포에 관한 방사선 물리학적 모델을 활용하여 인체내의 삼차원적인 방사선 조사선량 분포를 가늠해볼수 있게 되었다. 또한 종양 부위와 주위 정상 장기 각각의 방사선량 분포에 대한 통계량을 분석하여 종양의 국소제어확률과 정상 장기의 부작용확률에 대한 방사선생물학적 수학모델을 수립하고 해당 치료계획에서의 방사선량 처방을 치료효율비(therapeutic ratio)가 가장 높은 수준으로 지정할 수 있게 되었다. 이와 같은 방사선치료 기법을 삼차원입체조형방사선치료라고 칭한다. 현대의 방사선치료는 기본적으로 삼차원입체조형방사선치료를 채용하고 있다.
간세포암의 방사선치료는 매우 높은 정확성과 정밀도를 요구한다. 주위 정상 장기인 간, 위장 및 십이지장은 비교적 방사선에 취약한 장기인데 특히 간경변증을 동반한 경우 이런 정상 장기의 방사선에 대한 견딤선량이 매우 낮아지게 되므로 종양 부위에 목표하는 방사선량을 투여하면서도 주위장기로의 방사선조사는 최소화해야 하기 때문이다. 또한 간부위는 호흡에 의한 영향을 많이 받는 대표적인 장기이다. 호흡에 의한 장기의 움직임은 전산화단층촬영 모의치료 영상에 잡음을 많이 일으키고 정확한 위치관계 파악을 어렵게한다. 또한 호흡에 의한 간 부위의 움직임은 치료계획을 수행할 당시와 실제 치료 시에 일관성 있게 유지되는 경우가 드물다. 따라서 이런 위치 관계의 불확실성을 감안하여 원하는 정도의 방사선량을 종양 부위에 투여하기 위해서는 종양 부위의 크기에 비해서 여유를 둔 더 넓은 부위에 방사선을 조사하는 것이 불가피하므로 정밀도 측면에서도 악영향을 미치게 된다.
방사선치료 수행을 위한 위와 같은 난관에도 불구하고 간세포암에 대한 방사선치료의 임상적 역할이 점차 확대되고 있는 것은 방사선치료 기법의 최근 발전에 힘입은 바가 매우 크다. 다음에서는 최근 비약적으로 발전하고 있는 최신 방사선치료 기법에 대하여 소개하고자 한다.
세기조절방사선치료는 가장 진보된 형태의 3차원입체조형치료 방법으로 각각의 치료 방향에서 투여되는 방사선의 세기를 조절하여 종양 주위의 정상 조직에 들어가는 방사선량을 최소화하고 종양 부위에만 선택적으로 원하는 방사선량을 전달할 수 있다. 개별 방사선조사 방향에서 종양과 주위 정상 조직의 위치 관계를 고려하여 방사선 빔을 수 개에서 수십 개까지 세분화하고 각각의 세분화된 영역마다 방사선의 양, 즉 세기를 조절하여 방사선치료를 하는 방법이다. 이 치료 기법의 핵심은 미리 종양 및 주변 정상 장기에 대한 견딤선량 및 상대적인 중요도를 조건으로 설정하여 놓고 컴퓨터가 이에 가장 근접한 세분화된 빔 세기를 계산해내는 이른바 역치료계획(inverse treatment planning)이다. 세기조절방사선치료는 현재의 방사선치료 기법 중 가장 정밀한 선량 분포를 구현한다고 볼 수 있다(Figure 1). 그러나 장비가 고가이며 통상적인 치료에 비하여 치료계획을 수립하는 시간이 오래 걸리고, 장비의 관리 및 치료 과정의 정밀성 유지를 위해 훈련된 고급 인력이 필요하다는 어려운 점도 동시에 존재한다.
세기조절방사선치료를 간세포암의 치료에 적용할 경우 주위 정상 장기에 들어가는 방사선량을 동일하게 하면서도 종양 부위에 방사선 조사 분포를 개선할 수 있으며 일부 환자에서는 처방선량을 증가시킬 수 있음이 발표되었다[8]. 그러나 호흡으로 인한 움직임이 많은 장기인 경우 세기조절 방사선치료로 얻을 수 있는 정상 조직 보호라는 이득이 감쇄되므로 조심스러운 시도가 필요하며 특히 호흡연동방사선치료법을 동시에 시행하는 등 조심스러운 시도가 필요하다.
넓은 의미의 영상유도방사선치료는 모의치료, 치료계획, 치료 정확성 확인, 치료 후 방사선량 평가 등 방사선치료의 전 과정에 각종 의학 영상을 이용하는 것을 의미하며 좁은 의미의 영상유도방사선치료는 방사선 치료실 내에서 각종 의학 영상의 도움을 받아 좀 더 정확하고 재현성 있는 치료를 시행하는 것을 의미한다. 즉 치료 범위 및 주위 정상 조직에 대한 방사선치료의 오차를 줄이기 위해 방사선치료 직전에 치료할 부위의 영상을 찍고 미리 계획된 치료 부위와 비교하여 위치 교정을 거친 후 방사선이 투여되는 보다 정확한 치료방법이다[7]. 종양의 크기, 형태, 위치 등에 관하여 치료실 내 영상으로 검증하여 치료계획 당시와 오차가 발생하였을 경우에 이를 실시간으로 교정하여 치료에 즉시 반영한다.
최신 방사선치료 기기들은 영상 유도 과정을 위하여 투시촬영, 원뿔빔전산화단층촬영(cone beam computed tomography), 디지털단층영상합성법(digital tomosynthesis), 나선형전산화단층촬영(spiral computed tomography)이 가능한 부속 장치 등을 장착하여 각각의 세부적인 기기 사양에 따라 특화된 치료를 수행할 수 있도록 디자인되어 있다(Figure 2). 흔히 인터넷에서 접할 수 있는 사이버나이프(Cyberknife), 토모테라피(Tomotherapy), 노발리스(Novalis TX) 등의 치료기기들은 나름대로의 다양한 영상유도장치를 장착하고 있으며 세기조절방사선치료 및 방사선수술(radiosurgery)법을 수행할 수 있는 고정밀 방사선치료용 영상유도방사선치료 기기의 일종이다.
간세포암은 인체 내에서 가장 방사선치료를 적용하기에 기술적 난관이 많은 부위의 종양 중 하나이다. 간 부위의 종양은 폐와 더불어 환자의 호흡에 의한 움직임이 발생하고 정상 장기와의 위치 관계를 정확하게 예측하기 어려우므로 정밀하고 정확한 치료의 적용에 어려움을 겪는다. 세기조절방사선치료의 정상 장기 보호 정도가 줄어들게 되고 매 치료시 정확하게 종양 부위를 조준하는데도 어려움이 있어 각종 고정밀 방사선치료 기법과 영상유도 기법의 적용이 쉽지 않았다. 다행히 최근 이런 난관을 극복하기 위한 호흡연동방사선치료법이 개발되고 임상에서도 간세포암의 방사선치료에 적용을 시작하여 이를 소개하고자 한다.
시간에 따른 변화라는 변수를 방사선치료에 고려하고자 하는 사차원방사선치료법은 호흡억제법, 호흡연동방사선치료법, 호흡추적방사선치료법 등이 있다. 본 논문에서는 가장 흔히 사용되는 호흡연동방사선치료법을 설명하고자 한다. 호흡연동방사선치료법은 모의치료 영상으로 4차원전산화단층촬영(4-dimensional computed tomography) 영상을 활용함으로써 각각의 호흡주기에 따른 종양의 위치와 정상 장기와의 위치관계를 정확하게 파악한다. 또한, 최신 방사선치료 기기들은 특정한 호흡주기에만 방사선 빔이 조사되고 치료를 원하지 않는 호흡 주기에서는 방사선 빔이 조사되지 않는 자동제어 장치를 장착하고 있다. 따라서, 호흡연동방사선치료의 과정은 우선 환자의 전체 호흡주기에 대한 4차원전산화단층촬영 모의치료 영상을 얻고, 치료를 원하는 특정 호흡주기의 영상만을 활용하여 방사선치료계획을 한 뒤 치료실 내 자동제어 장치를 활용하여 원하는 특정 호흡주기에만 방사선이 조사되도록 하는 것으로 이루어진다(Figure 3) [7].
호흡연동방사선치료는 세기조절방사선치료 및 영상유도방사선치료와 동시에 적용될 수 있으므로 호흡에 의한 불확실성이 많은 간세포암의 방사선치료에서 정확도와 정밀성의 추구를 가능하게 하는 최신 맞춤형 방사선치료 기법이라고 할 수 있다.
양성자치료는 수소 원자의 핵을 구성하는 소립자인 양성자를 빠른 속도로 암이 생긴 부위에 쏘아서 암 조직을 파괴하는 치료 방법이다. 양성자치료의 원리는 양성자 빔이 인체를 통과할 때 별다른 반응 없이 통과하다가 암 조직에 도달하는 순간 에너지 전달이 절정에 이르고, 암 조직을 지나치는 순간 그 자리에서 소멸되는 고유의 물리적 특성인 브래그최대점(Bragg peak) 현상을 이용한다는 점이다. 종양 앞쪽의 정상조직을 그대로 통과하므로 부작용이 미미하고 종양 뒤쪽의 정상 조직에는 양성자가 소멸하여 특히 간세포암의 방사선치료에서 정상 간조직의 손상을 획기적으로 줄여줌으로써 치료율 확대에 기여할 수 있을 것으로 기대된다(Figure 4).
양성자치료는 간기능이 치료방법의 선택에 큰 영향을 미치는 간세포암의 치료에 매력적인 대안으로 떠오르고 있는데 최근 일본에서 산발적인 치료결과의 보고가 이루어지고 있다[9]. 장기 국소제어율은 74-100%로 평가되며 5년 생존율이 26-39% 정도로 평가되고 있으며 간기능이 양호한 단일 종양을 대상으로 한 분석에서는 5년 생존율이 50%를 상회하는 것으로 보고되어 잠재적으로 완치 목적의 치료로써의 가능성도 예측되고 있다(Table 1) [9]. 특히 X-선을 이용한 방사선치료와 달리 일부 Child-Pugh B 혹은 C등급의 환자에서도 치료의 적용이 가능한 것으로 여겨지고 있다.
단점은 고가의 치료장비로 인한 비용 측면인데 일반적인 X-선 장비에 비하여 어떤 환자가 고가에도 불구하고 양성자 치료로 명확한 이득을 얻을 수 있을지 좀 더 명확한 적응증이 결정될 필요가 있다.
정위절제방사선치료는 뇌정위방사선수술(brain stereotactic radiosurgery)을 전신적으로 확장한개념으로 통상적인 분할 방사선치료와 달리 1-4회 정도의 단기간에 종양 부위에만 방사선을 집중하는 치료 기법이다. 간세포암의 정위절제방사선치료의 중요한 착안점 중 하나는 종양 부위의 조준을 매우 정확하게 할 수 있도록 최근 발전된 방사선치료 기법의 발전을 적극적으로 활용하여 충분한 정확도와 정밀도를 확보하고 종양 부위에 대한 방사선조사 영역의 여유를 극도로 작게 유지해야 한다는 점이다. 이를 통해 암 조직을 효과적으로 제거할 수 있고 주위 정상 조직 및 장기의 영향을 최소화할 수 있다.
정위절제방사선치료의 대상이 되는 간세포암은 현행 간세포암 진료 가이드라인에 나타난 것보다 비교적 작은 크기의 종양을 대상으로 한다. 주로 재발성 간세포암이 대상이 되며 다른 종양 절제 방법인 수술, 고주파열치료술, 에탄올주입술등이 불가능한 환자를 대상으로 많이 시행되는데 작은 크기의 종양을 대상으로 하기 때문에 근치 목적으로의 활용 가능성을 가늠해볼 수 있는 측면이 있다. 현재까지 간세포암에 대한 정위절제방사선치료를 시도한 5개의 전향적 임상연구가 발표되었다[2021222324]. 대개 74-100% 가량의 장기 국소제어율을 보이며 Child-Pugh A등급에서는 안전한 치료로 판단되어 향후 다른 국소 치료 방법을 적용할 수 없는 작은 크기의 간세포암치료에서 적용이 늘어날 것으로 기대된다(Table 2).
국외의 간세포암 진료 및 치료 관련 가이드라인에는 간세포암의 치료에서 방사선치료의 역할을 언급하고 있는 예로는 북미 지역의 간세포암 방사선치료 연구자들에 의하여 영향을 받는 National Comprehensive Cancer Network 가이드라인이 유일하다. 물론 간세포암의 방사선치료 관련 연구논문이 해마다 증가하고 있지만 전향적 연구가 드물고 치료방법으로써 방사선치료가 포함된 무작위 배정 3상 임상연구는 전혀 발표되지 않고 있다. 또한, 최초 치료로써의 역할이외에도 재발성 간세포암 등의 치료에서 병합요법 중 하나로 방사선치료의 쓰임새가 증가하고 있는 현실이지만 재발성 간세포암의 구제 치료 혹은 고식적 치료에 대한 가이드라인은 아직까지 전무한 실정이다[30].
간세포암의 방사선치료를 다루는 여러 연구자들에 의해 향후 임상연구 측면에서 나아가야 할 방향들이 BCLC 병기 분류의 각각의 병기에 맞추어 활발히 제시되고 있다[3132]. 간세포암에서 방사선치료의 연구 방향은 BCLC의 각각의 병기에 맞추어 제시되었다. 완치가 가능한 BCLC 0-1의 병기에서는 다른 완치 목적의 치료가 불가능한 상황에서 완치 목적의 치료로써의 시도, 간이식 시행전의 중개치료(bridging therapy)역할 혹은 병기 감소 목적으로써의 시도가 연구방향으로 제시되었다. 생존 기간의 연장이 가능한 BCLC B-C 병기에서는 경동맥화학색전술이 더 이상 반응을 보이지 않는 경우의 구제치료로서, 혹은 간문맥종양혈전증이 있는 상황에서 sorafenib과의 병용치료로써의 가능성을 제시하였다. 증상 관리를 목적으로 치료하게 되는 BCLC D 병기에서는 증상 완화 목적의 저선량 방사선치료가 연구 방향으로 제시되었다. 2011년부터 Radiation Therapy Oncology Group에서 BCLC B-C 병기의 환자를 대상으로 sorafenib을 기본으로 방사선치료 병용 여부를 무작위 배정하는 국제 다기관 대조군 연구를 시작하였다.
국내의 간세포암 진료 가이드라인을 통해서 간세포암의 치료에서 방사선치료의 비근치적 치료로서의 역할이 임상진료에서 자리잡고 있는 현실이다. 전이성 병소로 인한 통증의 완화 이외에도 경동맥화학색전술과의 병용치료, 간문맥종양혈전증을 동반한 경우의 방사선치료의 역할 등이 인정받고 있다.
방사선치료 분야는 최근 매우 빠르게 발전하고 있는데 특히 세기조절방사선치료, 영상유도방사선치료, 호흡연동방사선치료 기법을 활용함으로써 간세포암처럼 방사선치료 시 불확실성이 높은 부위에 대해서도 정확성과 정밀성을 추구하는 것이 가능해지고 있다. 또한 비용 측면에서의 약점에도 불구하고 탁월한 방사선 물리 특성으로 인하여 양성자치료가 큰 주목을 받고 있으며 잠재적인 완치 목적 치료로써 기대를 모으고 있다.
이런 방사선치료 기법의 비약적 발전은 간세포암의 치료에서 1-4회의 단기간에 국소 제어가 가능한 수준의 방사선량을 조사하는 정위절제방사선치료의 형태로 진화하고 있다. 정위절제방사선치료는 현재까지의 임상연구 결과로 볼때 장기간의 국소 제어가 가능한 것으로 평가되며 Child-Pugh A등급에서는 안전한 치료이다. 다른 국소치료법을 적용할 수 없는 작은 크기의 간세포암 치료에 적용할 수 있을 것으로 판단된다.
간세포암의 방사선치료에서 최근 발전된 치료기법은 다양한 병기의 간세포암 치료 관련 임상 연구에서 방사선치료의 참여 가능성을 높여주고 있다. 향후 비근치적 목적의 치료 옵션에 그치지 않고 정위절제방사선치료를 비롯한 방사선치료의 역할이 확대될 것으로 기대된다.
Figures and Tables
Figure 1
Isodose curves with different external radiotherapy techniques. (A) Two-dimensional radiotherapy. (B) Three-dimensional radiotherapy. (C) Intensity-modulated radiotherapy. CTV, clinical target volume.
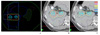
Figure 2
Concepts of image-guided radiotherapy (IGRT). (A) Linear accelerator equipped with in-room imaging devices (On-Board Image, Varian, Palo Alto, CA, USA; ExacTrac, Brain-Lab, Feldkirchen, Germany) for IGRT. (B) Daily setup using 2-dimensional imaging modality. (B-1) Reference images using digitally reconstructed radiographs, and (B-2) kV images using on-board imager. (C) Daily setup using 3-dimensional volumetric imaging modality. (C-1) Reference images using 3-dimentional reconstruction of planning computed tomography images, and (C-2) in-room cone-beam computed tomography images.
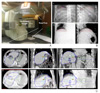
Figure 3
Concepts of respiration-gated radiotherapy. (A) Red-line indicates the level of liver dome at end-exhale phase (50%) and yellow-line indicates the level of liver dome at end-inhale phase (0%). In the respiratory-gated radiotherapy setting, treatment delivery is done in only gating window periods when the target position is pre-determined end-exhale phases. (B) Treatment Fields with and without Gating Technique (B-1 and B-2, respectively). (C) Dose volume histogram with gating (solid line) and without gating (dotted line); with same target coverage, treatment with gating delivers less radiation to normal tissues.
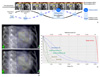
Figure 4
Comparison between proton therapy and radiotherapy using X-ray. (A) Characteristics of percentage depth dose from radiation delivery. (B) Comparison of isodose curves between intensity-modulated proton therapy (B-1) and three-dimensional conformal radiotherapy using 10 MV photon (B-2). SOBP, Spread out bragg peak.

Acknowledgement
This research was supported by Basic Science Research Program through the National Research Foundation of Korea(NRF) funded by the Ministry of Education, Science and Technology (NRF-2012R1A1A 2042414). This study was supported by Samsung Medical Center grant [GFO1130081].
References
1. Park JW. Korean Liver Cancer Study Group and National Cancer Center. Practice guideline for diagnosis and treatment of hepatocellular carcinoma. Korean J Hepatol. 2004; 10:88–98.
2. Kim DY, Park W, Lim DH, Lee JH, Yoo BC, Paik SW, Kho KC, Kim TH, Ahn YC, Huh SJ. Three-dimensional conformal radiotherapy for portal vein thrombosis of hepatocellular carcinoma. Cancer. 2005; 103:2419–2426.

3. Park W, Lim DH, Paik SW, Koh KC, Choi MS, Park CK, Yoo BC, Lee JE, Kang MK, Park YJ, Nam HR, Ahn YC, Huh SJ. Local radiotherapy for patients with unresectable hepatocellular carcinoma. Int J Radiat Oncol Biol Phys. 2005; 61:1143–1150.

4. Mornex F, Girard N, Beziat C, Kubas A, Khodri M, Trepo C, Merle P. Feasibility and efficacy of high-dose three-dimensional-conformal radiotherapy in cirrhotic patients with small-size hepatocellular carcinoma non-eligible for curative therapies-mature results of the French Phase II RTF-1 trial. Int J Radiat Oncol Biol Phys. 2006; 66:1152–1158.

5. Kim TH, Kim DY, Park JW, Kim SH, Choi JI, Kim HB, Lee WJ, Park SJ, Hong EK, Kim CM. Dose-volumetric parameters predicting radiation-induced hepatic toxicity in unresectable hepatocellular carcinoma patients treated with three-dimensional conformal radiotherapy. Int J Radiat Oncol Biol Phys. 2007; 67:225–231.

6. Korean Liver Cancer Study Group and National Cancer Center, Korea. Practice guidelines for management of hepatocellular carcinoma 2009. Korean J Hepatol. 2009; 15:391–423.
7. Brock KK. Imaging and image-guided radiation therapy in liver cancer. Semin Radiat Oncol. 2011; 21:247–255.

8. Eccles CL, Bissonnette JP, Craig T, Taremi M, Wu X, Dawson LA. Treatment planning study to determine potential benefit of intensity-modulated radiotherapy versus conformal radiotherapy for unresectable hepatic malignancies. Int J Radiat Oncol Biol Phys. 2008; 72:582–588.

9. Skinner HD, Hong TS, Krishnan S. Charged-particle therapy for hepatocellular carcinoma. Semin Radiat Oncol. 2011; 21:278–286.

10. Hawkins MA, Dawson LA. Radiation therapy for hepatocellular carcinoma: from palliation to cure. Cancer. 2006; 106:1653–1663.
11. Dawson LA, Ten Haken RK. Partial volume tolerance of the liver to radiation. Semin Radiat Oncol. 2005; 15:279–283.

12. Meng MB, Cui YL, Lu Y, She B, Chen Y, Guan YS, Zhang RM. Transcatheter arterial chemoembolization in combination with radiotherapy for unresectable hepatocellular carcinoma: a systematic review and meta-analysis. Radiother Oncol. 2009; 92:184–194.

13. Seong J, Koom WS, Park HC. Radiotherapy for painful bone metastases from hepatocellular carcinoma. Liver Int. 2005; 25:261–265.

14. Huang JF, Wang LY, Lin ZY, Chen SC, Hsieh MY, Chuang WL, Yu MY, Lu SN, Wang JH, Yeung KW, Chang WY. Incidence and clinical outcome of icteric type hepatocellular carcinoma. J Gastroenterol Hepatol. 2002; 17:190–195.

15. Hsu HC, Chen TY, Chiu KW, Huang EY, Leung SW, Huang YJ, Wang CY. Three-dimensional conformal radiotherapy for the treatment of arteriovenous shunting in patients with hepatocellular carcinoma. Br J Radiol. 2007; 80:38–42.

16. Zeng ZC, Tang ZY, Fan J, Qin LX, Ye SL, Zhou J, Sun HC, Wang BL, Wang JH. Consideration of role of radiotherapy for lymph node metastases in patients with HCC: retrospective analysis for prognostic factors from 125 patients. Int J Radiat Oncol Biol Phys. 2005; 63:1067–1076.

17. Park YJ, Lim do H, Paik SW, Koh KC, Lee JH, Choi MS, Yoo BC, Nam HR, Oh DR, Park W, Ahn YC, Huh SJ. Radiation therapy for abdominal lymph node metastasis from hepatocellular carcinoma. J Gastroenterol. 2006; 41:1099–1106.

18. Choi HJ, Cho BC, Sohn JH, Shin SJ, Kim SH, Kim JH, Yoo NC. Brain metastases from hepatocellular carcinoma: prognostic factors and outcome: brain metastasis from HCC. J Neurooncol. 2009; 91:307–313.

19. Nakamura N, Igaki H, Yamashita H, Shiraishi K, Tago M, Sasano N, Shiina S, Omata M, Makuuchi M, Ohtomo K, Nakagawa K. A retrospective study of radiotherapy for spinal bone metastases from hepatocellular carcinoma (HCC). Jpn J Clin Oncol. 2007; 37:38–43.

20. Méndez Romero A, Wunderink W, Hussain SM, De Pooter JA, Heijmen BJ, Nowak PC, Nuyttens JJ, Brandwijk RP, Verhoef C, Ijzermans JN, Levendag PC. Stereotactic body radiation therapy for primary and metastatic liver tumors: a single institution phase i-ii study. Acta Oncol. 2006; 45:831–837.

21. Tse RV, Hawkins M, Lockwood G, Kim JJ, Cummings B, Knox J, Sherman M, Dawson LA. Phase I study of individualized stereotactic body radiotherapy for hepatocellular carcinoma and intrahepatic cholangiocarcinoma. J Clin Oncol. 2008; 26:657–664.

22. Cárdenes HR, Price TR, Perkins SM, Maluccio M, Kwo P, Breen TE, Henderson MA, Schefter TE, Tudor K, Deluca J, Johnstone PA. Phase I feasibility trial of stereotactic body radiation therapy for primary hepatocellular carcinoma. Clin Transl Oncol. 2010; 12:218–225.

23. Price TR, Perkins SM, Sandrasegaran K, Henderson MA, Maluccio MA, Zook JE, Tector AJ, Vianna RM, Johnstone PA, Cardenes HR. Evaluation of response after stereotactic body radiotherapy for hepatocellular carcinoma. Cancer. 2012; 118:3191–3198.

24. Bujold A, Massey CA, Kim JJ, Brierley J, Cho C, Wong RK, Dinniwell RE, Kassam Z, Ringash J, Cummings B, Sykes J, Sherman M, Knox JJ, Dawson LA. Sequential phase I and II trials of stereotactic body radiotherapy for locally advanced hepatocellular carcinoma. J Clin Oncol. 2013; 31:1631–1639.

25. Bush DA, Hillebrand DJ, Slater JM, Slater JD. High-dose proton beam radiotherapy of hepatocellular carcinoma: preliminary results of a phase II trial. Gastroenterology. 2004; 127:5 Suppl 1. S189–S193.

26. Kawashima M, Furuse J, Nishio T, Konishi M, Ishii H, Kinoshita T, Nagase M, Nihei K, Ogino T. Phase II study of radiotherapy employing proton beam for hepatocellular carcinoma. J Clin Oncol. 2005; 23:1839–1846.

27. Hata M, Tokuuye K, Sugahara S, Fukumitsu N, Hashimoto T, Ohnishi K, Nemoto K, Ohara K, Matsuzaki Y, Akine Y. Proton beam therapy for hepatocellular carcinoma patients with severe cirrhosis. Strahlenther Onkol. 2006; 182:713–720.

28. Hashimoto T, Tokuuye K, Fukumitsu N, Igaki H, Hata M, Kagei K, Sugahara S, Ohara K, Matsuzaki Y, Akine Y. Repeated proton beam therapy for hepatocellular carcinoma. Int J Radiat Oncol Biol Phys. 2006; 65:196–202.

29. Fukumitsu N, Sugahara S, Nakayama H, Fukuda K, Mizumoto M, Abei M, Shoda J, Thono E, Tsuboi K, Tokuuye K. A prospective study of hypofractionated proton beam therapy for patients with hepatocellular carcinoma. Int J Radiat Oncol Biol Phys. 2009; 74:831–836.

30. Park HC, Seong J, Tanaka M, Zeng ZC, Lim HY, Guan S, Bae SH, Tak WY. Multidisciplinary management of nonresectable hepatocellular carcinoma. Oncology. 2011; 81:Suppl 1. 134–140.





 PDF
PDF ePub
ePub Citation
Citation Print
Print




 XML Download
XML Download