Abstract
Although every pregnant woman and her physician hope for an easy pregnancy free of complications, complications can occur to a greater or lesser extent, some of which are still considered inevitable. The maternal mortality ratio in the Republic of Korea recently increased from 13.5 per 100,000 live births in 2009 to 17.2 in 2011, along with a noticeable increase, of up to 20%, in the proportion of older pregnant women (>35 years old). In contrast to postpartum bleeding, which has decreased, amniotic fluid embolism and pulmonary embolism, which are closely related to older maternal age and typically considered inevitable, are causing an increasing proportion of maternal mortalities. The neonatal mortality rate, defined the rate of death per 1,000 live births under 28 days of life, was reported to be 1.7 in 2011 in Korea and respiratory distress of newborns accounts for about one third of neonatal deaths. The pre-valence of cerebral palsy (CP) is approximately 2 per 1,000 live-born children and has remained unchanged over recent decades worldwide. Although multiple antenatal factors, including pre-term birth, low birth weight, infection/inflammation, multiple gestation, and other pregnancy com-plications have been frequently associated with CP, the underlying causes of CP remain largely unknown and recent evidence has indicated that birth asphyxia plays a minor role. This review provides information on the contemporary medical understanding of amniotic fluid embolism, pulmonary embolism, meconium aspiration syndrome, and CP, which are generally considered to be 'no-fault accidents' during birth.
건강한 임신과 출산은 모든 여성과 그 가족들의 희망이며 기본적으로 생리적(physiologic)인 과정이다. 그러나 의학적인 관점에서는 임신과 출산에 관련된 병적인(pathologic) 상황이 확률적으로 존재함을 부인할 수 없다. 이러한 과정은 임신부터 출산까지 다양하게 분포하는데 예를 들면 자연유산의 빈도는 10-15%, 태아기형의 빈도는 2-3%, 조산의 빈도는 7-10%, 임신성당뇨 및 임신중독증의 빈도는 각각 약 3-5%, 전치태반 및 태반조기박리의 빈도도 각각 0.5-1%에 달한다. 또한 자궁내태아사망의 빈도도 200분의 1의 확률로 존재하며 이는 영아급사증후군보다 약 6배 높은 수치이다[1]. 한편 출생 후 신생아가 첫 호흡을 시작하는 과정에서 100명 중 1명은 신생아 심폐소생술(neonatal resuscitation)이 필요하다라는 사실은 의학적으로 잘 알려져 있다[2]. 생후 27일 이내의 사망으로 정의되는 신생아 사망의 빈도가 출생아 1,000명의 당 1.7명이고(2011년, 한국) 이 중 신생아 호흡곤란이 약 3분의 1의 원인을 차지한다[3]. 모성사망은 빈도상으로 낮아 출생아 10만 명을 기준으로 하는 모성사망비로 나타내며 우리나라 통계청 보고에 의하면 2009년에 13.5명에서 2011년 17.2명으로 증가하였으며 이러한 원인 중의 하나로 35세 이상의 고령산모의 구성비가 약 20% 증가가 관련된 것으로 분석되었다[3]. 모성사망은 산과적 합병증에 의한 직접모성사망과 기타 내외과적 기저질환에 의한 간접모성사망으로 나누며 직접모성사망이 전체 모성사망의 3분의 2을 차지한다. 최근 우리나라의 직접모성사망의 원인은 상대적으로 출혈 등의 원인이 감소하고 양수색전증, 폐색전증 등 소위 산과적 색전증에 의한 것이 크게 증가하고 있으며 이러한 변화는 미국 등 선진국에서의 변화와 흡사하다. 뇌성마비는 출생아 1,000명당 약 2명 정도로 발생한다[4]. 이와 같이 임신과 출산에 관한 병적인 상황은 확률적으로 존재함에도 불구하고 예를 들면 모성사망과 같이 매우 드문 질환일수록 미리 예측할 수 있는 방법이 없기 때문에 의학적으로는 불가항력적인 상황으로 이해되지만 산모와 보호자의 입장에서는 의료사고의 上皇으로 이해되는 경우가 많아 갈등의 소지가 많다.
필자는 본 의학강좌를 통하여 임신과 출산 관련 대표적인 모성사망, 신생아 사망 중 대표적인 '불가항력 의료사고'로 거론되는 양수색전증, 폐전색증과 태변흡인증후군과 뇌성마비의 병태생리에 대한 의학적인 이해를 돕고자 한다.
양수색전증(amniotic fluid embolism)은 갑작스런 심혈관계허탈(sudden cardiovascular collapse), 의식상태변화, 파종성혈관내응고장애(disseminated intravascular coagulation) 등을 특징으로 하는 치명적인 산과질환이다. 양수색전증은 1926년 Meyer 등이 진통중인 여성이 갑작스럽게 사망한 이후 부검을 통하여 산모의 폐혈관에 태아 debris가 있었음을 관찰하였고 이후 1941년 Steiner와 Lushbaugh에 의하여 진통 중 또는 분만 직후 산모의 사망 이후 부검을 통하여 산모의 폐혈관에서 fetal mucin과 squamous cell이 발견된 경우, 양수색전증으로 기술되었다[5].
양수색전증은 직접 모성사망이 중요한 원인이자, 특히 피할 수 없는(unavoidable) 모성사망의 주요 원인으로 잘 알려져 있다[6]. 양수색전증은 특히 선진국에서 모성사망의 중요한 원인으로 미국에서는 양수색전증이 모성사망 원인의 13.7%를, 캐나다와 호주에서는 각각 10.9%, 13.1%를 차지한다[6]. 한국보건사회연구원 보고에 의하면 2007-2008년도 우리나라의 모성사망의 원인 중 양수색전증이 차지하는 비율은 전체의 11.5%에 해당하였다[7]. 양수색전증의 발생빈도는 미국 보고에 의하면 12,953 분만 당 한 건으로 조사되었다[8].
양수색전증의 발생기전은 아직 밝혀져 있지 않다. 과거에는 양수색전증의 원인으로 양수와 그 내용물이 산모의 정맥으로 들어가 폐순환을 방해함으로써 폐색전증과 같은 저산소혈증, 폐고혈압 및 우심부전이 발생하고 이차적으로 파종성혈관내응고장애와 좌심부전이 발생하는 것으로 생각되었다[13]. 양수색전증으로 사망한 산모의 부검소견에서 다량의 양수 및 그 내용물들이 발견된 사실은 이러한 가설을 지지하였다[14]. 하지만, 동물 실험에서 다량의 양수가 모체 순환계로 주입되어도 해가 되지 않는다고 보고되었고[15] 최근 연구 결과 양수색전증 산모에서 과민증(anaphylaxis)과 연관된 혈청 트립타제(tryptase)와 뇨 히스타민(histamine)이 증가하는 소견이 관찰되었다[16]. 양수색전증 산모의 41%에서 아토피 또는 알레르기의 과거력이 있는 것으로 알려져 있으며 양수색전증의 남아를 분만한 경우 더 많이 발생하는 것으로 나타났다. 이러한 결과를 토대로 Clark 등[10]은 양수색전증이라는 용어 자체가 'misnomer'라고 하였다. 따라서 현재 양수색전증의 병태생리는 양수 및 그 내용물이 모체 순환계로 들어갔을 때 일부 산모에게서 발생하는 불가항력적인 과민반응으로 이해되고 임신 과민반응증후군(anaphylactoid syndrome of pregnancy)으로 불리운다[13].
미국과 캐나다의 3백만 명의 분만을 대상으로 시행한 대규모연구 결과, 공통적으로 밝혀진 양수색전증 발생의 독립적인 위험인자로는 35세 이상 산모, 제왕절개분만, 겸자(forceps) 또는 흡입(vacuum) 분만, 전치태반 및 태반조기박리, 자간증, 태아곤란증(fetal distress) 등이 관련되는 것으로 조사되었다[6]. 한편, 태아곤란증과 수술적 분만의 경우는 양수색전증의 위험인자라기 보다는 분만 전 발생한 양수색전증의 임상 소견일 가능성이 있다. 즉 진통 중 양수색전증이 먼저 발생하여 태아곤란증이 발생하고 이로 인하여 신속한 분만이 필요한 상황이 되어 수술적 분만이 시행된 것일 수 있다는 것이다[6]. 2006년 Lancet에 발표된 연구 결과에서는 양수색전증 발생의 독립적인 위험인자로 양수과다증, 자궁경부열상, 자궁파열이 관련되었다[17]. 유도분만의 시행이 과연 양수색전증의 위험요인인지에 대해서는 논란이 있는데, 캐나다 연구에서는 유도분만을 시행한 경우 자연 진통에 비하여 양수색전증의 발생 빈도가 1.8배 증가(odds ratio [OR], 1.8; confidence interval [CI], 1.3-2.7)된다고 보고된 반면[17], 미국 연구에서는 유도분만은 양수색전증 발생의 독립적인 위험인자가 아닌 것으로(OR, 1.5; CI, 0.9-2.3) 보고되었다[8]. 한편, 양수색전증 발생의 감소와 관련된 요인으로는 산모의 나이가 20세 이하인 경우, 난산(dystocia)이 있었던 경우라고 알려졌다[6].
양수색전증은 진통 중 또는 분만 직후의 산모에게 호흡곤란, 기침, 저산소혈증, 저혈압, 경련, 의식상태 변화 및 파종성혈액내응고장애 및 갑작스런 태아서맥 등의 증상이 나타나면 의심한다. 양수색전증의 전형적인 두 가지 증상은 갑작스런 호흡곤란과 저혈압이나 경기발작(seizure)이 초기증상으로 나타나는 경우도 30%이고 태아서맥이 초기 증상인 경우도 17%에 달한다[10]. 동일한 연구에 의하면 46례의 양수색전증 중 2명을 제외한 대부분이 심장 마비(cardiac arrest) 또는 심각한 심장부정맥(cardiac arrhythmia)의 소견을 보였는데 이 중의 50%에서는 초기 증상이 5분 이내에 발생하여 양수색전증이 얼마나 급격하게 발생하는 산과적 응급상황인지를 보여주었다[10]. 또한 응고장애는 양수색전증의 흔한 증상으로 83%에서 발견되는데 이의 발생 역시 반 수 이상에서 초기 증상이 발현된 지 4시간 이내에 발생한다. 또한 양수색전증의 검사실 소견으로 전혈구검사에서 백혈구의 감소 및 혈색소 감소가 나타날 수 있고, fibrinogen의 감소와 프로트롬빈 및 부분 트롬보플라스틴의 지연이 관찰된다. 양수색전증 진단과 관련하여 혈청 zinc coproporphyrin, sialyl Tn antigen 및 보체에 대한 연구 보고가 있지만, 이들에 대하여는 더 많은 임상연구가 필요하다[6].
양수색전증의 정확한 발생기전은 아직 알려져 있지 않다. 과거에는 양수에 의한 색전이 원인이라고 생각되었으나 최근 연구결과에서는 아나필락시스와 같은 과민반응 및 일종의 면역반응으로 이해되고 있다[16]. 현재로서는 양수색전증을 미리 예측하거나 예방할 수 있는 방법이 없는 상태이고 또한 증상이 급격하게 발생하므로 산모 및 가족에게는 가장 비극적인(catastrophic) 상황임과 동시에 의료진에게도 가장 대표적인 불가항력적인 상황이라고 할 수 있다. 양수색전증의 치료는 산모의 혈압, 산소포화도, 심박출량을 유지하면서 응고장애를 교정하는 지지요법(supportive care)이다. 앞으로 양수색전증의 발생기전에 대한 더 많은 연구가 필요할 것으로 생각된다.
임신 자체가 혈전색전증(thromboembolism)의 위험인자인 것은 이미 잘 알려져 있다. 임신 중에는 비임신 상태에 비하여 혈전색전증의 위험도가 5배 증가하고 분만 후 3개월 이내에는 약 60배 증가한다[19]. 폐색전증(pulmonary thromboembolism)의 빈도는 10,000명 임신 당 5-12명 꼴로 발생하며 산욕기에서 폐색전증의 빈도는 10,000명 당 3-7명 정도로 발생한다[2021]. 임신 중 혈전색전증은 대부분 정맥에서 발생하며, 심부정맥혈전증(deep vein thrombosis)이 75-80%, 폐색전증이 20-25%를 차지하고 미국에서 폐색전증을 포함한 정맥 혈전색전증은 모성사망 원인의 9%를 차지한다고 한다[22].
폐색전증의 증상은 호흡곤란(82%), 흉통(49%), 기침(20%), 실신(14%), 객혈(7%) 등과 같이 비특이적이다. 또한 대부분의 증례에서 저산소혈증을 보이지만 정상 산소포화도가 질환을 배제할 수 없으며, 혈전색전증의 선별검사로 널리 쓰이는 D-dimer 는 임신 중에 상승할 수 있으므로 임신부에서 폐색전증의 진단은 쉽지 않다. 우선적으로 폐색전증이 의심되면 흉부X선검사를 하고, 환기-순환 스캔을 시행하고, 전산화단층촬영 폐동맥조영술을 시행하는 수순이 권고된다.
폐색전증이 심하여 활력징후가 불안정한 경우 심폐우회(cardiopulmonary bypass) 및 색전제거술(embolectomy)을 시행하며 바로 제왕절개술로 분만한다. 활력징후가 안정적인 임산부에게는 헤파린을 투여한다. 비분할헤파린(unfractionated heparin)이 저 분자량 헤파린보다 혈전량(clot burden)을 빠르게 감소시키기 때문에 더 선호되며, 치료는 80 IU/kg을 부여(loading)한 후 aPTT를 감시하면서 18 IU/kg/h 정도로 투여한다[23]. 활력징후가 안정적이고 증상이 미약한 환자에게는 저 분자량 헤파린을 투여할 수 있다.
산후출혈이 개발도상국에서 모성사망의 주원인이라면, 색전증은 선진국에서 모성사망의 주원인이다. 우리나라에서도 산과적 색전증으로 인한 모성사망 건수가 2009년 12건에서 2011년 22건으로 발생이 현저히 증가하고 있는 것으로 조사되었으며 이는 2011년 전체 모성사망 원인의 약 4분의 1에 해당한다[3]. 이러한 변화는 생활습관의 서구화에 따라 활동이 감소하고 비만한 산모가 증가하며, 고령 산모 및 불임환자의 증가, 쌍태임신의 증가, 제왕절개 수술률의 증가 등이 관련되며 앞으로 우리나라에서 폐색전증으로 인한 모성사망은 더욱 증가할 것으로 우려된다. 최근 미국 산부인과학회의 지침에 따르면 35세 이상의 산모 또는 체질량지수가 30으로 비만한 경우 등 폐색전증의 위험도가 중등도로 증가하는 산모에서 제왕절개수술을 시행하는 경우 저 분자량 헤파린 사용 또는 압박스타킹의 사용을 권하고 있으나 이러한 예방적인 조치의 효과에 대한 전향적 연구 결과는 없는 상황이다[24]. 따라서 앞으로 우리나라 실정에 맞는 폐색전증을 예방하기 위한 연구가 진행되어야 할 것으로 생각된다.
태변흡인증후군(meconium aspiration syndrome)은 건강한 만삭아 또는 지연 분만아(postterm infants) 사망의 가장 중요한 원인이다. 태변흡인증후군으로 인한 사망은 주로 중증인 경우 발생하고 사망률은 12%(범위 5-37%)에 이른다[2526]. 미국의 보고에 의하면 매년 25,000-30,000건의 태변흡인증후군이 발생을 하고 이 중 약 1,000건의 신생아 사망이 발생한다[27]. 2002년 Yoder 등[28]의 보고에 의하면 1990년 5.8% 빈도를 보였던 태변흡인증후군이 1997년에는 1.5%로 약 3분의 1로 감소하였는데 이러한 감소에 가장 많이 기여한 요소는 유도분만의 시행으로 41주 이후의 분만이 감소한 것에 기인한다고 한다. 그럼에도 불구하고 태변흡인증후군은 신생아 호흡곤란증 원인의 10%를 차지하고 모든 주산기 사망의 2%를 차지한다[29]. 국내에서 태변흡인증후군의 유병률에 대한 조사는 희박하여 2011년 건강보험심사평가원 자료를 분석한 국내 보고에 의존하자면 우리나라에서 매년 평균 406명의 환자에서 태변흡입증후군의 진단되어 이는 평균 출생 1,000명당 0.92명에 해당하였고 여아보다 남아에서 다소 더 높은 경향이 관찰되었다[30].
양수 내 태변착색(meconium staining in amniotic fluid) 현상은 만삭에서 8-25%로 흔하게 발생하고[273132] 특히 지연임신에서 더욱 증가, 42주 이후에는 23-52%로 높아진다[3334]. 2011년 Balchin 등[35]에 의한 대규모연구 결과에 의하면(n=499,096) 양수 내 태변착색의 빈도는 조산에서 5.1%에 불과한 반면, 만삭에서는 16.5%였고 42주 이상의 지연임신의 경우에는 27.1%로 현저히 증가하였다. 같은 연구에서 양수 내 태변착색의 독립적인 위험인자로써 흑인, 남아시아 인종의 경우가 백인에 비하여 양수 내 태변착색의 위험도가 각각 8.4배, 3.3배 증가하였다. 양수 내 태변착색의 증가와 관련된 기타 위험 인자로는 양수감소증(양수지수<5 cm), 중뇌동맥의 박동지수(pulsatility index)의 감소, 산모의 발열, 아편 또는 아편유사제의 사용, 지연임신에서 목덜미 탯줄(nuchal cord)이 여러 번 있는 경우 등이 있다. 양수 내 태변착색이 thin한 경우에는 thick한 경우와 달리 불량한 주산기 예후와 관련이 없다[36]. 분만 전 양수 내 태변착색이 발생하는 기전으로는 생리적인 호르몬 또는 신경조절 기전에 의하거나, 태아의 장 성숙을 반영하거나 또는 만성적인 저산소증 등 복합적인 것으로 알려져 있다[37].
한편 양수 내 태변착색은 진통 중 태아심박동 이상(fetal compromise)와 관련된 경우도 있지만 아무런 합병증이 없는 진통 과정 후에도 흔히 발생하여 양수 내 태변착색과 태아 저산소증과의 연관성은 일치되지 않는 결과를 보인다[37]. Steer 등[34]과 Baker 등[38]의 연구에 의하면 진통 중 양수 내 태변착색 자체가 태아의 저산소증을 예측하는데 독립적인 위험인자가 아닌 것으로 나타났다. 이러한 이유로는 앞서 언급한 바와 같이 양수 내 태변착색 자체가 만삭분만의 약 5분의 1에서 발생하는 매우 흔한 임상적 상황임을 고려하면 당연한 결과라 할 수 있다. 따라서 진통 중 태아감시의 지침에 따라 양수 내 태변착색이 관찰되는 소견만으로는 의미있는 태아의 심박동의 이상이 동반되지 않는 한, 지속적인 태아심박동 감시(monitoring) 이외의 제왕절개수술의 적응증이 되지 않는다[38].
태변흡인증후군은 양수 내 태변착색이 있는 신생아에서 달리 설명되지 않는 호흡곤란이 발생하는 임상적 상황으로 정의된다[27]. 태변흡인증후군의 호흡기 증상으로는 빈호흡 등의 호흡곤란증, 청색증, 폐의 탄성(compliance)의 감소로 인한 공기걸림(air trapping)등이 있다. 과거에는 태변흡인증후군을 출생 후 4시간 이내에 호흡곤란을 보이면서 흉부방사선 검사에서 coarse, patchy infiltrate, 폐침윤(consolidation), 무기폐, air leak, hyperinflation 등의 특징적인 소견을 보이는 경우로 정의하였다[39]. 그러나, 태변흡인증후군의 임상양상을 보이면서 정상적인 흉부방사선 소견을 보이는 경우도 있는 점 등을 고려하여 최근 Cleary와 Wiswell [40]은 태변흡인증후군을 중증도에 따라 1) 경증의 태변흡인증후군: 40% 농도 이하의 산소를 48시간 이내에서 필요로 하는 경우, 2) 중등도의 태변흡인증후군: 40% 농도 이상의 산소를 48시간 이상에서 필요로 하면서 air leak가 없는 경우, 3) 중증(severe) 태변흡인증후군: 48시간 이상 인공호흡기를 필요로 하면서 지속적인 폐동맥고혈압이 동반되는 경우로 정의하였다.
지속성 폐동맥고혈압(persistent pulmonary hypertension)은 중증 태변흡인증후군의 40%에서 발견되고, 특히 체외순환(extracorporeal membrane oxygenation) 치료를 필요로 했던 중증태변흡인증후군의 75%에서, 신생아 사망에 이른 중증 태변흡인증후군의 100%에서 관찰된다[41]. 반면 지속성 폐동맥고혈압에서 태변흡인증후군이 차지하는 분율은 약 66%이다[42].
지속성 폐동맥고혈압은 출생 후에도 폐동맥의 혈관수축(vasoconstriction)이 지속되면서 R-L shunt(동맥관 또는 난원공을 통한)가 지속되는 것을 특징으로 한다. 이러한 폐동맥의 혈관수축은 폐혈관의 반응성(vasoreactivity)의 증가로 인한 일시적 연축(spasm)을 통해서 올 수도 있고 폐세동맥(pulmonary arteriole) 혈관의 근육비후(hypertrophic muscle)라는 만성적인 변화에 의해서 올 수도 있다.
과연 태변흡인 자체가 지속성 폐동맥고혈압의 원인인지에 대해서는 불확실하다. 과거에는 급성으로 폐로 흡인된 태변이 폐동맥의 고혈압성 반응을 일으키게 되고 지속성폐동맥고혈압의 임상양상을 나타내는 것으로 알려졌으나, 중증 태변흡인증후군으로 출생 후 48시간 이내에 사망한 경우의 100%에서 말단(distal) 폐세동맥의 근육화(muscularization)이라는 '만성적' 변화가 관찰되는 것으로 보고되어[4143] 지속성폐동맥고혈압의 병태생리에 있어서 급성 태변흡인 이외에 다른 요소들이 사망한 신생아들의 호흡기 증상에 관여함을 시사하고 있다. 또한 de novo로 폐세동맥의 근육화가 일어나는데 3-8일이 걸리고[44] 동물실험 결과 태변의 흡입 자체로는 중증 태변흡인증후군에서 발견되는 폐동맥고혈압의 소견이 발생하지 않아[45] 적어도 지속성폐동맥고혈압이 동반된 중증태변증후군에서 태변의 흡입과 폐동맥 고혈압 간의 시간적 인과관계(temporal relationship)는 불분명하다고 결론지을 수 있다[25].
양수 내 태변착색의 가장 중요한 합병증인 태변흡인증후군은 모든 생존아 출생당 1-3%로 발생하는 비교적 흔한 질환이다[46]. 태변흡인증후군은 진통 중 양수 내 태변착색이 있는 경우의 약 11%(범위 2-36%)에서만 발생하고[47] 실제로 양수 내 태변착색이 있었던 경우의 대부분에서는 태변흡인증후군이 발생하지 않는다.
태변흡인증후군은 분만 전 또는 진통 전에도 생길 수 있고 진통 없이 예정된 제왕절개수술로 태어난 신생아에게도 발생할 수 있다[52]. 여러 연구결과에서 중증 태변흡인증후군의 대부분은 자연분만이 아니라 제왕절개수술로 출생한 신생아에서 발생한 것으로 알려졌다[5354]. 실제로 태변흡인증후군의 심한 정도와 진통 중 양수 내 태변착색의 진단으로부터 분만까지 걸리는 시간은 역비례 관계를 보였고[2655], Thureen 등[41]의 연구결과에 의하면 중증태변흡인증후군으로 출생 후 48시간 만에 사망한 경우 태반에서 심한 태변착색의 변화를 보이지 않아 상대적으로 태변에 노출된 시간이 짧음을 보여주었다.
태변흡인증후군이 발생하는 원인은 복합적이며 아직까지 정확한 병태생리가 밝혀져 있지 않지만 지금까지의 연구결과에 의하면 다음의 네 가지 기전이 관여하는 것으로 알려졌다[56]. 첫째, 기도폐쇄, 둘째, 계면활성제의 생성 및 기능 저하, 셋째, 혈관수축제(vasoconstrictors) 또는 염증성 매개인자(inflammatory mediator)에 의한 화학적 폐렴(chemical pneumonitis), 마지막으로 신생아 지속성폐동맥고혈압(persistent pulmonary hypertension of newborn)에 의한 R-L shunt가 있다.
Guinea pigs을 이용한 실험결과에 의하면 태변흡인증후군에서 보이는 폐손상(lung destruction)의 소견은 폐조직에 흡수된 태변의 양과 상관관계를 보이지 않고 분만 당시의 저산소증(hypoxia), 산증(acidosis)의 정도와 연관된다고 알려졌다[57]. 태변흡입증후군을 나타내는 신생아의 68%에서 태아의 심박동 이상이 있었고[58] 약 50%에서는 신생아 산증이 동반되었다고 한다[5859].
최근, 미국 국립보건원(National institute of health)의 Ghidini와 Spong [25]은 경증, 중등도의 태변흡인증후군은 자궁 내에서의 태변흡입에 의하여 발생할 수 있지만 중증 태변흡인증후군은 저산소증뿐만 아니라 밝혀지지 못한 다른 원인들이 복합적으로 작용하는 다인성(multifactorial) 질환으로 두 질환 군이 각각 다른 병태생리를 갖는 질환일 가능성이 있다는 의견을 제시하였다. 이러한 증거로 첫째, 폐로의 흡인된 태변의 양과 태변에 노출된 시간과 태변흡인증후군의 중증도 간의 상관관계가 없다는 많은 연구 결과들과[26394057], 둘째, 흉부방사선 영상의 소견으로 태변흡인증후군의 심한 정도(severity)를 전혀 예측할 수 없다는 점 등을 꼽았다. 또한 이들은 증증 태변흡인증후군의 발생기전에 있어서 폐로의 태변흡입이 보다는 만성적인 가사(asphyxia), 자궁 내 감염이 중요한 역할을 하고, 출생 후 관찰되는 지속성폐동맥 고혈압은 자궁 내 환경에서 이미 진행된 병적인 경과에 의한다는 가설을 제시하였다[25]. 즉, 자궁 내 환경의 만성적 저산소증에 의하여 fetal wasting syndrome이 발생하고, 태반의 허혈성 변화(ischemic change) 및 폐혈관의 증식 및 저산소 반응성 유전자들이 유도되고, 자궁 내 감염에 의해서는 중성구, 대식세포(macrophage) 및 사이토카인의 활성화와 보체반응(complement system)에 의해서 조직의 파괴가 일어나는 태아염증반응증후군(fetal inflam-matory response syndrome)이 중증 태변흡인증후군의 발병 기전에 중요한 역할을 한다는 것이다.
특히 앞서 언급한 바와 같이 태변흡인증후군으로 사망한 신생아에서 관찰되는 말단 폐세동맥의 근육화라는 만성적 변화는 태변흡인증후군의 병태생리의 관점에서 결국 출생 후 태변의 흡입으로 인한 기도의 기계적 폐쇄가 과연 태변흡인증후군의 진행에 핵심적인 역할을 하는지 의문을 갖게 한다[32]. 최근에는 태변흡인증후군에서 발생되는 폐손상이 폐에 국한되지 않고 전신적인 영향을 준다는 연구가설들이 제시되기도 하였으며 폐손상의 기전에 있어서 염증성 또는 비염증성 세포자멸사(apoptosis)가 관여한다는 연구결과도 있다[60]. 결론적으로 태변흡인증후군의 발병기전 및 병태생리는 아직까지 현대의학에서 밝히지 못한 것들이 대부분이다[60].
앞서 언급한 바와 같이 지연임신은 양수 내 태변착색의 독립적인 위험인자이다. 따라서 유도분만을 서두르는 것이 궁극적으로 태변흡인증후군의 발생을 감소시킬 것으로 예상되며 이는 이미 많은 연구들에서 입증된 바 있다[61]. 최근에 발표된 메타분석 결과 41주에 유도분만을 시행하는 것이 기대요법(expectant management)을 하는 것에 비하여 태변흡인증후군의 발생빈도를 57% 감소시키고(RR, 0.43; 95% CI, 0.23-0.79) 주산기사망률을 70% (RR, 0.31; 95% CI, 0.11-0.88) 의미 있게 줄이는 것으로 나타났다[62].
진통 중 태아심박동 모니터는 태변흡인증후군의 위험인자인 태아의 저산소증을 진단하는 방법으로 권장되어왔다. 그러나 실제로 여러 연구들을 종합한 메타분석 결과에서 진통 중 태아심박동 모니터의 사용이 궁극적으로 신생아의 이환과 사망을 감소시킨다는 증거는 없는 것으로 보고되었다[63].
진통 중에 양수를 주입(amnioinfusion)함으로써 태변을 희석시켜 태변흡인증후군의 위험도를 감소시키려는 시도에 대한 많은 연구들이 있었으며 2000년의 메타분석 결과, 이러한 진통 중 양수주입술로 태변흡인증후군의 발생빈도를 의미 있게 감소시킬 수 있다고 보고되었다[64]. 그러나 이후 2005년 New England Journal of Medicine에 발표된 13개의 나라에서 약 2,000명의 산모를 대상으로 한 대규모 전향적 연구 결과, 진통 중 양수 주입은 궁극적으로 태변흡인증후군의 빈도 및 주산기 사망률을 감소시키지 못하였다[65]. 따라서 2006년 미국 산부인과학회의 지침에 따르면 양수 내 태변착색이 있는 경우 태변흡인증후군의 발생을 감소시키기 위하여 일상적(routine)으로 양수주입술을 시행하는 것은 권장되지 않고 있다[66].
역사적으로 1976년 Carson 등에 의해서 양수 내 태변착색이 있었던 태아의 처치에 있어서 태아의 머리가 만출된 후 어깨가 나오기 전에 신생아의 구강(oropharynx) 또는 비강(nasopharyx)을 suction하는 것이 태변흡인증후군의 발생빈도를 줄일 수 있다는 연구결과가 발표된 이후 이러한 처치는 미국산부인과학회 및 미국소아과학회의 지침으로 받아들여져 이후 30년 동안 대부분의 분만장에서 흔히 시행되었다. 그러나 놀랍게도 2004년 Lancet에 발표된 양수 내 태변착색이 있던 신생아 약 2,500명을 대상으로 한 대규모 전향적 연구 결과, suction의 시행이 태변흡인증후군의 발생 및 이로 인한 사망률에 전혀 차이가 없는 것으로 나타나[67] 이제는 더 이상 양수 내 태변착색이 있던 신생아의 '분만 중ʼ 구강 또는 비강 suction이 일상적으로 권고되지 않는다[68].
신생아 심폐소생술 프로그램(neonatal resuscitation program)에 의하면 양수 내 태변 착색이 있었던 경우 출생 후 신생아가 쳐져 있는(non-vigorous) 경우에만 분만 직후 기도 삽관을 통하여 기도 내(endotracheal) 이물질을 흡인할 것을 권장하고[2] vigorous한 경우에는 기도 삽관을 통한 흡인이 필요하지 않고 구강과 비강에 있는 이물질만 bulb syringe 또는 large bore suction catheter를 이용하여 제거하는 것을 권장한다.
산과학과 신생아학의 발전에도 불구하고 태변흡인증후군은 높은 이환 및 사망률을 보이는 불가항력적인 신생아 질환이다. 발병기전의 관점에서는 진통 중 양수 내 태변착색은 만삭의 약 5분의 1에서 발견되는 흔한 경우인 반면 이 중 유독 일부에서 신생아 사망과 연관될 수 있는 태변흡인증후군이 발생하는지는 아직까지 현대의학에서 밝히지 못하고 있다. 역사적으로 태변의 흡입을 감소시키려는 양수주입술과 같은 산과적 처치나 분만 직후 신생아 구강 또는 비강을 suction하는 처치를 통하여 태변의 흡입 자체를 감소시키기 위한 노력들이 태변흡인증후군을 예방할 수 없다는 사실들이 이미 밝혀졌다. 현재까지의 연구결과 태변흡인증후군의 발생을 감소시킬 수 있는 산과적 조치로는 41주 유도분만을 통해 지연임신을 예방하는 것이 유일하고 분만 후 처치로는 출생 직후 태변 착색 양수에서 태어난 신생아가 처져 있는 상태라면 즉시 기도 흡인을 실시하는 방법 이외에 태변흡인증후군을 예방하기 위한 방법은 없다. 한편, 제왕절개분만인 경우에도 태변흡인증후군이 발생할 수 있다는 사실과 신생아 사망률이 높은 중증 태변흡인증후군에서 관찰되는 만성적 폐혈관의 변화는 태변흡인증후군의 발병기전에 있어서 진통 과정 자체가 기여하는 바가 제한적임을 시사한다. 앞으로 태변흡인증후군에 있어서 만성 저산소증, 자궁 내 감염, 기타 태아모체의 스트레스 요인 등의 역할에 대한 연구가 필요하며 이러한 병태생리의 이해가 근간이 되어야 중증 태변흡인증후군을 예방할 수 있는 방법을 찾아낼 수 있을 것으로 기대한다.
뇌성마비(cerebral palsy)의 발생빈도는 생존아 1,000명당 약 2명이며, 최근 40여 년간 전세계적으로 변화하지 않았다[4]. 2006년 뇌성마비의 정의를 재정립하기 위한 국제회의 결과 뇌성마비는 다음과 같이 정의되었다[6970]. “뇌성마비란 발달 중에 있는 태아 또는 영아의 뇌의 비진행성 장애로 인하여 활동에 제한을 주는 운동이 자세의 발달에 영구적 장애를 초래하는 질환의 군으로써 종종 감각, 인지, 지능, 의사소통이나 간질 또는 이차적인 근골격계의 문제로 인한 행동장애가 동반되기도 한다.”
뇌성마비의 진단에서 중요한 것은 이 질환은 단일 질병이 아니라 하나의 질환군이며 그 원인과 임상 양상이 상이한 질환의 집합체라는 점이다[71]. 한편, 뇌성마비의 진단에서 '비진행성'의 의미는 '뇌성마비의 진단이 내려지는 시점 이전에 이미 원인 요인이 발생하였고, 현재 병의 진행 여부에 원인 요소가 더 이상 작동하지 않는다'라는 의미이다. 즉, 신경계에 지속적 활동성 병변이 있다면 이는 뇌성마비의 진단기준에 맞지 않는다. 그러나 실제로 뇌성마비의 기능장애 정도나 임상양상 자체가 시간에 따라서 변할 수 있다는 사실을 고려하여 뇌성마비의 정의에 '영구적'이라는 표현은 환자의 입장에서 지나치게 비관적 예후를 내포하여 바람직하지 않다고 지적된 바 있다[72].
뇌성마비의 진단은 18-24개월에 할 수 있으나 임상증상이 확실한 경우는 보다 조기에 진단할 수 있고 임상증상이 불확실한 경우에는 36개월까지 미룰 수 있다. 전문가들은 뇌성마비의 진단시기를 최소한 생후 24개월 이후로 하는 것이 바람직하다고 권장한다[71]. 그 이유는 생후 18개월에 신경학적인 이상소견을 보여 뇌성마비의 가능성이 있다고 판단되었지만 추후에 정상적인 발달 과정을 보이는 경우가 있기 때문이다. 실제로 이러한 현상은 조산아에서 더 많이 발생하여[73] 전반적으로는 1세 때 신경학적 이상을 보였던 경우의 50%에서 7세에는 정상적인 신경 발달을 보인다고 한다[74]. 또한 18개월에 걷지 못하는 경우로 정의되는 일명 'late walking'은 뇌성마비 환아의 흔한 증상이지만 실제로 late walker의 단 3.5%만이 궁극적으로 뇌성마비로 진단되었다[75].
임상적으로 뇌성마비의 진단은 연령에 따른 앉기, 잡고 일어나기, 걷기 등의 운동 이정표(motor milestone), 자세 및 심부건반사와 근긴장도 등에 대한 검사자에 의한 이학적인 검사 또는 부모의 관찰에 의존한다. 2008년 Paneth [71]는 뇌성마비의 진단이 어려운 이유가 다음의 4가지 원인에 기인한다고 하였다. 첫째, 뇌성마비의 진단 자체가 어떠한 객관적인 검사 결과에 의하여 진단되는 것이 아니라 검사자의 이학적 검사 결과 소견에 의하여 진단이 내려지므로 어느 정도 검사자간 차이(interobserver variability)가 불가피하다. 둘째, 뇌성마비의 임상 양상을 나타내는 신경학적 이상의 형태가 다양하다. 셋째, 뇌성마비의 진단이 이루어지는 연령인 아동기의 아이들은 각각 운동 능력에 차이가 있으므로 경한 정도의 뇌성마비와 다른 신경발달장애를 보이는 질환과의 감별이 어렵다. 넷째, 영유아기의 신경계는 발달 과정에 있기 때문에 다양한 운동 이상이 일시적으로 나타난 것일 수 있고 이후에 뇌성마비로 진행하지 않는 경우도 있다. 따라서 너무 이른 시기에 진단이 이루어지는 경우에는 진단의 실수가 있을 수 있다.
뇌성마비에서 나타나는 운동장애의 특성에 따라서 강직성(spastic), 실조성(ataxia), 근긴장이상(dystonia), 아테토시스(athetosis)의 형태로 나누고, 운동장애의 침범 부위에 따라서 양측 마비(diplegic), 편마비(hemiplegic), 사지마비(quadriplegic)로 구분한다.
뇌성마비의 형태는 뇌성마비의 원인인자에 따라서 다르게 나타난다. 예를 들어 만삭아에서의 뇌성마비는 편마비 또는 사지마비인 경우가 대부분이고 조산아의 경우에는 양측마비인 경우가 흔하다. 편마비성 뇌성마비의 가장 흔한 두 가지 원인은 주산기 뇌졸중(perinatal stroke)과 선천성 뇌기형이다. 강직성 양측 마비는 조산아에서 더 흔하지만 만삭아에서도 나타날 수 있다[76]. 한편, 전반적인 저산소성 허혈성 뇌손상 이후에 발병한 뇌성마비의 형태는 주로 강직성 사지마비의 형태로 나타난다.
뇌성마비는 하나의 병이 아닌 질환군 또는 증후군으로 뇌성마비의 임상양상이 다른 질환의 일부로 나타날 수 있다. 특히 대뇌의 백질을 침범하는 신경계의 진행성 질환들(예를 들면 유전성 백색질장애) 와의 감별이 중요하며 이는 검사실 결과를 통해서 이루어진다. 뇌성마비의 일부는 유전적 또는 대사성 질환에 의해서 발생하는데 이러한 질환은 확진하기 위한 검사 비용이 매우 고가(高價)로 안타깝게도 어떠한 경우에 이러한 검사들을 시행하는 것이 바람직한지에 대한 만족스러운 알고리즘은 없는 상태이다[71].
뇌는 그 발달 과정에서 자극이 가해지는 시기에 따라 특정한 유형의 병변을 나타내게 된다. 즉, 임신 전반부는 신경전구세포의 증식 및 이동이 일어나므로 이 시기의 유전적 또는 후천적 손상에 의해서는 주로 뇌발육불량(brain mal-development)이 나타난다. 한편 임신 중반기 이후에는 신경세포의 성장 및 분화가 주로 이루어지며 이는 출생 후로 이어진다. 따라서 이 시기의 감염성 또는 허혈성 자극들은 신경세포의 발달에 영향을 미치게 되고 결과적으로 임신 3분기 초기의 조산아에서는 뇌실주위백질연화증(periventricular leukomalacia)이 주로 발생한다. 또한 만삭아는 대뇌피질 또는 심부회백질(basal ganglia, thalamus)이 자극에 취약하다. 따라서 자기공명영상(magnetic resonance imaging, MRI) 검사는 뇌성마비의 원인이 제공된 시간을 이해하는데 도움이 된다[777879]. 최근 MRI 검사의 유용성은 증가하고 있으며 과거에는 뇌성마비의 진단에 컴퓨터단층촬영 또는 MRI와 같은 뇌영상검사가 일반적으로 시행되지 않았으나 2004년 미국신경과학회(American Academy of Neurology)에서는 모든 뇌성마비에 대해서 뇌영상검사를 시행할 것을 권장했다[80]. 2008년 Korzeniewski 등[81]의 보고에 의하면 전체 뇌성마비 환아의 85%에서 뇌의 이상소견이 발견되었고 가장 흔한 뇌영상 소견으로 뇌실주위(periventricular region)의 백질소실(white matter loss)이었고 신경세포이동이상(neuronal migration disorder)과 같은 뇌의 선천성 기형도 전체 뇌성마비의 10-15%를 차지하였다. 2006년 미국의 Wu 등[82]이 보고에 의하면 36주 이후에 분만된 뇌성마비 환아(n=377명)의 뇌 MRI 소견에서 가장 흔하게 발견되는 이상은 국소적 동맥경색(focal arterial infarction)으로 22%를 차지하였고 뇌기형(brain malfor-mation) 14%, 뇌실주위백질이상(periventricular white matter abnormalities)이 12%, 뇌위축(brain atrophy)이 7%를 차지하였으며 저산소성 허혈성 뇌손상(hypoxic ischemic brain injury)을 보인 경우는 5%에 불과하였다. 또한 정상소견을 보이는 경우도 31%였다. 이 연구는 미국에서 1991년부터 2002년까지 10여 년에 걸쳐 이루어진 코호트연구로서 결국 이 연구결과를 통하여 만삭아에서 발생한 뇌성마비 중 분만과정과 관련이 있다고 말할 수 있는 최소한의 조건이라고 할 수 있는 저산소성 허혈성뇌손상은 전체 뇌성마비 환아의 단 5%에서만 관찰됨이 밝혀졌다[82].
Ashwal 등[80]이 제안한 뇌성마비 환아의 원인을 찾기 위한 평가 과정에 따르면, 뇌성마비의 진단 초기에 뇌에 대한 영상검사를 시행하여 뇌 병변의 종류나 선천성 뇌기형의 종류를 파악한다. 병력이나 영상검사에서 원인이 밝혀지지 않는 경우는 대사성질환과 유전질환에 대한 검사를 시행한다. 또한 편마비의 소견이 있는 뇌성마비의 경우에는 응고이상에 대한 검사를 고려해야 한다. 모든 뇌성마비의 환아는 지적장애에 대한 검사와 안과검사, 청력검사를 시행해야 하고 말하기와 언어장애, 영양상태 및 성장에 대한 모니터가 필요하다.
지금까지 알려진 뇌성마비의 임신 전 요인으로는 산모의 나이(20세 이하, 35세 이상), 다산부, 초임부, 두 임신 사이의 기간이 매우 길거나 짧은 경우, 자궁 내 태아사망의 과거력, 낮은 사회 경제적 수준, 간질, 당뇨, 갑상선질환, 자가면역질환, 응고질환과 같은 산모의 질환이 있다[83]. 또한 신생아가 남아인 경우, 산모가 불임치료를 받은 경우도 뇌성마비의 위험인자로 알려졌으며 흑인에서 뇌성마비의 발생빈도가 증가한다는 연구결과도 있다[8283]. 뇌성마비의 임신 후 위험요인으로는 선천성기형, 조산, 다태임신, 임신중독증이나 태반조기 박리와 같은 임신 관련 합병증, 자궁 내 태아 발육지연, TORCH와 같은 바이러스 질환, 자궁 내 감염, 임상적 또는 조직학적 융모양막염 등이 있다. 이러한 여러 가지 위험 요인들은 뇌성마비의 발생에 복합적 원인으로 작용하는 경우가 많다.
전체 뇌성마비 환아에서 자궁 내 태아 발육 지연(fetal growth restriction, 10 백분위수 미만)이 차지하는 비율은 19.1%이다[86]. 이와 같이 자궁 내 태아 발육 지연은 뇌성마비의 주요 원인으로 여겨지나 태아 성장지연 자체에 의한 뇌손상뿐만 아니라 태아 성장지연을 유발하는 다른 요인에 의한 뇌손상의 가능성을 먼저 고려해야 한다. 예를 들면, 염색체 이상을 가진 경우 성장지연과 신경학적 발달장애를 동반할 수 있고 그 밖에 선천성 감염, 산모의 약물복용, 음주, 흡연 등의 여러 가지 원인으로 성장지연과 신경발달의 장애가 초래될 수 있다[87]. 만성적인 태반관류장애가 있는 경우 지속적인 저산소증을 유발하여 태아 성장지연과 신경학적 손상을 초래할 수 있으나 이의 기전을 아직 명확히 밝혀져 있지 않다. 2006년 미국의 대규모 연구에서 만삭에 분만된 뇌성마비 환아에 있어서 심한 자궁 내 태아 발육 지연이 동반될 경우 뇌성마비의 발생 빈도가 4.3배 증가하였다[82].
미국의 인구기반연구(population based study)에서 2,500 gm 이상으로 출생한 뇌성마비 환아 중 저산소증과 관련된 분만합병증이 있었던 경우는 6%에 불과하였으며[89] 전체적으로 주산기 가사(birth asphyxia)에 의한 뇌성마비의 발생빈도는 약 12,500명 중의 한 명으로 보고되었다[90]. 또한 이러한 주산기 가사에 의한 뇌성마비의 발생빈도는 최근 수 십 년간 꾸준히 감소되어 왔다[91]. 한편 Graffney 등[92]의 연구에 의하면 37주 이상의 만삭분만으로 태어난 210명의 뇌성마비 환아 중 분만 중의 예방 가능한 원인에 의한 경우는 26명으로 약 10%에 불과한 것으로 나타났다.
역사적으로는 주산기 가사를 줄여서 뇌성마비의 발생빈도를 감소시킬 목적으로 1970년대부터 진통 중 태아 심박동 전자감시가 널리 사용하게 되었고 그 결과 미국에서의 제왕절개 수술률은 5%에서 25%로 급증하였으나 같은 기간동안 뇌성마비의 발생빈도는 전혀 감소하지 않았으며[93] 오히려 만삭에서 제왕절개 수술이 급증했는데 불구하고 뇌성마비의 빈도는 증가되었다[94]. 실제로 미국 캘리포니아에서 1991년부터 2000년까지 10년 동안 500만 명 이상의 코호트를 대상으로 한 연구에서 주산기 가사의 빈도는 1,000명의 생존아 출생당 14.8명에서 1.3명으로 90% 감소되었으나 같은 기간에 뇌성마비 발생률에는 전혀 감소되지 않았다[9596]. 이와 같은 연구결과는 뇌성마비의 병태생리학적 원인 중 주산기 가사가 차지하는 비율이 매우 낮음을 시사한다. 또한 태아 심박동 전자감시가 과연 신생아의 뇌손상을 감소시키는가에 대한 주요 연구들을 종합한 메타분석 결과에서도 진통 중 태아 심박동 모니터를 하는 것은 신생아 제대혈의 염기부족(base deficit)와 상관 관계가 있고 신생아 발작(neonatal seizure)의 빈도를 감소시키는 것은 사실이지만 전체적으로 주산기 사망률이나 뇌성마비 등 소아 신경학적 이환을 전혀 감소시키지 못했다고 결론지었다[97]. 진통 중 태아 심음 감시 장치의 가장 큰 문제점은 진통의 시작 이전에 이미 손상된 태아를 underestimation하는 반면 진통기간 동안에 손상가능성이 있는 태아는 overestimation한다는 것이다[98].
중요한 것은 주산기 가사가 뇌성마비와 연관되었다라고 주장을 하기 위해서는 신생아는 출생 후 신생아 뇌병증(neonatal encephalopathy)의 소견이 있어야 한다[99]. 즉, 전반적인 저산소성 허혈상태(global hypoxia-ischemia)이 있었으나 신생아기에 신생아 뇌병증의 소견이 없었다면 저산소성 허혈상태는 추후 뇌성마비 발생의 원인이 되지 않는다[97]. 또한 전반적 저산소성 허혈상태는 편마비 또는 양측마비성 뇌성마비와는 관련이 없다.
결국 수십 년 동안의 여러 임상역학연구를 통하여 얻은 의학적인 지식 및 근거를 바탕으로 하여 2003년 미국산부인과학회(American College of Obstetricians and Gynecologists)와 미국소아과학회(American Academy of Pediatrics)에서는 분만 중 저산소증이 뇌성마비의 발생과 관련이 있다고 정의하기 위한 필수 조건으로 다음의 네 가지 조건을 모두 만족시켜야 한다고 한다고 결론지었다[100]. 첫째, 분만 당시 제대혈의 pH 7.0 이하의 대사성산증이 있으면서 염기부족이 12 mmol 이상인 경우, 둘째, 분만 주수가 34주 이상이면서 분만 후 24시간 이내에 신생아가 중등도 혹은 중증의 저산소성 허혈성 뇌손상의 증상을 보이는 경우, 셋째, 뇌성마비의 유형 중 경직성 사지마비(spastic quadriplegic) 혹은 사지이상운동 형태(dyskinetic type)의 뇌성마비의 소견이 있는 경우, 넷째, 원인을 알 수 있는 다른 인자들, 예를 들면 외상, 혈액응고질환, 감염, 유전성질환으로 인한 것이 아님이 확인이 된 경우이다.
한편, 이러한 정의는 미국의 질병관리본부(Centers for Disease Control), 소아신경학회(Child Neurologic Society), 미국 국립보건원(National Institute of Health)뿐만 아니라 호주뉴질랜드산부인과학회(The Royal Austrian and New Zealand College of Obstetrics and Gynecologists), 캐나다 산부인과학회(Society of Obstetrics and Gynecologists of Canada)의 공식적인 지지를 받은 바 있다[100].
신생아 뇌병증(neonatal encephalopathy)의 발생빈도는 만삭아 1,000명당 1-6명의 빈도로 발생한다[100]. 신생아 뇌병증이란 대개 만삭아에서 출생 후 며칠 이내에 신생아가 호흡, 근긴장도 및 반사(reflex)를 유지하는 데 어려움이 있으면서 의식저하 또는 경기발작(seizure) 등이 나타나는 임상적 증후군이다. 신생아 뇌병증의 70%가 분만전 요인에 의하여 발생한다. 2005년 호주에서 발표된 인구기반연구에 따르면 뇌성마비 환아의 24%에서만 신생아기에 신생아 뇌병증의 소견이 있었고 나머지 4분의 3은 신생아기의 이상이 없는 것으로 나타났다. 또한 신생아 뇌병증 생존아의 13%에서만 뇌성마비가 발생하였다[101]. 신생아 뇌병증 발생의 빈도를 의미 있게 증가시키는 임신 전 요인, 분만 전(antepartum) 및 분만 시(intrapartum) 요인을 Table 4에 인용하였다[102].
주산기 뇌졸중(neonatal stroke or perinatal stroke)은 주산기(즉 태아기 또는 신생아기에)에 발생하는 허혈성 뇌졸중을 의미하며, 병리학적 또는 영상의학적으로 뇌의 국소동맥경색(focal arterial infarct)의 증거가 발견되는 경우로 정의된다. 주산기 뇌졸중은 신생아 4,000명 당 1명의 빈도로 발생하고 출생 후 뇌성마비나 신생아 발작으로 이어진다[104]. 최근 인구기반연구 결과에서 만삭분만의 2,300분의 1에서 일측성 주산기 뇌졸중이 발견되었다고 보고된 바 있어[105] 주산기 뇌졸중이 드물지 않은 질환임을 짐작할 수 있다. 실제로 주산기라는 시기는 성인에서 발생하는 허혈성 뇌졸중과 비슷한 정도의 혈전 발생위험을 갖고 있으며 이는 소아기의 뇌졸중의 발생에 비하면 17배 높은 수치이다[104].
주산기 뇌졸중은 신생아의 근긴장저하, 무호흡, 신생아 경련 등의 비특이적인 증상으로 나타나는 경우가 많고 초음파 검사로는 진단이 되지 않는 경우도 많다. Ramaswamy 등[106]은 만삭의 신생아 뇌병증의 5%에서 주산기 허혈성 뇌졸중이 발견되었다고 보고하였다. 주산기 허혈성 뇌졸중의 발병이 과연 어느 시기에 오는 것인가에 대해서는 원인불명인 경우가 많다. 산과적으로 중요한 점은 주산기 허혈증의 발병이 분만(또는 진통)의 이전에 이루어진 경우라도 이를 산전에 진단하는 것은 불가능하기 때문에 '주산기 가사'의 증상과 같이 신생아가 쳐지는 증상(neonatal depression)으로 나타나는 날 수 있다라는 점이다.
주산기 허혈성 뇌졸중은 만삭분만된 편측성 뇌성마비 환아의 가장 흔한 원인이다[104]. 주산기에 허혈성 뇌졸중이 호발하는 이유는 ① 태아 혈액의 높은 점도와 ② 임신으로 인한 전반적인 항응고체계의 억제 상태 및 ③ 태반의 낮은 혈류 속도로 인하여 혈전이 잘 형성되기 때문이다. 덧붙여 ④ 산모의 유전적 또는 후천적 혈전 성향증(thrombophilia)은 태반형성 과정에 영향을 미치고 태반의 혈관손상을 일으키며 태아혈관에서 혈액응고를 초래한다. 주산기 뇌졸중의 위험 요인으로 불임치료의 과거력이 있는 경우 발생빈도가 7.5배 증가하고, 전자간증이 있는 경우 5.3배, 조기양막파수가 동반된 경우 3.8배, 융모양막염이 있는 경우 3.4배 증가한다[107]. 기타 주산기 허혈성 뇌졸중에 대한 자세한 내용은 국내 연구진에 의한 종설을 참고하기 바란다[108].
단태아에 비해 다태아에서 뇌성마비의 위험이 높다는 사실은 이미 잘 알려져 있다. 전체 뇌성마비 환아 중에서 쌍태임신의 차지하는 빈도는 12% 정도이며 최근 보조생식술 및 이에 따른 다태 임신(multiple pregnancy)의 증가로 인하여 이는 앞으로 더 증가될 가능성이 있다. 쌍태아는 단태아보다 5배, 삼태아인 경우에는 단태아보다 13배 정도로 뇌성마비의 위험이 증가한다[107]. 다태아의 뇌성마비의 빈도가 증가하는 것은 저체중 출생과 조산의 빈도가 증가하기 때문으로 생각된다. 쌍태임신에서 일측 태아나 영아사망은 뇌성마비의 위험 요인이며 같은 성별의 태아인 경우 다른 성별의 태아인 경우보다 뇌성마비의 위험이 약 2배 가량 증가되며 또한 보조생식술에 의해서 뇌성마비의 발생이 약 8% 증가한다는 미국의 연구결과도 있다[109].
1999년 Kraus와 Acheen [110]는 뇌성마비로 소송 중인 15건 중 11개의 태반에서 태아 혈관 내에 혈전이 발견되었다는 사실을 보고하면서 뇌성마비의 발생에 있어서 태아 혈전성 병변(fetal thrombotic vasculopathy, FTV)의 중요성이 강조되기 시작하였다. 2005년 Redline [111]은 125명의 신생아 뇌병증 또는 뇌성마비로 의료소송과 관련된 만삭아의 태반병리(placental pathology) 검사 결과, 태반의 여러 가지 태아혈관병변(fetal thrombotic vasculopathy, chronic villitis with obliterative vasculopathy, chorioamnionitis with severe fetal vasculitis, meconium associated fetal vascular necrosis)이 50% 이상으로 정상아의 태반의 10%에 비하여 현저히 증가함으로 보고하였다. 이러한 연구결과를 토대로 Redline [112]은 뇌성마비와 연관이 있는 태반의 병리학적 소견 및 그 분류를 체계적으로 정리하였다(Table 5).
한편, 뇌성마비와 태반병리와 관계에 대한 연구에서 중요한 부분은 신생아 뇌병증과 관련된 태반병리 소견의 상당한 부분이 만성 또는 아급성으로 발생하는 병변이라는 것이다. 예를 들면 뇌성마비 환아의 태반에서 가장 흔하게 발견되는 소견인 태반의 태아혈전염증성반응(fetoplacental thromboin-flammatory processes) 중 fetal thrombotic vasculopathy와 chronic villitis with obliterative fetal vas-culopathy는 분만의 수 주 전에 시작되어 분만 시까지 서서히 진행하는 특징을 가지고 있다. 나머지 태아측 혈관 병변인 chorioamnionitis with severe fetal vasculitis와 meconiumassociated fetal vascular necrosis는 분만 수 일 이전부터 발생하는 아급성 변화로 정상적인 분만의 과정에서 발생할 수 있는 병변의 과장된 형태로 이해되며 심한 정도 및 태아 혈관측의 파괴정도에 따라서 정상과 구분된다.
결론적으로 최근 10여 년간 뇌성마비와 태반병리와의 관련성에 대한 연구결과, 태반의 태아혈전염증성반응이나 모체혈관저관류(maternal vascular underperfusion)와 같은 만성 또는 아급성 병리가 이후의 뇌성마비의 발생과 관련이 있다는 중요한 사실들이 밝혀지고 있다. 이러한 태반병리에 관한 연구는 분만진통과 관련된 의료소송에서 의료진에게 중요한 자료로 제공될 수 있을 뿐만 아니라 뇌성마비의 다양한 병태생리를 이해하는데 중요한 열쇠를 쥐고 있을 것으로 생각된다.
스웨덴의 국가데이터베이스에 의하면 한 가족 안에서 뇌성마비의 발생빈도가 증가한다고 한다[113]. 뇌성마비 발생의 위험인자인 조산, 태반조기박리, 임신중독증 등 자체가 유전적인 소인과도 관련이 있다는 사실을 고려하면 뇌성마비의 발생에 유전적인 요인이 관여할 가능성이 있다. 한편, 주산기 뇌졸중의 대표적인 위험인자인 혈전성경향(thrombophilia)의 경우 흔히 유전성으로 발병한다. 뇌성마비와 발생과 관련이 있다고 알려진 유전자 변이(genetic variants)로는 염증성 싸이토카인과 유전자 및 apolipoprotein E variant가 있으며[114115] 최근 nitric oxide synthase의 변이가 뇌성마비의 위험도를 증가시킨다는 연구결과들이 발표되었다[116]. 뇌성마비의 유전학적 요인에 대한 연구결과를 고려하면 결국 뇌성마비라는 것이 여러 가지 유전자들이 위험도에 관여하고 유전자와 환경과의 상호작용에 의해서 발생하는 복잡한 질환으로 이해된다.
위에 제시된 많은 임상적, 역학적 연구결과를 통하여 이제 대부분의 뇌성마비는 분만 과정 자체가 아닌 태아의 발달 과정이나 분만 후 신생아기의 다인자성(multifactorial) 요인에 의하여 발생하고 이를 막을 수 없다는 사실들이 밝혀지면서 뇌성마비의 분만과정 자체와 연관성은 과거에 생각했던 것보다 현저하게 적다 것이 알려졌다[91102117118119120]. 특히 뇌성마비의 발생 원인으로 중요한 두 가지가 밝혀졌는데, 첫 번째는 주산기 감염 또는 자궁 내 감염이 뇌병변을 일으킬 수 있다라는 것이고, 두 번째는 응고성 인자(prothrombotic factor) 또는 다른 요인들에 의한 주산기 뇌졸중이 선천성 편마비성 뇌성마비의 원인으로 작용한다는 것이다.
역사적으로는 분만 시의 급성적인 변화로 인한 주산기 가사 등으로 인하여 대부분의 뇌성마비가 발생할 것이라는 19세기 중반의 한 정형외과 의사 Little의 잘못된 가설로 인하여[121] 주산기 가사를 진단하기 위한 전자 태아 심박동 감시의 사용이 보편화되었고 이에 따라 불필요한 제왕절개 수술의 급증하게 되었다. 그럼에도 불구하고 정작 뇌성마비의 발생빈도는 전혀 감소하지 않았고 오히려 출산 관련 의료소송(childbirth litigation) 산업이 시작되었을 뿐이다[122]. 이러한 결과는 대부분 뇌성마비의 발병이 분만 진통 과정의 몇 시간에 이루어지는 것이 아니라 7,000시간의 긴 자궁 내 환경과 관련된 것이라는 증거이다[123].
다행이 최근 수십 년의 연구결과 결국 뇌성마비의 70-80%의 원인이 산전 원인에 기인한다라는 사실이 밝혀지고[83] 또한 분만 중 저산소증이 뇌성마비의 발생과 관련이 있다고 정의하기 위한 필수 조건들이 확립됨에 따라 뇌성마비의 불가항력성에 대한 의학적 이해는 가능하게 되었으며 이러한 근거 중심의 의학적 이해를 바탕으로 하여야만 뇌성마비의 발생을 예방할 수 있는 방법이 제시될 수 있을 것으로 생각된다.
임신과 출산에 관한 병적인 상황은 확률적으로 존재함에도 불구하고 예를 들면 모성사망과 같이 매우 드문 질환일수록 미리 예측할 수 있는 방법이 없기 때문에 의학적으로는 '불가항력적'인 상황으로 이해되지만 산모와 보호자의 입장에서는 '의료사고'의 상황으로 이해되는 경우가 많아 갈등의 소지가 많다. 이러한 '불가항력적 상황'에서 본 종설에서 제시하고 있는 바와 같이 양수색전증, 폐전색증과 태변흡인증후군과 뇌성마비의 병태생리에 대하여 의학적으로 이해하려는 노력이 필요하다.
논문은 분만과 관련하여 대표적인 의료사고로 거론되는 질환인 양수색전증, 폐색전증, 태반흡인증후군, 뇌성마비에 대하여, 최근까지의 임상적, 역학적 연구결과를 토대로 이들 질환 발생이 가진 불가항력적 특징을 이해할 수 있게 해주는 논문이다. 과거 오랜 기간 동안의 잘못된 가설과 편견 덕분에 뇌성마비를 포함한 분만 관련 질환들이 모두 분만 과정에서 발생하는 것이라는 오해를 낳아왔고, 이런 오해는 일반인들에게도 정설처럼 생각되어져 왔다. 하지만 최근까지의 많은 수의 연구결과를 바탕으로 이 질환들은 발생자체가 불가항력적 특징을 가지고 있다는 것을 체계적으로 명확하게 기술하였다. 최근 의료사고를 해결하기 위한 제도 마련이라는 명목으로 제정-시행되고 있는 '의료분쟁조정법'에서도이러한 불가항력적 질병에 대한 재고가 있어야 할 것으로 생각된다.
[정리: 편집위원회]
Figures and Tables
Table 1
Diagnostic criteria used for the United States and the United Kingdom registries for amniotic fluid embolism

Modified from Stafford I, et al. Obstet Gynecol Clin North Am 2007;34:545-553 [18].
Table 2
Risk factors for venous thromboembolism in pregnancy with adjusted odds ratios compared with women without the risk factor

Modified from Gray G, et al. Best Pract Res Clin Obstet Gynaecol 2012;26:53-64 [23].
Table 3
Odds ratios for cerebral palsy according to gestational age at birth, stratified for year of birth, maternal age, parity, and smoking habits

Modified from Thorngren-Jerneck K, et al. Obstet Gynecol 2006;108:1499-1505 [85].
Table 4
Risk factors from before conception, antepartum, and intrapartum period for newborn encephalopathy
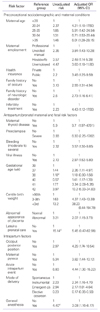
Modified from Badawi N, et al. BMJ 1998;317:1549-1553 [102].
OR, odds ratio; CI, confidence interval.
a)Not significant.
Table 5
Subcategories of placental pathology relevant to cerebral palsy

Modified from Redline RW. Clin Perinatol 2006;33:503-516 [112].
Acknowledgement
We are grateful to Dr. Yun Sil Chang (Department of Pediatrics) and Dr. Jeong-Yi Kwon (Department of Physical and Rehabilitation Medicine) from Samsung Medical Center, Sungkyunkwan University School of Medicine for review of this manuscript in regard to meconium aspiration syndrome and cerebral palsy, respectively.
References
1. Balayla J, Azoulay L, Abenhaim HA. Maternal marital status and the risk of stillbirth and infant death: a population-based cohort study on 40 million births in the United States. Womens Health Issues. 2011; 21:361–365.

2. Kattwinkel J. American Academy of Pediatrics. American Heart Association. Textbook of neonatal resuscitation. 6th ed. Elk Grove Village: American Academy of Pediatrics;2011.
3. Statistics Korea. Statistical report of cause of death in Korea in 2009-2011. Daejeon: Statistics Korea;2012.
4. Oh SY. Current opinion of cerebral palsy. Korean J Obstet Gynecol. 2007; 50:1191–1204.
5. Steiner PE, Lushbaugh CC. Maternal pulmonary embolism by amniotic fluid as a cause of obstetric shock and unexpected deaths in obstetrics. JAMA. 1941; 117:1245–1254.
6. Conde-Agudelo A, Romero R. Amniotic fluid embolism: an evidence-based review. Am J Obstet Gynecol. 2009; 201:445e1–e13.

7. Choi JS, Seo K, Lee NH, Lee SW, Lee SW, Shin CW, Bu YK. 2007-2008 Infant and maternal mortality analysis. Seoul: Mini-stry of Health and Welfare;2010.
8. Abenhaim HA, Azoulay L, Kramer MS, Leduc L. Incidence and risk factors of amniotic fluid embolisms: a population-based study on 3 million births in the United States. Am J Obstet Gynecol. 2008; 199:49.e1–49.e8.

10. Clark SL, Hankins GD, Dudley DA, Dildy GA, Porter TF. Amniotic fluid embolism: analysis of the national registry. Am J Obstet Gynecol. 1995; 172:1158–1167.

11. Gilbert WM, Danielsen B. Amniotic fluid embolism: decreased mortality in a population-based study. Obstet Gynecol. 1999; 93:973–977.

13. Williams J, Mozurkewich E, Chilimigras J, Van De Ven C. Critical care in obstetrics: pregnancy-specific conditions. Best Pract Res Clin Obstet Gynaecol. 2008; 22:825–846.

14. Steiner PE, Lushbaugh CC. Landmark article, Oct. 1941: maternal pulmonary embolism by amniotic fluid as a cause of obstetric shock and unexpected deaths in obstetrics. By Paul E. Steiner and C. C. Lushbaugh. JAMA. 1986; 255:2187–2203.

15. Adamsons K, Mueller-Heubach E, Myers RE. The innocuousness of amniotic fluid infusion in the pregnant rhesus monkey. Am J Obstet Gynecol. 1971; 109:977–984.

16. Benson MD, Kobayashi H, Silver RK, Oi H, Greenberger PA, Terao T. Immunologic studies in presumed amniotic fluid embolism. Obstet Gynecol. 2001; 97:510–514.

17. Kramer MS, Rouleau J, Baskett TF, Joseph KS. Maternal Health Study Group of the Canadian Perinatal Surveillance System. Amniotic-fluid embolism and medical induction of labour: a retrospective, population-based cohort study. Lancet. 2006; 368:1444–1448.

18. Stafford I, Sheffield J. Amniotic fluid embolism. Obstet Gynecol Clin North Am. 2007; 34:545–553.

19. Pomp ER, Lenselink AM, Rosendaal FR, Doggen CJ. Pregnancy, the postpartum period and prothrombotic defects: risk of venous thrombosis in the MEGA study. J Thromb Haemost. 2008; 6:632–637.

20. Andersen BS, Steffensen FH, Sorensen HT, Nielsen GL, Olsen J. The cumulative incidence of venous thromboembolism during pregnancy and puerperium: an 11 year Danish population-based study of 63,300 pregnancies. Acta Obstet Gynecol Scand. 1998; 77:170–173.

21. Heit JA, Kobbervig CE, James AH, Petterson TM, Bailey KR, Melton LJ 3rd. Trends in the incidence of venous thromboembolism during pregnancy or postpartum: a 30-year population-based study. Ann Intern Med. 2005; 143:697–706.

22. James A. Committee on Practice Bulletins-Obstetrics. Practice bulletin no. 123: thromboembolism in pregnancy. Obstet Gynecol. 2011; 118:718–729.
23. Gray G, Nelson-Piercy C. Thromboembolic disorders in obstetrics. Best Pract Res Clin Obstet Gynaecol. 2012; 26:53–64.

25. Ghidini A, Spong CY. Severe meconium aspiration syndrome is not caused by aspiration of meconium. Am J Obstet Gynecol. 2001; 185:931–938.

26. Hernandez C, Little BB, Dax JS, Gilstrap LC 3rd, Rosenfeld CR. Prediction of the severity of meconium aspiration syndrome. Am J Obstet Gynecol. 1993; 169:61–70.

27. Fanaroff AA. Meconium aspiration syndrome: historical aspects. J Perinatol. 2008; 28:Suppl 3. S3–S7.

28. Yoder BA, Kirsch EA, Barth WH, Gordon MC. Changing obstetric practices associated with decreasing incidence of meconium aspiration syndrome. Obstet Gynecol. 2002; 99:731–739.

29. Qian L, Liu C, Zhuang W, Guo Y, Yu J, Chen H, Wang S, Lin Z, Xia S, Ni L, Liu X, Chen C, Sun B. Chinese Collaborative Study Group for Neonatal Respiratory Diseases. Neonatal respiratory failure: a 12-month clinical epidemiologic study from 2004 to 2005 in China. Pediatrics. 2008; 121:e1115–e1124.

30. Choi HJ, Suh HS, Hahn S, Lee J, Park BJ, Lee SM, Kim HS, Bae CW. The burden of illness for meconium aspiration syndrome and cost prediction related to surfactant therapy for meconium aspiration syndrome in Korea. J Korean Med Assoc. 2011; 54:549–556.

31. Locatelli A, Regalia AL, Patregnani C, Ratti M, Toso L, Ghidini A. Prognostic value of change in amniotic fluid color during labor. Fetal Diagn Ther. 2005; 20:5–9.

32. Ross MG. Meconium aspiration syndrome: more than intrapartum meconium. N Engl J Med. 2005; 353:946–948.

33. Usher RH, Boyd ME, McLean FH, Kramer MS. Assessment of fetal risk in postdate pregnancies. Am J Obstet Gynecol. 1988; 158:259–264.

34. Steer PJ, Eigbe F, Lissauer TJ, Beard RW. Interrelationships among abnormal cardiotocograms in labor, meconium staining of the amniotic fluid, arterial cord blood pH, and Apgar scores. Obstet Gynecol. 1989; 74:715–721.

35. Balchin I, Whittaker JC, Lamont RF, Steer PJ. Maternal and fetal characteristics associated with meconium-stained amniotic fluid. Obstet Gynecol. 2011; 117:828–835.

36. Mahomed K, Nyoni R, Masona D. Meconium staining of the liquor in a low-risk population. Paediatr Perinat Epidemiol. 1994; 8:292–300.

37. Ahanya SN, Lakshmanan J, Morgan BL, Ross MG. Meconium passage in utero: mechanisms, consequences, and management. Obstet Gynecol Surv. 2005; 60:45–56.

38. Baker PN, Kilby MD, Murray H. An assessment of the use of meconium alone as an indication for fetal blood sampling. Obstet Gynecol. 1992; 80:792–796.
39. Rossi EM, Philipson EH, Williams TG, Kalhan SC. Meconium aspiration syndrome: intrapartum and neonatal attributes. Am J Obstet Gynecol. 1989; 161:1106–1110.

40. Cleary GM, Wiswell TE. Meconium-stained amniotic fluid and the meconium aspiration syndrome: an update. Pediatr Clin North Am. 1998; 45:511–529.
41. Thureen PJ, Hall DM, Hoffenberg A, Tyson RW. Fatal meconium aspiration in spite of appropriate perinatal airway management: pulmonary and placental evidence of prenatal disease. Am J Obstet Gynecol. 1997; 176:967–975.

42. Heritage CK, Cunningham MD. Association of elective repeat cesarean delivery and persistent pulmonary hypertension of the newborn. Am J Obstet Gynecol. 1985; 152:627–629.

43. Perlman EJ, Moore GW, Hutchins GM. The pulmonary vasculature in meconium aspiration. Hum Pathol. 1989; 20:701–706.

44. Rabinovitch M. Structure and function of the pulmonary vascular bed: an update. Cardiol Clin. 1989; 7:227–238.

45. Cornish JD, Dreyer GL, Snyder GE, Kuehl TJ, Gerstmann DR, Null DM Jr, Coalson JJ, deLemos RA. Failure of acute perinatal asphyxia or meconium aspiration to produce persistent pulmonary hypertension in a neonatal baboon model. Am J Obstet Gynecol. 1994; 171:43–49.

46. Urbaniak KJ, McCowan LM, Townend KM. Risk factors for meconium-aspiration syndrome. Aust N Z J Obstet Gynaecol. 1996; 36:401–406.

47. Wiswell TE, Bent RC. Meconium staining and the meconium aspiration syndrome: unresolved issues. Pediatr Clin North Am. 1993; 40:955–981.

48. Velaphi S, Vidyasagar D. Intrapartum and postdelivery management of infants born to mothers with meconium-stained amniotic fluid: evidence-based recommendations. Clin Perinatol. 2006; 33:29–42.

49. Sriram S, Wall SN, Khoshnood B, Singh JK, Hsieh HL, Lee KS. Racial disparity in meconium-stained amniotic fluid and meconium aspiration syndrome in the United States, 1989-2000. Obstet Gynecol. 2003; 102:1262–1268.

50. Dargaville PA, Copnell B. Australian and New Zealand Neonatal Network. The epidemiology of meconium aspiration syndrome: incidence, risk factors, therapies, and outcome. Pediatrics. 2006; 117:1712–1721.

52. Greenough A. Meconium aspiration syndrome: prevention and treatment. Early Hum Dev. 1995; 41:183–192.
53. Byrne DL, Gau G. In utero meconium aspiration: an unpreventable cause of neonatal death. Br J Obstet Gynaecol. 1987; 94:813–814.

54. Sunoo C, Kosasa TS, Hale RW. Meconium aspiration syndrome without evidence of fetal distress in early labor before elective cesarean delivery. Obstet Gynecol. 1989; 73:707–709.

55. Krebs HB, Petres RE, Dunn LJ, Jordaan HV, Segreti A. Intrapartum fetal heart rate monitoring. III. Association of meconium with abnormal fetal heart rate patterns. Am J Obstet Gynecol. 1980; 137:936–943.
56. Swarnam K, Soraisham AS, Sivanandan S. Advances in the management of meconium aspiration syndrome. Int J Pediatr. 2012; 2012:359571.

57. Jovanovic R, Nguyen HT. Experimental meconium aspiration in guinea pigs. Obstet Gynecol. 1989; 73:652–656.

58. Ramin KD, Leveno KJ, Kelly MA, Carmody TJ. Amniotic fluid meconium: a fetal environmental hazard. Obstet Gynecol. 1996; 87:181–184.

59. Blackwell SC, Moldenhauer J, Hassan SS, Redman ME, Refuerzo JS, Berry SM, Sorokin Y. Meconium aspiration syndrome in term neonates with normal acid-base status at delivery: is it different? Am J Obstet Gynecol. 2001; 184:1422–1425.

60. Kaapa PO. Meconium aspiration syndrome (MAS): where do we go? Research perspectives. Early Hum Dev. 2009; 85:627–629.
61. Hofmeyr GJ. What (not) to do before delivery? Prevention of fetal meconium release and its consequences. Early Hum Dev. 2009; 85:611–615.

62. Hussain AA, Yakoob MY, Imdad A, Bhutta ZA. Elective induction for pregnancies at or beyond 41 weeks of gestation and its impact on stillbirths: a systematic review with meta-analysis. BMC Public Health. 2011; 11:Suppl 3. S5.

63. Alfirevic Z, Devane D, Gyte GM. Continuous cardiotocography (CTG) as a form of electronic fetal monitoring (EFM) for fetal assessment during labour. Cochrane Database Syst Rev. 2006; (3):CD006066.

64. Pierce J, Gaudier FL, Sanchez-Ramos L. Intrapartum amnioinfusion for meconium-stained fluid: meta-analysis of prospective clinical trials. Obstet Gynecol. 2000; 95(6 Pt 2):1051–1056.

65. Fraser WD, Hofmeyr J, Lede R, Faron G, Alexander S, Goffinet F, Ohlsson A, Goulet C, Turcot-Lemay L, Prendiville W, Mar-coux S, Laperriere L, Roy C, Petrou S, Xu HR, Wei B. Amnioinfusion Trial Group. Amnioinfusion for the prevention of the meconium aspiration syndrome. N Engl J Med. 2005; 353:909–917.

66. ACOG Committee Obstetric Practice. ACOG Committee Opinion Number 346, October 2006: amnioninfusion does not prevent meconium aspiration syndrome. Obstet Gynecol. 2006; 108:1053.
67. Vain NE, Szyld EG, Prudent LM, Wiswell TE, Aguilar AM, Vivas NI. Oropharyngeal and nasopharyngeal suctioning of meconium-stained neonates before delivery of their shoulders: multicentre, randomised controlled trial. Lancet. 2004; 364:597–602.

68. Perlman JM, Wyllie J, Kattwinkel J, Atkins DL, Chameides L, Goldsmith JP, Guinsburg R, Hazinski MF, Morley C, Richmond S, Simon WM, Singhal N, Szyld E, Tamura M, Velaphi S. Neonatal Resuscitation Chapter Collaborators. Part 11: Neonatal resuscitation: 2010 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science With Treatment Recommendations. Circulation. 2010; 122:16 Suppl 2. S516–S538.
69. Bax M, Goldstein M, Rosenbaum P, Leviton A, Paneth N, Dan B, Jacobsson B, Damiano D. Executive Committee for the Definition of Cerebral Palsy. Proposed definition and classification of cerebral palsy, April 2005. Dev Med Child Neurol. 2005; 47:571–576.

70. Rosenbaum P, Paneth N, Leviton A, Goldstein M, Bax M, Damiano D, Dan B, Jacobsson B. A report: the definition and classification of cerebral palsy April 2006. Dev Med Child Neurol Suppl. 2007; 109:8–14.
72. O'Shea TM. Diagnosis, treatment, and prevention of cerebral palsy. Clin Obstet Gynecol. 2008; 51:816–828.
73. Bracewell M, Marlow N. Patterns of motor disability in very preterm children. Ment Retard Dev Disabil Res Rev. 2002; 8:241–248.

76. Zupan V, Gonzalez P, Lacaze-Masmonteil T, Boithias C, d'Allest AM, Dehan M, Gabilan JC. Periventricular leukomalacia: risk factors revisited. Dev Med Child Neurol. 1996; 38:1061–1067.

77. Krageloh-Mann I, Horber V. The role of magnetic resonance imaging in elucidating the pathogenesis of cerebral palsy: a systematic review. Dev Med Child Neurol. 2007; 49:144–151.

78. Perlman JM. Intrapartum asphyxia and cerebral palsy: is there a link? Clin Perinatol. 2006; 33:335–353.

79. Drobyshevsky A, Derrick M, Prasad PV, Ji X, Englof I, Tan S. Fetal brain magnetic resonance imaging response acutely to hypoxia-ischemia predicts postnatal outcome. Ann Neurol. 2007; 61:307–314.

80. Ashwal S, Russman BS, Blasco PA, Miller G, Sandler A, Shevell M, Stevenson R. Quality Standards Subcommittee of the American Academy of Neurology. Practice Committee of the Child Neurology Society. Practice parameter: diagnostic assessment of the child with cerebral palsy: report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society. Neurology. 2004; 62:851–863.

81. Korzeniewski SJ, Birbeck G, DeLano MC, Potchen MJ, Paneth N. A systematic review of neuroimaging for cerebral palsy. J Child Neurol. 2008; 23:216–227.

82. Wu YW, Croen LA, Shah SJ, Newman TB, Najjar DV. Cerebral palsy in a term population: risk factors and neuroimaging findings. Pediatrics. 2006; 118:690–697.

83. Jacobsson B, Hagberg G. Antenatal risk factors for cerebral palsy. Best Pract Res Clin Obstet Gynaecol. 2004; 18:425–436.

84. Hagberg B, Hagberg G, Beckung E, Uvebrant P. Changing panorama of cerebral palsy in Sweden. VIII. Prevalence and origin in the birth year period 1991-94. Acta Paediatr. 2001; 90:271–277.

85. Thorngren-Jerneck K, Herbst A. Perinatal factors associated with cerebral palsy in children born in Sweden. Obstet Gynecol. 2006; 108:1499–1505.

86. Bax M, Tydeman C, Flodmark O. Clinical and MRI correlates of cerebral palsy: the European Cerebral Palsy Study. JAMA. 2006; 296:1602–1608.
87. Jarvis S, Glinianaia SV, Blair E. Cerebral palsy and intrauterine growth. Clin Perinatol. 2006; 33:285–300.

88. Yoon BH, Park CW, Chaiworapongsa T. Intrauterine infection and the development of cerebral palsy. BJOG. 2003; 110:Suppl 20. 124–127.

89. Grether JK, Nelson KB. Maternal infection and cerebral palsy in infants of normal birth weight. JAMA. 1997; 278:207–211.

90. Blair E, Stanley FJ. Intrapartum asphyxia: a rare cause of cerebral palsy. J Pediatr. 1988; 112:515–519.

91. Smith J, Wells L, Dodd K. The continuing fall in incidence of hypoxic-ischaemic encephalopathy in term infants. BJOG. 2000; 107:461–466.

92. Gaffney G, Flavell V, Johnson A, Squier MV, Sellers S. Model to identify potentially preventable cerebral palsy of intrapartum origin. Arch Dis Child Fetal Neonatal Ed. 1995; 73:F106–F108.

94. Winter S, Autry A, Boyle C, Yeargin-Allsopp M. Trends in the prevalence of cerebral palsy in a population-based study. Pediatrics. 2002; 110:1220–1225.

95. Wu YW, Backstrand KH, Zhao S, Fullerton HJ, Johnston SC. Declining diagnosis of birth asphyxia in California: 1991-2000. Pediatrics. 2004; 114:1584–1590.

97. Graham EM, Petersen SM, Christo DK, Fox HE. Intrapartum electronic fetal heart rate monitoring and the prevention of perinatal brain injury. Obstet Gynecol. 2006; 108:656–666.

98. Phelan JP, Kim JO. Fetal heart rate observations in the brain-damaged infant. Semin Perinatol. 2000; 24:221–229.

99. Ellenberg JH, Nelson KB. Cluster of perinatal events identifying infants at high risk for death or disability. J Pediatr. 1988; 113:546–552.

100. American College of Obstetricians and Gynecologists. Task Force on Neonatal Encephalopathy and Cerebral Palsy. Ameri-can Academy of Pediatrics. Neonatal encephalopathy and cerebral palsy: defining the pathogenesis and pathophysiology. Washington, DC: American College of Obstetricians and Gynecologists;2003.
101. Shankaran S. Prevention, diagnosis, and treatment of cerebral palsy in near-term and term infants. Clin Obstet Gynecol. 2008; 51:829–839.

102. Badawi N, Kurinczuk JJ, Keogh JM, Alessandri LM, O'Sullivan F, Burton PR, Pemberton PJ, Stanley FJ. Antepartum risk factors for newborn encephalopathy: the Western Australian case-control study. BMJ. 1998; 317:1549–1553.

103. Montenegro MA, Cendes F, Saito H, Serra JG, Lopes CF, Piovesana AM, Milanez H, Guerreiro MM. Intrapartum complications associated with malformations of cortical development. J Child Neurol. 2005; 20:675–678.

105. Kirton A, deVeber G. Cerebral palsy secondary to perinatal ischemic stroke. Clin Perinatol. 2006; 33:367–386.

106. Ramaswamy V, Miller SP, Barkovich AJ, Partridge JC, Ferriero DM. Perinatal stroke in term infants with neonatal encephalopathy. Neurology. 2004; 62:2088–2091.

107. Lee J, Croen LA, Backstrand KH, Yoshida CK, Henning LH, Lindan C, Ferriero DM, Fullerton HJ, Barkovich AJ, Wu YW. Maternal and infant characteristics associated with perinatal arterial stroke in the infant. JAMA. 2005; 293:723–729.

108. Roh CR. Ischemic perinatal stroke. Korean J Obstet Gynecol. 2009; 52:391–399.
110. Kraus FT, Acheen VI. Fetal thrombotic vasculopathy in the placenta: cerebral thrombi and infarcts, coagulopathies, and cerebral palsy. Hum Pathol. 1999; 30:759–769.

111. Redline RW. Severe fetal placental vascular lesions in term infants with neurologic impairment. Am J Obstet Gynecol. 2005; 192:452–457.

113. Hemminki K, Li X, Sundquist K, Sundquist J. Familial risks for common diseases: etiologic clues and guidance to gene identification. Mutat Res. 2008; 658:247–258.

114. Gibson CS, MacLennan AH, Goldwater PN, Haan EA, Priest K, Dekker GA. South Australian Cerebral Palsy Research Group. The association between inherited cytokine polymorphisms and cerebral palsy. Am J Obstet Gynecol. 2006; 194:674.e1–674.e11.

115. Kuroda MM, Weck ME, Sarwark JF, Hamidullah A, Wain-wright MS. Association of apolipoprotein E genotype and cerebral palsy in children. Pediatrics. 2007; 119:306–313.

116. Gibson CS, Maclennan AH, Dekker GA, Goldwater PN, Sullivan TR, Munroe DJ, Tsang S, Stewart C, Nelson KB. Candidate genes and cerebral palsy: a population-based study. Pediatrics. 2008; 122:1079–1085.

117. Badawi N, Kurinczuk JJ, Keogh JM, Alessandri LM, O'Sullivan F, Burton PR, Pemberton PJ, Stanley FJ. Intrapartum risk factors for newborn encephalopathy: the Western Australian case-control study. BMJ. 1998; 317:1554–1558.

118. Nelson KB, Ellenberg JH. Antecedents of cerebral palsy: multivariate analysis of risk. N Engl J Med. 1986; 315:81–86.

119. Nelson KB, Leviton A. How much of neonatal encephalopathy is due to birth asphyxia? Am J Dis Child. 1991; 145:1325–1331.

120. Nelson KB. What proportion of cerebral palsy is related to birth asphyxia? J Pediatr. 1988; 112:572–574.

121. Raju TN. Historical perspectives on the etiology of cerebral palsy. Clin Perinatol. 2006; 33:233–250.

122. Blumenthal I. Cerebral palsy: medicolegal aspects. J R Soc Med. 2001; 94:624–627.




 PDF
PDF ePub
ePub Citation
Citation Print
Print


 XML Download
XML Download