Abstract
Multiple sclerosis (MS) is the most common demyelinating disease affecting the central nervous system of young adults living in the western world. MS should be strongly suspected when a young adult develops one or more neurological episodes consistent with damage to white matter within the central nervous system (CNS), especially when these affect the optic nerves, brainstem, or spinal cord. The patient with relapses, each of which can be attributed to demyelination in the CNS, requires no investigation prior to establishing the diagnosis of clinically definite MS. For a diagnosis of MS, separate anatomical sites within the CNS must have been affected on different occasions, typically three. MS in Asian populations is characterized by the selective and dominant involvement of the optic nerve and spinal cord with some incidence of brainstem lesions. 35-40% of MS cases in Korea are of this optico-spinal type with or without brainstem lesions. Reported cases of neuromyelitis optica spectrum disease (NMOSD), causing severe optic neuritis (ON) and/or longitudinally extensive transverse myelitis, either monophase or with a relapse-remitting pattern, some of which were diagnosed previously as the optico-spinal form of MS in Asia, have increased annually in Korea with the development of the NMO-IgG or aquaporin4-antibody detecting technique. NMO-IgG detection is very important in the diagnosis of early stage of NMOSD and the differentiation of MS and other demyelinating disease. Many new convenient oral drugs or very potent intravenous monoclonal antibodies for targeting VLA-4, CD20, and CD52 may decrease the annual relapse rate and burden of brain-spinal cord lesionsin MS.
다발성경화증은 중추신경계에 국한된 대표적인 탈수초염증질환이다. 아직 정확한 병리기전은 밝혀지지 않았지만, 말초혈관, 림파절에서 감작된 자가반응 CD4 helper세포 혹은 CD8 cytotoxic 세포, 여러 염증세포가 뇌혈관방어막을 통과하여 microglia 등에 의해 한번 더 활성화되면서 중추신경계 수초(myelin)의 여러 항원에 공격을 하여 염증반응을 유발하고 신경회로의 탈수초와 축삭손상을 일으킨다. 염증세포와 microglia, 활성화된 림파구에서 분비되는 시토카인에 의해서 염증반응이 잠잠해지거나 혹은 조금씩 지속될 수 있는 환경을 만들 수 있다[1]. 주로 20-40세 사이에 흔히 발생하고 10세 이전이나 60세 이후에는 드물다. 유럽계 백인에서 빈번하고 위도 45-60° 사이에서 발병률이 높고 여자가 남자보다 2배정도 잘 생긴다[2]. 동양인과 흑인에서는 상대적으로 드물다. 우리나라에서 2000-2005년 사이의 환자를 대상으로 한 연구에서 유병률은 3.5-3.6이었고 남녀비는 1:1.26로 여자가 많았다[3]. 처음 증상으로 혹은 반복되는 증상으로 시신경염에 의한 시력저하, 시야장애와 부분 척수염에 의한 상하지 부분마비, 감각이상증, 대소변장애 등을 많이 호소한다[4]. 이런 유형의 다발성경화증은 뇌자기공명영상(magnetic resonance imaging, MRI)에서 백인 다발성경화증 환자에서 흔히 볼 수 있는 뇌실주위, 인접피질부위, 소뇌 등에서 병변이 발견되지 않고 시신경계나 뇌간, 경부-흉부 척수 부위에 병변이 있어, 별도로 시신경척수 형 다발성경화증(optico-spinal multiple sclerosis)으로 명명하기도 하였다(Figure 1) [5]. 65% 이상의 다발성경화증 환자는 두 차례 이상의 뇌병변, 시신경염, 척수염 등에 의한 재발·완화되는 과정을 거쳐 서서히 진행되는 이차성진행(secondary progressive)형으로 진행되며 10%는 2-3차례의 재발·호전을 반복하다 더 이상 진행되지 않는 양성(benign)형으로 남는다. 다발성경화증 환자의 10% 내에서 재발·호전 등의 변화 없이 처음부터 지속적으로 진행되는 일차성진행(primary progressive) 형으로 표현될 수 있다[6]. 척추체 3분절 이상에 걸쳐 생기는 급성횡단성척수염 및 심한 시력장애와 시야장애, 안구통을 호소하는 시신경염이 척수염과 동시에 혹은 별도로, 반복적으로 재발되는 시신경척수염(neuromyelitis optica, NMO)은 백인보다는 아시아지역의 한국, 일본, 중국의 중년여자에게서 많이 생기고(Table 1) (Figure 2) [78]. 다발성경화증과 치료가 틀리기 때문에 NMO-IgG항체검사[910]를 실시하여 조기진단과 치료가 필요하다.
갑작스럽게 혹은 서서히 나타날 수 있다. 일부 환자는 무증상 뇌병변이 우연히 발견되는 경우도 있다. 301명의 환자의 증상을 정리한 Swingler의 보고에서 가장 많이 호소하는 순서로 나열하면 위약, 감각이상증, 운동실조, 괄약근조절장애, 피로, 경련, 복시, 시력장애, 장운동장애, 말더듬, 어지럼, 안면통증, 기억력장애, 두통 순이며 시작 증상으로는 감각이상증, 위약, 시력장애, 운동실조증, 복시 등 시신경, 척수, 및 뇌줄기 병변에 의한 증상을 호소하였다[2]. 신경학적 검사에서 가장 많이 발견되는 징후는 시력저하, 복부피부반사소실, 진동감각저하, 건반사항진, 색각장애, 상지운동실조, 안구진탕, 근긴장항진, 주저-긴박뇨 등이다[2]. 증상과 징후로 추정된 가장 많이 연관된 뇌병변은 시신경계, 척수, 뇌줄기-소뇌, 뇌피질 순이다. 우리나라 다발성경화증 환자의 증상은 시신경척수 형이 많기 때문에 위약, 감각이상, 방광증상, 시력장애, 장운동장애 등의 순으로 많았다[11].
백인 환자들에서 주로 뇌병변, 소뇌-뇌줄기에 여러 병변이 생기는 전형적인 형의 다발성경화증과는 달리, 한국 및 아시아지역에서 비교적 많은 시신경척수형 다발성경화증은 주로 시신경과 척수에 병변이 흩어져있어 상하지 및 몸통의 감각증상, 운동실조증, 방광증상, 경련, 시력장애, 장운동장애 등의 증상을 호소한다[57]. 뇌줄기 병변에 의한 경한 증상과 증후도 말더듬증, 어지럼 증상과 복시, 안진 등의 증후가 발견되기도 한다(Figure 1). 특히 여자 환자가 많으며 처음 증상이 늦게 나타나지만 병이 지속되는 기간은 별 차이가 없었다[5]. 시신경척수형 비는 영국(6%)과 비교해서 일본(42%)에서는 7배로 높았고[5] 아산병원의 환자에서는 33%로 역시 유럽보다는 높았다. 최근 NMO-IgG항체양성인 NMO가 그전에 보고된 시신경척수형과는 치료방법과 임상양상이 다른 질환으로 분류되어[812] NMO-IgG항체 측정이 개발된 2003년 후 다발성경화증의 분류에서는 시신경척수형이 유럽과 미국의 통계보다 많이 높지 않다. 또한 2010년 개정된 McDonald 다발성경화증 진단기준은 굳이 시신경척수형으로 따로 나눌 필요가 없어졌다[13]. NMO의 최근 주요 진단기준조건은 1) 한쪽 또는 양쪽 시신경염이 한번 혹은 여러 차례에 걸쳐 생기고, 2) 적어도 3분절 척추체를 초과하는 긴 횡단성 척수염이 동시에 혹은 시간을 두고 각각 재발이 발생할 때로 정하였다(Figure 2). 부진단기준은 1) 혈청이나 뇌척수액에서 NMO-IgG항체가 발견되고, 2) 뇌MRI소견이 정상이거나 다발성경화증을 의심할만한 소견이 없을 때로 정하였다[8].
척수액과 혈청의 IgG비를 척수액과 혈청의 알부민 비로 나눈 값으로 정의하며 뇌척수액 내 과도한 IgG생성을 증명하는 의미가 있으며 올리고클론띠와 같이 중추신경계에서 B-cell이 활성화된 면역반응을 간접적으로 시사하는 의미가 있으나 특이성은 떨어진다[14].
대부분의 조영증강 병변은 뇌백질부, 피질인접부, 피질밑 심부에서 잘 관찰된다. 조영증강은 평균적으로 4-6주 지속되나 1주간 지속되는 경우도 있다. 3개월 이상 지속되는 경우는 매우 드물기 때문에 지속적으로 조영 증강되는 종양이나 신경사르코이드증(neuro-sarcoidosis)과 감별하기 위하여 재촬영이 필요할 수도 있다. 초기 재발-회복되는 환자에서 조영증강병변은 잘 관찰되나 최근 재발이 없는 이차성진행성형의 환자와 일차성진행성형의 환자에서 조영증강된 병변은 잘 관찰할 수 없다[17].
T1강조영상은 뇌실질부 손상을 보기 위해 촬영한다. 작은 혈관질환과 노환된 뇌병변과는 달리 다발성경화증 환자의 만성 T2병변의 20-30%는 T1강조영상에서 지속적으로 T1 hypointense 병변으로 보이는 특성이 있다. 만성 T1 hypointense 병변은 T1 isointense 병변보다 축삭손상과 더 연관이 있다. 초기 T1 hypointense 병변은 간혹 T1조영증강 병변으로 보일 수 있으며 정상으로 회복되는 경우 적어도 수 개월 걸린다[16].
다발성경화증환자의 진단은 매우 까다롭다. 정확한 진찰과 뇌척수MRI, 시신경자극유발전위검사 등으로 뇌병변이 공간적으로 적어도 2개 이상 있는 지를 확인한다. 뇌척수 면역질환으로 인한 실험실적인 결과(뇌척수액검사, IgG 지표, oligoclonal band, NMO-IgG항체검사)와 반복 MRI를 촬영하여 시간적으로 재발이 되었거나 지속적으로 진행되는 지를 확인한다. NMO-IgG 항체역가가 높은 양성일 때는 제외된다. 다른 뇌척수질환으로는 임상증상과 발병양상, 실험실 적인 결과를 설명할 수가 없다고 생각될 때 가능하다.
병의 진행과 재발을 줄이기 위하여 초기에 면역조절약을 일찍 사용하기 위하여 개정된 2010년 McDonald 다발성경화증 진단기준의 특징은 1회 임상발병, 1개 병변에 대한 객관적인 임상증거(임상적단독증후군)에 뇌척수MRI로 증명된 공간파종과 시간파종이 있을 경우 가능하다. 공간파종은 다발성경화증에 특징적인 중추신경영역(뇌실주위, 피질곁, 천막하 혹은 척수) 중 2개 이상의 영역에서 적어도 1개 이상의 T2병변이 있을 때로 규정하였다. 시간파종은 검사시기와 상관없이 증상과 상관 없는 가돌리늄조영증강과 조영증강이 되지않는 병변이 동시에 존재하거나 혹은 MRI 검사시기와 관계없이 기준MRI와 비교하여 추적MRI에서 새로운 T2병변 또는 새로운 가돌리늄조영증강병터가 있을 때로 규정하였다[14].
의사가 다발성경화증환자를 처음 봤을 때 임상유형은 다음 세가지로 분류된다. 1) 환자의 증상과 증후가 중추신경계의 각각 다른 부위의 병변이 탈수초화 되면서 재발-회복을 반복하면서 생겼을 때(임상적으로 확실한 혹은 거의 확실한 다발성경화증), 2) 확실치 않은 병력과 전형적인 탈수초화 병변으로 인한 독립된 증상이 최근 생겼을 때, 3) 탈수초화와 축삭변성으로 여겨지는 증상이 지속적으로 진행될 때로 구분할 수 있다.
급성 시신경, 척수염, 의식장애나 뇌기능장애를 나타내는 심한 뇌병변이 있을 경우 초기에 methyl prednisol 1,000 mg을 정맥주사로 3일에서 5일간 사용하고 경구 스테로이드 약으로 용량을 줄이면서 2-3주 정도 사용 후 중단한다. 지속적으로 적은 용량으로 사용하는 것은 재발방지에 도움이 되지 않다는 보고가 있다[18].
사이토카인 조절제인 interferon (IFN)-β를 10-18년간 사용하여 재발-완화형 환자의 재발횟수를 줄이고 뇌척수의 누적 병변의 정도를 줄여 병의 진행을 억제하는 효과가 있다고 보고하였다[19]. 현재 우리나라에서도 IFN-β 등 면역조절약의 처방기준은 다른 나라들과 같이 베타페론(IFN-β-1b, 베네세린; IFN-β-1a, 레비프프리필드, 레비도즈) 주사제, 코팍손(Copaxone) 주사제 등을 사용한다. 주로 면역조절약(immunomodulating agent)로 사이토카인의 분비 등을 조절하거나 T-helper 2 cell의 기능을 향상시키는 약으로 재발-완화형이나 이차성진행형에 사용한다.
Mitoxantrone, cyclophosphamide, azathioprine, temsirolimus 등의 세포독성(cytotoxic) 제제도 사용한다. 특히 mitoxantrone은 이차진행성 환자에 유일하게 도움이 된다.
최근 경구약제인 스핑고신-1-인산염(sphingosine-1-phosphate)수용체 에 작용하는 핀골리모드(fingolimod) [20]와 피리미딘합성을 억제하는 테리플루노마이드(teri-flunomide) [21], 면역조절능력과 항산화 작용이 있는 BG-12(dimethyl fumarate) [22] 등이 있다. Very late anti-gen-4에 대한 단클론항체(monoclonal antibodies) 제제인natalizumab (Tysabri) [23]이 식품의약품안전처 승인을 받았고, 성숙림프구표면항원인 CD52에 대한 인간화항체(humanized antibody)인 알렘투주맙(alemtuzumab), B림파구표면항원인 CD20에 대한 항체인 리툭시맙(rituxi-mab), Daclizumab (Zenopax)제제도 제한적인 범위 내에서 미국 식품의약국 공인을 받아 시판될 것으로 추정된다. 일부 약제는 진행다초점백질뇌병변(progressive multifo-cal leukoencephalopathy)과 같은 심각한 부작용과 부정맥 등이 보고되어 장기추적연구가 필요하다.
다발성경화증으로 인한 여러 증상과 신경계장애를 줄여주는 대증요법이 있다. 경직을 줄여주는 baclofen, posi-tive 혹은 negative myoclonus를 줄여주는 clonazepam, 뇨폐색에 도움이 되는 doxazosin mesylate (α1 blocker) 등을 사용한다.
다발성경화증은 시신경, 척수, 뇌줄기 등 중추신경계에 염증을 일으키는 재발되는 탈수조성질환이다. 초기에 독립된 증상으로 내원했을 경우 일찍 베타인터페론 등 면역조절약을 사용하면 재발-회복형인 경우 장기적으로 도움이 된다. 1년에 2차례 이상의 재발과 활동성 MRI병변이 자주 있을 경우 핀골리모드, natalizumab, mitoxantrone 등으로 약을 변경할 수 있다. 시신경척수염과 감별에 NMO-IgG, 항아쿠아포린항원에 대한 항체검사가 결정적인 도움이 된다. 또한 복용하기 편한 경구 제재도 많이 나와서 궁극적으로 대부분의 다발성경화증은 초기부터 잘 치료하면 극복될 수 있는 병이 될 것이다.
대표적인 중추신경계 탈수초질환인 다발성경화증에 대하여 임상증상, MRI, 진단법, 치료 등 전반적인 부분을 간략하게 소개하였다. 특히 우리나라에 흔한 시신경척수염과의 차이점에 대해 강조하여 실용적인 지식을 전달하고 있다. 다발성경화증과 시신경척수염의 병인기전 연구와 치료약제 개발 등이 급격한 진전을 보이고 있는 현 시점에서 이 질환의 임상적 측면을 간결하게 요약하여 제공하고 있다는 점에서 임상의 뿐 아니라 이 분야를 연구하는 기초의학자에게도 도움이 될 것으로 판단된다.
[정리: 편집위원회]
Figures and Tables
Figure 1
Magnetic resonance imaging findings in 27-year-old female patient of multiple sclerosis. (A) Two separate lesions (arrows) of cerical spinal cord in sagital T2 weighted image. (B,C) Multiple scattered small lesions in corpus callosum, medulla (arrows, B), avoid shaped perpendicular to corpus callosum (arrow, C) in sagittal brain fluid attenuated inversion recovery (FLAIR) image. (D,E) Small scattered lesions in right middle cerebellar peduncle (arrow, D) and left lateral medula lesion (arrow, E) in axial FLAIR.
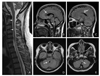
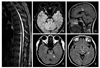
Figure 2
Magnetic resonance imaging (MRI) findings in 44-year-old female patient of neuromyelitis optica. (A) Long cord lesions (≥3 vertebral segments, arrow) in saggital T2W image of the thoracic spinal cord. (B) Gadolinium enhanced right optic nerve (arrow) in T1W axial brain MRI. (C) Small isolated lesion of corpus callosum (arrow) in weighted fluid attenuated inversion recovery (FLAIRW) axial brain MRI. (D) Isolated left tegmental upper pons lesion (arrow) in FLAIRW axial brain MRI. (E) Central hypothalamic and midbrain lesions (arrows) in FLAIRW axial brain MRI.
References
1. Hemmer B, Archelos JJ, Hartung HP. New concepts in the immunopathogenesis of multiple sclerosis. Nat Rev Neurosci. 2002; 3:291–301.

2. Swingler RJ, Compston DA. The morbidity of multiple sclerosis. Q J Med. 1992; 83:325–337.
4. Yu YL, Woo E, Hawkins BR, Ho HC, Huang CY. Multiple sclerosis amongst Chinese in Hong Kong. Brain. 1989; 112(Pt 6):1445–1467.

6. Compston A. The diagnosis of multiple sclerosis. In : McAlpine D, Compston A, Confavreux C, Lassmann H, McDonald I, editors. McAlpine's multiple sclerosis. 4th ed. New York: Churchill Livingston;2006. p. 351–388.
7. Nakashima I, Fujihara K, Miyazawa I, Misu T, Narikawa K, Nakamura M, Watanabe S, Takahashi T, Nishiyama S, Shiga Y, Sato S, Weinshenker BG, Itoyama Y. Clinical and MRI features of Japanese patients with multiple sclerosis positive for NMO-IgG. J Neurol Neurosurg Psychiatry. 2006; 77:1073–1075.

8. Wingerchuk DM, Lennon VA, Lucchinetti CF, Pittock SJ, Weinshenker BG. The spectrum of neuromyelitis optica. Lancet Neurol. 2007; 6:805–815.

9. Lennon VA, Kryzer TJ, Pittock SJ, Verkman AS, Hinson SR. IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4 water channel. J Exp Med. 2005; 202:473–477.

10. Lennon VA, Wingerchuk DM, Kryzer TJ, Pittock SJ, Lucchinetti CF, Fujihara K, Nakashima I, Weinshenker BG. A serum auto-antibody marker of neuromyelitis optica: distinction from multiple sclerosis. Lancet. 2004; 364:2106–2112.

11. Kim KK. Optico-spinal multiple sclerosis and neuromyelitis optica. J Korean Neurol Assoc. 2006; 24:Supp 1. 66–69.
12. Carroll W, Saida T, Kim H, Kira J, Kermode A, Tsai C, Fujihara K, Kusunoki S, Tanaka M, Kim K, Bates D. A guide to facilitate the early treatment of patients with idiopathic demyelinating disease (multiple sclerosis and neuromyelitis optica). Mult Scler. 2013; 01. 16. [Epub]. DOI: 10.1177/1352458512471092.

13. Polman CH, Reingold SC, Banwell B, Clanet M, Cohen JA, Filippi M, Fujihara K, Havrdova E, Hutchinson M, Kappos L, Lublin FD, Montalban X, O'Connor P, Sandberg-Wollheim M, Thompson AJ, Waubant E, Weinshenker B, Wolinsky JS. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol. 2011; 69:292–302.

14. McLean BN, Luxton RW, Thompson EJ. A study of immunoglobulin G in the cerebrospinal fluid of 1007 patients with suspected neurological disease using isoelectric focusing and the Log IgG-Index: a comparison and diagnostic applications. Brain. 1990; 113(Pt 5):1269–1289.

15. Montalban X, Tintore M, Swanton J, Barkhof F, Fazekas F, Filippi M, Frederiksen J, Kappos L, Palace J, Polman C, Rovaris M, de Stefano N, Thompson A, Yousry T, Rovira A, Miller DH. MRI criteria for MS in patients with clinically isolated syndromes. Neurology. 2010; 74:427–434.

16. Bagnato F, Jeffries N, Richert ND, Stone RD, Ohayon JM, McFarland HF, Frank JA. Evolution of T1 black holes in patients with multiple sclerosis imaged monthly for 4 years. Brain. 2003; 126(Pt 8):1782–1789.

17. Miller DH, Rudge P, Johnson G, Kendall BE, Macmanus DG, Moseley IF, Barnes D, McDonald WI. Serial gadolinium enhanced magnetic resonance imaging in multiple sclerosis. Brain. 1988; 111(Pt 4):927–939.

18. Compston A. Disease-modifying treatments in multiple sclerosis. In : McAlpine D, Compston A, Confavreux C, Lassmann H, McDonald I, editors. McAlpine's multiple sclerosis. 4th ed. New York: Churchill Livingston;2006. p. 729–810.
19. Croze E, Yamaguchi KD, Knappertz V, Reder AT, Salamon H. Interferon-beta-1b-induced short- and long-term signatures of treatment activity in multiple sclerosis. Pharmacogenomics J. 2012; 06. 19. [Epub]. DOI: 10.1038/tpj.2012.27.

20. Kappos L, Radue EW, O'Connor P, Polman C, Hohlfeld R, Calabresi P, Selmaj K, Agoropoulou C, Leyk M, Zhang-Auberson L, Burtin P. FREEDOMS Study Group. A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med. 2010; 362:387–401.

21. Oh J, O'Connor PW. An update of teriflunomide for treatment of multiple sclerosis. Ther Clin Risk Manag. 2013; 9:177–190.
22. Killestein J, Rudick RA, Polman CH. Oral treatment for multiple sclerosis. Lancet Neurol. 2011; 10:1026–1034.

23. Polman CH, O'Connor PW, Havrdova E, Hutchinson M, Kappos L, Miller DH, Phillips JT, Lublin FD, Giovannoni G, Wajgt A, Toal M, Lynn F, Panzara MA, Sandrock AW. AFFIRM Investigators. A randomized, placebo-controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med. 2006; 354:899–910.





 PDF
PDF ePub
ePub Citation
Citation Print
Print



 XML Download
XML Download