서론
소아청소년기에서 발생하는 뇌종양의 치료에는 방사선 치료가 매우 중요한 역할을 한다. 수술적 치료는 대부분의 소아청소년기의 뇌종양에서 중추적 역할을 담당하나 종양의 완벽한 절제를 시도할 경우 종양 주변의 정상조직의 기능적 손상을 초래할 수 있고 이는 소아청소년기에 치료받은 환자의 삶의 질을 떨어뜨리게 된다. 방사선 치료는 수술과 병행하여 사용됨으로써 수술로 완전히 절제되지 못한 미세종양부위를 치료할 뿐 아니라 때로는 수술 없이 단독으로 국소 종양을 치료하는데 사용되기도 한다. 소아청소년의 뇌종양에 대한 방사선 치료는 어른의 뇌종양을 치료할 때와는 다른 몇 가지 고려해야 할 점이 있다. 첫째, 소아청소년 연령대의 뇌종양은 병리학적인 특징이 매우 다양하며 그 중에서도 특히 태아세포에서 기원하는 종양의 비율이 높다. 태아조직에서 기원하는 종양의 특징 중 하나는 뇌척수액을 통한 종양세포의 전이경향이 높다는 점인데 이 때문에 방사선치료시 원발부위 종양뿐 아니라 전뇌척수부위 전체를 조사범위로 잡아야 하는 경우가 많다. 둘째, 방사선치료로 인한 이차효과가 어른에 비해 매우 크다는 점이다. 뇌의 성숙은 태어난 후 3년 이내에 거의 이루어지고 6세 이상이 되면 성장속도가 매우 느려진다[1]. 신경세포의 수는 영유아기에 이미 성년과 거의 같은 수로 존재하나 세포의 크기나 신경자극전달부의 성숙, 말이집형성(myelinization)과 같은 신경조직의 성숙에 필요한 과정들은 출생 이후부터 청소년기를 통하여 성숙과정이 지속된다. 방사선이 주어지면 이러한 뇌의 성숙과정이 늦어지며 이러한 영향은 방사선치료를 받는 나이가 어릴수록 심해진다. 이런 점들은 소아뇌종양의 치료에 있어 방사선의 사용을 최대한 피하고 항암제를 적극적으로 사용하는 치료방법을 찾게 만들어왔으며 실제로 항암제 사용은 소아청소년기 뇌종양의 일부에서 방사선의 조사범위나 조사량을 줄이는 데에 어느 정도 기여하였다고 보여진다. 하지만 많은 뇌종양의 경우 항암제는 그것만으로 수술이나 방사선과 같은 국소치료의 효과를 대치하지는 못한다. 이러한 이유때문에 성장기에 있는 소아청소년의 뇌종양을 치료할 때 독성을 최소화할 수 있는 방사선치료 방법을 찾는 것은 매우 중요하다. 양성자치료는 현재에 이용 가능한 모든 방사선치료 중 이러한 목적에 가장 가까이 근접해 있다고 볼 수 있으며 특히 스캔빔 기술을 이용한 양성자치료는 종양 외의 부위에 전달되는 방사선량을 극적으로 줄일 수 있어서 소아뇌종양의 방사선치료 분야에 획기적으로 기여할 것으로 기대되고 있다. 이 논문에서는 전공 및 비전공 의료인 독자들을 대상으로 양성자치료의 원리와 임상적 적용에 대해 소개하고자 한다.
양성자치료의 원리
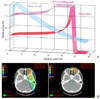
양성자는 질량 1.67 × 10-27 kg의 질량을 가진 수소의 원자핵이다. 일반적인 핵자(nucleon)는 중성자와 양성자로 구성되어 있고 이들 각각의 질량은 전자의 그것보다 약 2,000배나 된다. 양성자는 원형의 거대한 입자 가속기 안에서 빛에 속도에 가까운 속도로 가속되고 가속기에서 치료실까지 인도되는 긴 자장의 터널을 여행하게 된 후 여기에 연결된 말단장치를 통하여 인체의 일정부위로 전달된다(Figure 1). 양성자가 도달할 수 있는 체내 조직의 깊이는 양성자의 에너지가 높을수록 깊어지는데 일단 조직 내에 들어 온 양성자입자는 체내의 원자를 이루는 전자나 원자핵과 상호작용을 일으키게 되고 이러한 상호작용이 만들어내는 에너지가 방사선의 치료효과를 나타내게 된다. 이때 질량이 무거운 양성자는 정해진 깊이에 오기까지는 운동에너지를 거의 잃지 않으며 특별하게 정해진 깊이에서 운동에너지를 폭발적으로 발산하고 완전히 정지한다. 이와같이 양성자입자가 체내에서 일으키는 에너지 축척의 두가지 형태중 앞부분은 양성자가 체내 조직에 들어온 후 물질을 구성하는 원자핵 내의 전자들과 전자기적 작용에 의해 에너지를 서서히 잃는 과정에 속하고 뒷부분은 양성자가 어느 시점에서 멈추어 섰을 때 에너지분출이 극대에 이른 후 운동에너지가 소실되기 때문인데 이는 방사선치료의 측면에서 생각했을 때 매우 특별한 장점이 된다. 양성자의 경우 인체 내 조직의 단위길이당 방사선에 의해 전달되는 에너지의 양(linear energy transfer)을 stopping power라고 부르며 양성자가 조직 내에서 완전히 정지하였을 때에 생기는 에너지피크를 정점은 Sir William Henry Bragg의 이름을 따서 "브레그 피크 (Bragg peak)"라고 부른다. 브레그 피크가 생기는 위치는 양성자빔의 에너지와 양성자빔이 통과하는 물질에 따라 다르며 이 에너지에 따라 양성자로 치료할 수 있는 종양의 깊이가 달라진다. 대개 약 230 MeV의 에너지를 가진 양성자의 경우 약 30 cm의 깊이에 있는 종양까지 치료할 수 있으며 이는 대개의 인체 내 생기는 종양을 모두 치료할 수 있음을 의미한다. 여러 에너지의 브레그 피크를 합치면 각 종양의 두께를 균일하게 조사할 수 있는 방사선의 분포를 얻을 수 있는데 (spread of Bragg peak) 이렇게 하여 브래그 피크의 폭을 넓혀 다양한 두께의 종양을 치료할 수 있다. 결과적으로 보통의 방사선이 피부 바로 밑에서 최대의 방사선이 쌓이고 깊이 들어감에 따라 점점 낮아지는 반면 양성자와 같은 입자방사선의 경우에는 입자가 여행하는 초입부위에는 소량의 방사선을, 그리고 종양자체에는 최고의 방사선을, 그리고 종양의 후방에서 방사선량은 제로가 되어버린다(Figure 2). 단위 방사선량당 나타내는 양성자의 생물학적인 효과는 보통 방사선보다 약간 높거나 비슷한 정도이지만 정상조직에 전달되는 방사선의 양을 줄임으로써 상대적으로 종양조직에 더 많은 방사선량을 조사할 수 있게 되어 양성자치료는 정상조직합병증을 줄이면서 종양치료율은 높일 수 있는 방법으로 생각되고 있다. 또한 정상조직에 전달되는 불필요한 방사선을 줄임으로써 소아암의 생존자에서 관찰될 수 있는 2차 암의 발생을 감소시킬 수 있음이 수학적 모델로 수 차례 계산되었다[23]. 실제 세계적으로 가장 많은 소아환자를 치료한 기관인 매사추세츠 종합병원의 임상관찰에 의하면 과거 기존의 방사선치료를 받은 1,591명의 소아암환자들과 503명의 양성자치료를 받은 소아암환자를 각각 6.1년과 7.7년의 중앙추적 기간을 가지고 관찰하였을 때 기존 방사선군과 양성자군에서 각각 12.8%와 6.4%의 환자에서 2차 암이 발생하여 양성자치료로 2차 암 발생률을 감소시킬 가능성이 입증되었다[4].
소아뇌종양에서 양성자치료의 효과
위에서 설명한 양성자치료의 특징은 어른에 비해 특히 성장과 발달이 중요한 소아들의 종양 치료에 더욱 더 중요하게 작용한다. 양성자치료가 거둘 수 있는 효과는 크게 두 가지로 기대된다. 첫째는 주위조직에 도달하는 방사선량이 줄어들면서 종양에 더 많은 양의 방사선을 줄 수 있어서 종양의 국소제어율을 높일 수 있다는 것, 두 번째로는 정상조직에 가는 방사선의 양을 극적으로 줄임으로써 급만성 부작용을 줄일 수 있다는 것이다. 첫 번째 목표로 양성자치료의 효능이 가장 잘 입증된 질병은 뇌의 기저부에 생기는 척색종과 연골육종, 그리고 안구의 흑색종 등이 대표적인 질병의 예이다. 대부분의 소아암에 대한 양성자치료의 필요성은 두 번째 효과에 근거한다. 성인의 고형암에서 방사선이 사용되는 경우에 비하여 소아에서는 아무리 적은 방사선량도 그 영향은 어른에 비해 상대적으로 크다고 생각되기 때문이다. 그렇다면 소아암에서의 양성자의 우수성은 과학적으로 입증이 되어있는가? 의학에서 가장 으뜸으로 치는 과학적인 입증은 3상 무작위배정에 의한 효과의 입증이다. 하지만 양성자치료에서 볼 수 있는 현격한 정상조직 방사선조사량의 감소효과를 볼 때에 일반 방사선치료와 양성자치료가 소아암에서 무작위 배정을 통하여 기존 방사선치료 방법과 비교되는 것은 쉽지 않은 일이다. 또한 양성자치료기의 수가 적고 고가의 치료비용부담이 대부분 환자의 가족에 의해 이루어져야 하는 경우가 많아 양성자치료가 제한적으로 사용되는 수밖에 없었으므로 무작위 배정을 통한 임상시험이 이루어지기 힘들기 때문이다. 최근 조사에 의하면 2011년까지 양성자치료의 결과에 대하여 출판된 영어로 된 논문은 모두 39개이다[5]. 이중 제 1,2상 전향적 연구는 3개이고 후향적 연구는 28개이며 나머지는 모두 아주 소수의 환자들의 치료결과를 보고한 것들이다. 최소한 5명의 환자데이터는 포함되어야 한다는 다소 느슨한 기준으로 뽑았을 때에도 소아 관련의 논문은 모두 합쳐 238명의 환자가 포함된 10개 정도였다. 이 논문들은 포도막흑색종과 횡문근육종에서의 결과를 포함하여 뇌종양에서는 상의세포종, 뇌기저부의 척색종과 연골육종, 그리고 저등급 성상세포종과 두개인두종에 대한 결과들로 5년 및 10년 국소제어율과 생존율은 매우 우수하게 보고되고 있다. 이 단락에서는 이러한 논문들을 소개하고 양성자치료에서 볼 수 있는 방사선의 분포를 몇 질환의 예를 들어 설명하고자 한다.
1. 소아뇌종양의 치료효과
현재까지 출판된 소아뇌종양의 양성자치료 성적은 두개인두종과 뇌기저부의 척색종에서 가장 많이 나와있다. 이 중 두개인두종의 국소제어율과 생존율은 각각 85%와 93%로 보고되고 있다[6]. 또한 매사추세츠 종합병원에서는 치료한 16명의 환자 중 15명에서 국소제어가 이루어졌음을 보고하고 있다[7]. 이는 과거 방사선치료 성적과 대등하거나 우수한 것으로 Merchant 등[8]에 의한 선량분포 비교에서 두개인두종은 특히 양성자빔을 사용하였을 때 내이, 시각교차점시신경, 그리고 정상 뇌실질에 가는 방사선량이 입체조형치료보다 현저하게 줄어듦을 보고하고 있다. 특히 이 논문에서는 두개인두종에서 수술만 시행하였다가 재발한 후 3차원 입체조형 방사선치료를 시행한 경우와 처음부터 수술과 3차원 입체조형 방사선치료를 사용하였을 때를 비교하였을 때 환자의 장기 신경인지기능에 영향을 미치는 요인을 두 가지로 요약하였는데 첫째로는 수술로 인하여 생긴 합병증이 있었을 때, 그리고 두 번째로는 45 Gy 넘게 방사선이 조사되는 정상뇌의 부피가 클 경우였다[9]. 특히 30명의 환자들 중 첫 치료로 수술만 시행한 군과 수술과 방사선치료를 겸한 군의 비교에서 수술만 시행한 군에서 8명이 결국은 재발하여 방사선치료를 받았으며 이 군에서 수술 후 생긴 부작용이 장기적인 지능의 손상, 눈과 신경기능의 손상 및 삶의 질에 나쁜 영향을 미쳤다고 보고하고 있어[10] 두개인두종에서 양성자를 사용하여 정상뇌에 들어가는 방사선량을 줄이고 제한적 수술과 양성자치료를 겸한다면 좋은 국소제어율과 함께 지능과 삶의 질을 유지하는 데에 도움이 될 것임을 시사하고 있다. 이들은 또한 시신경교종에서도 양성자를 사용하였을 때 종양과 아주 근접해 있는 작은 부피의 정상조직(chiasm, pituitary, hypothalamus)에는 보통 방사선과 비교하여 별 차이가 없었지만 측두엽과 내이에는 양성자치료를 사용함으로써 방사선량을 상당히 줄일 수 있었고 또한 천막하 뇌조직과 천막상뇌기질에도 방사선량을 줄일 수 있었음을 보고하고 있다. 뇌의 저급성 상상세포종을 양성자로 치료하였을 때 5년 국소제어율과 생존율은 87%와 93%로 보고되고 있다[11]. 뇌의 상의세포종의 경우 26개월의 중앙추적기간을 가지고 관찰해 보았을 때 매사츠세츠 종합병원(Massachusetts General Hospital)의 보고에 의하면 국소제어율 86%, 무병생존율 80%, 그리고 생존율 89%를 얻을 수 있었고 이 결과는 한 번 재발 후 치료한 환자까지 포함된 것이기 때문에 매우 좋은 결과라고 생각할 수 있다[12]. 양성자는 뇌기저부와 척추에 발생한 척색종 및 연골육종에도 좋은 효과를 보여주고 있으며 이런 경우 종양과 가까이 위치한 뇌조직에 매우 적은 빈도의 급만성부작용을 보이면서도 약 70-100%의 5년 생존율을 보고하고 있다. 양성자치료는 몇 가지의 안구종양의 치료에도 효과적인 것으로 알려져 있다. 1-2세 영유아에서 호발하는 망막아세포종의 경우 종양의 위치에 따라서는 안구주변의 뼈와 눈물샘 등을 피하면서 치료할 수 있는 경우가 있으며 특히 양안의 망막아세포종에서는 질환이 덜 심한 한 쪽의 눈의 시력이 보존되어있으면서 단일병소일 때 양성자치료의 좋은 적응증이 된다고 생각된다[13]. 크기로는 4 mm 이내의 작은 종양의 경우 국소적인 외과적 수술로 좋은 효과를 볼 수 있어 양성자치료는 중간 정도 크기의 종양에서 사용하는 것이 적당하다고 여겨진다. 20세 이하의 안구흑생종 환자에서 17명의 포도막 흑색종 환자를 16.7년의 중앙관찰기간(3-25년)을 가지고 추적조사 하였을 때 17명 모두에서 눈을 보존하면서 생존하였으며 이 중 시력에 대한 기록이 있는 13명의 환자들에서는 시력이 보존된 상태로 보고되었다[14]. 한편 눈에 발생한 횡문근육종에 있어서 양성자의 사용은 안와 주변의 뼈, 눈물샘, 시신경, 뇌하수체, 측두엽과 다른 부분의 정상뇌조직에 도달하는 방사선량을 현저하게 줄일 수 있다[15].
2. 양성자치료의 치료계획과 dosimetric benefit
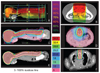
Figure 3에서 보여주는 소아뇌종양의 방사선치료계획에 대한 예는 양성자치료를 사용하였을 때 보통 방사선치료를 사용했을 때와 비교하여 얻을 수 있는 이점을 보여준다(Figure 3). 수모세포종이나 배아세포종에서 전뇌척수 방사선치료 시 각각 3차원 입체조형치료(상), 토모치료(중), 그리고 양성자치료(하)를 사용하였을 때에 볼 수 있는 방사선분포도를 각각 측면(A, C, E)과 단면(B, D, F)에서 보았을 때 3차원 입체조형치료에서는 치료에 필요한 방사선량의 약 60%에 해당하는 방사선이 폐, 간, 심장, 장, 신장 등의 내부장기에 조사됨을 알 수 있다. 토모치료의 경우(중) 방사선량이 치료의 타겟이 되는 뇌척수부위에 집중되기는 하나 5-10%의 방사선량이 뇌척수외의 거의 모든 내부장기에 광범위하게 뿌려지게 되는 것을 보여준다. 반면 양성자치료의 경우(하)에는 브레그 피크 현상 때문에 타겟 부위에는 방사선이 원하는 만큼 조사되면서도 내부장기에는 작은 양의 방사선도 전달되지 않음을 볼 수 있다(Figure 3A, 3B). 운동은[3] 전뇌척수 방사선치료에 있어서 양성자치료는 식도, 위, 간, 폐 ,췌장, 신장 등의 내부장기에 조사되는 방사선량을 3차원 입체조형치료나 토모치료에 비해 현저히 낮추어 이차암의 발생위험을 줄일 수 있음을 보여주었다. Figure 4 는 성장이 완료된 청소년의 경우 양성자빔의 조사 범위를 뇌척수액낭으로 한정지었을 때 척추의 후방부위 2-3 mm에서 방사선량이 멈추어 버리는 것을 볼 수 있다. 결과적으로 척추 뼈가 방사선 부위에서 빠지는 만큼 골수기능의 저하를 방지할 수 있게 된다. 이러한 방법의 양성자치료 계획은 골수기능 저하를 동반하는 항암제치료와 방사선치료를 병행할 때 항암제의 투여를 손쉽게 해 준다.
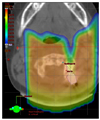
Figure 5A는 수모세포종에서 후두부의 종양부위에 조사야를 줄여서 치료할 때 일반 광자선을 이용한 3D 입체조형 치료(3D conformal radiotherapy, 3D CRT), 세기변조방사선치료(intensity modulated radiotherapy), 그리고 양성자치료계획의 비교이다. 3D CRT는 세기변조치료 및 양성자치료에 비해 종양주변의 정상뇌 부위에 많은 방사선량이 조사된다. 세기변조방사선치료는 3D CRT에 비해 방사선분포가 종양의 모양에 좀 더 가깝게 맞추어지면서 종양주변의 정상조직에 전달되는 방사선량도 줄여주지만 양성자 치료에 비하여 내이, 측두엽, 뇌하수체, 시상하부 등 뇌의 중요 부위에 조사되는 방사선의 량이 상대적으로 높은 것을 볼 수 있다. Figure 5B에서 보여지는 dose volume histogram은 방사선량과 정상조직의 용적을 세기변조치료와 양성자치료에서 비교한 것이다.
양성자치료의 응용에 있어 논의점
1. 임상적용에 있어서의 복잡성
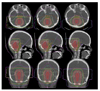
양성자치료는 환자를 치료함에 있어 치료계획을 세우고 치료가 시작될 때까지의 과정이 복잡하여 보통 방사선치료에 비해 시간과 인력이 두 배 이상 소요된다. 또한 1 mm 이내의 오차범위로 치료가 들어가야 하므로 치료 시 환자의 정확한 자세유지가 필요하고 치료 전 매번 영상촬영을 통하여 자세의 정확성을 확인하여야 한다(Figure 6). 나이가 어린 소아환자들의 경우에는 이를 위하여 전문 진정마취팀이 필요하다(Figure 7). 또한 치료의 질관리 면에 있어서도 보통 방사선치료보다 시간과 노력이 많이 요구되는데 이는 양성자빔의 경계가 매우 날카로와 치료 시 setup에 많은 영향을 받을 뿐 아니라 양성자빔이 들어가는 인체 내 조직의 구성 성분에 따라 방사선의 분포가 민감하게 달라질 수 있기 때문이다. 따라서 양성자빔의 측정 시에는 실제 인체와 비슷한 동물의 장기를 사용하여 측정치를 얻는 것은 물론이고 양성자빔의 분포에 영향을 줄 수 있는 종양근처의 인공 삽입물질들에 대한 철저한 검토를 시행한다. Figure 8은 2, 3번 경추 부위에 생긴 척색종의 양성자치료 시 수술 당시 삽입된 금속물질이 종양부위의 양성자분포에 부정확성을 야기함을 보여주는 예이다. 수술 후 양성자치료를 고려할 때에는 수술자와 양성자치료를 하는 방사선종양학자 사이에 긴밀한 정보교환이 미리 이루어지는 것이 매우 중요하다.
2. 비용효과면
설치비용과 치료비, 이 두 가지는 양성자치료의 실효성을 생각할 때에 생각하게 될 수밖에 없는 두 가지 측면이다. 양성자치료기는 장비구입과 설치비용에 있어서 보통 방사선 치료시설에 비해 4-6배 이상의 비용이 필요하며 한해당 유지에 드는 비용 또한 3-5배 정도로 더 높다[16]. 하지만 양성자치료의 비용효과측면을 검토할 때에 질보정생존연수(quality-adjusted life years)의 개념을 적용시키면 수모세포종을 가진 5세 환아가 치료종료 후 여러 가지 만성질환을 가지게 되면서 사용하게 되는 의료비를 감안할 때 장기적으로 오히려 23,600 유로화의 비용절감과 0.68의 삶의 질을 반영한 생명연장의 가치(quality-adjusted life year, QALY)를 가진다고 조사 되었다[17]. 암치료용 양성자치료기의 설치에 대한 결정은 단순히 소아암의 치료성적 뿐 아니라 이렇게 삶의 질에 대한 개념이 포함된 생존율의 향상에 얼마나 큰 비중을 두느냐에 따라 달라질 수 있다. 현재 전 세계적으로 사용되고 있는 양성자치료설비는 34개이며 2014년까지 세계적으로 사용될 양성자치료 시설은 적어도 2배 이상 증가할 것으로 집산되고 있다[5].
결론
1954년 처음으로 버클리대학 물리연구소에서 환자치료에 처음으로 사용된 양성자치료는 2011년 현재 세계적으로 65,000명의 환자들에게 이미 사용된 검증된 치료방법이라고 할 수 있다. 특히 소아의 뇌종양에서 사용되었을 때 방사선치료 후 종양이 없는 정상조직에 도달하는 방사선조사를 피할 수 있게 됨으로써 신경인지기능의 손상을 최소화 하면서도 우수한 치료 효과를 거둘수 있는 방법이다. 최근 개발되어 이미 사용되기 시작한 스캔빔 양성자치료와 세기변조양성자치료기법은 이러한 양성자치료의 효과를 더욱 발전시킨 방법으로 앞으로 소아뇌종양의 치료에 크게 기여할 것으로 기대된다.
Peer Reviewers' Commentary
본 논문은 방사선 종양학 분야에서 많이 논의가 되고 있는 양성자치료의 최신지견을 밝힌 것으로써 방사선종양학 전문의 뿐만 아니라 항암치료를 시행하고 있는 다른 분야의 의사들에게도 많은 도움이 되는 논문이라도 생각된다. 최근의 방사선치료는 여러 가지 장비가 서로 각축하는 양상을 보이고 있다. 그러나 이러한 technology의 발전이 있다고 하더라도 그 장비에 쓰이는 방사선은 photon이 대부분이므로 이와 다른 물리적 특성을 보이는 양성자치료는 많은 의사들의 경험이 없기 때문에 이 논문을 통하여 경험을 쌓을 수 있을 것으로 판단된다. 양성자로 치료할 수 있는 여러 가지 질환이 있지만 그 중에서도 특히 소아뇌종양에서 유용성과 부작용의 감소에 초점이 맞추어져 있는 본 논문은 소아뇌종양에 관심이 많은 독자라면 한번쯤 탐독해야 할 논문이다. 양성자치료는 세계적으로 점점 더 많은 기관에서 치료기가 가동되고 있는 추세이지만 우리나라에서는 국립암센터만이 유일하게 장비를 가동하고 있어서 향후에도 좋은 data를 산출하여 소아뇌종양 환자의 치료를 한 단계 더 발전시킬 수 있었으면 하는 바램이다.
[정리: 편집위원회]




 PDF
PDF ePub
ePub Citation
Citation Print
Print







 XML Download
XML Download